去除干扰对内蒙古典型草原植物叶片功能属性的影响
张景慧, 黄永梅, 陈慧颖, 杨涵越
地表过程与资源生态国家重点实验室, 北京师范大学资源学院, 北京 100875
去除干扰对内蒙古典型草原植物叶片功能属性的影响
张景慧, 黄永梅*, 陈慧颖, 杨涵越
地表过程与资源生态国家重点实验室, 北京师范大学资源学院, 北京 100875
以内蒙古典型草原为研究对象,选取放牧和割草、去除放牧、去除放牧和割草样地进行群落调查和叶片属性测量,比较分析各样地土壤性质、群落生产力及主要物种的比叶面积(SLA, Specific Leaf Area)、叶片干物质含量(LDMC, Leaf Dry Matter Content)、叶片氮含量(LNC, Leaf Nitrogen Concentration)在个体、功能群和群落水平对去除干扰的响应。结果表明,1)去除干扰处理在短期对土壤特性和群落生产力的影响不显著;2) 多数物种在放牧和割草样地SLA较低,说明典型草原多数物种的SLA表现为放牧逃避;3) 不同功能群植物叶片属性对去除干扰的响应不一致,去除放牧后,多年生杂类草的SLA和LDMC不受影响,但LNC变小;多年生禾草的SLA增加,而LDMC和LNC无显著变化。一年生植物在去除放牧和割草后,LNC显著增加。去除割草后,多年生禾草SLA减小,而多年生杂类草SLA、LNC增加,LDMC减小;4) 在群落水平,放牧和割草样地由于较占优势的多年生禾草SLA较低,群落比叶面积最低,在去除放牧和割草样地,群落叶片氮含量显著增加;5) 在内蒙古典型草原,LDMC能够很好地将多年生禾草和多年生杂类草区分,SLA在个体、功能群和群落水平均比LDMC敏感。
群落属性;功能群;叶片属性;去除放牧;去除割草
生态系统正在被人类以前所未有的方式开发利用,随着载蓄量的增加和不间断的割草,草原生态系统的生产力正在下降[1-2]。在过去,生态学家多关注放牧、割草、施肥对草原植被动态的影响,现在,随着大范围退耕还草、围封禁牧等生态工程在草原地区的开展,越来越多的研究者开始关注去除过度利用后草原的响应[3-4]。人类利用方式的改变会引起一些物种的多度发生改变,造成原有物种消失以及替代物种的出现。为了更好地制定和实施草原管理措施,需要对植物的生长状态进行评估[5]。在这种情况下,植物功能属性被越来越多的应用于评价管理措施对生态系统过程、生产力以及养分循环的影响[6-7]。在植物的功能属性中,叶片属性与植物抵抗干扰和捕获资源密切相关[4,8]。易于定量化并与植物功能联系紧密的叶片属性成为研究者关注的焦点[8-9],其中比叶面积(SLA)、叶片干物质含量(LDMC)和叶片氮含量(LNC)被认为在个体水平、群落水平和生态系统水平影响植物的碳和养分循环[10-11]。比叶面积(SLA)是饱和状态下植物的叶片面积与叶片干重的比值;叶片干物质含量(LDMC)是叶片的干重与叶片饱和鲜重的比值;叶片氮含量(LNC)是叶片中全氮的含量与叶片干重的比值。
国内外关于叶片属性的研究多集中在资源利用、对干扰和环境梯度的响应等方面[12-16]。在叶片属性和干扰的关系研究中,放牧对植物叶片属性的影响受到较多关注[6,15],但叶片属性对割草响应的研究较少。许多研究表明对放牧适应的物种在放牧后生长速度加快,比叶面积增大,而对放牧逃避的物种在放牧后,生长速度减缓,比叶面积降低[17]。叶片属性对干扰强度响应敏感,Louault[4]等在半天然草地的研究结果表明,随着干扰强度降低,叶片比叶面积降低,叶片干物质含量增加。随着放牧强度的增加,比叶面积大,叶片干物质含量小的物种的多度增加[15]。LNC可以很好地反映土壤的肥力状况[18],是植物营养价值和喜食性的指示指标[19-20]。探讨植物群落功能属性需要以物种属性为基础,群落加权平均属性是最常用的定量化方法之一[21-22],是以相对生物量为权重计算群落水平的属性值[23]。群落加权平均属性可同时反映群落物种组成和物种属性值的影响[13]。
内蒙古典型草原对亚欧草原具有广泛的代表性,历史上一直被用作放牧场和打草场[24]。长期的放牧导致生物多样性锐减以及系统功能的下降[25]。为了对草原进行保护,人们开始对草原实施禁止放牧和打草管理。关于禁止放牧和打草对群落特征的研究已见很多报道[26-27],但该区域植物叶片功能属性对降低干扰的响应的研究还鲜有报道。本文以去除放牧和割草后内蒙古典型草原的主要物种叶片属性为研究对象,旨在探讨:(1)土壤和群落特征对去除干扰的响应;(2) 物种、功能群和群落水平叶片功能属性对去除干扰的响应;(3)叶片功能属性对去除干扰的敏感性。
1 材料和方法
1.1 研究区概况与样地布设
实验在内蒙古自治区锡林浩特市以东的毛登牧场进行(44°10.878′ N, 116°22.128′ E),海拔910—1377 m。年平均气温为2.36 ℃,最热月在7月为21.2 ℃,最冷月在1月为-19.4 ℃,无霜期90—115 d,年平均降雨量281 mm (1953—2013年), 主要集中在6—8月,雨热同期,年蒸发量是年降雨量的5.8倍[28]。2012年该区域年降雨量较大(511.7 mm),2013年降雨量为273.4 mm。该区域地带性土壤为栗钙土,地带性植被为大针茅草原。天然草地以大针茅(Stipagrandis)和羊草(Leymuschinensis)为优势种,常见的物种还有糙隐子草(Cleistogenessquarrosa)、冰草 (Agropyroncristatum)、冷蒿(Artemisiafrigida)、扁蓄豆(Melilotoidesruthenia)细叶韭(Alliumtenuissimum)等。
本实验区的天然草场以放牧为主,近10年来的放牧强度为1.08只绵羊/hm2,每年8月打草1次。2008年,毛登牧场围封了2.87万hm2草场作为生态保护区,保护区内禁止放牧,部分区域作为打草场,每年8月打草1次;部分草场以生态保护为主,禁止放牧和割草[29]。根据不同的割草和放牧的管理,选取了3个样地:对照样地(放牧和割草处理CK),去除放牧样地(RG)及去除放牧和割草样地(RGH)。3个样地间彼此相距不超过5 km,气候、地貌、土壤、原生群落类型相同。
1.2 样品采集和叶片属性的测量
2012年和2013年的8月中旬,当植物达到最大生物量时,在每个样地随机布设3个100 m样带,样带之间距离超过500m,在每样带起点、中点和末端各设置一个1 m × 1 m的样方调查植物群落学特征,齐地面分种剪取样方中植物的地上部分,带回实验室65 ℃烘干至恒重。2012年8月,用环刀在每个样地中随机取3个土样,105 ℃烘干至恒重,测定0—10 cm土壤容重。同时,每个样地随机取3个土样,取样深度为0—10 cm,带回实验室分析土壤的全氮和全碳含量。
2012年8月中旬,对每个样地的主要物种进行采样,这些物种的地上生物量占群落总生物量的90%以上。每个物种在每个样地挖取没有遮挡的、长势良好的成熟植株10株(丛)分成3份,带回实验室将叶片分离,进行叶片氮含量的测定。土壤全碳全氮含量和植物叶片氮含量的测定采用全自动元素分析仪(CHN-600, LECO, St. Joseph, MI, USA)。2013年8月中旬,对样地中常见的14—15个物种进行采样,每个样地选取完全伸展的、完整的成熟个体10株(丛),采用标准测量方法测量叶片干物质含量[30],用叶面积仪(Li-3000,LI-COR,Superior St. Lincoln, NE, USA)测量叶面积。SLA和LDMC分别用以下公式计算:SLA=叶片面积(cm2)/叶片干重(g),LDMC=叶片干重(mg)/叶片饱和鲜重(g)。
以3个样地共有的物种划分植物功能型,植物功能群叶片属性为每个样地该功能型植物种叶片属性的平均值。多年生杂类草的SLA和LDMC为扁蓿豆、冷蒿、麻花头(Serratulacentauroides)、细叶韭、野韭(Alliumramosum)和粘毛黄芩(Scutellariaviscidula)的SLA和LDMC平均值,LNC为冷蒿,麻花头,细叶韭和野韭的平均值。多年生禾草的SLA、LDMC和LNC为冰草、糙隐子草,大针茅以及羊草的平均值。一年生植物LNC为刺藜(Chenopodiumaristatum)、藜(Chenopodiumalbum)和猪毛菜(Salsolacollina)的平均值。
群落的加权平均属性用以下公式计算[23]:
式中,pi是物种i在群落中的相对生物量,ti是物种i的属性值,n是群落中的物种数。
1.3 数据处理
对于在所有样地均出现的物种,使用SPSS用单因素方差分析(ANOVA)比较各处理间属性的差异。对在任意两个样地出现的物种采用t-测验进行比较分析。以2012年物种相对生物量和LNC计算群落叶片氮含量(LNCagg),以2013年物种相对生物量和SLA以及LDMC计算群落比叶面积(SLAagg)和群落叶片干物质含量(LDMCagg)。对于生物量和群落属性值,先将每样带中3个样方的数据平均,然后采用单因素方差分析(ANOVA)比较各处理间的差异。
2 结果
2.1 去除干扰对土壤特性和群落生产力的影响
对不同处理下样地的土壤特征进行比较,结果表明土壤0—10 cm全碳、全氮以及土壤容重在各样地间的差异不明显(F2,6=1.33,P=0.33;F2,6=1.26,P=0.35;F2,6=1.70,P=0.26, 表1)。2012年降水较丰富,各样地间的群落生产力没有显著差异(F2,6=0.051,P=0.95),同样的结果在降水接近多年平均值的2013年也出现(F2,6=0.71,P=0.53,图1)。
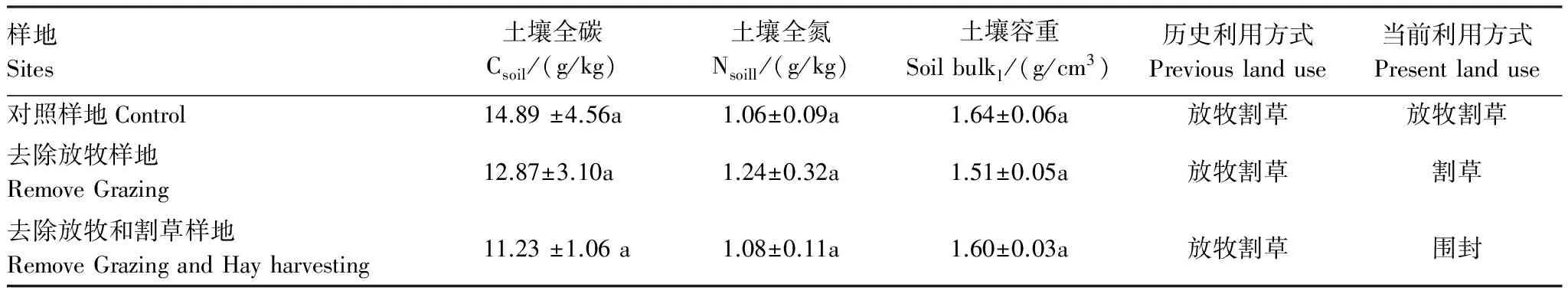
表1 不同样地土壤特征和利用方式
数值后不同字母表示在0.05水平上差异显著, 表中数据为平均值±标准误差
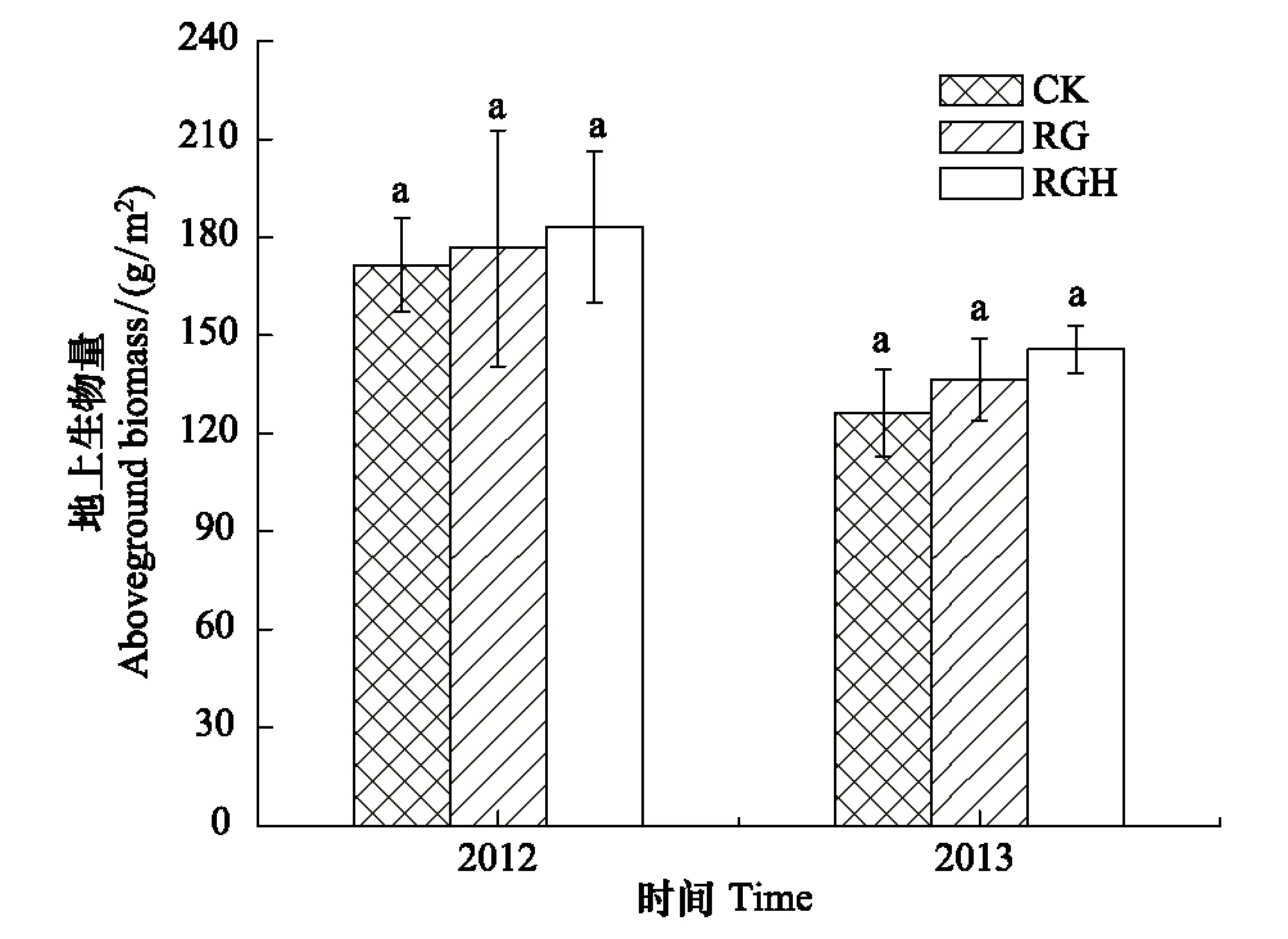
图1 不同土地利用方式下群落的地上生物量Fig.1 Aboveground biomass under different land-uses CK:对照样地 Control;RG:去除放牧样地 Remove Grazing;RGH:去除放牧和割草样地 Remove Grazing and Hay harvesting;误差线上方的相同小写字母表示在0.05水平上差异不显著。图中数据为平均值±标准误差
2.2 主要物种的叶片属性对不同处理的响应
选定的13个物种中有11个物种的SLA在样地间存在差异。去除放牧以后,多年生杂类草除白花黄耆(Astragalusgalactites)和粘毛黄芩,其它植物SLA均未发生变化,而4种多年生禾草的SLA增大。去除放牧和割草以后,物种SLA变化方向一致,除冷蒿和粘毛黄芩保持不变外,其他物种SLA较对照样地显著增加。去除割草以后(RGH样地与RG样地相比),多年生杂类草中6种植物SLA增加,多年生禾草中除冰草外,其他物种SLA降低(表2)。
3个样地所有多年生杂类草LDMC的变化范围在124—360 mg/g之间,多年生禾草的变化范围在374—506 mg/g之间,LDMC可以明显的区分两个功能群植物。13种植物有7个物种对去除干扰处理有响应。去除放牧后,所有多年生杂类草植物LDMC无显著变化,冰草LDMC增加,糙隐子草LDMC减小。去除放牧割草后,扁蓿豆和粘毛黄芩的LDMC减小,其他物种LDMC变化不显著。去除割草以后(RGH样地与RG样地相比),5种多年生杂类草植物LDMC显著减小,4种多年生禾草LDMC无显著变化(表3)。
表4所列12种植物中,有5种植物的LNC在去除干扰后有明显响应。多年生杂类草中冷蒿和细叶韭在仅有割草干扰的样地(RG样地)LNC降低。与对照样地相比,在去除放牧割草后,一年生植物刺藜和猪毛菜的叶片氮含量增加,去除割草后(RGH样地与RG样地相比) 碱韭、冷蒿、细叶韭和猪毛菜的LNC增加(表4)。
2.3 不同处理对功能群叶片属性和组成的影响
对不同样地功能群的叶片属性进行多重比较,结果表明,多年生杂类草和多年生禾草的SLA对处理的响应明显(F2,220=11.86,P<0.001和F2,125=25.70,P<0.001),去除放牧的2个样地(RG样地和RGH样地)多年生禾草的SLA显著增加(P<0.001和P<0.001),去除放牧和割草后,多年生杂类草的SLA显著增加(P<0.001)。对各样地不同功能群的SLA进行t检验,结果表明:在对照样地和去除放牧和割草样地,多年生杂类草的SLA显著高于多年生禾草(tCK=11.94,P<0.001和tRGH=5.03,P<0.001),去除放牧样地,SLA在功能群间差异不显著(tRG=-1.05,P=0.35, 图2)。
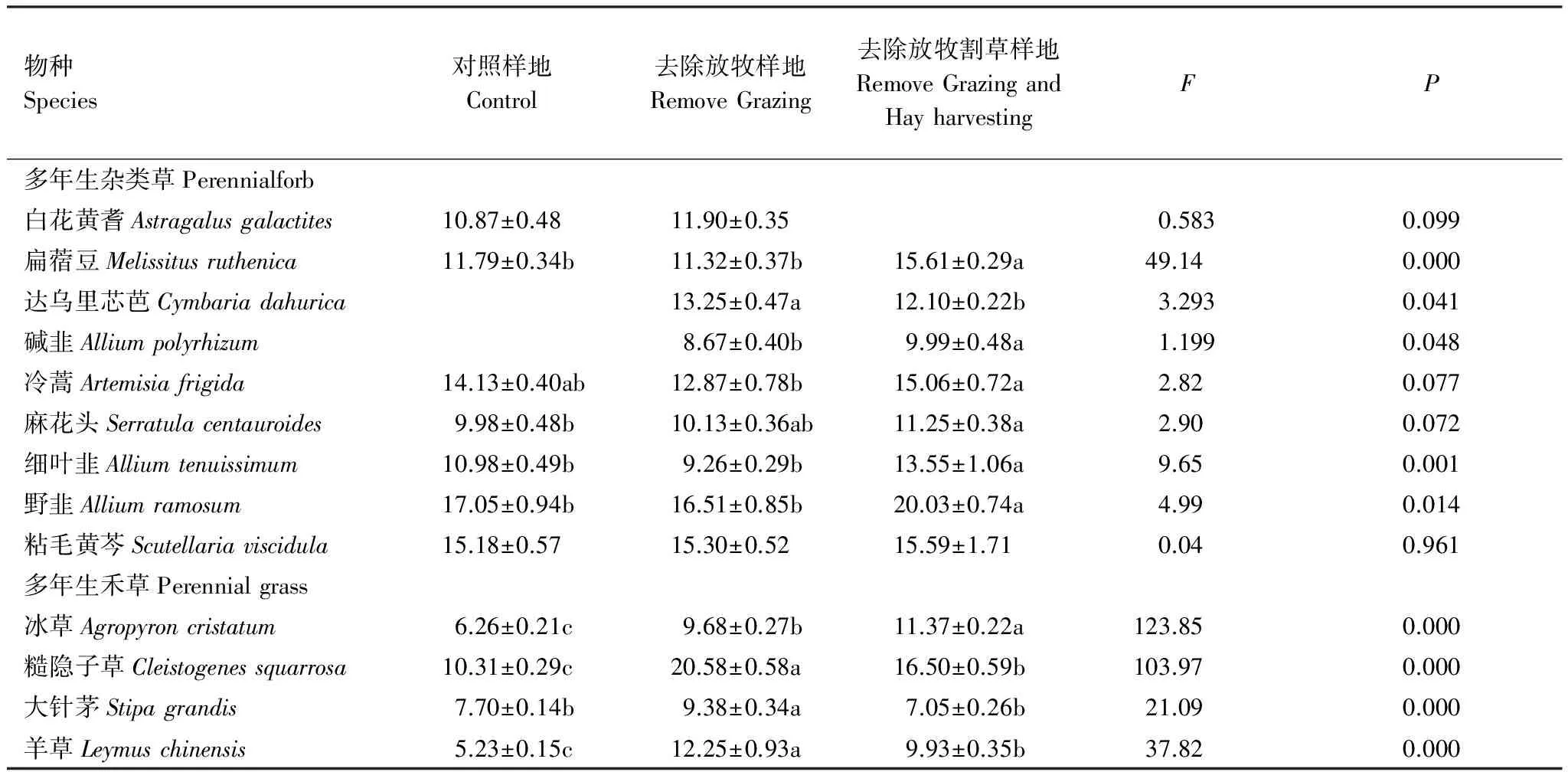
表2 不同样地植物比叶面积(SLA)的比较/(m2/kg)(平均值±SE)
数值后不同字母表示在0.05水平上差异显著
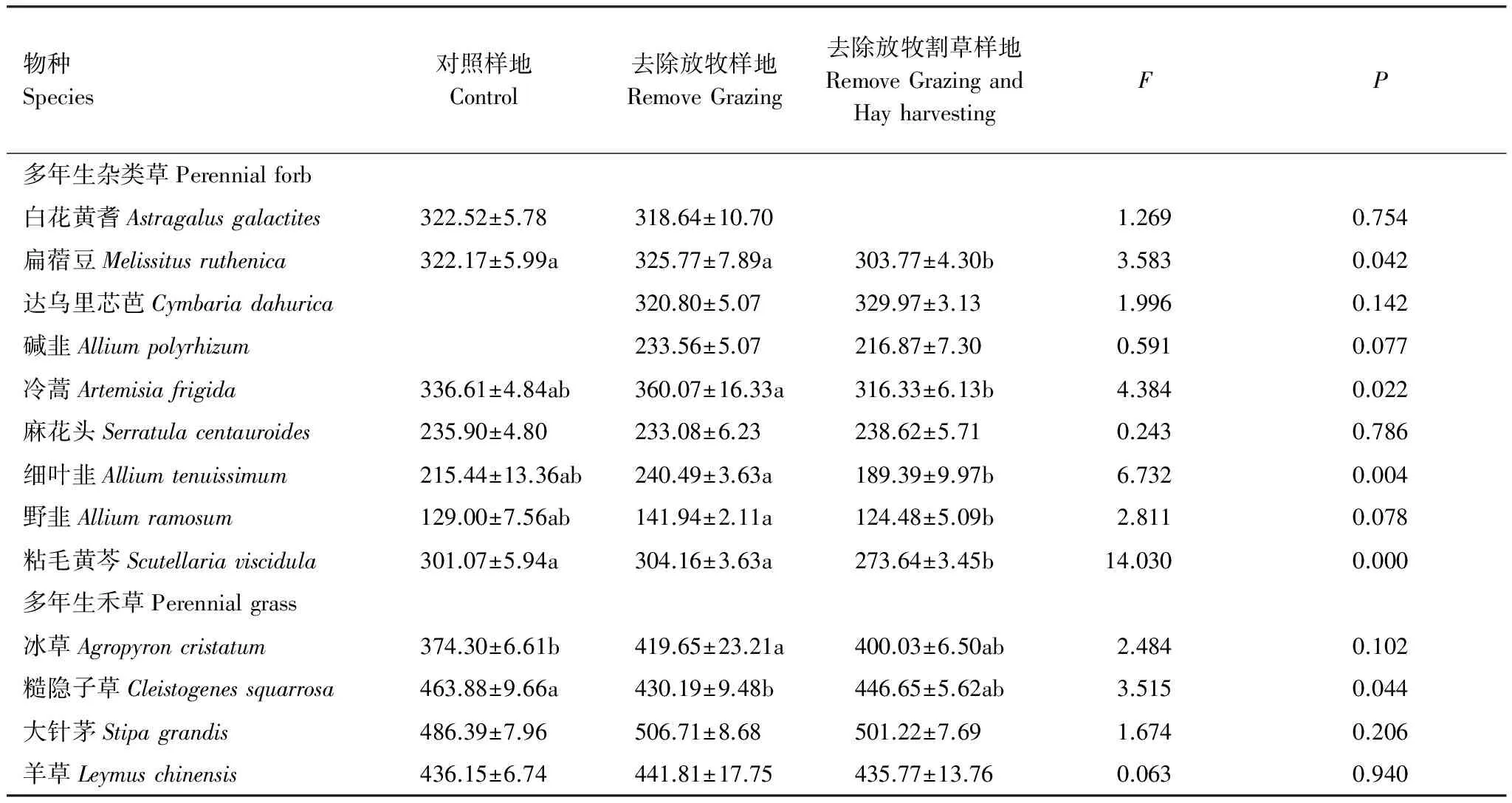
表3 不同样地植物叶片干物质含量(LDMC)的比较/(mg/g)(平均值±SE)
数值后不同字母表示在0.05水平上差异显著
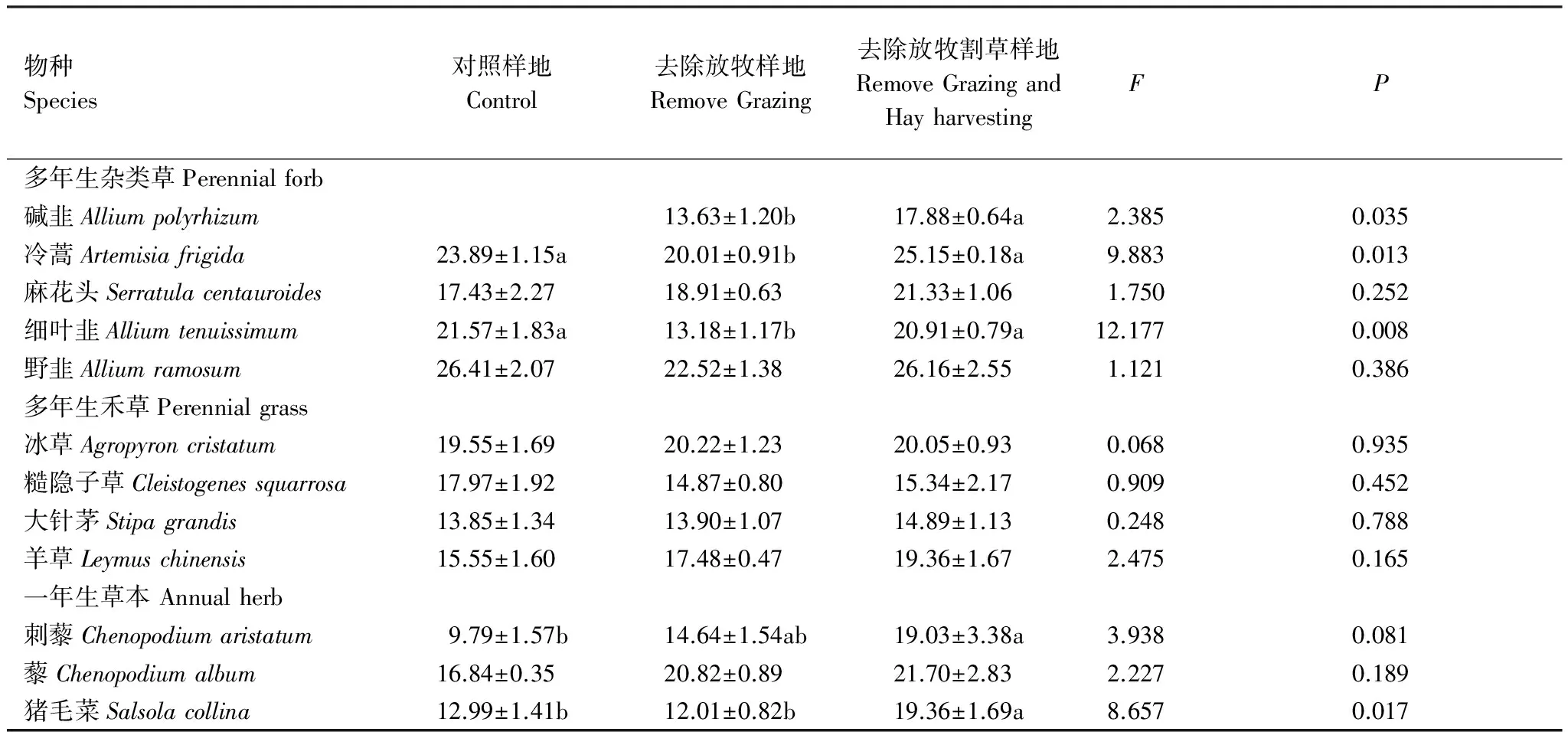
表4 不同样地植物叶片氮含量(LNC)的比较/(mg/g)(平均值±SE)
数值后不同字母表示在0.05水平上差异显著
多年生杂类草的叶片干物质含量对处理的响应明显(F2,220=3.62,P=0.028),表现在去除放牧和割草样地比去除放牧样地的LDMC低(P=0.003),多年生禾草的LDMC在样地间无显著差异(F2,125=0.36,P=0.70)。在各样地中多年生杂类草的LDMC均显著低于多年生禾草(tCK=-16.70,P<0.001;tRG=-12.26,P<0.001, 和tRGH=-19.87,P<0.001, 图2)。
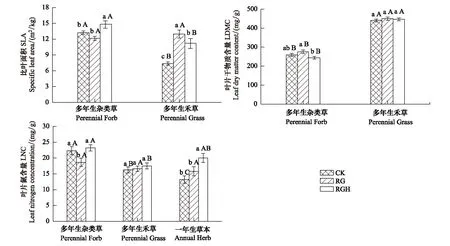
图2 3种样地不同功能群叶片属性的比较Fig.2 Comparisons of leaf traits of different function group in three sitesCK:对照样地 Control;RG:去除放牧样地 Remove Grazing;RGH:去除放牧和割草样地 Remove Grazing and Hay harvesting;不同小写字母表示同一功能群叶片属性在样地间差异显著(P<0.05);不同大写字母表示在同一样地不同功能群叶片属性存在显著差异(P<0.05);图中数据为平均值±标准误差
不同功能群的叶片氮含量对处理间的响应不同,去除放牧后多年生杂类草的LNC显著减少(P=0.029),多年生禾草的LNC对各处理的响应不明显(F2,33=0.28,P=0.76)。一年生植物在放牧和割草都去除后LNC显著增加(P=0.002)。在对照样地多年生杂类草的LNC显著高于多年生禾草(P=0.001),多年生禾草LNC高于一年生植物(P=0.047)。功能群水平LNC在去除放牧样地没有显著差异(F2,30=1.71,P=0.198)。去除放牧和割草样地中多年生杂类草的LNC显著高于多年生禾草(P=0.001, 图2c)。
2.4 不同处理对群落叶片属性的影响
群落水平比叶面积对不同的处理响应比较敏感(F2,6=73.62,P<0.001),去除放牧和去除放牧和割草样地群落水平的SLA均显著高于对照样地(P<0.001和P<0.001)。而群落水平的叶片干物质含量则对处理无响应(F2,6=2.32,P=0.179)。群落LNC在各样地间差异显著(F2,6=21.73,P=0.002),表现在去除放牧和割草样地显著高于对照样地(P=0.001)和去除放牧样地(P=0.001, 表5)。

表5 不同样地群落属性的比较(平均值±SE)
数值后不同字母表示在0.05水平上差异显著
3 讨论
关于放牧对叶片属性影响的研究广泛认同两种机制:放牧适应和放牧逃避[20]。对放牧适应的物种在放牧后,牧草生长速率加快,牧草质量变好,SLA增加。而对放牧逃避的物种则表现为生长速度减缓,牧草质量以及适口性变差,植物SLA降低[17]。在本研究中,除了白花黄耆和粘毛黄芩外,其它物种在去除放牧和割草后均表现为SLA显著增加,说明在典型草原多数物种的SLA表现为放牧逃避。植物在放牧等干扰下会出现植物个体小型化的现象,表现在植株变矮,叶片变小变窄,枝叶质地变硬等[31],从而导致植株叶面积减小,进而引起植物SLA的降低。不同功能群植物对放牧和割草的响应不同。去除放牧仅割草的样地多年生杂类草的SLA和LDMC没有变化(表2,表3),但LNC降低(图2),这与该样地长期割草而又缺乏动物排泄物的补给有关[4,32]。在去除放牧的两个样地中,多年生禾草的SLA显著增加,但该功能群LDMC和LNC对去除干扰的响应并不明显(图2)。一年生植物在去除放牧和割草以后LNC增加(表4, 图2),从而使得该样地群落水平LNC显著高于其他两个样地(表5)。
多年生杂类草和多年生禾草对去除割草的响应并不一致。大部分多年生杂类草在去除割草以后SLA、LNC增加,LDMC降低(表2—表4)。许多研究表明SLA、LNC和LDMC与植物的生长速率和资源的储藏和获取密切相关[13,23]。植物SLA、LNC增加,LDMC降低说明植物的生长速率增加,植物获取资源的效率增加[15]。围封后多年生杂类草叶片属性的变化可能是草原恢复的表现。多年生禾草在去除割草后LNC、LDMC不变,说明多年生禾草对割草的响应没有多年生杂类草敏感。多数多年生禾草在存在割草干扰时反而具有更高的SLA是一个有趣的现象,这可能为多年生禾草对割草适应的一种表现。
叶面积、鲜重以及干重测量值来自于同一植株,以此计算的SLA和LDMC因此具有相同的自由度,这里我们研究两个属性对降低干扰响应的敏感性。在物种水平,有11种植物在人类利用方式改变后SLA发生改变,而仅有7个物种的LDMC发生变化(表2,表3)。在功能群水平,多年生禾草SLA对不同处理在P<0.001水平有响应,LDMC的显著性水平为P=0.7;多年生杂类草在降低干扰后,变化敏感(P<0.001),LDMC的P值为0.028。在群落水平SLAagg对不同处理响应比较敏感(F值为111.52,P<0.001),而LDMCagg在不同样地无差异(F值仅为1.74,P值为0.196)。说明在内蒙古典型草原中物种、功能群和群落水平上SLA比LDMC对干扰更敏感。Roche[33]等也发现SLA比LDMC更加容易发生变化,SLA的种内变异性为36.5%而LDMC仅为9%。同时,在本研究中我们发现,所有多年生杂类草的LDMC均小于多年生禾草(表3),这一结果与Al Haj Khaled[5]等的研究结果相似,他们发现LDMC可将植物分为多年生禾草、丛生杂类草和直立杂类草3类。近年来,许多研究用植物的功能属性划分植物功能型(PFT)[4,7],并且证明植物功能型是解释和预测生态系统功能的简便、有效地“工具”[34]。LDMC由于具有便于测量,在功能群间差异显著且较SLA更加稳定的特点,因此可以作为划分植物功能型的合适的植物功能属性[5,7]。
不同的生物群落在不同的处理下物种组成会发生很大变化,群落中植物功能属性有可能沿不同的方向变化(增加,减少或不变),对群落总体属性进行定量化测量,可以反应群落物种组成和物种属性的综合特征。群落属性因此被越来越多的生态学家关注,广泛应用于预测土地利用变化和全球气候变化对生态系统功能和服务的影响[6,13,21,35]。群落属性值由物种组成和属性的变化共同决定[13],通常表现为优势种或优势功能群决定群落属性[36]。对照样地的SLAagg显著低于去除放牧样地和去除放牧和割草样地的SLAagg(表5),说明该样地由SLA比较小的物种占优势。
净第一性生产力代表着群落碳的输入,能够反映气候变化、动物啃食以及人类收获对生态系统的影响[13]。去除干扰后,群落净第一性生产力、土壤全碳和全氮含量表现出增加的趋势,土壤容重表现出降低的趋势,但差异均不显著(表1,图1)。这可能与以下两方面的原因有关,首先,生态系统具有一定的缓冲能力,可以抵抗和吸收一定的干扰,从而维持相对稳定的生产[37];其次,有研究表明1—7月的降雨量是内蒙古草原生产力的主要影响因子[38],降雨对生产力的影响大于干扰的影响。同时,在草原生态系统中,强度较低的放牧和刈割初期对净第一性生产力影响不明显[26,39]。
现在,越来越多的研究认识到,干扰时间是影响草地生态系统的重要因子[27,40]。在本研究中,去除干扰时间为5—6a,虽然净第一性生产力和土壤属性变化不显著,但物种和功能群水平上全碳含量、全氮含量等固碳属性有明显差异[29]。有研究表明内蒙古典型草原,从物种尺度上推到功能群尺度再到群落尺度,叶片属性对放牧干扰的响应不同[41]。发现去除放牧和割草干扰后,物种、功能群和群落叶片属性都有一些发生了显著变化,其中不同处理间的SLA在3个水平均有明显差异,多年生杂类草和多年生禾草的SLA都对干扰响应敏感,所以群落水平也有明显差别(表2,图2,表5)。而LDMC在物种和功能群水平存在一定的差异,但群落水平没有差别,LNC的差异主要由一年生植物引起(表3—表5,图2)。Bao[26]等对刈割处理下羊草草原17年的演替过程进行了研究,在干扰初期,系统通过功能组成的不断调节维持相对稳定的功能,在群落结构变化积累到一定程度后,系统功能迅速发生变化。本研究的结果表明在去除干扰时,最早响应在植物个体功能属性和物种组成比例等方面,生态系统生产力、固碳能力等生态功能响应不显著,随着干扰去除时间或实验时间的增加,生态系统生态功能是否会发生明显变化,需要开展长期实验进一步分析。
4 结论
内蒙古典型草原去除干扰5—6a对土壤固碳属性、群落的生产力没有显著影响,但对植物叶片属性有影响。大针茅草原的大多数物种表现为放牧逃避[31],有放牧活动时SLA变小。多年生杂类草对去除割草干扰响应敏感,在割草区域由于常年割草且缺乏动物排泄物补给,叶片氮含量降低。去除放牧和割草后(围封),植物存在SLA、LNC增加,LDMC降低的趋势,说明在草原封育后植物生长速率加快,并从资源储藏向资源获取的策略转变[13,23],为封育初期草原恢复的一种表现。同时,本研究表明,在内蒙古典型草原,LDMC能够很好地将多年生禾草和多年生杂类草区分,降低干扰下物种、功能群和群落水平的SLA均比LDMC敏感,用LDMC划分植物功能群或功能型(PFT)更合理。
致谢:感谢内蒙古大学草地生态学研究基地对本实验给予的帮助。
[1] Loreau M, Naeem S, Inchausti P, Bengtsson J, Grime J P, Hector A, Hooper D U, Huston M A, Raffaelli D, Schmid B, Tilman D, Wardle D A. Biodiversity and ecosystem functioning: current knowledge and future challenges. Science, 2001, 294(5543): 804-809.
[2] Tong C, Wu J, Yong S, Yang J, Yong W. A landscape-scale assessment of steppe degradation in the Xilin River Basin, Inner Mongolia, China.Journal of China Arid Environment, 2004, 59(1): 133-149.
[3] 徐柱, 闫伟红, 刘天明, 吉木色, 柳剑丽. 中国草原生物多样性、生态系统保护与资源可持续利用. 中国草地学报,2011, 33(3): 1-5.
[4] Louault F, Pillar V D, Aufrère J, Garnier E, Soussana J F. Plant traits and functional types in response to reduced disturbance in a seminatural grassland. Journal of Vegetation Science, 2005, 16(2): 151-160.
[5] Al Haj Khaled R, Duru M, Theau J P, Plantureux S, Cruz P. Variation in leaf traits through seasons and N-availability levels and its consequences for ranking grassland species. Journal of Vegetation Science, 2005, 16(4): 391-398.
[6] Díaz S, Lavorel S, de Bello F, Quétier F, Grigulis K, Robson T M. Land change science special feature: incorporating plant functional diversity effects in ecosystem service assessments. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(52): 20684-20689.
[7] Ansquer P, Duru M, Theau J P, Cruz P. Functional traits as indicators of fodder provision over a short time scale in species-rich grasslands. Annals of Botany, 2009, 103(1): 117-126.
[8] Craine J M, Froehle J, Tilman D C, Wedin D A, Chapin F S. The relationships among root and leaf triats of 76 grassland species and relative abundance along fertility and disturbance gradients.Oikos, 2001, 93(2): 274-285.
[9] Weiher E, van der Werf A, Thompson K, Roderick M, Garnier E, Eriksson O. Challenging Theophrastus: a common core list of plant traits for functional ecology. Journal of Vegetation Science, 1999, 10(5): 609-620.
[10] Cornelissen J H C, Pérez-Harguindeguy N, Diaz S, Grime J P, Marzano B, Cabido M, Vendramini F, Cerabolini B. Leaf structure and defence control litter decomposition rate across species and life forms in regional flora on two continents. New Phytologist, 1999,143(1): 191-200.
[11] Lavorel S, Garnier E. Predicting changes in community composition and ecosystem functioning from plant traits: revisiting the Holy Grail. Functional Ecology, 2002, 16(5): 545-556.
[12] 李玉霖, 崔建垣, 苏永中. 不同沙丘生境主要植物比叶面积和叶干物质含量的比较. 生态学报, 2005, 25(2): 304-311.
[13] Garnier E, Lavorel S, Ansquer P, Castro H, Cruz P, Dolezal J, Eriksson O, Fortunel C, Freitas H, Golodets C, Grigulis K, Jouany C, Kazakou E, Kigel J, Kleye M, Lehsten V, Leps J, Meier T, Pakeman R, Papadimitriou M, Papanastasis V, Quested H M, Quétier F, Robson M, Roumet C, Rusch G, Skarpe C, Sternberg M, Theau J P, Thébault A, Vile D, Zarovali M P. Assessing the effects of land-use change on plant traits, communities and ecosystem functioning in grasslands: a standardized methodology and lessons from an application to 11 European sites. Annals of Botany, 2007, 99(5): 967-985.
[14] 赵雪艳, 汪诗平. 不同放牧率对内蒙古典型草原植物叶片解剖结构的影响. 生态学报, 2005, 29(6): 2906-2918.
[15] Cruz P, De Quadros F L F, Theau J P, Frizzo A, Jouany C, Duru M, Carvalho P C F. Leaf traits as functional descriptors of the intensity of continuous grazing in native grasslands in the South of Brazil. Rangeland Ecology & Management, 2010, 63(3): 350-358.
[16] Geng Y, Wang Z H, Liang C Z, Fang J Y, Frank B, Kühn P, Scholten T, He J S. Effect of geographical range size on plant functional traits and the relationships between plant, soil and climate in Chinese grasslands. Global Ecology and Biogeography, 2012, 21(4): 416-427.
[17] Adler P, Raff R, Lauenroth W K. The effect of grazing on the spatial heterogeneity of vegetation.Oecologia, 2001, 128(4): 465-479.
[18] Sabaté S, Sala A, GraciaCA. Nutrient content inQuercusilexcanopies: Seasonal and spatial variation within a catchment. Plant and Soil, 1995, 168-169(1): 297-304.
[19] Pérez-Harguindeguy N, Díaz S, Vendramini F, Cornelissen J H C, Gurvich D E, Cabido M. Leaf traits and herbivore selection in the field and in cafeteria experiments. Austral Ecology, 2003, 28(6): 642-650.
[20] Cingolani A M, Posse G, Collantes M B. Plant functional traits, herbivore selectivity and response to sheep grazing in Patagonian steppe grasslands. Journal of Applied Ecology, 2005, 42(1): 50-59.
[21] Lavorel S, Grigulis K, Lamarque P, Colace M P, Garden D, Girel J, Pellet G, Douzet R. Using plant functional traits to understand the landscape distribution of multiple ecosystem services. Journal of Ecology, 2011, 99(1): 135-147.
[22] Roscher C, Schumacher J, Gubsch M, Lipowsky A, Weigelt A, Buchmann N, Schmid B, Schulze E D. Using plant functional traits to explain diversity-productivity relationships. PLoS One, 2012, 7(5): e36760.
[23] Garnier E, Cortez J, Billès G, Navas ML, Roumet C, Debussche M, Laurent G, Blanchard A, Aubry D, Bellmann A, Neill C, Toussaint JP. Plant functional markers capture ecosystem properties during secondary succession. Ecology, 2004, 85(9): 2630-2637.
[24] Bai Y F, Wu J G, Xing Q, Pan Q M, Huang J H, Yang D L, Han X G. Primary production and rain use efficiency across a precipitation gradient on the Mongolia plateau. Ecology, 2008, 89(8): 2140-2153.
[25] Bai Y F, Wu J G, Clark C M, Pan Q M, Zhang L X, Chen S P, Wang Q B, Han X G. Grazing alters ecosystem functioning and C: N: P stoichiometry of grasslands along a regional precipitation gradient. Journal of Applied Ecology, 2012, 49(6): 1204-1215.
[26] Bao Y J, Li Z H, Zhong Y K. Compositional dynamics of plant functional groups and their effects on stability of community ANPP during 17 yr of mowing succession onLeymuschinensissteppe of Inner Mongolia, China. ActaBotanicaSinica, 2004, 46(10): 1155-1162.
[27] 单贵莲, 徐柱, 宁发, 马玉宝, 李临杭. 围封年限对典型草原群落结构及物种多样性的影响. 草业学报, 2008, 17(6): 1-8.
[28] 李俊兰, 宋丹, 苗芳芳. 内蒙古毛登牧场蝽类昆虫多样性及区系特征分析. 内蒙古大学学报: 自然科学版, 2013, 44(4): 382-388.
[29] 陈慧颖, 张景慧, 黄永梅, 龚吉蕊. 内蒙古大针茅草原常见植物在不同土地利用方式下的固碳属性. 植物生态学报, 2014, 38(8): 821-832.
[30] Cornelissen J H C, Lavorel S, Garnier E, Diaz S, Buchmann N, Gurvich D E, Reich P B, terSteege H, Morgan H D, van der Heijden M G A, Pausas J G, Poorter H. A handbook of protocols for standardised and easy measurement of plant functional traits worldwide. Australian Journal of Botany, 2003, 51(4): 335-380.
[31] 王炜, 梁存柱, 刘钟龄, 郝敦元. 草原群落退化与恢复演替中的植物个体行为分析. 植物生态学报, 2000, 24(3): 268-274.
[32] Schönbach P, Wan H W, Gierus M, Bai Y F, Müller K, Lin L J, Susenbeth A, Taube F. Grassland responses to grazing: effects of grazing intensity and management system in an Inner Mongolian steppe ecosystem. Plant and Soil, 2011, 340(1/2): 103-115.
[33] Roche P, Díaz-Burlinson N, Gachet S. Congruency analysis of speciesranking based on leaf traits: which traits are the more reliable?.Plant Ecology, 2004, 174(1): 37-48.
[34] 孟婷婷, 倪健, 王国宏. 植物功能性状与环境和生态系统功能. 植物生态学报, 2007, 31(1): 150-165.
[35] Conti G, Díaz S. Plant functional diversity and carbon storage—an empirical test in semi-arid forest ecosystems. Journal of Ecology, 2013, 101(1): 18-28.
[36] Grime J P. Benefits of plant diversity to ecosystems: immediate, filter and founder effects. Journal of Ecology, 1998, 86(6): 902-910.
[37] Folke C, Carpenter S, Walker B, Scheffer M, Elmqvist T, Gunderson L, Holling C S. Regime shifts, resilience, and biodiversity in ecosystem management. Annual Review of Ecology, Evolution, and Systematics, 2004, 35: 557-581.
[38] Bai Y F, Han X G, Wu J G, Chen Z Z, Li L H. Ecosystem stability and compensatory effects in the Inner Mongolia grassland. Nature, 2004, 431(7005): 181-184.
[39] Dormaar J F, Adams B W, Willms W D. Impacts of rotational grazing on mixed prairie soils and vegetation.Journal of Range Management, 1997, 50(6): 647-651.
[40] McSherry M E, Ritchie M E. Effects of grazing on grassland soil carbon: a global review. Global Change Biology, 2013, 19(5): 1347-1357.
[41] Zheng S X, Ren H Y, Lan Z C, Li W H, Wang K B, Bai Y F. Effects of grazing on leaf traits and ecosystem functioning in Inner Mongolia grasslands: scaling from species to community. Biogeosciences, 2010, 7(3): 1117-1132.
Effect of disturbance removal on leaf functional traits of plants in the Inner Mongolia steppe
ZHANG Jinghui, HUANG Yongmei*, CHEN Huiying, YANG Hanyue
State Key Laboratory of Surface Processes and Resource Ecology, College of Resources Science and Technology, Beijing Normal University, Beijing 100875, China
Grassland is the primary vegetation type throughout the world, and covers approximately 40% of land in China, most of which has been damaged because of intensive livestock use or mowing. The management of grassland is in need of tools to diagnose the state of the vegetation, and for this reason, ecologists have begun to study plant functional traits. Among plant functional traits, specific leaf area (SLA, the ratio of leaf area to leaf dry mass), leaf dry matter content (LDMC, the ratio of leaf dry mass fresh mass) and leaf nitrogen concentration (LNC) appear to be associated with plant growth and nutrition cycles.Numerous experiments have tested the effect of grazing and mowing on grassland function and structure, few attempts focusing on grassland that have been taken out of grazing or mowing. In this study, three types of sites were selected in different management areas: the control site affected by grazing and hay harvesting, the site with no grazing, and the site lacking grazing and hay harvesting. Within each site, community characteristics were investigated in August of 2012 and 2013. The leaf traits measured included; SLA, LDMC, and LNC of 14—15 of the most dominant species in each site. Our main goals in this study were to examine: 1) whether removal of the disturbance had a significant effect on soil and community productivity, 2) how plant leaf functional traits are affected by reduced disturbances at the species, functional group, and community level, and 3) the sensitivity of specific leaf area(SLA) and leaf dry matter content (LDMC) to the removal of disturbances.The results showed that the removal of a disturbance had significant effects on plant leaf traits and community structure but not on soil or community productivity. Most of species in control site had low SLA, which indicated species usually avoided grazing on the Inner Mongolia steppe. Leaf traits of species belonging to different functional groups responded differently to the removal of disturbances. There was no change in the SLA and LDMC of any perennial forbs when grazing was removed. LDMC and LNC of perennial grasses did not change in response to the removal of disturbances, while SLA of the species from these functional groups changed significantly after the disturbance removal. The LNC of annual herb increased when there was a removal of grazing and hay harvesting. At the community level, the control site had the lowest community-aggregated SLA value, which was due to a lower SLA in its dominant functional group (perennial grass), while the remove grazing and hay harvesting site had the highest overall community LNC value. In addition, it was easy to distinguish perennial grasses and forbs by the LDMC values, and SLA was more sensitive to the reduction of disturbances than the LDMC at the species, functional group, and community levels.
community-aggregated traits; functional group; leaf traits; grazing removal; hay harvesting removal
国家自然科学基金资助项目(41371069, 41030535);长江学者和创新团队发展计划资助项目(IRT1108)
2015-03-21;
日期:2016-01-05
10.5846/stxb201503210544
*通讯作者Corresponding author.E-mail: ymhuang@bnu.edu.cn
张景慧, 黄永梅, 陈慧颖, 杨涵越.去除干扰对内蒙古典型草原植物叶片功能属性的影响.生态学报,2016,36(18):5902-5911.
Zhang J H, Huang Y M, Chen H Y, Yang H Y.Effect of disturbance removal on leaf functional traits of plants in the Inner Mongolia steppe.Acta Ecologica Sinica,2016,36(18):5902-5911.

