前期水淹对牛鞭草后期干旱胁迫光合生理响应的影响
韩文娇,白林利,李昌晓,崔 振,燕江伟,秦 红
三峡库区生态环境教育部重点实验室 重庆市三峡库区植物生态与资源重点实验室 西南大学生命科学学院,重庆 400715
前期水淹对牛鞭草后期干旱胁迫光合生理响应的影响
韩文娇,白林利,李昌晓*,崔 振,燕江伟,秦 红
三峡库区生态环境教育部重点实验室 重庆市三峡库区植物生态与资源重点实验室 西南大学生命科学学院,重庆 400715
水淹和干旱是限制植物生长的两种主要环境因子。三峡库区消落带由于其特殊的地形条件和人工水文节律,呈现以年度为周期的“水淹-落干”交替变化的水文变动特征,在消落带生长的植物因此受到水淹和干旱交替胁迫的双重影响。为了探究库区蓄水对消落带植被干旱耐受性的影响,以当年生牛鞭草扦插苗为试验对象,设置对照组(CK)、表土水淹组(SF)、全淹组(TF)、 对照-干旱组(CD)、表土水淹-干旱组(SFD)、全淹-干旱组(TFD)6个处理组,研究不同水分处理对牛鞭草光合特性的影响。结果表明:(1)水淹和干旱胁迫均对牛鞭草光合特性造成显著影响;(2)水淹胁迫阶段,与CK组相比,牛鞭草SF和TF组净光合速率、气孔限制值和水分利用效率显著下降,胞间CO2浓度显著上升;(3)干旱胁迫阶段,牛鞭草CD和SFD组净光合速率、气孔导度、胞间CO2浓度和蒸腾速率等光合参数显著低于CK组,TFD组净光合速率、气孔导度、胞间CO2浓度和蒸腾速率等指标与CK组无显著差异;(4)复水阶段,各处理组净光合速率、气孔导度、胞间CO2浓度和蒸腾速率等指标均与CK组无显著差异。研究表明,前期水淹并未增加牛鞭草对后期干旱胁迫的敏感性,牛鞭草对水淹和干旱胁迫均具有较好的耐受性,有助于牛鞭草对库区消落带生境变化的适应性。
三峡库区;消落带;牛鞭草;光合特性;水淹;干旱
伴随着三峡工程的全面运行,三峡库区形成了面积为349 km2、淹水长达6个月、水位在145—175 m之间呈年度周期性变化的大型消落带[1]。作为库区陆生系统与水生系统之间的交错地带,消落带区域内的物质、能量和信息交换频繁,其对于减缓库区水土流失、保护生物多样性及保护生境等具有重要的作用[2-3]。然而,该消落带的形成使库区许多陆生植物因不适应长时间的淹水环境而死亡,从而导致库区消落带原有植被大量退化[4-6]。加上退水后消落带完全出露期间正好处于重庆炎热的夏季,不同程度的干旱水分胁迫进一步增加了库区消落带生态植被修复的难度[7]。
库区消落带植被生态修复的关键是筛选出既耐淹又耐旱的两栖性物种。水淹条件下,氧气匮乏是限制植物生长的主要因素,植物生长、光合及代谢等过程受限,水淹敏感性植物死亡率显著升高[8-9]。然而,对于耐淹植物而言,可通过形成不定根、通气组织、形成气膜促进水下光合能力等方式提高水下存活率或通过促进茎伸长等方式适应水淹胁迫[10-12]。干旱条件下,植物生长发育均受抑制,耐旱种可通过提高水分利用效率,增加脯氨酸等渗透调节物质维持生长[13]。作为植物生命活动最重要的过程之一,光合作用变化在一定程度上能反映出植物的生长状况。牛鞭草(Hemarthriaaltissima)为禾本科牛鞭草属多年生根茎草本植物,主要分布在热带及亚热带地区,少数分布于北半球温带湿润地区[14]。该草生长迅速、产量高、具有较强的适应性和抗逆性,可作为良好的水土保持作物[12]。目前已有研究表明牛鞭草具有较强的水淹耐受性[12, 15-16],可作为三峡库区消落带植被修复的备选物种[15]。然而,由于库区复杂多变的水文变动特征,牛鞭草经长时间淹水后于夏季出露,夏季为库区消落带的干旱频发期[17]。在经历水淹之后,面对接踵而至的干旱胁迫,牛鞭草光合生理响应机制将可能出现变化。尽管有研究表明,某些耐淹物种同样具有耐旱特性[18],且前期水淹并未增加植株对后期干旱胁迫的敏感性[19],但对于生长于三峡库区消落带的牛鞭草而言,前期水淹是否会增加牛鞭草对后期干旱胁迫光合生理响应的敏感性仍未知。因此本研究通过模拟库区消落带土壤水分变化特征,探究前期水淹对牛鞭草后期耐受干旱胁迫的光合生理响应机制的影响,为库区消落带植被修复重建提供一定的理论基础。
1 材料与方法
1.1 材料
选择当年生的牛鞭草扦插苗作为研究对象。2014年5月选取嘉陵江边自然生长的牛鞭草(H.altissima),剪成长为10 cm的茎段扦插于盆钵中(盆中央内径17 cm,盆高20 cm),每盆2株,共120盆(240株),土壤为紫色土。所有盆栽实验均置于西南大学三峡库区生态环境教育部重点实验室实验基地透明大棚下(海拔249 m),进行相同水分、光照等管理,2014年6月5日正式开展实验,此时株高(14.63±0.96) cm。
1.2 试验设计
试验共分为3个阶段,均采用完全随机区组设计。第一阶段(Phase I)为水淹阶段,将试验植株随机分为3个处理组,即对照组(CK),表土水淹组(SF)和全淹组(TF),每组各40盆,共120盆。对照组(CK),土壤含水量保持在田间持水量的60%—63%[20](称重法);表土水淹组(SF),水淹超过土壤表面5 cm;全淹组(TF),TF组苗盆放入水池中,池水保持没过植株顶端1 m[21]。48 d后,每组随机选取4盆用于光合参数的测定,4盆用于牛鞭草生理生化指标的测定,剩余96盆植株用于后续实验。
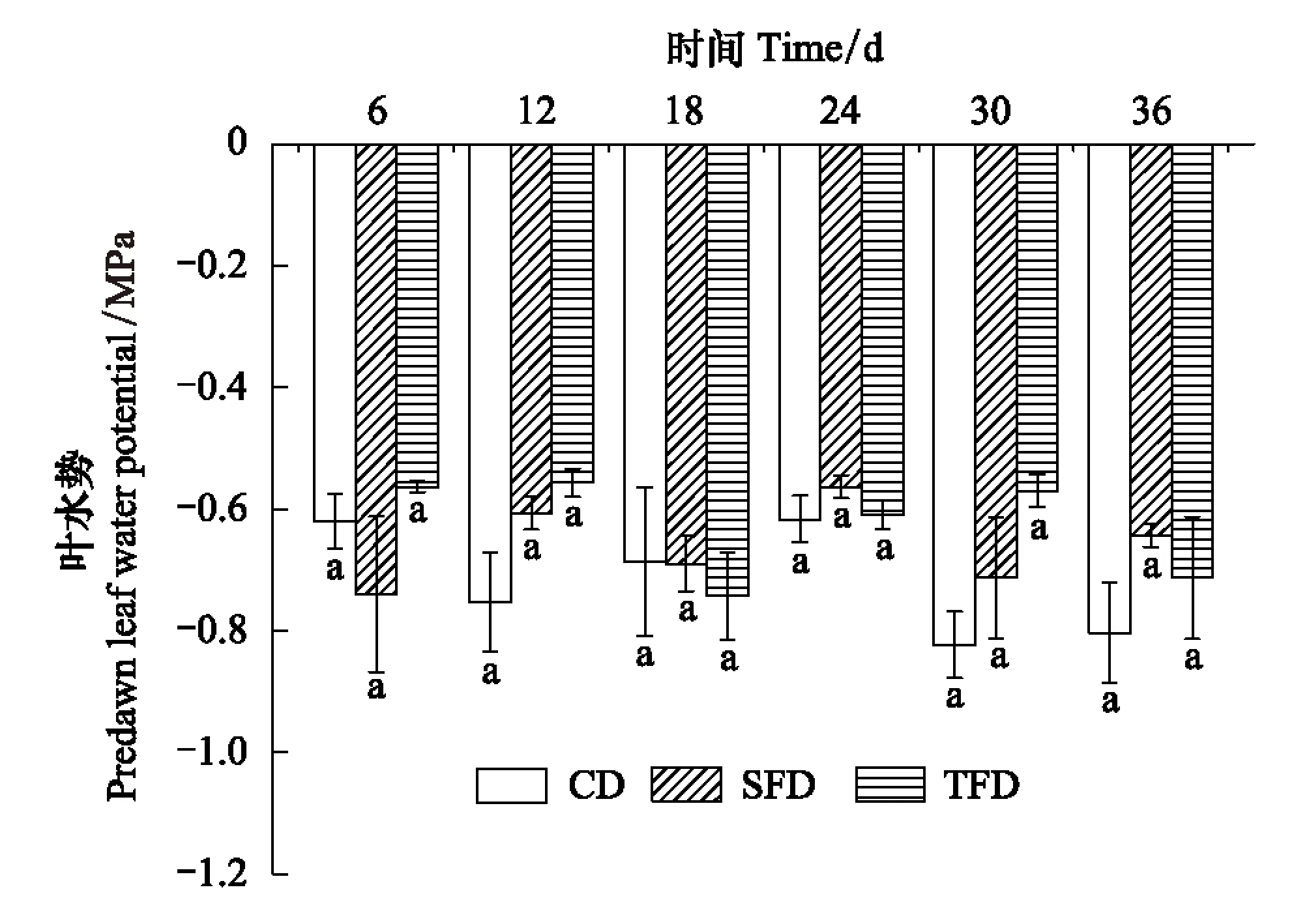
图1 牛鞭草在轻度干旱阶段清晨叶水势的变化(阶段Ⅱ) Fig.1 Changes of predawn leaf water potential of Hemarthria altissima during drought stress(Phase Ⅱ)CD: 对照干旱组control-drought; SFD: 表土水淹干旱组Soil-surface flooding-drought; TFD: 全淹干旱组Total flooding-drought
第二阶段(Phase II)为干旱阶段,在第一阶段的基础上,将CK、SF和TF组中植株随机各分为2个小组,一组继续保持原有的水分处理,另一组为轻度干旱组。因此,第二阶段共有6个处理组,即对照组(CK)、表土水淹组(SF)、全淹组(TF)、对照-干旱组(CD),表土水淹-干旱组(SFD)和全淹-干旱组(TFD),每组16盆,共96盆。轻度干旱组,土壤含水量保持在田间持水量的40%—50%[22](称重法),为监测轻度干旱状态,采用露点水势仪Psypro(由美国Wescor公司生产)于清晨(6:00—7:00)测定牛鞭草成熟叶片的叶水势,以清晨叶水势小于-0.5 MPa为达到轻度干旱的标准(图1),由于实验期间正值重庆炎热的夏季,气温较高(36—40℃),盆钵放水3 d后,CD、SFD和TFD处理组即达到轻度干旱状态。36 d后,每组随机选取4盆用于光合参数的测定,4盆用于牛鞭草生理生化指标的测定,剩余48盆植株用于后续实验。
第三阶段(Phase Ⅲ)为复水阶段,所有处理均按照对照组(CK)恢复供水,时间为30 d。
1.3 土壤氧化还原电位的测定
采用土壤氧化还原电位计DW-1型(江苏江分电分析仪器有限公司生产)对牛鞭草土壤氧化还原电位(Eh)进行测定。将电位计探头插入土壤中,距离土壤表面10 cm,待读数稳定后取值,每个处理重复测定4次。通气良好,含氧量充足的土壤,其土壤氧化还原电位介于+400—(+700) mV之间变化,淹水后土壤氧化还原电位变化从+400到+72 mV,当土壤氧化还原电位低于+350 mV时,则表明土壤氧气匮乏[23]。
1.4 光合指标的测定
于晴天9:00—12:00,采用Li-6400便携式光合系统(Li-Cor 6400, Li-Cor Inc, USA)对牛鞭草健康成熟的功能叶片中部(从植株顶端往下数第3—4片叶)进行光合指标的测定[24],其中,将TF组移出水池后用吸水纸将所选叶片附着的水迅速轻轻擦干,立即进行光合参数的测定。光源为红蓝光,叶室2 cm×3 cm,在预备试验的基础上确定光合有效辐射(PAR)为1200 mol m-2s-1,叶室温度为25 ℃,CO2浓度为大气CO2浓度。测定指标包括净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)与蒸腾速率(Tr),并计算水分利用效率(WUE=Pn/Tr)和气孔限制值(Ls=1—Ci/Ca)[25]。同时,标定放入叶室的牛鞭草叶片区域,测定结束后立即放入冰盒带回实验室,使用WinRHIZO根系分析仪(WinRHIZO,LC4800-II LA2400)扫描其测定部位的叶面积,并通过换算得出各处理的光合参数。每处理每次测定4盆(共8株)。
1.5 叶绿素含量的测定
选取用于测定光合指标的植物叶片,采用浸提法测定其叶绿素含量[26]。采用岛津5220分光光度计(UV-5220,Shimadzu,日本) 分别对叶绿素a(chla)、叶绿素b(chlb)、类胡萝卜素(car)的吸光值A663、A645和A470进行测定,并计算其含量。总叶绿素含量(chls)=叶绿素a(chla)+叶绿素b(chlb)。每处理每次测定4盆(共8株)。
1.6 数据分析
将水分处理作为独立因素,采用SPSS 19.0进行单因素方差分析(One-way ANOVA),以揭示不同水分处理对牛鞭草光合特性的影响。运用Tukey′s检验法检验每个指标在同一阶段不同处理组(α=0.05)的显著差异性。
2 结果
2.1 水淹对牛鞭草土壤氧化还原电位的影响

图2 水淹阶段牛鞭草土壤氧化还原电位的变化(阶段Ⅰ和Ⅱ) Fig.2 Changes of soil redox potential (Eh) of Hemarthria altissima during flooding stress(Phase Ⅰ and Ⅱ)CK: 对照组Control; SF: 表土水淹组Soil-surface flooding
由图2中可知,在整个实验期间,对照组(CK)土壤氧化还原电位始终高于418 mV,表明土壤通气良好。而表土水淹组(SF),在实验进行的6 d后,土壤氧化还原电位低于+350 mV,且呈逐渐下降趋势,表明SF组土壤氧气含量下降。
2.2 水淹对牛鞭草光合特性的影响(阶段Ⅰ)
经48 d不同程度水淹处理后,牛鞭草SF和TF组存活率为100%。与CK相比,第一阶段结束时,牛鞭草SF和TF组净光合速率(Pn)均显著下降,分别显著降低了24%(P< 0.05)和58%(P< 0.05)(图3)。牛鞭草TF组气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr)与CK相比均显著增加,分别比CK组增加了78%(P< 0.05),133%(P< 0.05)和86%(P< 0.05)。而SF组Ci与CK组相比显著升高58%(P< 0.05),但Gs和Tr与CK组之间均未达到显著差异(图3)。
SF和TF组气孔限制值(Ls)和水分利用效率(WUE)的结果与Pn结果相类似,均显著低于CK组,其中SF组Ls和WUE分别比CK组显著降低26%(P< 0.05)和37%(P< 0.05),TF组Ls和WUE分别比CK组显著降低70%(P< 0.05)和78%(P< 0.05)(图4)。
经第一阶段水淹处理后,牛鞭草SF组和CK组的叶绿素a(chla)、叶绿素b(chlb)、总叶绿素(chls)含量、chla/chlb、类胡萝卜素(car)含量、chls/car均无显著差异,TF组除chlb和chls显著高于CK组外,chla、chla/chlb、car和chls/car均与CK无显著差异(表1)。

图3 阶段I不同水分处理下净光合速率、气孔导度、胞间CO2浓度和蒸腾速率的变化(平均值±标准误)Fig.3 Changes of Pn, Gs, Ci and Tr under different treatments at the end of phase Ⅰ (Means ± SE)不同字母表示不同处理组之间的差异显著(α=0.05);Pn: 净光合速率 Photosynthesis rate; Gs: 气孔导度Stomatal conductance;Ci: 胞间CO2浓度 Intercellular CO2 concentration; Tr: 蒸腾速率Transpiration rate

图4 阶段I不同水分处理下气孔限制值和水分利用效率的变化(平均值±标准误)Fig.4 Changes of Ls and WUE under different treatments at the end of phase Ⅰ (Means ± SE)不同字母表示不同处理组之间的差异显著(α=0.05)
2.3 干旱对牛鞭草光合特性的影响(阶段Ⅱ)
SF、CD和SFD的Pn均显著低于CK组,分别比CK组降低38%(P< 0.05)、25%(P< 0.05)和22%(P< 0.05),但TFD组与CK组却无显著差异。水淹组(SF和TF)和干旱组(CD、SFD和TFD)存活率均为100%,但由于TF组叶片凋落,未能测定其光合参数(图5)。轻度干旱组CD和SFD的Gs和Tr均显著低于CK组,而TFD组的Gs和Tr与CK组相比分别均无显著差异(图5)。Ci除SF组显著高于CK组外,CD、SFD与TFD组均与CK组无显著差异。另外,CD和SFD组两者间的Pn、Gs、Ci和Tr均无显著差异,且均显著低于TFD组的Pn和Tr。
与CK组相比,牛鞭草SF组Ls显著降低,CD、SFD和TFD组Ls均有所增加,但均未达到显著水平(P> 0.05)(图6)。牛鞭草CD、SFD和TFD的WUE均高于CK组,分别增加了40%(P< 0.05)、47%(P< 0.05)和27%(P> 0.05)。
第二阶段结束后,牛鞭草SF、CD和SFD组的chla、chlb、chls、chla/chlb、car相较于CK组而言,分别均未达显著差异(P> 0.05),与TFD组显著高于CK组形成鲜明的对比(表2)。各轻度干旱组间,CD和TFD组chla、chlb、chls显著高于SFD组,但chla/chlb和chls/car在各组之间则无显著差异(表2)。

表1 阶段I不同水分处理下叶绿素含量变化(平均值±标准误)
不同字母表示不同处理组之间的差异显著(α=0.05

图5 阶段II不同水分处理下净光合速率、气孔导度、胞间CO2浓度和蒸腾速率的变化(平均值±标准误)Fig.5 Changes of Pn, Gs, Ci and Tr under different treatments at the end of phase Ⅱ (Means ± SE)TF组因叶片凋落,未能测定光合参数; 不同字母表示不同处理组之间的差异显著(α=0.05);Pn: 净光合速率— Photosynthesis rate; Gs: 气孔导度 Stomatal conductance;Ci: 胞间CO2浓度 Intercellular CO2 concentration; Tr: 蒸腾速率 Transpiration rate
TF组因叶片凋落,未能测定叶绿素含量; 不同字母表示不同处理组之间的差异显著(α=0.05)
2.4 复水对牛鞭草光合特性的影响(阶段Ⅲ)
水淹与干旱胁迫解除后,牛鞭草各处理组Pn、Gs、Ci、Tr、Ls、WUE与CK组相比均无显著差异(图7),表明各处理组均达到与CK组相一致的水平(其中,TF组为复水后新生叶片测定值)。另外,与CK组相比,牛鞭草SF、TF、CD、SFD和TFD组chla、chlb、chls、car和chls/car均无显著差异(图8)。

图7 阶段Ⅲ不同水分处理下净光合速率、气孔导度、胞间CO2浓度和蒸腾速率的变化(平均值±标准误)Fig.7 Changes of Pn, Gs, Ci and Tr under different treatments at the end of phase Ⅲ (Means ± SE)不同字母表示不同处理组之间的差异显著(α=0.05);Pn: 净光合速率 Photosynthesis rate; Gs: 气孔导度 Stomatal conductance;Ci: 胞间CO2浓度 Intercellular CO2 concentration; Tr: 蒸腾速率Transpiration rate

图8 阶段Ⅲ不同水分处理下气孔限制值和水分利用效率的变化(平均值±标准误)Fig.8 Changes of Ls and WUE under different treatments at the end of Phase Ⅲ (Means ± SE)不同字母表示不同处理组之间的差异显著(α=0.05)
3 讨论
3.1 水淹对牛鞭草光合特性的影响
已有研究表明,非耐淹植物淹水后,其光合参数受到显著影响,Pn、Gs、Tr和WUE均随着淹水时间的延长而显著下降[27-28]。如籼稻品种IR 42(OryzasativaL.),淹水8 d后,其Pn仅为对照组的5%[29]。与非耐淹物种不同,耐淹种通过采取不同的适应策略(如逃避策略或静默策略等)降低水淹对其光合作用的影响,从而维持较高的光合能力[30]。Mommer等[31]对酸模(Rumexpalustris)的研究发现,淹水后形成的水生叶,其表皮细胞的细胞壁和角质层均变薄,降低了扩散阻力,促进了植物水下光合的能力。在本研究中,还观察到牛鞭草TF组叶片变薄等类似的现象,且第一阶段结束时,牛鞭草SF和TF组Pn分别为CK组的76%和42%(图1)。与宽叶独行菜(Lepidiumlatifolium)[32](其在水淹超过土壤表面1cm处理50 d后,Pn为对照组的56%—72%)的研究结果相似,表现出较强的耐淹性。第二阶段末,牛鞭草SF组的Pn在第一阶段的基础上进一步下降,比CK组显著降低38%(图2),TF组因叶片凋落未能测得其光合指标,叶片凋落的原因可能是由于在全淹状态下,牛鞭草根系损伤导致植物养分供应不足或水淹导致植物细胞膜损伤等造成[33],也可能是牛鞭草通过叶片凋落降低对物质能量的消耗,为维持水下存活率及胁迫去除后能快速恢复所采取的一种适应方式[34]。另外,本研究中,第一阶段结束时,TF组Pn显著低于SF组,其原因是全淹条件下,植物处于低氧(水体中气体交换速率为大气中的10-4倍)及低光照环境,且水体增加了对植物的静水压力,使植物获取氧气的能力降低,而氧作为植物光合传递链的最终受体,其含量降低将直接导致植物光合能力下降,光合同化产物降低[31,35]。SF组Pn虽低于CK组,但其地上部分仍处于大气环境中,叶片可获得充足的氧气进行光合作用;其次, SF组中牛鞭草还形成不定根,不定根的形成促进了根系对氧气的吸收,从而促进了牛鞭草光合作用的进行。

表3 阶段Ⅲ不同水分处理下叶绿素含量变化(平均值±标准误)
不同字母表示不同处理组之间的差异显著(α=0.05)
水淹影响植物Pn的主要因素为气孔限制和非气孔限制[36]。气孔限制是由于水淹导致植物叶片气孔关闭[40]。有研究表明淹水2 h后,气孔开始关闭[37],其关闭使植物对CO2吸收能力下降,从而导致Pn下降[38-39]。非气孔限制是由于水淹后,植物叶绿体或核酮糖-1,5-二磷酸羧化/加氧酶活性(RuBP)下降,或电子传递、光合磷酸化等过程受阻,从而导致Pn下降[36,38,40]。Gs与植物Pn和耐淹性密切相关,许多研究表明,Gs下降使植物CO2吸收量下降[41],细胞间较低的CO2浓度以及光合作用中相关酶底物浓度的减少,直接导致植物Pn下降[42]。而在本研究中,第一、二阶段SF组Gs与CK组无显著差异(图1,图2),说明牛鞭草Pn下降可能是通过影响RuBP羧化酶活性等非气孔因素所引起的[43]。与SF组不同的是,牛鞭草TF组Gs显著高于CK组(图1)。其原因可能是全淹条件下,牛鞭草形成适应水淹环境的水生叶,较薄的水生叶使叶片中水分蒸腾作用加快,从而有利于多余水分的排出,维持植物正常的生长,表现出一定的耐受特性[44]。
Farquhar等[45]曾提出,通过胞间CO2浓度(Ci)和气孔限制值(Ls)两个参数可判定影响植物光合速率下降的主要原因是由气孔限制或非气孔限制引起的。若植物Pn和Ci均下降,Ls增加,则认为气孔关闭是影响植物净光合速率下降的主要原因;若Pn和Ls下降,Ci增加,说明非气孔限制是导致植物净光合速率下降的主要原因。在本研究中,牛鞭草SF和TF组在第一、二阶段结束后,Ci显著高于CK组(图1,图2),而Ls显著低于CK组(图1,图2),由此可得出水淹导致牛鞭草Pn下降是由非气孔限制因素所引起的。
叶绿素a(chla)、叶绿素b(chlb)和类胡萝卜素(car)是植物光合作用中最主要的几种光合色素,具有吸收、传递、转化光能的作用[46]。在水淹胁迫下,多数植物光合色素会随着淹水时间的延长显著降低,Yordanova等[40]对大麦(barley)的研究发现,水淹120 h后,叶绿素含量显著低于CK组。光合色素降低,植物光合能力受影响,叶片出现发黄、凋落等现象[33,47]。而在本研究中,牛鞭草SF组chla、chlb、chls与car与CK组间均无显著差异,与香蒲(Typhalatifolia)[48]和落羽杉(Taxodiumdistichum)[49]的研究结果相似,表明表土水淹对牛鞭草光合作用的影响是由代谢抑制等原因造成,而不是叶绿素损伤所致。与SF不同的是,TF的chls显著高于CK组,与对野古草(ArundinellaanomalaSteud.)[50]的研究结果相似,其原因可能是在全淹条件下,牛鞭草通过提高叶绿素含量维持水下光合能力,从而在一定程度上缓解水淹对牛鞭草光合能力的影响。
3.2 干旱对牛鞭草光合特性的影响
三峡库区由于其“冬蓄夏排”的反季节水位变化,植被不仅要经历水淹胁迫,同时还要遭受干旱胁迫的影响。同其他胁迫类似,干旱显著影响植物生理、代谢过程,如生长受限、光合能力和养分吸收下降等[50-52]。光合作用是受水分亏缺影响的主要过程之一[53]。与水淹胁迫相同,气孔关闭也是干旱影响植物净光合速率的主要因素之一[54]。在干旱胁迫下,植物通过气孔关闭限制过多的水分散失以及降低细胞间CO2的浓度,而这种表现形式可认为是阻止植物叶水势降低以及叶片失水的有效方式[55]。在本研究中,CD和SFD组牛鞭草Pn、Gs和Tr均显著低于CK组,与Akram等[56]对狗牙根(Cynodondactylon)的研究结果相似。然而,CD与SFD组两者间的Pn、Gs、Ci和Tr等光合指标均无显著差异(图5),说明前期水淹并未影响牛鞭草对后期干旱胁迫的光合生理响应,其结果与白林利等[18]对水杉(Metasequoiaglyptostroboides)的研究结果相似,推测其原因可能是SFD组水淹去除后,根系获得充足的氧气,为应对后期干旱胁迫,通过促进其根系快速生长(根系生长数据未列出),提高水分传导速率,维持一定的光合速率。另外,CD与SFD组的Ci和Ls与CK组无显著差异。但Ls呈增长趋势,说明CD和SFD组Pn下降的部分原因是由气孔关闭所引起的。与CD和SFD不同的是,TFD组在轻度干旱期间,清晨叶水势虽与CD和SFD组无显著差异,但其Pn、Gs并未进一步下降,而是显著高于CD和SFD组,且与CK无明显差异。其原因可能与TFD组全淹-干旱胁迫条件下植株的渗透调节相关,在本试验后期对牛鞭草营养元素含量的研究发现,TFD组的叶N、K元素含量均高于CK、CD和SFD组,N是光合作用中多种酶的组成成分,K具有调节气孔开闭的作用,其含量的增加有利于植株提高光合同化能力和细胞原生质的保水能力[57-58]。由此,本研究TFD 组Pn和Gs与CK无显著差异,其原因是植物从全淹环境出露后,牛鞭草可通过调节其生理过程(如衰老的淹没组织与新生叶片间的养分再分配等)[59],促进N、K的吸收,提高细胞保水和抗旱能力,从而也进一步反映出前期的水淹胁迫并未增加牛鞭草对后期干旱胁迫光合生理的敏感性。
光合色素作为植物光合作用的重要组成成分,其含量高低在某一程度上反映了植物生长状况和光合能力的强弱[60]。目前,多数研究表明,植物光合色素会随着干旱胁迫时间的延长或强度的增加而显著下降,光合色素的降低将导致光能转化和能量提供受限,进而影响光合作用的正常运转[61-62]。然而,在本研究中,CD和SFD的chla、chlb、chls与CK均无显著差异,而TFD组显著高于CK组,其原因可能是牛鞭草通过增强或维持较高的光合色素含量缓解外界干旱环境影响,或与干旱条件下牛鞭草叶片含水量减少相关,叶片含水量的减少可能是对叶面积减小有补偿作用,是植物维持正常光合速率的生理响应机制之一[63-64]。car不仅是光合色素,还作为一种抗氧化剂,具有清除活性氧,防止膜脂过氧化和保护叶绿体等作用[65-66]。本研究中,CD、SFD和TFD的car含量变化与chla相似,说明轻度干旱条件下,牛鞭草可能通过维持较高的car清除多余的活性氧,降低对叶绿体的损伤,从而对牛鞭草光合机构起到一定的保护作用,这也是牛鞭草对干旱胁迫的适应性表现[55]。
耐旱性较强的植物除降低水分散失外,提高WUE也是应对干旱胁迫的主要方式之一。 叶片水平的WUE不仅能反映光合作用与蒸腾作用之间的关系,也能有效反映植物对水分的利用状况[67-68]。当植物受到水分胁迫时,WUE高低可作为判定植物耐旱性强弱的一个有效指标[69]。有研究表明,在干旱胁迫下,植物水分利用效率增加,较高的WUE有利于植物维持碳同化产物的增加,从而表现出一定的耐旱性[70-71]。在本研究中,牛鞭草CD和SFD组WUE均显著高于CK组,说明在轻度干旱胁迫条件下,牛鞭草通过提高WUE以应对水分供应不足的情况,从而表现出对干旱胁迫具有一定的耐受特性[72]。其结果与前人对大豆(Glycinemax)[73]、胡杨(Populuseuphratica)[74]的研究结果相似。另外,由本研究结果可知,牛鞭草CD、SFD和TFD 3组间WUE均无显著差异,说明牛鞭草经历长时期水淹后,并未增加对后期干旱胁迫水分利用效率的敏感性。
3.3 复水对牛鞭草光合特性的影响
水分胁迫去除后,对耐受性较强的植物而言,其生理、代谢等过程将逐渐恢复,如气孔开放、光合速率上升和过氧化物含量下降等,但恢复的程度与物种和胁迫的时间、强度有关[41,75]。恢复能力越快的植物其胁迫耐受性越强。如王磊等[76]对小麦(Triticumaestivum)的研究中,发现在干旱胁迫去除后,小麦Pn能快速恢复,部分品种Pn甚至高于CK组。本研究中,CD和SFD组复水30 d后,其Pn、Gs等光合指标均与CK组无明显差异,表明牛鞭草能快速恢复生长及光合能力,以抵消胁迫期间的损失,从而表现出对环境的适应性[77]。
水淹胁迫期间,由于水体中较低的气体交换速率和低光照等因素,植物光合、代谢等生理过程受到显著影响[78]。然而,当水淹胁迫去除后,植物生长及光合等生理过程也会发生一系列变化。如某些植物在水淹胁迫解除后反而出现死亡等现象[44]。导致这种现象出现的原因可能是植物从低氧、低光照的水淹环境直接进入高氧、高光照条件的陆生环境,植物因其不适应高光高氧环境而出现光合系统受损、叶片脱水较快、活性氧含量增加等现象[44]。本研究中,当水淹胁迫去除后,牛鞭草TF组在复水3 d后开始产生新芽,复水30 d后Pn与CK组无明显差异,从而说明牛鞭草可能通过调整其生理过程(如电子传递过程等),适应高光高强环境[21]。另外,牛鞭草在经历水淹和干旱胁迫后,仍具有较高的恢复能力,说明牛鞭草对水淹和干旱均具有较强的耐受性。
4 结论
研究发现,前期水淹并未对牛鞭草后期干旱胁迫的光合生理造成显著影响。牛鞭草虽在一定程度上受到水淹与干旱的影响,但仍表现出较强的耐受性及可塑性,且在复水阶段具有较强的恢复能力,因此可考虑作为库区消落带的修复植物。
[1] 苏维词. 三峡库区消落带的生态环境问题及其调控. 长江科学院院报, 2004, 21(2): 32-34, 41-41.
[2] Yang F, Wang Y, Chan Z L. Perspectives on screening winter-flood-tolerant woody species in the riparian protection forests of the Three Gorges Reservoir. PLoS One, 2014, 9(9): e108725.
[3] Naiman R J, Decamps H. The ecology of interfaces: riparian zones. Annual Review of Ecology and Systematics, 1997, 28(1): 621-658.
[4] Peng C G, Zhang L, Qin H J, Li D H. Revegetation in the water level fluctuation zone of a reservoir: An ideal measure to reduce the input of nutrients and sediment. Ecological Engineering, 2014, 71(1): 574-577.
[5] Tian R, Cao C X, Jia H C, Xu M, Xiang H B, Lei G C, Tian K, Weng J N, Cao H H. Health assessment of the water-level-fluctuation zone (WLFZ) in the Three Gorges area based on spatial information technology//Proceedings of the 2012 IEEE International Geoscience and Remote Sensing Symposium. Munich: IEEE, 2012: 7236-7239.
[6] 郭泉水, 康义, 洪明, 金江群, 朱妮妮, 聂必红, 王佐庆. 三峡库区消落带陆生植被对首次水陆生境变化的响应. 林业科学, 2013, 49(5): 1-9.
[7] 李昌晓, 钟章成. 三峡库区消落带土壤水分变化条件下池杉幼苗光合生理响应的模拟研究. 水生生物学报, 2005, 29(6): 712-716.
[8] Mommer L, Pedersen O, Visser E J W. Acclimation of a terrestrial plant to submergence facilitates gas exchange under water. Plant, Cell & Environment, 2004, 27(10): 1281-1287.
[9] Perata P, Armstrong W, Voesenek L A C J. Plants and flooding stress. New Phytologist, 2011, 190(2): 269-273.
[10] Kozlowski T T, Pallardy S G. Acclimation and adaptive responses of woody plants to environmental stresses. The Botanical Review, 2002, 68(2): 270-334.
[11] Colmer T D, Pedersen O. Underwater photosynthesis and respiration in leaves of submerged wetland plants: gas films improve CO2and O2exchange. New Phytologist, 2008, 177(4): 918-926.
[12] 王海锋, 曾波, 李娅, 乔普, 叶小齐, 罗芳丽. 长期完全水淹对4种三峡库区岸生植物存活及恢复生长的影响. 植物生态学报, 2008, 32(5): 977-984.
[13] 靳军英, 张卫华, 黄建国. 干旱对扁穗牛鞭草生长, 营养及生理指标的影响. 植物营养与肥料学报, 2011, 17(6): 1545-1550.
[14] 杨盛婷, 黄琳凯, 张新全, 蒋晓梅, 严海东, 黄秀. 干旱胁迫对扁穗牛鞭草叶片抗氧化系统及膜脂过氧化的影响. 热带作物学报, 2013, 34(11): 2083-2089.
[15] 李兆佳, 熊高明, 邓龙强, 谢宗强, 樊大勇. 狗牙根与牛鞭草在三峡库区消落带水淹结束后的抗氧化酶活力. 生态学报, 2013, 33(11): 3362-3369.
[16] Luo F L, Nagel K A, Scharr H, Zeng B, Schurr U, Matsubara S. Recovery dynamics of growth, photosynthesis and carbohydrate accumulation after de-submergence: a comparison between two wetland plants showing escape and quiescence strategies. Annals of Botany, 2011, 107(1): 49-63.
[17] 冯大兰, 黄小辉, 向仲怀, 漆波, 秦俭, 耿养会. 桑树在模拟三峡库区消落带干旱条件下的生长状况及土壤氮磷元素的变化. 蚕业科学, 2013, 39(5): 862-867.
[18] 白林利, 李昌晓. 水淹对水杉苗木耐旱性的影响. 林业科学, 2014, 50(11): 166-174.
[19] Elcan J M, Pezeshki S R. Effects of flooding on susceptibility ofTaxodiumdistichumL. seedlings to drought. Photosynthetica, 2002, 40(2): 177-182.
[20] 李昌晓, 钟章成. 池杉幼苗对不同土壤水分水平的光合生理响应. 林业科学研究, 2006, 19(1): 54-60.
[21] Luo F L, Nagel K A, Zeng B, Schurr U, Matsubara S. Photosynthetic acclimation is important for post-submergence recovery of photosynthesis and growth in two riparian species. Annals of Botany, 2009, 104(7): 1435-1444.
[22] 黄小辉, 刘芸, 李佳杏, 熊兴政, 尹小华, 陈阳, 秦俭, 黄先智, 杜英武. 水分胁迫对三峡库区消落带桑树幼苗生理特性的影响. 林业科学, 2013, 48(12): 122-127.
[23] Pezeshki S R. Root responses of flood-tolerant and flood-sensitive tree species to soil redox conditions. Trees, 1991, 5(3): 180-186.
[24] 谭淑端, 张守君, 张克荣, 党海山, 黎明, 张全发. 长期深淹对三峡库区三种草本植物的恢复生长及光合特性的影响. 武汉植物学研究, 2009, 27(4): 391-396.
[25] Yang Y H, Wu J C, Wu P. Effects of superabsorbent polymer on the physiological characteristics of wheat under drought stress and rehydration. African Journal of Biotechnology, 2011, 10(66): 14836-14843.
[26] 高俊凤. 植物生理学实验指导. 北京: 高等教育出版社, 2006: 74-77.
[27] Pezeshki S R, DeLaune R D. Soil oxidation-reduction in wetlands and its impact on plant functioning. Biology, 2012, 1(2): 196-221.
[28] Voesenek L A C J, Colmer T D, Pierik R, Millenaar F F, Peeters A J M. How plants cope with complete submergence. New Phytologist, 2006, 170(2): 213-226.
[29] Panda D, Sharma S G, Sarkar R K. Chlorophyll fluorescence parameters, CO2photosynthetic rate and regeneration capacity as a result of complete submergence and subsequent re-emergence in rice (OryzasativaL.). Aquatic Botany, 2008, 88(2): 127-133.
[30] Mommer L, Pons T L, Visser E J W. Photosynthetic consequences of phenotypic plasticity in response to submergence:Rumexpalustrisas a case study. Journal of Experimental Botany, 2006, 57(2): 283-290.
[31] Mommer L, Pons T L, Wolters-Arts M, Venema J H, Visser E J W. Submergence-induced morphological, anatomical, and biochemical responses in a terrestrial species affect gas diffusion resistance and photosynthetic performance. Plant Physiology, 2005, 139(1): 497-508.
[32] Chen H G, Qualls R G, Blank R R. Effect of soil flooding on photosynthesis, carbohydrate partitioning and nutrient uptake in the invasive exoticLepidiumlatifolium. Aquatic Botany, 2005, 82(4): 250-268.
[33] Islam M A, Macdonald S E. Ecophysiological adaptations of black spruce (Piceamariana) and tamarack (Larixlaricina) seedlings to flooding. Trees, 2004, 18(1): 35-42.
[34] 刘泽彬, 程瑞梅, 肖文发, 郭泉水, 王娜. 模拟水淹对中华蚊母树生长及光合特性的影响. 林业科学, 2014, 50(9): 73-81.
[35] Chen H G J, Zamorano M F, Ivanoff D. Effect of flooding depth on growth, biomass, photosynthesis, and chlorophyll fluorescence ofTyphadomingensis. Wetlands, 2010, 30(5): 957-965.
[36] Pezeshki S R. Wetland plant responses to soil flooding. Environmental and Experimental Botany, 2001, 46(3): 299-312.
[37] Jackson M B. Long-distance signalling from roots to shoots assessed: the flooding story. Journal of Experimental Botany, 2002, 53(367): 175-181.
[38] Tang Z C, Kozlowski T T. Some physiological and morphological responses ofQuercusmacrocarpaseedlings to flooding. Canadian Journal of Forest Research, 1982, 12(2): 196-202.
[39] Striker G G. Flooding stress on plants: anatomical, morphological and physiological responses. Ⅰ Rijeka-Croatia: Intech Open Access Publisher, 2012:1-28.
[40] Yordanova R Y, Popova L P. Photosynthetic response of barley plants to soil flooding. Photosynthetica, 2001, 39(4): 515-520.
[41] Verma K K, Singh M, Gupta R K, Verma C L. Photosynthetic gas exchange, chlorophyll fluorescence, antioxidant enzymes, and growth responses ofJatrophacurcasduring soil flooding. Turkish Journal of Botany, 2014, 38(1): 130-140.
[42] Zhao H F, Zhao Y, Zhang C, Tao X, Xu X N. Growth, leaf gas exchange, and chlorophyll fluorescence responses of two cultivars ofSalixintegraThunb. to waterlogging stress. Journal of Agricultural Science and Technology, 2014, 16(1): 137-146.
[43] Pierce S C, Pezeshki S R, Moore M T. Ditch plant response to variable flooding: A case study ofLeersiaoryzoides(rice cutgrass). Journal of Soil and Water Conservation, 2007, 62(4): 216-225.
[44] 刘云峰, 秦洪文, 石雷, 张会金, 刘立安, 姜闯道, 王德炉. 水淹对水芹叶片结构和光系统Ⅱ光抑制的影响. 植物学报, 2010, 45(4): 426-434.
[45] Farquhar G D, Sharkey T D. Stomatal conductance and photosynthesis. Annual Review of Plant Physiology, 1982, 33(1): 317-345.
[46] Ronzhina D A, Nekrasova G F, Ppyankov V I. Comparative characterization of the pigment complex in emergent, floating and submerged leaves of hydrophytes. Russian Journal of Plant Physiology, 2004, 51(1): 21-27.
[47] 衣英华, 樊大勇, 谢宗强, 陈芳清. 模拟淹水对枫杨和栓皮栎气体交换, 叶绿素荧光和水势的影响. 植物生态学报, 2006, 30(6): 960-968.
[48] Li S, Pezeshki S R, Goodwin S. Effects of soil moisture regimes on photosynthesis and growth in cattail (Typhalatifolia). Acta Oecologica, 2004, 25(1/2): 17-22.
[49] Pezeshki S R, Pardue J H, DeLaune R D. Leaf gas exchange and growth of flood-tolerant and flood-sensitive tree species under low soil redox conditions. Tree Physiology, 1996, 16(4): 453-458.
[50] 罗芳丽, 王玲, 曾波, 叶小齐, 陈婷, 刘巅, 张艳红. 三峡库区岸生植物野古草(ArundinellaanomalaSteud.)光合作用对水淹的响应. 生态学报, 2006, 26(11): 3602-3609.
[51] Zhou S X, Medlyn B, Sabaté S, Sperlich D, Prentice I C. Short-term water stress impacts on stomatal, mesophyll and biochemical limitations to photosynthesis differ consistently among tree species from contrasting climates. Tree Physiology, 2014, 34(10): 1035-1046.
[52] Akram N A, Shahbaz M, Ashraf M. Nutrient acquisition in differentially adapted populations ofCynodondactylon(L.) Pers. andCenchrusciliarisL. under drought stress. Pakistan Journal of Botany, 2008, 40(4): 1433-1440.
[53] Pinheiro C, Chaves M M. Photosynthesis and drought: can we make metabolic connections from available data?. Journal of Experimental Botany, 2011, 62(3): 869-882.
[54] Gallé A, Haldimann P, Feller U. Photosynthetic performance and water relations in young pubescent oak (Quercuspubescens) trees during drought stress and recovery. New Phytologist, 2007, 174(4): 799-810.
[55] Souza R P, Machado E C, Silva J A B, Lagoa A M M A, Silveira J A G. Photosynthetic gas exchange, chlorophyll fluorescence and some associated metabolic changes in cowpea (Vignaunguiculata) during water stress and recovery. Environmental and Experimental Botany, 2004, 51(1): 45-56.
[56] Akram N A, Shahbaz M, Ashraf M. Relationship of photosynthetic capacity and proline accumulation with the growth of differently adapted populations of two potential grasses (Cynodondactylon(L.) Pers. andCenchrusciliaris(L.) to drought stress. Pakistan Journal of Botany, 2007, 39(3): 777-86.
[57] 潘瑞炽, 王小菁, 李娘辉. 植物生理学. 北京: 高等教育出版社, 2004: 28-55.
[58] Shukla S K, Singh K, Singh B. Biomass productivity and nutrient availability ofCynodondactylon(L.) Pers. growing on soils of different sodicity stress. Biomass and Bioenergy, 2011, 35(8): 3440-3447.
[59] Mauchamp A, Blanch S, Grillas P. Effects of submergence on the growth ofPhragmitesaustralisseedlings. Aquatic Botany, 2001, 69(2/4): 147-164.
[60] 何军, 许兴, 李树华, 米海莉, 张源沛, 赵天成, 马有明. 水分胁迫对牛心朴子叶片光合色素及叶绿素荧光的影响. 西北植物学报, 2004, 24(9): 1549-1598.
[61] 陈昕, 徐宜凤, 张振英. 干旱胁迫下石灰花楸幼苗叶片的解剖结构和光合生理响应. 西北植物学报, 2012, 32(1): 111-116.
[62] Zgallaï H, Steppe K, Lemeur R. Effects of different levels of water stress on leaf water potential, stomatal resistance, protein and chlorophyll content and certain anti-oxidative enzymes in tomato plants. Journal of Integrative Plant Biology, 2006, 48(6): 679-685.
[63] 孙景宽, 李田, 夏江宝, 董波涛. 干旱胁迫对沙枣幼苗根茎叶生长及光合色素的影响. 水土保持通报, 2011, 31(1): 68-71.
[64] 李兰芳, 包维楷, 吴宁. 白刺花幼苗对不同强度干旱胁迫的形态与生理响应. 生态学报, 2009, 29(10): 5406-5416.
[66] Guha A, Sengupta D, Rasineni G K, Reddy A R. Non-enzymatic antioxidative defence in drought-stressed mulberry (MorusindicaL.) genotypes. Trees, 2012, 26(3): 903-918.
[67] Navarrete-Campos D, Bravo L A, Rubilar R A, Emhart V, Sanhueza R. Drought effects on water use efficiency, freezing tolerance and survival ofEucalyptusglobulusandEucalyptusglobulus×nitenscuttings. New Forests, 2013, 44(1): 119-134.
[68] 刘吉利, 赵长星, 吴娜, 王月福, 王铭伦. 苗期干旱及复水对花生光合特性及水分利用效率的影响. 中国农业科学, 2011, 44(3): 469-476.
[69] 曹生奎, 冯起, 司建华, 常宗强, 卓玛错, 席海洋, 苏永红. 植物叶片水分利用效率研究综述. 生态学报, 2009, 29(7): 3882-3892.
[70] Nunes C, de Sousa Araújo S, da Silva J M, Fevereiro M P S, da Silva A B. Physiological responses of the legume modelMedicagotruncatulacv. Jemalong to water deficit. Environmental and Experimental Botany, 2008, 63(1/3): 289-296.
[71] Swarthout D, Harper E, Judd S, Gonthier D, Shyne R, Stowe T, Bultman T. Measures of leaf-level water-use efficiency in drought stressed endophyte infected and non-infected tall fescue grasses. Environmental and Experimental Botany, 2009, 66(1): 88-93.
[72] 王振夏, 魏虹, 李昌晓, 吕茜, 周珺, 高伟, 陈伟. 土壤水分交替变化对湿地松幼苗光合特性的影响. 西北植物学报, 2012, 32(5): 980-987.
[73] Earl H J. Stomatal and non-stomatal restrictions to carbon assimilation in soybean (Glycinemax) lines differing in water use efficiency. Environmental and Experimental Botany, 2002, 48(3): 237-246.
[74] 李志军, 罗青红, 伍维模, 韩路. 干旱胁迫对胡杨和灰叶胡杨光合作用及叶绿素荧光特性的影响. 干旱区研究, 2009, 26(1): 45-52.
[75] Xu Z Z, Zhou G S, Shimizu H. Plant responses to drought and rewatering. Plant Signaling & Behavior, 2010, 5(6): 649-654.
[76] 王磊, 张彤, 丁圣彦. 干旱和复水对不同倍性小麦光合生理生态的影响. 生态学报, 2008, 28(4): 1593-1600.
[77] Wang L, Zhang T, Ding S Y. Effect of drought and rewatering on photosynthetic physioecological characteristics of soybean. Acta Ecologica Sinica, 2006, 26(7): 2073-2078.
[78] Simova-Stoilova L, Demirevska K, Kingston-Smith A, Feller U. Involvement of the leaf antioxidant system in the response to soil flooding in twoTrifoliumgenotypes differing in their tolerance to waterlogging. Plant Science, 2012, 183(9): 43-49.
Effects of flooding on the photosynthetic response of Hemarthria altissima to drought
HAN Wenjiao, BAI Linli, LI Changxiao*, CUI Zhen, YAN Jiangwei, QIN Hong
Key Laboratory of Eco-Environments in Three Gorges Reservoir Region (Ministry of Education), Chongqing Key Laboratory of Plant Ecology and Resources in Three Gorges Reservoir Region, School of Life Science, Southwest University, Chongqing 400715, China
In the hydro-fluctuation belt of the Three Gorges Reservoir Area (TGRA), plants are subjected to a long period of flooding which can affect their growth and survival. In additional, when the flooding recedes, plants may experience drought stress that can also affect their growth and photosynthesis. Thus, screening for suitable species that can survive these fluctuating conditions is necessary for the successful restoration of vegetation to the hydro-fluctuation belt of the TGRA.Hemarthriaaltissima, a plant commonly found in the TGRA, may be one such suitable plant in the remediation process of the hydro-fluctuation belt.H.altissimahas a high survival rate and is well adapted to flooding; however, the response of these plants to drought following flooding and the physiological mechanisms behind this response are unknown. In order to characterize these mechanisms, we studied leaf gas exchange, stomatal limitation (Ls), and water use efficiency (WUE) inH.altissimaunder different water regimes in the hydro-fluctuation belt of the TGRA. We applied the following six water regimes: control (CK, soil water content 60%—63% of soil water field capacity), soilsurface flooding (SF, with water level 5 cm above the soil surface), total flooding (TF, with water level 1 m above the soil surface), control-drought (CD, control group followed by drought treatment), soil surface flooding-drought (SFD, soil surface flooding followed by drought) and total flooding-drought (TFD, total flooding followed by drought). Net photosynthetic rate (Pn), transpiration rate (Tr),Ls, and WUE ofH.altissimain the SF and TF groups were significantly lower than that in the control group, whereas the intercellular CO2concentration (Ci) in SF and TF were significantly higher than in the control group after the end of flooding stress, which indicated that the decrease inPnmay be attributed to non-stomatal limitation. Under drought stress,Pn,Gs, andTrin groups CD and SFD were significantly lower than in the control group, whereas in TFD, they showed no significant differences to the control after the end of drought stress. In contrast to the SF and TF groups,Ciin the CD, SFD, and TFD groups was slightly lower than that in the control group. However,Lsin the CD, SFD, and TFD groups increased under drought stress, indicating that stomatal limitation could be the main cause of the decline ofPn. WUE in the CD, SFD, and TFD groups was significantly higher than in the control group, indicatingH.altissimacoped with water stress by increasing WUE. By the end of the recovery period, thePn,Gs,Ci,Tr,Ls, and WUE of the SF, TF, CD, SFD, and TFD groups showed no significant difference to those of the control, indicating thatH.altissimacan adapt to flooding followed by drought stress. Previous flooding did not affect the subsequent sensitivity ofH.altissimato drought. This characteristic ofH.altissimais beneficial to its potential survival when transplanted to the hydro-fluctuation belt of the TGRA.
The Three Gorges Reservoir Area; riparian zone;Hemarthriaaltissima; photosynthesis; flooding; drought stress
重庆市林业重点科技攻关项目(渝林科研2015-6);重庆市自然科学基金重点项目(CSTC2013JJB00004);中央高校基本科研业务费专项资金项目(XDJK2013A011);中央财政林业科技推广示范项目(渝林科推 [2014|10])
2015-07-18;
2016-03-21
10.5846/stxb201507181513
*通讯作者Corresponding author.E-mail: lichangx@swu.edu.cn
韩文娇,白林利,李昌晓,崔振,燕江伟,秦红.前期水淹对牛鞭草后期干旱胁迫光合生理响应的影响.生态学报,2016,36(18):5712-5724.
Han W J, Bai L L, Li C X, Cui Z, Yan J W, Qin H.Effects of flooding on the photosynthetic response ofHemarthriaaltissimato drought.Acta Ecologica Sinica,2016,36(18):5712-5724.

