苏云金芽孢杆菌酵解大西洋鲑加工废弃物制备抗氧化酵解液研究
陈 琳, 李秉钧, 冯俊荣, 于本淑, 韩恭文
(1 烟台大学海洋学院,山东 烟台 264005;2 山东省水生生物资源养护管理中心,山东 烟台 26400;3 龙口市水产技术推广站,山东 龙口 265700)
苏云金芽孢杆菌酵解大西洋鲑加工废弃物制备抗氧化酵解液研究
陈 琳1, 李秉钧1, 冯俊荣1, 于本淑2, 韩恭文3
(1 烟台大学海洋学院,山东 烟台 264005;2 山东省水生生物资源养护管理中心,山东 烟台 26400;3 龙口市水产技术推广站,山东 龙口 265700)
为减少因大西洋鲑加工废弃物中的蛋白成分而造成的环境污染和资源浪费,同时提高其综合利用价值,探索以大西洋鲑加工废弃物制成的干粉为原料,使用一株苏云金芽孢杆菌,通过控制料液比、接种量、发酵时间、温度、pH和菌龄等发酵条件来酵解鱼粉,以制取抗氧化酵解液。首先以总抗氧化活性和α-氨基氮含量为指标,找到最佳单因素条件;然后在单因素试验的基础上,以水解度和总抗氧化活性为指标,使用正交实验 L25(56)对发酵条件进行优化,确定最佳发酵条件为:料液比2.0 g/50 mL,接种量3%,发酵时间72 h,温度30℃,pH 6.6,菌龄48 h,该条件下酵解得到的发酵液总抗氧化活性为503.59 U,鱼粉水解度为17.29%。研究表明,采用苏云金芽胞杆菌酵解大西洋鲑加工废弃物以制取抗氧化酵解液,具有一定的可行性。
大西洋鲑;废弃物;苏云金芽孢杆菌;酵解;抗氧化酵解液;正交实验
大西洋鲑已在我国成功实现大规模养殖。其加工产生的废弃物中含有大量的蛋白质,直接遗弃不但浪费资源还污染环境[1]。若能有效利用大西洋鲑加工废弃物,将有可能获得更多的蛋白资源[2]。人体内过剩的活性氧自由基,与多种慢性疾病的产生及人体衰老有很大的关系[3-4]。抗氧化是生物体实现自我保护的根本性机制[5]。通过蛋白质可控酶解技术制取的抗氧化肽作为天然的抗氧化剂能很好地解决以上问题[6]。
酶解法是一种获得抗氧化酵解液的有效方式,主要有内源酶酶解法、外源酶酶解法、微生物酵解法[7-8]。微生物酵解法由于其自身的优势已经成为当下研究的热点[9]。苏云金芽孢杆菌作为一种常见微生物被广泛用来生产蛋白酶[10]。使用苏云金芽孢杆菌直接酵解大西洋鲑加工废弃物,来制取抗氧化酵解液的研究尚未见诸报道。
1 材料与方法
1.1 材料与仪器
实验材料、试剂和培养基:大西洋鲑加工废弃物(鱼头、鱼鳍和鱼尾);磷酸氢二钠、琼脂、葡萄糖、磷酸二氢钠、氯化钠、盐酸、氢氧化钠、甲醛等(均为分析纯);总抗氧化能力(T-AOC)测定试剂盒(南京建成生物工程研究所);菌种活化培养基(牛肉膏0.3%、蛋白胨1.0%、氯化钠0.5%、琼脂2.0%、pH 6.6);种子液培养基(葡萄糖0.5%、酵母膏1%、蛋白胨0.5%、氯化钠0.2%、pH 6.6)[11]。
实验仪器:250HG型数显光照震荡培养箱(金坛市精达仪器制造厂);HYQ150生物摇床(武汉汇诚生物科技有限公司);H1650-W型台式高速离心机(湖南湘仪实验室仪器开发有限公司);V-1100D型可见分光光度计(上海美谱达仪器有限公司);LDZM-40KCS型立式压力蒸汽灭菌器(上海申安医疗器械厂);PHS-3CpH计(上海仪电科学仪器股份有限公司)。
1.2 实验方法
1.2.1 大西洋鲑加工废弃物主要成分测定方法
蛋白质含量:微量凯氏定氮法[12];脂肪含量:索氏抽提法[13];灰分测定:灼烧法[14]。
1.2.2 原料处理
原料处理流程[15]:原料切碎→烘干(70℃,24 h)→绞碎→第一次脱脂(乙醇原料比4∶1)→烘干(70℃,2 h)→第二次脱脂(异丙醇原料比2∶1)→烘干(70℃,24 h)→过筛网(120目)。
1.2.3 抗氧化酵解液制备
称取一定量经二次脱脂处理的鱼粉与50 mL相应pH缓冲液混合,为防止外源微生物的干扰,将混合物进行高温蒸汽灭菌,然后再控制时间、接种量、菌龄、温度进行振荡培养(120 r/min),反应结束后,将酵解液置于沸水浴中15 min灭酶,再将酵解液离心(10 000 r/min,10 min),上清液即为所需酵解液[16]。
1.2.4 酵解液生化指标及其测定方法
α-氨基氮含量:甲醛滴定法[14];样品总氮含量:凯氏定氮法[14];总抗氧化活性:使用总抗氧化能力(T-AOC)测定试剂盒,取样0.5 mL[17]。
总抗氧化能力计算公式:
MT-AOC=(A-A0)×(V1/V2)×N×V3×100/30
式中:MT-AOC—总抗氧化能力,U;A—测定光密度(OD)值;A0—对照OD值;V1—反应液总量,mL;V2—取样量,mL;N—样本测试前稀释倍数;V3—发酵液体积,mL。
水解度计算公式:
S=M1/M2×100%
式中:S—水解度,%;M1—上清液中氨基氮总含量,mg;M2—样品中总氮含量,mg。
1.2.5 实验设计
以总抗氧化能力和氨基氮含量为指标,考察温度、酵解时间、接种量、pH、料液比、菌龄6个因素对酵解反应的影响,并进行单因素实验,确定最适单因素条件。在单因素实验基础上,以总抗氧化能力和水解度为指标,采用L25(56)正交表进行正交实验设计,确定大西洋鲑加工废弃物的最佳酵解条件。
2 结果与分析
2.1 大西洋鲑加工废弃物鱼粉的主要成分
大西洋鲑加工废弃物制备的脱脂鱼粉中含有大量的蛋白质,可以经过进一步加工将其酶解制成抗氧化肽,以增大其综合利用价值以及水产养殖企业的经济效益,缓解水产加工原料不足的状况。脱脂鱼粉的蛋白质、脂肪和灰分的含量分别为(70.596±0.247)%、(3.074±0.071)%和(25.153±0.236)%;未脱脂鱼粉的蛋白质、脂肪和灰分的含量分别为(47.504±0.315)%、(37.322±0.412)%和(13.477±0.334)%。
2.2 单因素试验结果
2.2.1 最适料液比的确定
在固定发酵时间24h、温度30℃、pH6.6、接种量2%、菌龄24h的条件下进行发酵实验,考察不同料液比对总抗氧化活性和氨基氮含量的影响(图1)。随着料液比的增大,总抗氧化活性和氨基氮含量均呈现出增长的趋势,开始时增长迅速,但在达到1.25g/50mL之后增速放缓。其原因是微生物释放的胞外酶酶解反应必须在水溶液中进行,因为蛋白酶必须溶解在相应的缓冲液中才能均匀分散在整个体系中,与底物接触并对其发生作用[18],底物浓度过高会导致流动性差,阻碍酶与底物接触,使反应速率降低[19]。

图1 不同料液比对总抗氧化活性和 氨基氮含量的影响Fig.1 Effect of material-solvent ratio on total antioxidantactivity and amino nitrogen content
除此之外,由于苏云金芽孢杆菌的种内竞争作用,菌量在一定时间之后是稳定的,从而使得蛋白酶的释放量也稳定,在1.25g/50mL时蛋白酶处于饱和状态,所以料液比的继续增大对总抗氧化活性和氨基氮含量的影响减小。因此,确定最适料液比为1.25g/50mL,此时总抗氧化活性为283.05U,氨基氮含量为20.16mg/100mL。
2.2.2 最适接种量的确定
为探索最适接种量,以总抗氧化活性和氨基氮含量为指标,在固定料液比1.25g/50mL、发酵时间24h、温度30℃、pH6.6、菌龄24h的条件下进行发酵实验(图2)。

图2 不同接种量对总抗氧化活性和 氨基氮含量的影响Fig.2 Effect of inoculum quantity on total antioxidantactivity and amino nitrogen content
在接种量低于2%时,总抗氧化活性和氨基氮含量随着接种量的增加而增长;高于2%之后,氨基氮含量趋于稳定而总抗氧化活性略有波动。其原因是,接种的菌株前期主要是数目的扩增。接种量较低时达到饱和要耗费更多时间,接种量高于2%时可以很快增殖到饱和,菌量稳定后,释放到环境中的胞外酶量也稳定,但由于料液比已固定,所以与鱼粉反应的酶量也趋于饱和,导致氨基氮含量指标的稳定。接种量3.5%的总抗氧化活性与2.0%相比提升不多。因此,确定最适接种量为2%。
2.2.3 最适反应温度的确定
在26~42℃范围内考察发酵温度对总抗氧化活性和氨基氮含量的影响,其他条件为:料液比1.25g/50mL,酵解时间48h,接种量2%,pH7.4,菌龄24h。温度不仅影响苏云金芽孢杆菌数目的扩增,而且影响蛋白酶的酶活。从图3可以看出,在30℃时总抗氧化活性为453.75U、氨基氮含量为31.8mg/100mL,前者达到最大值,后者趋于最大值。因此,确定最适发酵温度为30℃。

图3 温度对总抗氧化活性和 氨基氮含量的影响Fig.3 Effect of temperature on total antioxidantactivity and amino nitrogen content
2.2.4 最适pH的确定
在固定料液比1.25g/50mL、发酵时间24h、温度30℃、接种量2%、菌龄24h的条件进行发酵,当pH5.8~6.2时氨基氮含量增长迅速,而在pH6.2~7.8时增长放缓,但总抗氧化活性不断增长,并在pH7.4时达到最大值。其原因是,苏云金芽孢杆菌可产生若干种胞外蛋白酶,最适pH为6.2~7.8,在此范围内,蛋白质底物均可被水解,其中pH7.4时的蛋白酶可水解鱼粉蛋白,产生最大量的抗氧化肽。因此,确定最适pH为7.4。
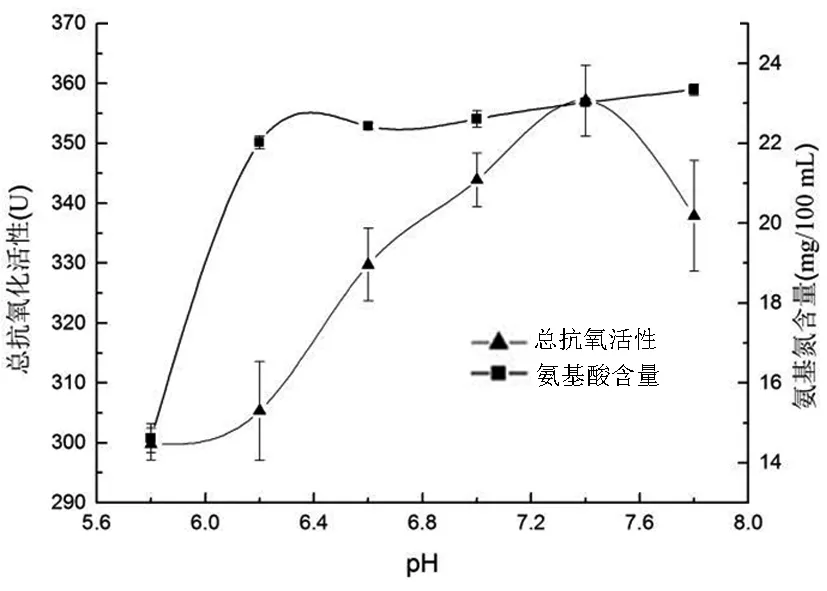
图4 不同pH对总抗氧化活性和 氨基氮含量的影响Fig.4 Effect of pH on total antioxidantactivity and amino nitrogen content
2.2.5 最适酵解时间的确定
酵解时间是发酵工艺的一个重要因素。为找到最佳酵解时间,在实验固定料液比1.25g/50mL、温度30℃、接种量2%、pH7.4、菌龄24h的条件下分析不同发酵时间对总抗氧化活性和氨基氮含量的影响(图5)。总抗氧化活性总体上呈先增长后下降趋势;而氨基氮含量在前24h随时间迅速增长,24h之后增速放缓。这与郑毅等[20]的实验结果相同。在48h后总抗氧化活性出现降低的情况,这可能是因为在48h之后随着营养物质的消耗,苏云金芽孢杆菌进入衰老期,新陈代谢活动减弱,从而产酶量降低,使得氨基氮含量趋于稳定,部分抗氧化肽消耗用于缓解衰老的缘由。综合考虑,确定最适酵解时间为48h,这时总抗氧化活性为287.82U。

图5 不同酵解时间对总抗氧化活性和 氨基氮含量的影响Fig.5 Effect of time on total antioxidantactivity and amino nitrogen content
2.2.6 最适菌龄的确定
在固定料液比1.25g/50mL、酵解时间48h、接种量2%、pH7.4、温度30℃的条件下分析不同菌龄对总抗氧化活性和氨基氮含量的影响。不同菌龄的菌种处于不同的生长阶段,用对数期的菌种接种,则子代培养物的延滞期就短,反之如果用延滞期或者衰亡期的菌种接种,则子代培养物的延滞期就长。从图6中可以看出,使用菌龄24h的种子液发酵时,总抗氧化活性为421.34U,达到
最大值,而12h菌龄的种子液细菌相对数量较少,因此,总抗氧化活性和氨基氮含量较低。大于24h菌龄的种子液或处于稳定期或处于衰亡期,子代均需经过较长的延滞期才能达到对数期。因此,确定最适菌龄为24h。

图6 菌龄对总抗氧化活性和 氨基氮含量的影响Fig.6 Effect of cell age on total antioxidantactivity and amino nitrogen content
2.3 正交试验优化结果
根据已知的单因素试验结果,应用正交试验对其酵解条件进行优化,确定其最佳酵解工艺条件(表1)。表中:A—料液比,g/50mL;B—接种量,mL/100mL;C—时间,h;D—温度,℃;E—pH;F—菌龄,h。

表1 正交试验因素与水平L25(56)Tab.1 Factors and levels in L25(56)orthogonal array design
以水解度和总抗氧化活性(简称总抗)为指标,分析表2的正交设计方案,以确定最佳反应条件。正交实验结果分析见表2、表3、表4。

表2 正交试验方案与结果分析Tab.2 The design and results of orthogonal test

表3 以水解度为指标的正交试验方差分析结果Tab.3 Analysis of variance by comparing the degree of hydrolysis

表4 以总抗为指标的正交试验方差分析结果Tab.4 Analysis of variance by comparing the total antioxidant activity
用苏云金芽孢杆菌发酵大西洋鲑加工废弃物制成的鱼粉时,以水解度为指标,从表3可以看出,6个因素对水解度均有显著性影响(P<0.05);由极差分析表2发现相关因素的影响程度依次为:发酵时间,温度,pH,料液比,菌龄,接种量;最佳实验组合为:料液比1.0 g/50 mL,接种量2%,发酵时间60 h,温度34℃,pH 6.6,菌龄12 h。以总抗氧化活性为指标,从表4可以发现,6个因素对水解度均有显著性影响(P<0.05);由极差分析表2发现相关因素的影响程度依次为:温度,料液比,发酵时间,接种量,pH,菌龄;最佳实验组合为:料液比2.0 g/50 mL,接种量3%,发酵时间72 h,温度30℃,pH 6.6,菌龄48 h。
上述两个最佳组合并未出现在正交表中,需要对其进行验证实验。采用两组优化工艺参数对大西洋鲑鱼加工废弃物进行酵解反应,鱼粉水解度分别为27.25%和17.29%,二者具有显著性差异(P<0.05);总抗氧化活性分别为282.88 U和503.59 U,二者具有显著性差异(P<0.05)。与表2中的数据比对发现,优化后的水解度最优实验组合比正交表中水解度提高了14.40%,总抗氧化活性最优实验组合提高了6.62%。通过两个最优组合比较可以发现,水解度和总抗氧化活性不成正变关系。
艾冰花等[15]使用响应面法优化后苏云金芽孢杆菌鲅鱼肽制备工艺条件为:料液比2.9 g/50 mL,接种量2%,发酵时间48 h,温度30℃,pH 6.6,菌龄24 h,所得总抗氧化活性为537.73U。比较后发现,温度和pH接近,其他因素有差异,但总抗氧化活性接近。分析原因是原料的不同造成各因素间相互作用,以及微生物发酵过程中太多的不可控因素。
3 结论
用苏云金芽孢杆菌发酵大西洋鲑加工废弃物干粉制取抗氧化酵解液,以总抗氧化活性和水解度为指标,在单因素试验的基础上,使用正交法对发酵条件进行优化,两个优化组合在总抗氧化活性和水解度上都有所提高;而温度、料液比、发酵时间、接种量、pH、菌龄等6个因素对总抗氧化活性均有显著影响。优化后得到的最佳反应条件为:料液比2.0 g/50 mL,接种量3%,发酵时间72 h,温度30℃,pH 6.6,菌龄48 h,该条件下酵解得到的发酵液总抗氧化活性为503.59 U,鱼粉水解度为17.29%。研究结果证明,用苏云金芽孢杆菌处理大西洋鲑鱼加工废弃物制取抗氧化酵解液是可行的
□
[1] 闫鸣艳,秦松.酶解刺参内脏蛋白制备抗氧化肽的研究[J].食品工业科技,2013,34(19):115-118.
[2] 裴小平,唐道邦,肖更生,等.抗氧化肽制备的应用现状及趋势[J].食品工业科技,2009,30(2):319-322.
[3] KAWANISHI S,HIRAKU Y,MURATA M,etal.The role of metals in site-specific DNA damage with reference to carcinogenesis[J].Free Radic Biol Med,2002,32:822-832.
[4] SACHIDANANDAME K,FAGAN S C,ERGUL A.Oxidative stress and cardiovascular disease:antioxidants and unresolved issues[J].Cardiovascular Drug Rev,2005,23:115-132.
[5] 樊金娟,罗霞,付岩松,等.米糠抗氧化肽大鼠体外抗氧化作用研究[J].食品科学,2010,31(9):251-254.
[6] CHAN K M,DECKER E A,MEANS W J.Extraction and activity of Carnosine,a naturally occurring antioxidant in beef muscle[J].Food Science,1993,58(1):1-4.
[7] SITTHIPONGi N,SOOTTAWAT B,HIDEKI K,etal.Functionalities and antioxidant properties of protein hydrolysates from the muscle of ornate threadfin bream treated with pepsin from skipjack tuna[J].Food Chemistry,2011,124:1354-1362.
[8] 彭德翔,丁卓平.抗衰老活性肽的研究进展[J].现代食品科技,2006,22(2):267- 270
[9] DEMAIN A L,ADRIO J.Contributions of microorganisms to industrial biology[J].Molecular Biotechnology,2008,38(1):41-55.
[10]CHEN C,LI JY,GUAN X.Optimization of growth medium for bacillus thuringiensis using rotational-combinational design[J].Journal of Fujian Agriculture and Forestry University,2005,34(1):34-36.
[11]艾冰花,李秉钧,冯俊荣.一株产蛋白酶芽孢杆菌紫外诱变育种的初步研究[J].渔业现代化,2015,42(4):39-43.
[12]史玮,孙莹,徐振斌.凯氏定氮法测定粮食蛋白质含量方法研究[J].粮食科技与经济,2013,38(5):31-32.
[13]王玉玲,丁淑芬,宋岩,等.索氏抽提法测定粗脂肪含量方法的探讨[J].粮食加工,2014,39(5):76-77.
[14]大连轻工业学院.食品分析[M].北京:中国轻工业出版社,1994:234-235.
[15]艾冰花,艾丽花,陈琳,等.响应面法优化鲅鱼抗氧化肽发酵条件[J].渔业现代化,2016,43(2):56-61.
[16]温建丰,杨文鸽,徐大伦.响应面法优化花蟹肉制备抗氧化肽的酶解工艺[J].核农学报,2013,27(12):1881-1886.
[17]吴永沛,刘明,倪辉.大豆抗氧化活性肽固态发酵工艺优化[J].中国食品学报,2007(6):52-57.
[18]郑毅,张志国,关雄.苏云金芽孢杆菌蛋白酶发酵动力学模型的构建[J].生物数学学报,2008,23(4):727-734.
[19]PHANTURAT P,BENJAKUL S,VISESSANGUAN W,et al.Use of pyloric caeca extract from bigeye snapper (Priacanthusmacracanthus) for the production of gelatin hydrolysate with antioxidant activity[J].LWT-Food Science and Technology,2010,43(1):86-97.
[20]姜艳喜,张建友,丁玉庭.鱿鱼副产物自溶水解过程的生化变化及其机理[J].食品工业科技,2010,31(12):142-145.
Study on the optimal conditions of preparing antioxidant hydrolysate from Atlantic salmon processing wastes usingBacillusThuringiensis
CHEN Lin1,LI Bingjun1,FENG Junrong1,YU Benshu2,HAN Gongwen3
(1SchoolofOcean,YantaiUniversity,Yantai264005,China;2ShandongHyelrobrosConservationandManagementCenter,Yantai264005,China;3LongkouAquacultureTechnologyExtendingStation,Longkou265700,China)
There are abundant proteins that are of high value in the processing residues of Atlantic salmon (Salmosalar); to avoid waste and environmental pollution caused by throwing them away,and to improve their comprehensive utilization value,the research was conducted where the dry powder made from Atlantic salmon processing residues were hydrolyzed byBacillusThuringiensisto produce antioxidant hydrolysate.The reaction conditions of the enzymatic hydrolysis including material-to-solvent ratio,inoculum quantity,time,temperature,pH and cell age were investigated.Firstly the best single factor was found by comparing the total antioxidant activity and amino nitrogen concentration; then based on single factor experiment and taking the degree of hydrolysis and the total antioxidant activity as indicators,orthogonal experimental design method was used to optimize the hydrolysis conditions,and the optimal conditions were determined by as follows:material-to-solvent ratio 0.7 g/50 mL,inoculum quantity 3%,time 72 h,temperature 30 ℃,pH 6.6 and cell age 48 h; under such conditions the total antioxidant activity and degree of hydrolysis were 503.59 U and 17.29%,respectively.In conclusion,it is feasible and practical to prepare antioxidant hydrolysate from Atlantic salmon processing wastes usingBacillusThuringiensis.
Atlantic salmon; processing wastes;bacillusthuringiensis; enzymolysis; antioxidant hydrolysate; orthogonal experiment
10.3969/j.issn.1007-9580.2016.05.006
2016-07-03
2016-09-20
山东省科技发展计划项目(2012GHY11515)
陈琳(1987—),男,硕士研究生,研究方向:水生生物学。E-mail:641584489@qq.com
李秉钧(1961—),男,教授,研究方向:水产养殖学、遗传育种学、海洋生物技术。E-mail:li6234307@163.com
TS254.9
A
1007-9580(2016)05-028-08

