锦江河特有鱼类国家级水产种质资源保护区浮游动物群落结构
梁正其, 王 慧, 冉 辉, 巴家文,, 李明刚
(1 铜仁学院 生物与农林工程学院,梵净山特色动植物资源重点实验室,贵州 铜仁 554300;2 铜仁市创建国家环境保护模范城市办公室,贵州 铜仁 554300)
锦江河特有鱼类国家级水产种质资源保护区浮游动物群落结构
梁正其1, 王 慧1, 冉 辉1, 巴家文1,2, 李明刚2
(1 铜仁学院 生物与农林工程学院,梵净山特色动植物资源重点实验室,贵州 铜仁 554300;2 铜仁市创建国家环境保护模范城市办公室,贵州 铜仁 554300)
为研究锦江河特有鱼类国家级水产种质资源保护区浮游动物群落结构特征,于2015年1月、4月、7月和10月按季度在锦江河保护区进行采样分析。结果显示,在保护区共采集到浮游动物4门51属82种,轮虫类、原生动物、桡足类和枝角类物种数占浮游动物物种总数的比例分别为46.34% 、29.27% 、15.85% 和 8.54%。优势种类为4门6属16种,其中轮虫类6种,原生动物4种,枝角类4种,桡足类2种。保护区浮游动物密度变幅为297.76~1 430.10 ind/L,平均为 855.13 ind/L;生物量变幅为5.73~26.36 mg/L,平均为14.37 mg/L;群落丰富度指数(Dm)变幅为3.18~4.90,平均为3.96;香农指数(H')变幅为2.11~3.12,平均为2.81;均匀度指数 (J') 变幅为0.81~0.89,平均为0.86。研究表明,在被摄食压力下降及饵料生物资源下降的共同影响下,保护区外界环境对个体较小的原生动物和轮虫有利,群落生态优势度也集中于上述浮游动物类群。受到水文特征的影响,锦江河核心区的浮游动物物种数、密度和生物量以及多样性指数总体高于实验区。
锦江河;水产种质资源;保护区;浮游动物;群落结构;生物多样性指数
锦江河发源于贵州省梵净山南麓,河流呈南北走向,北部最终流入湖南境内,该河宽30~100 m,深3~10 m,流速缓慢,全程158 km,流域面积4 086 km2。2009年经农业部审定,锦江河成为第三批特有鱼类国家级水产种质资源保护区,重点保护区域为贵州省铜仁段,该河段长68.6 km,总面积约980 hm2,主要保护的鱼类为野生鳜、黄颡鱼等。保护区分为核心区和实验区,核心区位于锦江河的三江公园(铜岩)至漾头电站河段,面积约600 hm2,实验区位于江口县龙井社区至三江公园(铜岩),面积约380 hm2。
浮游动物作为次级生产力在水生态系统中起着重要的作用[1-2],并对水生生态系统物质循环和能量流动起关键作用[3]。为了比较系统、全面了解该保护区浮游动物群落结构和水质情况,本文结合锦江河水文特点以及沿途生活污水排放与网箱养殖水体情况设置采样点,对锦江河特有鱼类国家级水产种质资源保护区浮游动物的种类组成、生物量、密度及其四季动态进行研究,利用生物多样性指数对水体进行评价,以期掌握保护区浮游动物群落特征和水质状况,为今后在保护区开展相关资源保护工作积累本底资料。
1 材料与方法
1.1 采样点位置和时间
按照湖泊调查规范,根据锦江河国家级水产种质资源保护区水域特点,设置10个采样点(图1)。
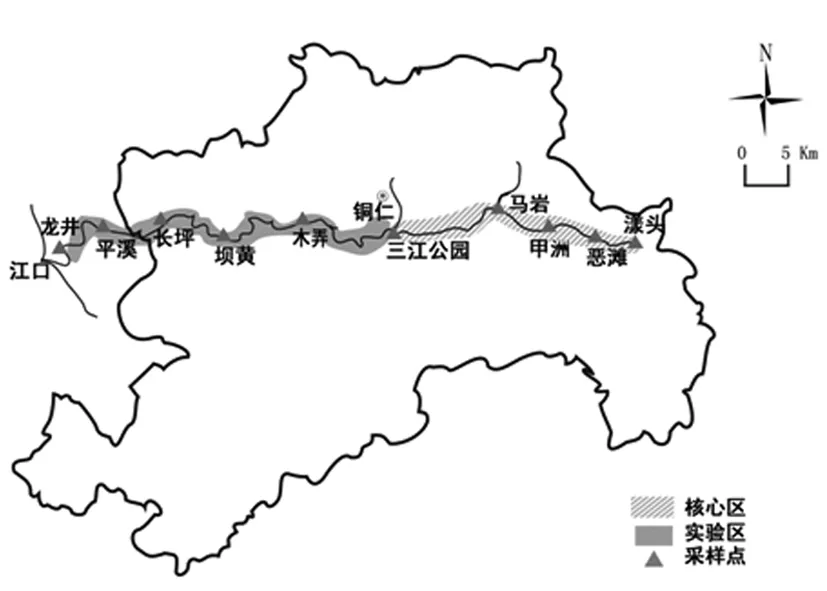
图1 保护区采样点位置示意图Fig.1 Sampling sites in national aquatic germplasm reserve
根据铜仁所处区域气候特点,分别在2015年1月(冬季)、4月(春季)、7月(夏季)和10月(秋季)进行采样。
1.2 浮游动物采集、计数方法
定性样品用25号浮游生物网(孔径64 μm)采集,在水深0~0.5m水层以5 m/s的速度左右拖拉3~5 min,然后装入采样品用5%福尔马林固定,带回实验室在20×10倍光学显微镜下观察分类;原生动物及轮虫定量样品用2 000 mL有机玻璃瓶采水器在水域上层(离河面1 m)、中层(离河面2 m)和下层(离河面3 m)采样,分别采取各层河水2 000 mL,倒入桶内混匀,取出其中1 000 mL,加入1%的鲁哥氏碘液固定,带回实验室后,静置沉淀24 h后浓缩至50 mL供镜检。然后摇匀取出水样,取出0.1 mL样品,利用浮游动物分析框在20×10倍光学显微镜下全片计数原生动物密度(平行3次);取出1 mL浓缩样品至1 mL计数框,在10×10倍显微镜下全片计数轮虫密度(平行3次)。枝角类和桡足类定量样品用采水器在水域上、中、下层采样,分别采取各层河水2 000 mL,混合后经13号浮游动物过滤网过滤后经5%福尔马林固定,浓缩后再用10×10倍显微镜下全部计数。浮游动物分类鉴定均参照《淡水浮游生物研究方法》[7]和《中国淡水生物图谱》[8-10]。
1.3 数据数据及分析
浮游动物的主要生态指数如密度(ind/L)、优势度(Y)、多样性(H')、均匀度(J')和丰富度指数(Dm)按以下公式计算[11-13]:
Y(ni/N)×fi
J′=H′/log2S
Dm=(S-1)/lnN
式中:pi= ni/N;ni—i种的个体数;N—所有种类总个体数;S—物种数。H'值在0~1范围为重污,在1~3范围为中污(其中,1~2为α-中污,2~3为β-中污),>3为轻污或无污。
2 结果
2.1 浮游动物种类组成
在10个采样点4次采样中,共鉴定浮游动物82种,隶属于4门51属,其中轮虫类最多,18属38种,占总数的46.34%;原生动物次之,18属24种,占29.27%;桡足类9属13种,占15.85%;枝角类最少,6属7种,占8.54%。2015年锦江河国家级水产种质资源保护区浮游动物种类组成见表1。
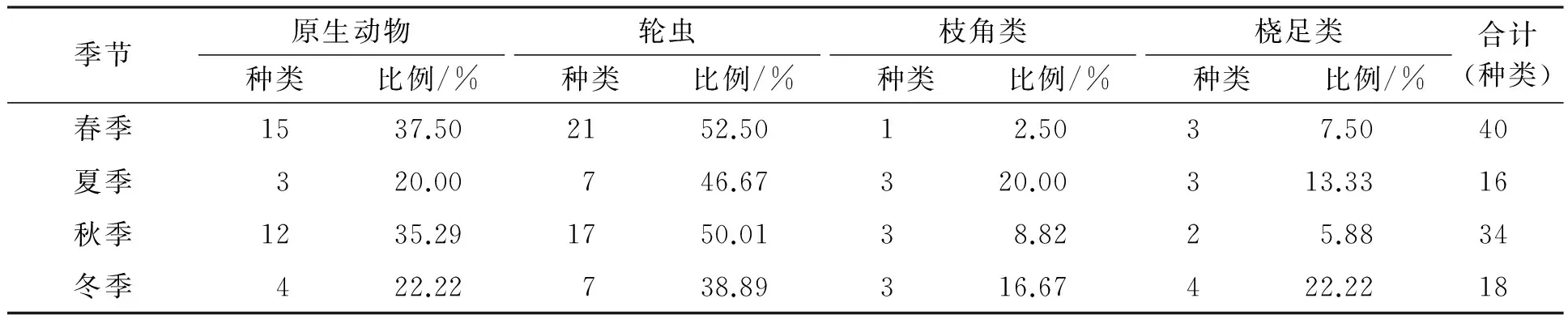
表1 保护区浮游动物种类组成季节变化Tab.1 Seasonal changes of zooplankton species composition in national aquatic germplasm reserve
从表1中可以看出,2015年浮游动物种类数季节变化较大:春季、秋季种类数高于夏季和冬季,且春秋两季浮游动物种类组成上均以小型浮游动物(原生动物和轮虫)占较大比例。无论是春秋季还是夏冬季,本次调查发现保护区浮游动物种类均以轮虫出现的种类数占比例较大,夏季和秋季均占总数的50%以上。可见,保护区浮游动物组成类型是以小型个体为主,大型个体为辅。
2.2 优势种组成及分布
以优势度指数Y≥0.02定为优势种,保护区内共发现浮游动物优势类群为4门6属16种,其中原生动物4属4种,轮虫类6属6种,枝角类3属4种,桡足类1属2种。实验区与核心区优势种组成有所差异(表2)。
注:“—”表示非优势种
2.3 浮游动物群落结构的时空动态变化
2.3.1 浮游动物种类组成的季节变化
原生动物、轮虫类组成的季节变化较大(表3)。
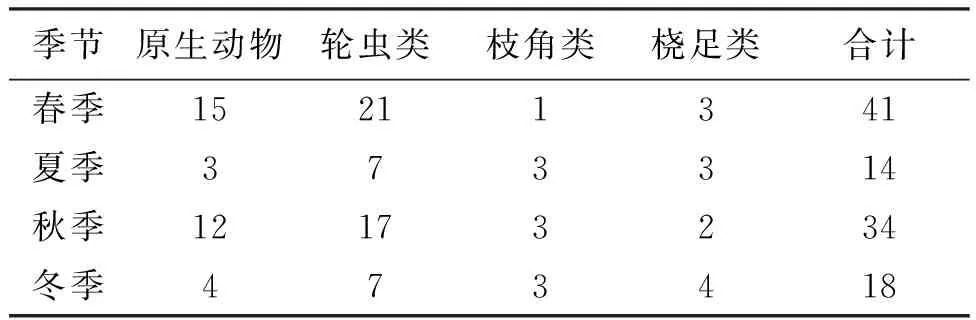
表3 保护区浮游动物的种类数Tab.3 Numbers of zooplankton species in national aquatic germplasm reserve
原生动物在春季最多(15 种),夏季最少(3种);轮虫类在春季最大,达21种,冬季、夏季最少,仅为7种。这种显著的季节性变化,原因可能为气温高的夏季不利于浮游动物的生长,因此随着气温升高,浮游动物有降低的趋势。
2.3.2 浮游动物密度、生物量季节变动趋势
锦江河保护区的浮游动物密度以秋季最高(1.43×103ind/L),其次是夏季(9.61×102ind/L)和春季(7.31×102ind/L),冬季最低(2.97×102ind/L)。浮游动物生物量也是秋季最高(26.36 mg/L),其次是夏季(14.18 mg/L),最少是春季(5.73 mg/L)。
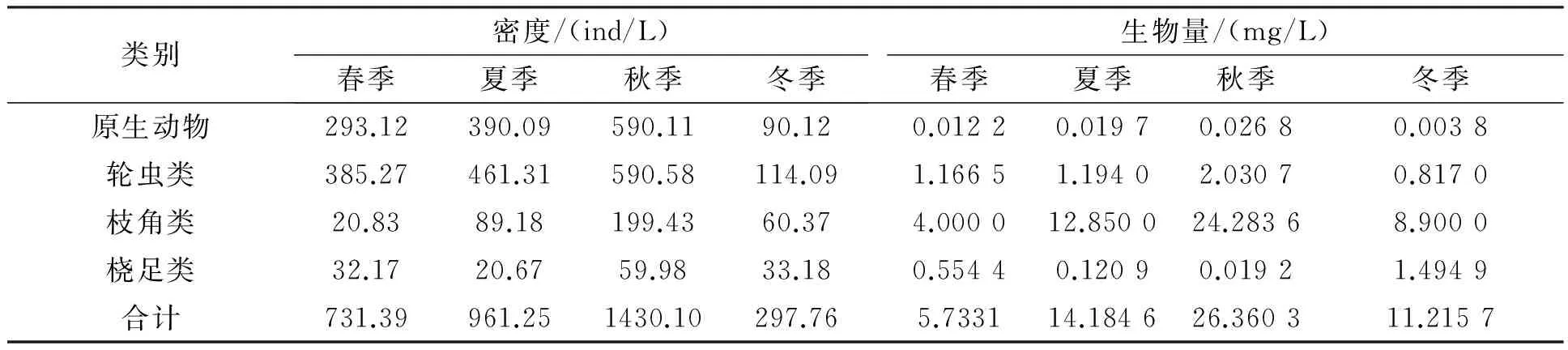
表4 浮游动物密度与生物量的季节变化Tab.4 Seasonal variation of zooplankton density and biomass
2.4 浮游动物群落分布特点
研究表明,保护区不同采样点的浮游动物分布存在一定的差异(表5),其优势群体均为轮虫类和原生动物。在实验区(龙井、平溪、长坪、坝黄、木弄),轮虫类占优势,其中坝黄占比最大(61.48%);而在核心区,轮虫类在甲洲的浮游动物组成中占比最大(60.71%) ,其次是原生动物在恶滩所占比例为50.00%;而枝角类和桡足类在各采样点所占比例变化不大。因此,实验区与核心区的浮游动物组成以小型动物为主,大型浮游动物为辅。
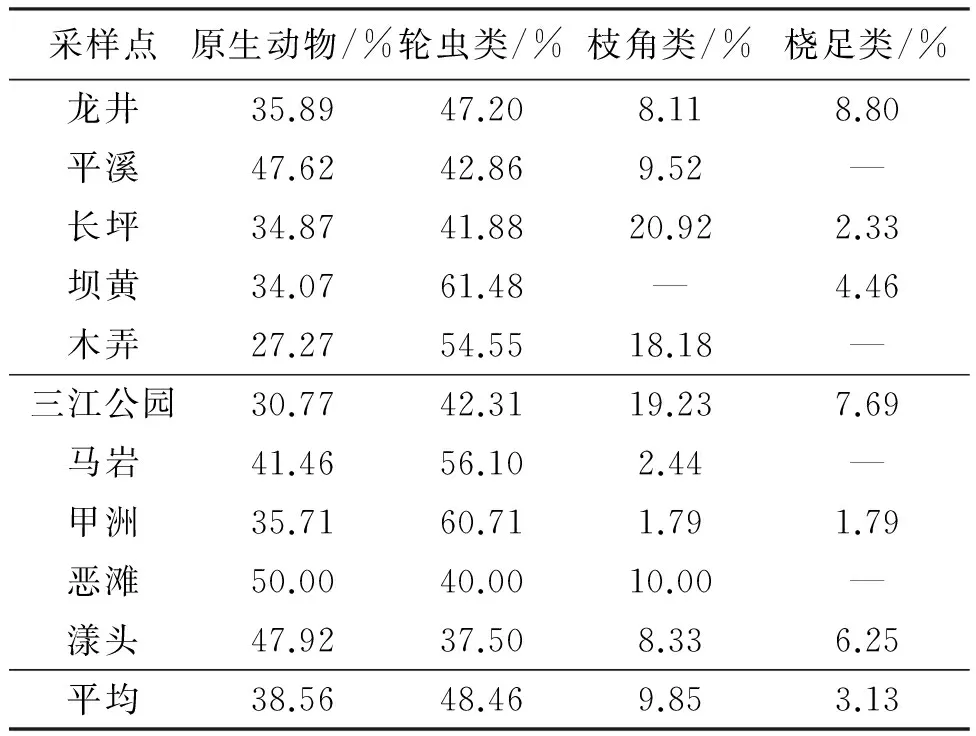
表5 保护区各样点浮游动物密度平均组成百分比Tab.5 Annual average composition of zooplankton density in national aquatic germplasm reserve
注:“—”表示未出现
2.5 浮游动物多样性指数的季节变化与水质的关系
浮游动物群落结构的季节变化将可能导致多样性指数、丰富度指数、均匀度指数产生相应的变化[14]。本研究这3个指数变化趋势基本一致,均在夏季最高。H'和Dm评价标准[15]是指数值越大,水质越好,即浮游动物的种类多样性指数越高,其群落结构越复杂,群落所包含的信息量也越大,稳定性越大,水质越好;多样性指数减小,群落结构趋于简单,稳定性变差,水质下降。锦江河保护区夏季3个指数都达到最大值。
根据水质评价标准[16],夏季、秋季水体洁净度均较高,从H'、Dm值可初步判断该水域达到中污染至清洁。在水体污染较轻或没污染时,生物物种数和种群数量都会较高[17]。从本调查的结果来看,锦江河浮游动物种类多,数量也较高,Shannon多样性指数值普遍较高,表明其水质状况较好。综合本研究的水质评价结果,锦江河保护区整体上为β-中污染或贫营养水平。
3 讨论
3.1 浮游动物空间变化与水质的关系
在正常水体(清洁型水体)中,浮游动物一般有种多、数量少的特点。在重污染的水体,几乎所有的水生生物(除了少数种类的细菌)都难以生存[18]。在较严重或中度富营养化的水体中,绝大多数敏感的浮游动物种类消失,往往是一些耐污染种类形成优势种(以较高数量出现),如萼花臂尾轮虫和椎尾水轮虫[17]。本研究发现,保护区浮游动物中轮虫在四季所占比例均最高,其次是原生动物,这与扎龙自然保护区浮游动物组成情况[5]、嬉子湖国家级水产种质资源保护区冬季浮游动物种类组成的情况[19]基本相同,而与李莉娜[20]、李反修[4]、陈永进[6]等的研究结果有所不同。
在龙井、坝黄、马岩、恶滩地区,萼花臂尾轮虫、椎尾水轮虫为优势种,这些种类作为污染水体的指示种,因保护区龙井、坝黄采样点位于集镇地区,马岩位于市区下方,恶滩为网箱所在区域,污染主要来自城区大量生活污水、工业废水排放以及残饵料、粪便沉积,导致这几个采样点污染相对严重,水体富营养化。保护区其他采样点发现晶囊轮虫、三肢轮虫、叶轮虫、老年低额溞等种类,这些均属于寡污染水体的指示种,因此这些采样点水质较好。根据以上研究结果分析,锦江河保护区全年水质为轻污染。要更好地维持现有水质、改善水质,需要加大污水处理厂建设,处理集镇、市区所占地排入锦江河的污水,拆除保护区内现有网箱,减少饵料、粪便残留带来的污染;同时还要保护和进一步改善河道周边的植被,提高水体的自净能力。
3.2 浮游动物与水产种质资源的关系
浮游动物在水生态系统中既扮演次级生产者,是小型鱼类、虾类及其他水生动物的食物,又扮演消费者角色,摄食浮游植物及细菌碎屑等,控制水体中有害藻类的大量繁生,清除部分腐质碎屑,调节水质[3]。相关研究表明,鳜鱼属凶猛肉食性鱼类,主要摄食鲜活的小杂鱼如鰟鮍、餐条、麦穗鱼、鲫和小虾[21];黄颡鱼食性是肉食性为主的杂食性鱼类,主要摄食小杂鱼,其次是虾以及各种陆生和水生昆虫、小型软体动物和其它水生无脊椎动物[22]。代应贵等[23]对梵净山及邻近地区鱼类资源调查中发现,锦江河中鳅科鱼类、马口鱼、麦穗鱼、鲫、餐条和鰟鮍等鱼类属于小型鱼类优势种,是保护区野生鳜、黄颡鱼的天然生物饵料,而浮游动物为锦江河小型鱼类、虾类等提供丰富的饵料基础。因此,了解锦江河保护区浮游动物群落结构特征,对促进了锦江河鳜、黄颡鱼等特有鱼类水产种质资源的增长,维持种群结构的稳定,具有积极作用。
4 结论
(1)锦江河浮游动物种类丰富,为小型鱼类、虾类等提供丰富的天然饵料,对促进锦江河鳜、黄颡鱼等特有鱼类水产种质资源的增长,更好地保护该水域鳜、黄颡鱼等特有鱼类资源有积极作用。(2)锦江河国家级水产种质资源保护区的水质为β-中污染或贫营养水平,达到渔业用水标准。(3)在被摄食压力下降及饵料生物资源下降的共同影响下,保护区外界环境对个体较小的原生动物和轮虫有利,群落生态优势度也集中于上述浮游动物类群。受到水文特征的影响,锦江河核心区的浮游动物物种数、密度和生物量以及多样性指数总体上高于实验区。
□
[1] CHEN G R,ZHONG P,ZHANG X F,etal.Zooplankton and its relationship with water quality in Huizhou West Lake[J].Journal of Lake Sciences,2008,20(3):351-356.
[2] CHEN Y J,ZHOU Y F,XU D P,etal.Zooplankton community characteristics and ecological assessment of water quality in Eriocheir sinensis,Siniperca chuatsi national aquatic germ plasm resources protected areas[J].Acta Agriculturae Universitatis Jiangxiensis,2014,36(4):833-840.
[3] 邱小琮,赵红雪,孙晓雪.沙湖浮游动物与水环境因子关系的多元分析[J].生态学杂志,2012,31(4):896-901.
[4] 李反修,姜作发,李喆,等.秋季逊别拉河自然保护区浮游动物群落结构特征的初步研究[J].水产学杂志,2013,26(3):43-46.
[5] 赵菲,于洪贤,马成学,等.应用浮游动物群落结构评价扎龙自然保护区的水质现状[J].水产学杂志,2013,26(1):41-45.
[6] 陈永进,周彦锋,徐东坡,等.中华绒螯蟹、鳜鱼保护区浮游动物群落特征与水质生态学评价[J].江西农业大学学报,2014,36(4):833-840.
[7] 章宗涉,黄祥飞.淡水浮游生物研究方法[M].北京:科学出版社,1991:2-414.
[8] 韩茂森,东蕴芳.中国淡水生物图谱[M].北京:海洋出版社,1995:1-375.
[9] 邓坚,李怡庭,林祚顶,等.中国内陆水域常见藻类图谱[M].武汉:长江出版社,2012:6-245
[10]陈橼,龙胜兴,宴妮,等.贵阳市(两湖一库)浮游生物多样性及常见种图集[M].贵州:贵州科技出版社,2011:43-274.
[11]陈清潮,黄良民,尹健强.南沙群岛及其邻近海域海洋生物多样性研究[M].北京:海洋出版社,1994:42-50.
[12]SHNNON C E,WEAVER W,The mathematical theory of commmunication[M].Urbana:University of Illinois Press,1949:11-13.
[13]SOBALLE D M,KIMMEL B L.A large-scale comparison of factors influencing phytoplankton abundance in rivers,lakes,and impoundments[J].Ecology,1987,68(6):1943-1954.
[14]王凤娟,胡子全,汤洁,等.用浮游动物评价巢湖东湖区的水质和营养类型[J].生态科学,2006,25(6):550-553.
[15]李学军,鲍战猛,高彩凤.北运河浮游动物调查及水质评价[J].生态学杂志,2014,33 (6):1559-1564.
[16]况琪军,马沛明,胡征宇,等.湖泊富营养化的藻类生物学评价与治理研究进展[J].安全与环境学报,2005,4 (2):87-91.
[17]陈光荣,钟萍,张修,等.惠州西湖浮游动物及其与水质的关系[J].湖泊科学,2008,20(3):351-356.
[18]许木启.从浮游动物群落结构与功能的变化看府河—白洋淀水体的自净效果[J].水生生物学报,1996,20(3):212-220.
[19]刘凯,蒋书伦,周彦锋,等.嬉子湖国家级水产种质资源保护区冬季浮游动物群落特征及影响因子[J].水生生物学报,2015,24(5):694-699.
[20]李莉娜,陈卫,高思佳,等.北京白河与温榆河浮游动物调查[J].四川动物,2008,27(5):802-803.
[21]杨代勤,陈芳,方长琰.洋圻湖鳜鱼的食性及生长特性[J].水利渔业,1999,19(3):11-12.
[22]袁刚,茹辉军,刘学勤.洞庭湖光泽黄颡鱼食性研究[J].水生生物学报,2011,35(2):270-275.
[23]代应贵,李敏.梵净山及邻近地区鱼类资源的现状[J].生物多样性,2006,14(1):55-64.
Structure of zooplankton community in national aquatic germplasm reserve for endemic fish of Jinjiang River
LIANG Zhengqi1,WANG Hui1,RAN Hui1,BA Jiawen1,2,LI Minggang
(1KeyLaboratoryofSpecialWildlifeResourcesinFanjingMountain,CollegeofBiologicalandAgroforestryEngineering,TongrenUniversity,Tongren,Guizhou554300,China;2TheofficeofcreatinganationalenvironmentalprotectionmodelcityinTongrencity,Tongren,Guizhou554300,China)
In order to explore the structure of zooplankton community in the National Aquatic Germplasm Reserve for Endemic Fish of Jinjiang River in different seasons,water samples were quarterly collected in January,April,July,and December,2015.The analysis results showed that 82 species belonging to 51 genera and 4 phyla were sampled,among which the rotiferos,protozoa,copepod and cladocera accounted for 46.34%,29.27%,15.85% and 8.54%,respectively.Sixteen species of 6 genera and 4 phyla were identified as dominant species,including 6 species of rotiferos,4 of protozoa,4 of cladocera and 2 of copepod.The range of zooplankton density was 297.76-1 430.10 ind/L and the average was 855.13 ind/L.The range of zooplankton biomass was 5.73-26.36 mg/L and the average was 14.37 mg/L.Margalef index (Dm) ranged from 3.18-4.90 with the average being 3.96; Shannon-Weiner index (H') ranged from 2.11-3.12 and the average was 2.81; Peilou index (J') ranged from 0.81-0.89 and the average was 0.86.The study indicated that,under the common influence of both the degressive pressure from predators and the decrease in food organisms,small individuals like protozoa and rotifers could benefit from the external circumstances of the reserve,and as a result,ecological dominance of zooplankton community were inclined to these groups.Besides,impacted by hydrological characteristics,the number,density and biomass of zooplankton species as well as the biodiversity index of the core area of Jinjiang River excelled those of the experimental area in general.
Jinjiang River; national aquatic germplasm; reserve; zooplankton; community structure; biodiversity indices
10.3969/j.issn.1007-9580.2016.05.014
2016-05-03
2016-08-28
贵州省科技厅项目([2014]7481);铜仁市创建国家环境保护模范城市课题(Trcmb16-4);贵州省高等学校重点支持学科[黔教合重点学科字(2011)232]
梁正其(1985—),男,讲师,硕士,研究方向:水生动物繁殖与发育生物学,水环境资源学。E-mail:trxylzq@126.com
S932.7
A
1007-9580(2016)05-071-06

