葡萄牙牡蛎的净化及其低温贮藏研究
祁剑飞, 曾志南, 宁 岳, 巫旗生
(福建省水产研究所,福建省海洋生物增养殖与高值化利用重点实验室,福建省海洋生物资源开发利用协同创新中心,福建 厦门,361013)
葡萄牙牡蛎的净化及其低温贮藏研究
祁剑飞, 曾志南, 宁 岳, 巫旗生
(福建省水产研究所,福建省海洋生物增养殖与高值化利用重点实验室,福建省海洋生物资源开发利用协同创新中心,福建 厦门,361013)
为保证生食葡萄牙牡蛎(Crassostreaangulata)的安全,在贝水比1∶10、水交换率3次/h、水温28℃、盐度28的条件下,采用流水式紫外线杀菌方法净化48 h,检测净化前后13个卫生指标的变化;净化后的牡蛎在冷藏(4℃)和冷冻(-18℃)两种条件下贮藏7 d以上;检测贮藏过程中菌落总数、大肠菌群和主要营养成分的变化。结果显示,经过48 h净化,菌落总数和大肠菌群含量均大幅下降,重金属、化学污染物等指标变化不大;两种贮藏条件下,菌落总数和大肠菌群都呈先下降再上升的变化,但始终处于安全水平内;蛋白质、脂肪、糖原含量缓慢下降,乳酸含量快速上升。研究表明,葡萄牙牡蛎在紫外线杀菌净化48 h后,至少在冷藏6 d或冷冻11 d 内可以保证食品安全。
葡萄牙牡蛎;贝类净化;低温贮藏;水产品加工
葡萄牙牡蛎(Crassostreaangulata)属双壳类、滤食性动物,易富集海水环境中的污染物,包括化学污染物、单胞藻产生的生物毒素,还有各种致病微生物等[1]。许多致病微生物通常与人类的粪便污染相关,因此,粪便指示菌如粪大肠菌群和大肠埃希氏菌也被用来评估是否存在细菌和病毒污染的风险。按照欧盟贝类收获区域分类标准,每100 g贝肉及体液中如果大肠杆菌数大于230,上市前需作净化处理[2]。
贝类净化是通过将贝类放置于盛有清洁海水的容器中,使其进行自身正常的滤食活动,这一过程可持续几小时或几天,从而除去微生物污染。通常结合紫外线、臭氧、氯化物等多种方式进一步促进贝类体内污染物的释放及致病微生物的消除[3-9]。由于净化不能完全去除微生物,在常温下贮藏很容易导致牡蛎腐败,极大地影响牡蛎的品质。而低温贮藏能够抑制中温性细菌的繁殖[10],因此,研究牡蛎在低温贮藏过程中细菌和主要营养物质的变化很有现实意义。
本研究按照《SC/T 3013—2002贝类净化技术规范》[11]的要求,对单体葡萄牙牡蛎进行流水式紫外线杀菌净化处理,检测牡蛎净化前后13项卫生指标的变化,同时观察、研究低温贮藏过程中菌落总数、大肠菌群和主要营养成分的变化,为葡萄牙牡蛎的净化和低温贮藏提供参考资料。
1 材料与方法
1.1 材料
二龄单体葡萄牙牡蛎取自石狮市永宁镇深沪湾。第一批牡蛎,平均壳高(12.41±2.50)cm,平均质量(154.60±38.10) g;第二批牡蛎平均壳高为(10.32±2.32 )cm,平均质量(134.00±28.20)g。净化前物理清除牡蛎表面污损生物,并将外壳洗刷干净。
1.2 方法
1.2.1 净化
海水为沙滤海水,按照文献[12]的要求,配置合适的紫外线灭菌器功率,使得消毒后的海水中大肠菌群含量为0;净化桶容积500 L,下置隔板隔离污物,污物连同废水从底部溢流出净化桶;挑拣外形完好的牡蛎装入筛筐中,个体叠两层,表层水充气,流水式净化。贝水比1∶10,水交换率3次/h,水温28℃,盐度28。
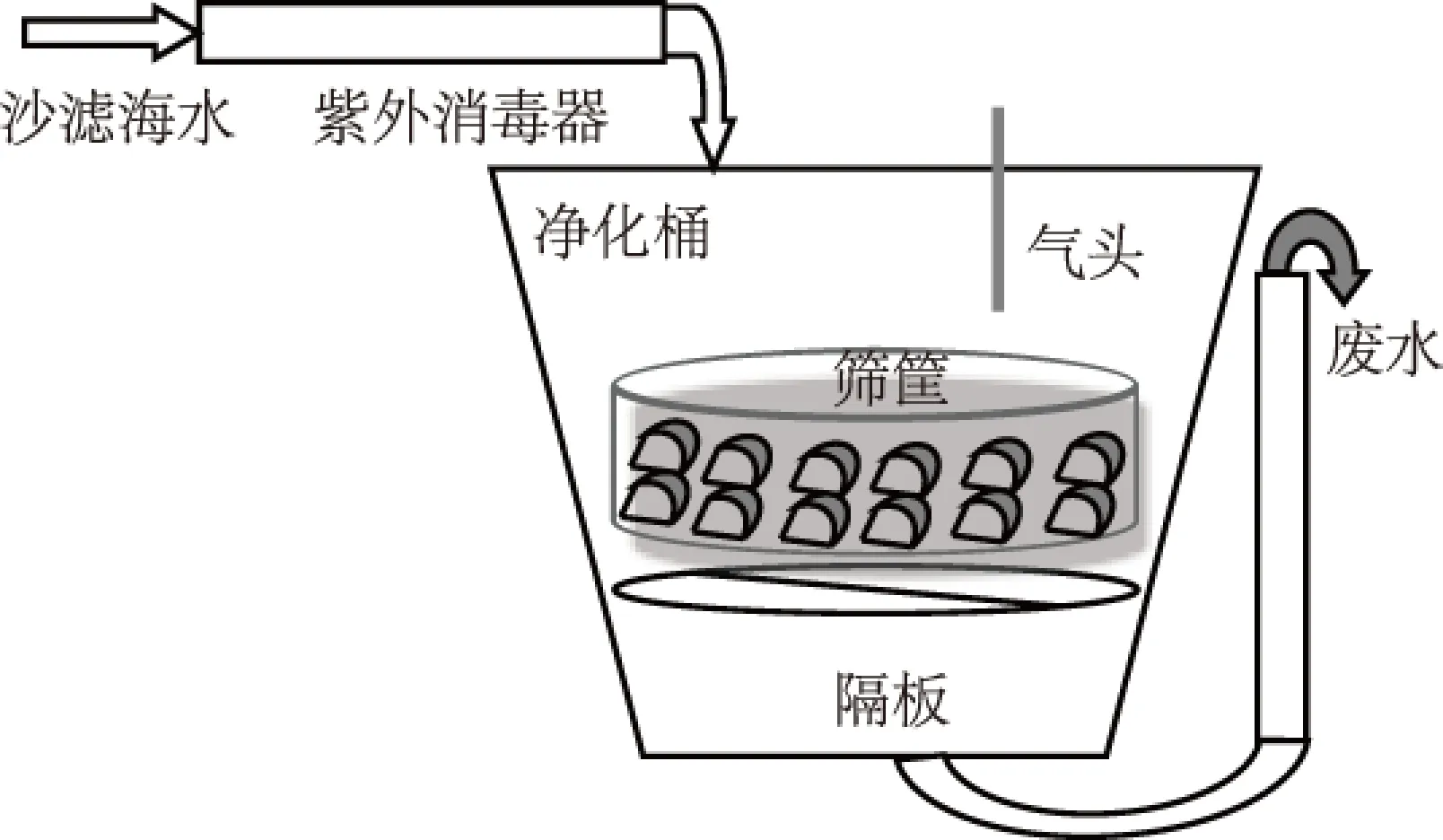
图1 牡蛎净化装置Fig.1 Facility of UV depuration system
第一批葡萄牙牡蛎于2014年3月净化,数量为100个。参考《GB 2762—2012食品安全国家标准食品中污染物限量》[13]和《GB 29921—2013食品安全国家标准食品中致病菌限量》[14]的规定,设定致病菌、污染物和贝类毒素指标并按照国家相关标准测定,测定时间为净化36 h后。同时还测定了12 h、24 h、36 h和48 h的菌落总数和大肠菌群。
1.2.2 贮藏
第二批葡萄牙牡蛎在2015年7月净化。将净化48 h的牡蛎分成2份,每份100个,分别在4℃和-18℃贮藏,在不同时间点检测菌落总数、大肠菌群、蛋白[15]、脂肪[16]、糖原及乳酸含量的变化。糖原及乳酸试剂盒均为苏州科铭生物技术有限公司生产。
1.2.3 数据分析
实验数据采用Microsoft Excel 2007进行统计分析、制图。
2 结果
2.1 净化前后卫生指标的变化
净化前后葡萄牙牡蛎的致病菌和污染物限量均符合国家强制标准[13-14],贝类毒素限量符合相关地方标准[17]。经过36 h的净化,菌落总数由2.2×104cfu/g降至1.0×103cfu /g,下降了95.45%;大肠菌群由2 400 MPN/g降至<30 MPN/g,下降了98.75%,其余指标变化不大(表1)。
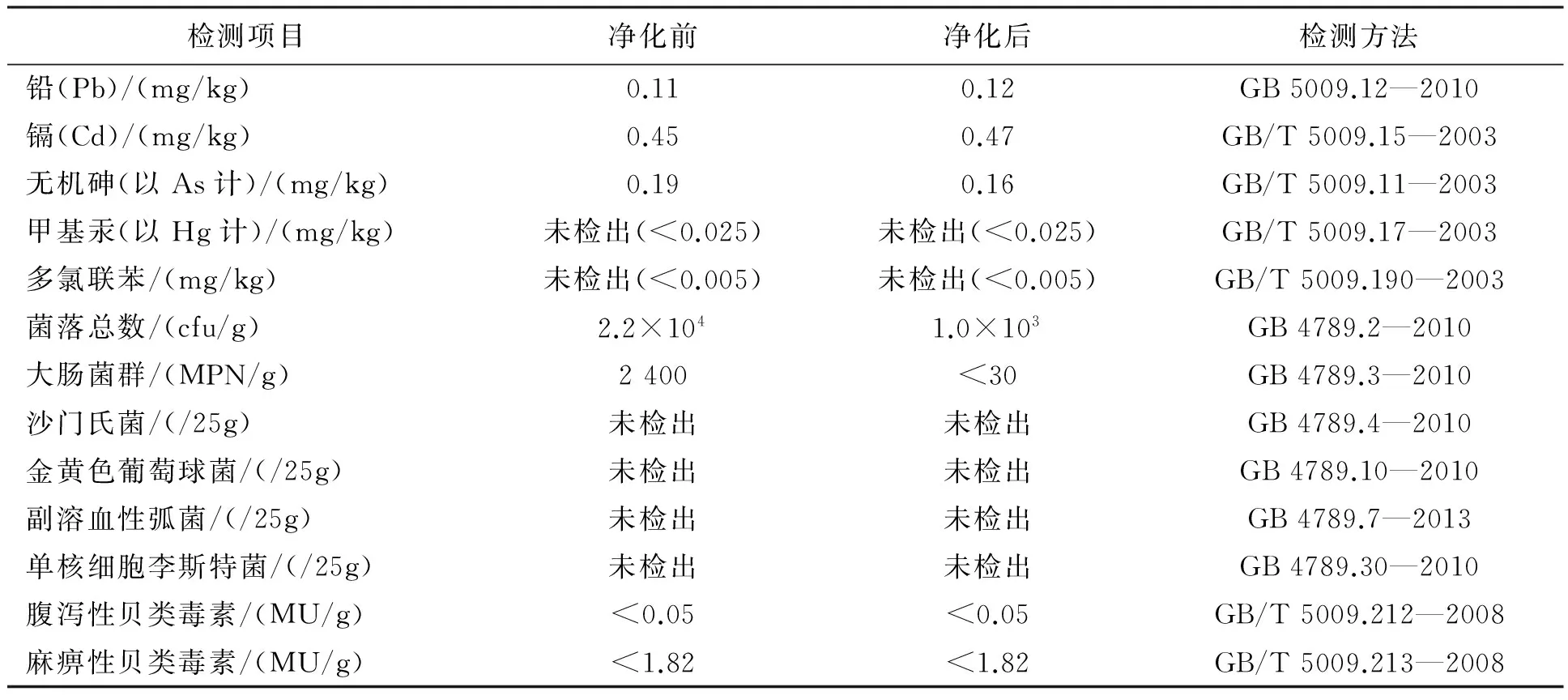
表1 36 h净化前后各项指标的变化情况Tab.1 Change in the safety indexes of oysters before and after 36 h depuration
紫外线系统48 h净化效果明显,葡萄牙牡蛎体内菌落总数和大肠菌群的含量降低了3个数量级(图2)。菌落总数和大肠菌群含量的变化曲线比较一致,前12 h大幅降低,随着含量的减少,细菌的代谢速率逐渐平缓,在最后12 h趋于停滞状态。菌落总数由初始的2.2×104cfu /g,降至10 cfu /g;大肠菌群由初始的2 400 MPN/g降至0.3 MPN/g,两项指标符合《GB 10136—2005腌制生食动物性水产品卫生标准》[18]。
2.2 冷藏过程中菌落总数、大肠菌群及主要营养
成分的变化
由图3可见,4℃贮藏期间,菌落总数和大肠菌群均呈现先降低再增长的变化过程。菌落总数从第1天的5.2×103cfu/g逐渐降至第4天最低1.1×103cfu/g,随后开始缓慢增长,到第6天增至3.1×103cfu/g,但始终处于安全范围内[18];大肠菌群由第1天的4.3 MPN/g降至第2天最低0.92 MPN/g,然后逐步增长,到第5天达到最高9.3 MPN/g,接近标准上限[17]。
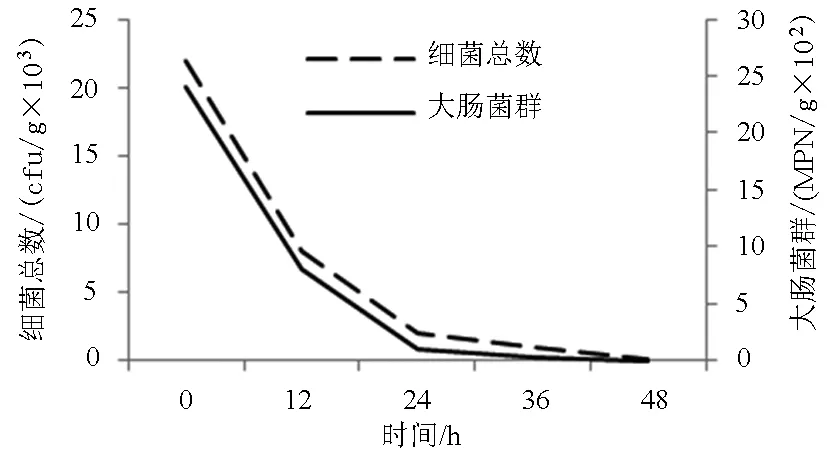
图2 净化过程中菌落总数和大肠菌群的变化Fig.2 Change in the total bacteria and coliform group of oysters during depuration
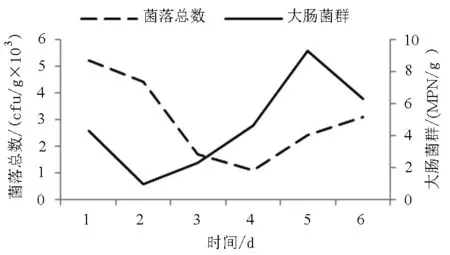
图3 4℃贮藏过程中菌落总数和大肠菌群的变化Fig.3 Change in the total bacteria and coliform group of oysters during 4℃storage
4℃贮藏期间,葡萄牙牡蛎的蛋白质、脂肪、糖原、乳酸的含量变化如图4所示。蛋白质、脂肪、糖原呈现缓慢降低的趋势(从第1天至第7天):蛋白质从5.41 g/100 g降至3.8 g/100 g;脂肪从1.5 g/100 g降至0.8 g/100 g;糖原作为最先消耗的能量形式,其含量出现大幅下降,从2.35g/100g降至0.7g/100g;由于无氧呼吸作用,乳酸含量则快速上升,从0.005 2g/100g增至0.05g/100g。
2.3 冷冻过程中菌落总数、大肠菌群及主要营养
成分的变化
由图5可见,-18℃下贮藏期间,葡萄牙牡蛎的菌落总数和大肠菌群都呈现先快速降低再缓慢增长的变化过程。菌落总数从第1天的5.2×103cfu/g逐渐降至第4天最低0.17×103cfu/g,随后开始缓慢增长,到第11天增至3.9×103cfu/g;大肠菌群从第1天的4.3 MPN/g降至第2天最低0.36 MPN/g,然后逐步增长,到第11天达到最高2.3 MPN/g。总之,两项指标在冷冻条件下优于冷藏,且符合标准[17-18]。
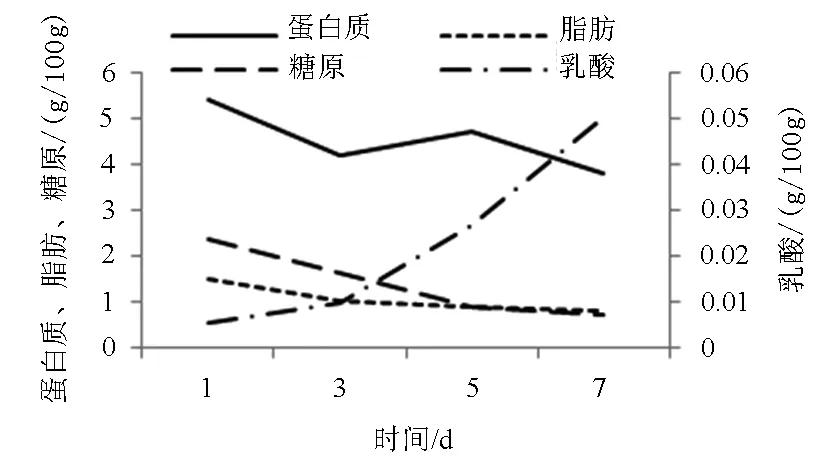
图4 4℃贮藏过程中蛋白质、脂肪、糖原、 乳酸的变化Fig.4 Change in protein,lipid,glycogen,and lactic acid of oysters during 4℃storage
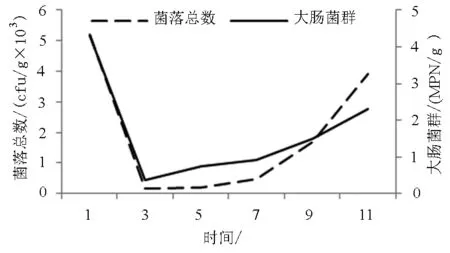
图5 -18℃贮藏过程中葡萄牙牡蛎菌落总数和 大肠菌群的变化Fig.5 Change in the total bacteria and coliform group of oysters during -18℃storage
-18℃贮藏期间,葡萄牙牡蛎的蛋白质、脂肪、糖原、乳酸的含量变化如图6所示。蛋白质、脂肪、糖原呈现缓慢降低的趋势(从第1天至第13天):蛋白质从5.41 g/100 g降至3.87 g/100 g;脂肪从1.5 g/100 g降至0.6 g/100g;糖原从2.35 g/100 g降至0.749 g/100 g,而乳酸含量快速上升,从0.005 2 g/100 g增至0.017 2 g/100 g。正如预期,各指标在冷冻情况下的变化幅度小于冷藏。
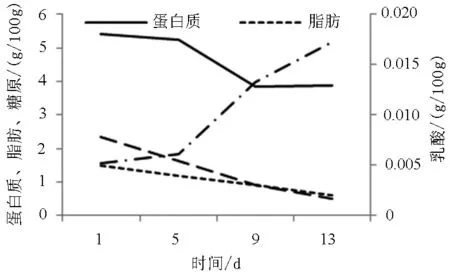
图6 -18℃贮藏过程中蛋白质、脂肪、糖原、 乳酸的变化曲线Fig.6 Change in protein,lipid,glycogen,and lactic acid of oysters during -18℃ storage
3 讨论
3.1 贝类净化的局限性
在第一批葡萄牙牡蛎净化实验中,致病菌、污染物、毒素等指标在净化前均符合国家相关标准和地方标准,但是菌落总数和大肠菌群含量较高,说明该海域海水受到人畜粪便及生活污水污染。经过36 h净化,除菌落总数和大肠菌群大幅下降外,其余指标无明显变化。一般来说,来源于粪便的指示菌(如大肠杆菌)和致病菌(如沙门氏菌)在设计合理且操作规范的净化系统中比较容易去除。慕翠敏等[5]报道太平洋牡蛎体内人工接种的大肠杆菌含量在紫外线系统中净化36 h后降低了2个数量级;乔庆林等[4]采用臭氧系统净化太平洋牡蛎,净化48 h后人工接种的大肠杆菌减少了2~3个数量级。但是,这样的净化对于许多种致病弧菌却不起作用,在其合适的盐度范围(如10~30)和足够高的温度(如高于20℃)还可能会促使弧菌浓度增加[19]。并且对于中度污染的贝类在18~21 ℃下净化5~7 d后,虽然大多数的病毒都能够去除,但仍有残存。由于病毒的致病剂量极低,这意味着净化并不能作为消除病毒的良好手段[20]。单纯的净化操作也不适用于受碳氢化合物、重金属、农药、或生物毒素等严重污染地区的水域采捕的双壳贝类,因为净化到安全标准要很长时间。比如,在软壳蛤(Mercenariaarenaria)中富集的多环芳烃类化合物(PAHs)需要几周的时间才能降低到安全水平[1]。
3.2 贝类净化实验方法的差别
一些研究显示,牡蛎体内的大肠杆菌污染是采用人工接种的方式实现的[3-5]。有研究认为,净化人工接种的大肠杆菌要比净化天然污染的大肠杆菌的效果好[1]。因此,采用人工接种后再净化的手段来评价商业运作中净化系统对贝类净化效果的方法有待商榷。而有些研究是通过检测贝类体内自然富集的菌落总数和大肠菌群来评判净化效果的。如陶晶等[6]报道,当海水中二氧化氯质量浓度为18.75 mg/g 时,在30 h 内可使蛤体内的菌落总数降低2.61个对数值;陈坚等[7]报道,用臭氧浓度0.4~1.6 mg/L或二氧化氯浓度5~20 mg/L 净化处理24 h,菌落总数大约减少90%,大肠菌群降低为0.3 MPN/g;蒋伟明等[8]报道,在温度30℃、盐度25、换水率1次/4 h、贝水比1∶4、净化时间36 h的条件下,近江牡蛎菌落总数和大肠菌群降低了2个数量级。本研究采用紫外线消毒沙滤海水至大肠菌群含量为0,以流水式紫外线杀菌方法净化葡萄牙牡蛎48 h,使自然富集的菌落总数和大肠菌群降低了3个数量级,使牡蛎达到了生食的标准[18]。
3.3 低温贮藏期间水产品微生物和主要营养成分
的变化
冷藏期间,葡萄牙牡蛎菌落总数呈先下降再上升的变化,这与曹荣等[21]关于太平洋牡蛎微冻过程中的变化相似。奥积昌世等[22]对竹筴鱼(Trachurusjaponicus)的微冻研究结果也属于这一类型。冷藏过程中菌落总数的变化还存在其它情况:第一类,菌落总数没有显著变化,如刘娜等[23]的研究表明中国毛虾 (Aceteschinensis) 4°C 贮藏下菌落总数在整个贮藏期间没有显著变化,贮藏至第60天时产品仍可继续食用;第二类,菌落总数一直增加,曾名勇等[24]发现鲫鱼在30 d的微冻贮藏期内菌落总数呈增长趋势;第三类,菌落总数一直下降,如Ehira等[25]研究结果表明沙丁鱼(Sardinopsmelanosticta)在微冻贮藏过程中菌落总数呈连续下降的趋势。在本实验中,冷冻期间的葡萄牙牡蛎菌落总数前期下降趋势较冷藏期间更加快速,这与郑瑞生等的研究结果相似[26]。曹荣等[27]和Balasundari等[28]发现牡蛎中菌落总数在-20℃的变化一直呈下降趋势。冷藏和冷冻期间菌落总数变化情况多样的原因可能与不同水产品的初始菌相中各菌株在一定条件下不同的耐受性有关:一些低温耐受性差的菌株在贮藏过程中不生长甚至死亡,导致菌落总数减少,而另一些耐低温菌仍然可以生长,造成菌落总数增加。
冷冻和冷藏是水产品保鲜最普通的方法。低温抑制了酶的活性和微生物的活动,并降低了食品基质中的水活性,对于水产品的腐败变质起到了抑制作用,而且该方法不需使用防腐剂、添加剂或其它调味料,因此它是保证水产品和水产食品鲜度、营养价值和原有风味的手段和途径之一[29]。费星等[30]报道近江牡蛎在生态冰温保活过程中粗蛋白和水分基本保持稳定,粗脂肪和糖原呈明显下降趋势,而乳酸呈显著上升趋势,这与本研究类似,但本研究在冷冻和冷藏条件下蛋白质也有所下降。这可能是因为在本研究中无论是冷冻还是冷藏,细菌仍然活跃有关(图3、图5)。但因为没有做菌相分析,并不清楚冷冻和冷藏条件下细菌种类组成变化有何差别。同时,牡蛎肌肉和内脏器官中分布有蛋白、脂肪水解酶及磷脂酶[31],在冷冻贮藏过程中,这些酶可能还保持着一定的活力,细菌和酶的共同作用,导致蛋白、脂肪、糖原降低,乳酸上升。
4 结论
紫外线消毒海水净化葡萄牙牡蛎48 h,可以大幅降低其菌落总数和大肠菌群含量;净化后的牡蛎在冷藏(4 ℃)条件下贮藏至少6 d,或是冷冻(-18 ℃)条件下贮藏至少11 d,菌落总数和大肠菌群含量仍在安全水平内。本研究结果可为生食牡蛎的净化和低温贮藏工艺提供参考。
□
[1] LEE R,LOVATELLI A,ABABOUCH L.双壳贝类净化:基础知识与实践[M].罗马:联合国粮食及农业组织,2009:5-12.
[2] Commission Regulation (EC) No.2073/2005 of 15 November 2005 on microbiological criteria for foodstuffs[S].
[3] 乔庆林,蔡友琼,徐捷,等.UV系统净化贝类中大肠杆菌的研究[J].海洋环境科学,2005,24(1):13-16.
[4] 乔庆林,蔡友琼,徐捷,等.采用臭氧系统净化太平洋牡蛎中的大肠杆菌的[J].食品与发酵工业,2004,30(5):72-75.
[5] 慕翠敏,孔令峰,于红,等.太平洋牡蛎中大肠杆菌净化的实验研究[J].中国海洋大学学报,2012,42(S):83-86.
[6] 陶晶,杨瑞金,张文斌,等.牡蛎净化工艺的研究[J].食品科技,2008,33(7):108-112.
[7] 陈坚,柯爱英,洪小括.泥蚶与牡蛎净化工艺优化初探[J].上海海洋大学学报,2012,21(1):132-138.
[8] 蒋伟明,吴卫君,潘志忠,等.紫外线系统净化近江牡蛎(Crassostrearivularis)中细菌的研究[J].西南农林学报,2011,24(5):1981-1986.
[9] 许永安,廖登远,章超桦,等.菲律宾蛤仔净化技术研究[J].渔业现代化,2007,34(4):9-12.
[10]许永安,位绍红,吴靖娜,等.净化僧帽牡蛎肉低温保鲜效果研究[J].渔业现代化,2009,36(6):46-49.
[11]SC/T 3013-2002 贝类净化技术规范[S].
[12]QB/T 1172-1999 紫外线消毒器[S].
[13]GB 2762-2012 食品安全国家标准食品中污染物限量[S].
[14]GB 29921-2013 食品安全国家标准食品中致病菌限量[S].
[15]GB 5009.5-2010 食品安全国家标准食品中蛋白质的测定[S].
[16]GB 5009.6-2003 食品中脂肪的测定[S].
[17]DBS 32/006-2014 食品安全地方标准即食生食动物性水产品[S].
[18]GB 10136-2005 腌制生物动物性水产品卫生标准[S].
[19]LEE R J,YOUNGER A D.Developing microbiological risk assessment for shellfish purification[J].International Biodeterioration and Biodegradation,2002,50(3):177-183.
[20]LEES D.Viruses and bivalve shellfish[J].International Journal of Food Microbiology.2000,59(1/2):81-116.
[21]曹荣,薛长湖,刘淇,等.太平洋牡蛎在-3℃微冻贮藏过程中的品质和细菌菌相变化[J].南方水产,2010,6(1):49-53.
[22]奥积昌世,清水哲也,松本明.Partial freezingによる贮藏海产鱼の细菌アロラ[J].日本水产学会志,1980,46(4):451-454.
[23]刘娜,嗡佩芳,朱亚珠,等.贮藏温度对中国毛虾(Aceteschinensis)品质变化影响的研究.[J].海洋与湖沼,2015,46(4):838-844.
[24]曾名勇,黄海,李玉环,等.鲫鱼在微冻保鲜过程中的质量变化[J].青岛海洋大学学报,2001,31(3):351-355.
[25]EHIRA S,FUJI T.Changes in viable bacterial count of sardine during partially frozen storage[J].Bulletin of the Japanese Society of Scientific Fisheries,1990,46(11):1419-1424.
[26]郑瑞生,王则金,童金华,等.鲍鱼冻藏过程生化及感官指标变化研究[J].中国食品学报,2012,12(11):170-177
[27]曹荣,薛长湖,许加超,等.太平洋牡蛎细菌菌相分析及-20℃冻藏过程中菌相变化[J].食品与发酵工业,2006,32(3):1-3.
[28]BALASUNDARI S,JAWAHAR ABRAHAM T,SHANMUGAM S A,etal.Frozen storage performance of edible oyster Crassostrea madrasensis (Preston)[J].Journal of Food Science and Technology-Mysore,1997,34(5):434-436.
[29]齐凤生,程秀荣.水产品冷藏链的现状和发展趋势[J].河北渔业,2003(3):40-41 .
[30]费星,秦小明,林华娟,等.近江牡蛎在净化和生态冰温保活过程中主要营养成分的变化[J].食品科技,2010,35(3):68-71.
[31]须山三千三,鸿巢章二.水产食品学[M].上海:上海科技出版社,1992:141-150.
Depuration and low-temperature storage of Portuguese oyster (Crassostreaangulata)
QI Jianfei,ZENG Zhinan,NING Yue,WU Qisheng
(KeyLaboratoryofCultivationandHigh-valueUtilizationofMarineOrganismsinFujianProvince,FujjianCollaborativeInnovationCenterforExploitationandUtilizationofMarineBiologicalResources,FisheriesResearchInstituteofFujian,Xiamen361013,China)
In order to guarantee the safety of Portuguese oyster (Crassostreaangulata) eaten raw,13 healthy indexes were examined before and after depuration for 48 h in a non-cyclical flow-through depuration system using ultraviolet light at ratio of oysters to water 1∶10,water exchange rate 3 times/h,temperature 28 ℃,and salinity 28.Then the total bacteria,coliform group and main nutritional components of depurated oysters stored respectively at 4 ℃ and -18 ℃ for more than 7 days were detected.The results showed that,after 48 h of depuration,the total bacteria and coliform group sharply declined while other indexes changed little; during 4 ℃ and -18 ℃ storage,total bacteria and coliform group declined at the beginning and then rose up,but were within safety levels; protein,fat and glycogen decreased slowly whereas lactic acid increased rapidly.In summary,for Portuguese oyster that has been depurated for 48 h in UV system,its safety could at least be guaranteed within 6 days of refrigerated or 11 days of frozen storage.
Crassostreaangulata; shellfish depuration; low-temperature storage; aquatic processing
10.3969/j.issn.1007-9580.2016.05.007
2016-07-24
2016-09-28
国家贝类产业技术体系项目(CARS-48);国家科技基础条件平台建设运行项目(2016DKA30470);福建省水产研究所科研发展基金资助项目(2014fjscq03);福建省政府种业工程项目(2014S1477-9)
祁剑飞(1984—),男,助理研究员,研究方向:水产养殖。E-mail:qijianfei007@163.com
曾志南(1963—),男,研究员,研究方向:水产养殖。E-mail:xmzzn@sina.com
S983
A
1007-9580(2016)05-036-06

