负荷双能量CT心肌灌注成像在冠心病诊断中的研究进展
彭 鲲 汤光宇*
负荷双能量CT心肌灌注成像在冠心病诊断中的研究进展
彭鲲汤光宇*
冠状动脉CT血管成像在评估冠状动脉狭窄程度及检测冠状动脉粥样硬化斑块有着较高的准确性,但不能提供病变血管所支配心肌区域的微循环信息。而双能量CT心肌灌注成像能够同时提供冠状动脉的解剖学信息及生理学信息,其较传统单能量CT心肌灌注有一定的优势,且具有相应的临床应用潜力。综述负荷双能量CT心肌灌注成像在冠心病诊断中的研究进展。
双能量CT;心肌灌注成像;心肌梗死;心肌缺血;硬化束伪影
Int J Med Radiol,2016,39(5):518-522
冠状动脉疾病(coronary artery disease,CAD)是威胁人类健康的主要疾病之一。研究证实[1],心肌血液供应的减少不仅与冠状动脉狭窄的程度有关,且与微血管功能障碍及易损斑块的破溃相关,仅凭解剖学狭窄程度不能准确预测其血流动力学改变。对于中等程度狭窄而未引起心肌缺血的病人,推迟血运重建术不会增加其死亡率及急性心肌梗死发病率,CAD病人的血运重建术应以心肌灌注功能状况为指导[1]。冠状动脉CT血管成像(coronary CT angiography,CCTA)对评估冠状动脉狭窄程度及检测冠状动脉粥样硬化斑块性质有着较高的准确性,但不能提供病变血管所支配心肌区域的微循环信息。传统单能量CT心肌灌注(single energy CT myocardial perfusion,SECT-MPI)包括动态增强CT心肌灌注及首过CT心肌灌注,能够同时检测冠状动脉及心肌血供情况,但易受线束硬化束伪影的影响。近年来双能量CT技术不断发展,尤其是负荷双能量CT心肌灌注技术的发展,潜在性地实现了“一站式”CCTA,与SECT-MPI相比,负荷双能量CT心肌灌注(dual-energy CT myocardial perfusion,DECT-MPI)检查不易受硬化束伪影的影响,碘图能够敏感地发现心肌灌注缺损。本文就DECT-MPI技术、临床应用、优势及不足等方面进行综述。
1 DECT-MPI技术
1.1原理及技术条件DECT-MPI的成像原理是在进行含碘对比剂增强扫描时,同时利用两种不同kV能量的X射线对心脏进行扫描,正常的心肌组织和发生缺血或梗死的心肌组织摄取含碘对比剂的能力是不同的,从而表现为CT值的差异,将这种分布差异用伪彩色标注即得到双能量CT心肌灌注图,它能够将心肌功能测试与冠状动脉解剖学分布情况相融合,对CAD进行综合诊断[2]。
目前能进行DECT-MPI检查的设备大致分为两类,双源双能量CT以及单源瞬时快速kV切换CT[2-3]。前者具有一对相互独立的互成90°或94°的球管探测器系统,能同时获得高能(140 kV)和低能(80、100 kV)X射线,如西门子双源CT(第一代双源CT两对球管探测器系统互成90°,而第二代双源CT两对球管探测器互成94°);后者能通过单个球管在超短时间内(<0.5 ms)快速切换kV而获得高、低能X射线(80~140 kV),如GE宝石能谱CT。双源CT双球管同时发射两种不同能量X射线的方式对消除成像事件的前后差异具有优势,图像匹配更精准;而单源瞬时快速kV切换CT能够有效降低散射线的剂量,减少由于心脏运动而造成高、低电压数据投影的不匹配现象。
1.2采集方式及图像处理为了区分心肌灌注缺损属可逆性还是不可逆性,大多数DECT-MPI扫描包括静息相、负荷相以及延迟相数据采集。目前主要有4种药物可用于负荷诱导的心肌充血,包括腺苷、类伽腺苷,多巴酚丁胺及双嘧达莫。出于安全因素考虑,临床主要应用的有腺苷以及类伽腺苷。其中腺苷由于其半衰期短(<10 s),作用直接,不良反应较轻微等优点被临床广泛应用。腺苷直接作用于腺苷受体,可产生直接、快速、短暂的血管扩张作用。腺苷负荷双能量CT采集需要在临床医生的指导下给予静脉腺苷滴注2~5 min,流率140 μg/(kg·min)[3]。其主要的不良反应包括室性心动过速,房室传导阻滞。腺苷使用禁忌证包括:①高度房室传导阻滞;②哮喘或慢性阻塞性肺部疾病;③窦性心动过缓;④系统性低血压;⑤严重的颈动脉狭窄。类伽腺苷选择性作用于腺苷A2A受体,适用于患有哮喘或慢性阻塞性肺部疾病的病人[4]。目前负荷双能量CT心肌灌注扫描主要的采集方式有两种,一种是先静息扫描,后负荷扫描;另一种则与之相反。先进行静息扫描,在进行功能检测之前可以获得CCTA用于分析冠状动脉[5];而先进行负荷扫描,则避免了静息扫描注射的对比剂污染,保证了缺血心肌与正常心肌之间的对比差异,易检测心肌灌注缺损[6],采集负荷图像时所使用的腺苷等药物会反射性引起心率加快而影响随后静息相影像质量及CCTA的评估,可采用β受体阻滞剂降低心率的方法获得较优质的静息相影像。正确的采集时间是检测心肌组织早期摄取碘含量的差别、确保诊断准确性的根本。Bischoff等[7]认为负荷相采集的最佳时间是主动脉根部CT值达100 HU后的6~18 s。延迟相的数据采集一般在其他相数据采集后的5~10 min进行[8]。
DECT-MPI模式采集的高、低原始能量数据经过后处理可重建得到4组数据:2组单能量影像(140 kV和100 kV影像)、融合影像(通常由50%~70%高能影像和30%~50%低能影像融合而成)和心肌内碘分布图。140 kV的影像噪声低,100 kV的影像分辨率高,碘图将高、低能量图的优势相结合,能够较清晰地显示心肌灌注缺损[8-10]。
2 负荷DECT-MPI临床应用
负荷DECT-MPI有助于区分可逆性心肌缺血、心肌梗死及正常心肌。血流供应减少的心肌节段对对比剂的摄取也相应减少,灌注影像表现为密度减低区(灌注缺损),提示该节段心肌发生缺血或梗死。可逆性心肌缺血在静息相与周围正常心肌灌注差异不大,但是在负荷相,腺苷使正常冠状动脉扩张,而狭窄的冠状动脉失去这种储备能力,狭窄动脉供血区心肌血流量无明显增加,与正常血管心肌供血区之间的血流分布差异增大,显示为灌注缺损;而延迟相无明显延迟强化[11-12]。梗死心肌在静息相及负荷相均表现为灌注缺损,且出现延迟强化,这主要是由于心肌梗死后,心肌细胞损伤,细胞膜完整性破坏,细胞间隙增大,对比剂流入/流出时间较周围正常心肌组织延长所致[13]。正常心肌在负荷、静息及延迟相上均有正常灌注。正常、缺血和梗死心肌的双能量CT表现见表1[7]。

表1 不同心肌在DECT-MPI上的表现
一些临床实验分别以单光子发射体层成像(single photon emission CT,SPECT)、有创冠状动脉造影(invasive coronary angiography,ICA)及MR心肌灌注成像(magnetic resonance-myocardial perfusion imaging,MR-MPI)为标准,发现负荷DECT-MPI在诊断可逆性及固定性心肌灌注缺损的敏感度和特异度分别达到77%~94%和74%~94%,阳性预测值及阴性预测值分别为53%~91%和85%~98%[14-19],见表2。近期研究亦认为DECT-MPI与CCTA联合评估心肌缺血可降低假阳性率,提高诊断准确性[9,19]。Ruzsics等[2]对35例已知或怀疑为CAD的病人利用双源CT进行静息相DECT-MPI扫描,以SPECT结果为参考,其检测心肌灌注缺损的敏感度、特异度分别约92%、94%,且鉴别出了90%的固定性灌注缺损和88%的可逆性灌注缺损。其可能与CT较SPECT具有更高的空间分辨力,可以检测到SPECT无法检测到的微小的、心内膜下的心肌缺血,且碘对比剂本身具有一定的扩血管作用而引起心肌充血,可增加小灶性心肌缺血的检出率。在一个小样本研究中,Weininger等[20]以MR心肌灌注及动态CT心肌灌注为参考,负荷DECT-MPI检测心肌灌注缺损的敏感度、特异度分别为93%、99%,并认为DECT-MPI和动态CT心肌灌注检测灌注缺损的一致性较好。有研究者[21]对冠状动脉旁路移植术后的病人DECT检测结果与延迟增强MR成像进行比较,在受到胸骨线及植入的金属物质影响下,DECT检测心肌梗死的敏感度、特异度、阳性预测值及阴性预测值达到了77%、97%、85%及96%,诊断准确度为94%,且认为重建的虚拟120 kV影像评估灌注缺损的效能最不易受金属植入物影响。Wichmann等[22]以延迟增强MR成像为参考,评估DECT延迟相各组单色图及标准线性融合图检测慢性心肌梗死的能力,得出80 keV图及标准线性融合影像可敏感地评估延迟强化,但DECT所示心肌梗死透壁范围都大于MRI所显示的心肌梗死范围。
3 负荷DECT-MPI的技术优势
负荷DECT-MPI是在静脉注射腺苷的状况下对心肌血流灌注进行评估,腺苷直接作用于冠状动脉引起短暂的扩张血管作用,而病变血管失去这种扩张功能,其供血区域的心肌血流量较周围正常冠状动脉供血区域心肌组织血流灌注量差异增大,表现为灌注缺损。而在静息相由于冠状动脉的储备功能,病变血管所支配心肌节段与正常血管支配心肌节段灌注差异不大,静息相DECT灌注成像不能敏感检测出可逆性灌注缺损。因此使用负荷DECTMPI可以提高检测可逆性灌注缺损的敏感性[11],为冠心病风险度评估及临床是否需要积极干预提供依据。传统单能量CT心肌灌注由于X线的多色性及其衰减的能量依赖性,高密度物质对低能X线大量吸收,引起X线束能量水平增高而产生硬化束伪影,出现心内膜下心肌缺血假象,会导致诊断准确性下降以及假阳性率的升高。双能量CT扫描模式通过从双能量数据重建获得多能量水平单色图像,与传统CT心肌灌注相比,不易受硬化束伪影的影响[23],且基于投影数据空间的影像重建方式有助于减少硬化束伪影[8]。有研究分析认为,虚拟高能量单色图像可减少高密度物质所引起的硬化束伪影的影响[24]。从理论上来讲,每个体素内碘含量反映了心肌组织的灌注量,将缺血区心肌组织与正常心肌组织或心室腔进行归一化处理来定量计算每个体素内的碘含量,可间接反映心肌血流量[25]。Koonce等[25]采用DECT心脏扫描模式对拟人胸部模型进行碘含量的定量评估,所测量的碘浓度与真正的碘浓度之间显示了良好的相关性(r=0.994~0.997,P<0.000 1),提示DECT-MPI测量心肌碘含量可以作为一种替代方式来定量测量心肌血液供应。
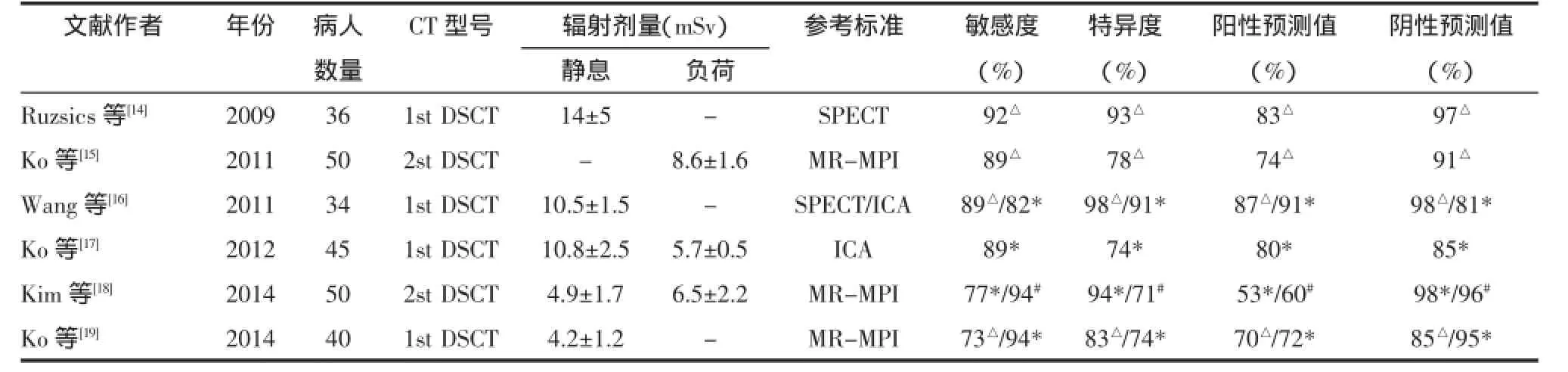
表2 不同双能量CT心肌灌注研究比较
4 负荷DECT-MPI的不足与展望
DECT-MPI拓宽了常规CCTA单纯解剖学评估的应用范围,能够同时评估冠状动脉管腔信息和心肌血液供应情况,但是该方法尚有不足与限制:①由于双能量CT系统及扫描方式的缺陷,整个心脏数据的采集来源于几个不同的心动周期,引起从心底部至心尖部的异构衰减,随着心动周期的延迟,正常心肌与缺血心肌之间的碘浓度差异将缩小,不利于灌注缺损的评估,易导致假阴性的升高[7]。②文献[6]报道正确的采集时间为主动脉根部CT值达100 HU后的6~18 s,但是仍有可能错过对比剂浓度峰值时间,且对比剂浓度峰值时间受心脏输出量及对比剂注射速度等因素的影响,如未能在最佳采集时间对病人进行扫描,可导致灌注缺损的检出率下降。③扫描方案至今尚未统一,与MR-MPI延迟增强扫描相比,CT延迟增强扫描影像信噪比低,检测心肌梗死更加具有挑战性,增加了辐射剂量却并没有显著增加其临床诊断价值,延迟扫描是否为必须的扫描程序仍有待于进一步研究[26]。④理论上双能量CT碘图能够对心肌节段的碘含量进行量化,达到定量评估心肌灌注的目的,但是目前该方法仍未应用于临床,其可靠性有待于进一步研究。⑤在辐射剂量方面,虽然自动化管电流调制技术、前瞻性心电触发技术、大螺距扫描,迭代重建法等的应用使得CCTA的辐射剂量降低至亚毫西伏水平[27],目前文献报道DECT-MPI辐射剂量要低于SPECT[28],但是部分研究DECT-MPI的辐射剂量仍达到12 mSv以上[20,26],因此DECT-MPI辐射剂量的减低仍有待于进一步研究。DECT-MPI在辅助CCTA诊断心肌梗死以及心肌缺血方面具有良好的应用前景,但若作为冠心病诊断的常规检查,则要求其在CT设备、辐射剂量、扫描方案及检查成功率方面有着更进一步的研究。
[1]Pijls NH,Fearon WF,Tonino PA,et al.Fractional flow reserve versus angiography for guiding percutaneous coronary intervention in patients with multivessel coronary artery disease:2-year follow-up of the FAME(Fractional Flow Reserve Versus Angiography for Multivessel Evaluation)study[J].J Am Coll Cardiol,2010,56:177-184.
[2]Ruzsics B,Lee H,Zwerner PL,et al.Dual-energy CT of the heart for diagnosing coronary artery stenosis and myocardial ischemia-initial experience[J].Eur Radiol,2008,18:2414-2424.
[3]So A,Hsieh J,Imai Y,et al.Prospectively ECG-triggered rapid kV-switching dual-energy CT for quantitative imaging of myocardial perfusion[J].JACC Cardiovasc Imaging,2012,5:829-836.
[4]Kurata A,Mochizuki T,Koyama Y,et al.Myocardial perfusion imaging using adenosine triphosphate stress multi-slice spiral computed tomography:alternative to stress myocardial perfusion scintigraphy[J].Circ J,2005,69:550-557.
[5]Salgado GC,Jimenez HA,Sanchez DME,et al.Comparative study of the safety of regadenoson between patients with mild/moderate chronic obstructive pulmonary disease and asthma[J].Eur J Nucl Med Mol Imaging,2014,41:119-125.
[6]George RT,Arbab-Zadeh A,Miller JM,et al.Computed tomography myocardial perfusion imaging with 320-row detector computed tomography accurately detects myocardial ischemia in patients with obstructive coronary artery disease[J].Circ Cardiovasc Imaging, 2012,5:333-340.
[7]Bischoff B,Bamberg F,Marcus R,et al.Optimal timing for firstpass stress CT myocardial perfusion imaging[J].Int J Cardiovasc Imaging,2013,29:435-442.
[8]Techasith T,Cury RC.Stress myocardial CT perfusion:an update and future perspective[J].JACC Cardiovasc Imaging,2011,4:905-916.
[9]Carrascosa PM,Cury RC,Deviggiano A,et al.Comparison of myocardial perfusion evaluation with single versus dual-energy CT and effect of beam-hardening artifacts[J].Acad Radiol,2015,22:591-599.
[10]Arnoldi E,Lee YS,Ruzsics B,et al.CT detection of myocardial blood volume deficits:dual-energy CT compared with single-energy CT spectra[J].J Cardiovasc Comput Tomogr,2011,5:421-429.
[11]Cannao PM,Schoepf UJ,Muscogiuri G,et al.Technical prerequisites and imaging protocols for dynamic and dual energy myocardial perfusion imaging[J].Eur J Radiol,2015,84:2401-2410.
[12]王洁,陈宏伟,方向明.负荷CT心肌灌注在冠心病中应用的初步研究进展[J].国际医学放射学杂志,2013:122-126.
[13]Gerber BL,Belge B,Legros GJ,et al.Characterization of acute and chronic myocardial infarcts by multidetector computed tomography: comparison with contrast-enhanced magnetic resonance[J].Circulation,2006,113:823-833.
[14]Ruzsics B,Schwarz F,Schoepf UJ,et al.Comparison of dual-energy computed tomography of the heart with single photon emission computed tomography for assessment of coronary artery stenosis and of the myocardial blood supply[J].Am J Cardiol,2009,104:318-326.
[15]Ko SM,Choi JW,Song MG,et al.Myocardial perfusion imaging using adenosine-induced stress dual-energy computed tomography of the heart:comparison with cardiac magnetic resonance imaging and conventional coronary angiography[J].Eur Radiol,2011,21:26-35.
[16]Wang R,Yu W,Wang Y,et al.Incremental value of dual-energy CT to coronary CT angiography for the detection of significant coronary stenosis:comparison with quantitative coronary angiography and single photon emission computed tomography[J].Int J Cardiovasc Imaging,2011,27:647-656.
[17]Ko SM,Choi JW,Hwang HK,et al.Diagnostic performance of combined noninvasive anatomic and functional assessment with dualsource CT and adenosine-induced stress dual-energy CT for detection of significant coronary stenosis[J].AJR,2012,198:512-520.
[18]Kim SM,Chang SA,Shin W,et al.Dual-energy CT perfusion during pharmacologic stress for the assessment of myocardial perfusion defects using a second-generation dual-source CT:a comparison with cardiac magnetic resonance imaging[J].J Comput Assist Tomogr, 2014,38:44-52.
[19]Ko SM,Park JH,Hwang HK,et al.Direct comparison of stress-andrest-dual-energy computed tomography for detection of myocardial perfusion defect[J].Int J Cardiovasc Imaging,2014,30 Suppl 1:41-53.
[20]Weininger M,Schoepf UJ,Ramachandra A,et al.Adenosine-stress dynamic real-time myocardial perfusion CT and adenosine-stress first-pass dual-energy myocardial perfusion CT for the assessment of acute chest pain:initial results[J].Eur J Radiol,2012,81:3703-3710.
[21]Bauer RW,Kerl JM,Fischer N,et al.Dual-energy CT for the assessment of chronic myocardial infarction in patients with chronic coronary artery disease:comparison with 3-T MRI[J].AJR,2010, 195:639-646.
[22]Wichmann JL,Arbaciauskaite R,Kerl JM,et al.Evaluation of monoenergetic late iodine enhancement dual-energy computed tomography for imaging of chronic myocardial infarction[J].Eur Radiol, 2014,24:1211-1218.
[23]Scheske JA,O'Brien JM,Earls JP,et al.Coronary artery imaging with single-source rapid kilovolt peak-switching dual-energy CT[J]. Radiology,2013,268:702-709.
[24]Bamberg F,Dierks A,Nikolaou K,et al.Metal artifact reduction by dual energy computed tomography using monoenergetic extrapolation[J].Eur Radiol,2011,21:1424-1429.
[25]Koonce JD,Vliegenthart R,Schoepf UJ,et al.Accuracy of dual-energy computed tomography for the measurement of iodine concentration using cardiac CT protocols:validation in a phantom model[J]. Eur Radiol,2014,24:512-518.
[26]Meinel FG,De Cecco CN,Schoepf UJ,et al.First-arterial-pass dual-energy CT for assessment of myocardial blood supply:do we need rest,stress,and delayed acquisition?Comparison with SPECT [J].Radiology,2014,270:708-716.
[27]Achenbach S,Goroll T,Seltmann M,et al.Detection of coronary artery stenoses by low-dose,prospectively ECG-triggered,highpitch spiral coronary CT angiography[J].JACC Cardiovasc Imaging, 2011,4:328-333.
[28]Carrascosa P M,Deviggiano A,Capunay C,et al.Incremental value of myocardial perfusion over coronary angiography by spectral computed tomography in patients with intermediate to high likelihood of coronary artery disease[J].Eur J radiol,2015,84:637-642.
(收稿2015-09-28)
The research progress of the stress dual-energy CT myocardial perfusion imaging in the diagnosis of coronary
artery disease
PENG Kun,TANG Guangyu.Department of Radiology,Clinical Medical College of Shanghai Tenth People’s
Hospital of Nanjing Medical University,Shanghai 200072,China
Coronary CT angiography has a high accuracy for non-invasive assessment of coronary artery stenosis severity and the atherosclerotic plaque,but the microcirculation in the territory of the stenozed artery still can not be evaluated.Dual-energy CT myocardial perfusion imaging can provide both anatomical and physiological information.It has certain advantages over the traditional single energy CT myocardial perfusion,and has potential clinical application which have been mentioned in the previous reports.This review describes the progress of stress dual-energy CT myocardial perfusion imaging in detecting coronary artery disease.
Stress dual-energy CT;Myocardial perfusion imaging;Myocardial infarction;Myocardial ischemia; Beam-hardening artifacts
10.19300/j.2016.Z3733
R541.4;R445.3
A
南京医科大学上海十院临床医学院放射科,上海200072
汤光宇,E-mail:tgy17@126.com
*审校者

