低氧诱导高迁移率组蛋白B1对人胰腺癌细胞凋亡抵抗和迁移的作用研究
苏兆亮,刘嫣方,宋 濂,陈雪莲,石 卉,姜玉洁,张礼荣,朱海涛,王冬青
·基础医学·
·论著·
低氧诱导高迁移率组蛋白B1对人胰腺癌细胞凋亡抵抗和迁移的作用研究
苏兆亮,刘嫣方,宋 濂,陈雪莲,石 卉,姜玉洁,张礼荣,朱海涛,王冬青
目的 观察低氧诱导人胰腺癌细胞系(SW1990)分泌高迁移率组蛋白B1(HMGB1)作用,并探讨胞外HMGB1在胰腺癌细胞凋亡抵抗及转移中的作用。方法 取对数生长期SW1990细胞分别给予以下处理:(1)常氧+PBS;(2)低氧+PBS;(3)低氧+HMGB1(100 μg/L);(4)低氧+HMGB1(100 μg/L)+EP(胞外HMGB1特异性抑制剂)。细胞处理72 h后,ELISA检测(1)及(2)2组细胞培养上清中HMGB1表达的差异;AnnexinV/PI流式细胞术检测(2)、(3)、(4)各组细胞的凋亡率;Transwell 迁移实验检测(2)、(3)、(4)各组细胞迁移能力差异;Western-blotting检测(2)、(3)、(4)各组细胞凋亡相关蛋白(Bcl-2)及迁移相关蛋白(E-cadherin、MMP-9)表达的差异。结果 ELISA结果显示低氧条件下,细胞培养上清中HMGB1表达含量升高,是常氧条件下的5倍;AnnexinV/PI流式细胞术检测以上3组细胞的凋亡率分别为:(23.47±2.20)%、(6.57±1.20)%、(20.03±1.89)%;低氧+HMGB1处理组细胞凋亡比率明显低于其他2组,差异有统计学意义(P<0.05); Transwell 迁移实验中各组穿至下室的细胞数分别平均为(161.3±16.0)、(399.7±13.0)、(184.3±16.0)个,差异有统计学意义(P<0.05),提示低氧条件下HMGB1能明显促进人胰腺癌SW1990细胞的迁移;Western-blotting结果显示HMGB1处理组Bcl-2及MMP-9表达增高,E-cadherin表达降低,差异有统计学意义(P<0.05)。结论 低氧可以促进肿瘤细胞释放HMGB1,从而促进人胰腺癌SW1990凋亡抵抗与迁移。
低氧;高迁移率组蛋白B1;胰腺癌;细胞迁移
胰腺癌是最常见的消化系统恶性肿瘤之一,因发病隐匿,亲淋巴结转移性等特性,胰腺癌的5年生存率不足5%[1-2]。因此深入研究胰腺癌的生物学特性对于改善胰腺癌生物学现状具有非常重要的临床意义。近年来,低氧对实体瘤生物学行为影响引起了学者广泛关注。据报道,低氧是导致肿瘤放化疗抵抗及转移的关键因素[3]。然而其确切机制仍不明确。本实验以人胰腺癌细胞系SW1990为研究对象,探讨低氧诱导肿瘤细胞释放高迁移率组蛋白B1(high mobility group protein B1, HMBG1)对低氧条件下肿瘤细胞凋亡抵抗及转移的作用,并试图阐释其发挥作用的分子机制。
1 材料与方法
1.1 主要试剂与仪器 血清(FBS)、细胞培养基DMEM/F12均购于美国GIBCO公司;胰蛋白酶购于AMERSCO公司;AnnexinV/PI细胞凋亡检测试剂盒(南京凯基生物公司);Transwell小室和细胞培养板24孔板购自美国Corning公司;β-actin、E-cadherin、MMP-9和Bcl-2抗体及辣根过氧化物酶标记的羊抗兔、羊抗鼠二抗则购于武汉博士德生物工程有限公司;CO2培养箱及天平(日立公司);离心机80-2(中国上海精密仪器厂),倒置相差显微镜(Olympus公司),CA950-2超净台(上海净化仪器厂),CYTONICS FC500流式细胞仪(美国Beckman Coulter公司)。
1.2 细胞培养及分组处理 SW1990(中科院上海细胞研究所)培养三代左右直到细胞状态稳定后培养于含10%胎牛血清的DMEM/F12培养基(内含青、链霉素各100 U/mL) 中,置于37 ℃、5% CO2条件下细胞培养箱中进行培养。细胞单层贴壁生长,至70%~80%融合时胰蛋白酶消化传代。分别给予以下4组处理:(1)常氧+PBS; (2)低氧+PBS;(3)低氧+HMGB1(100 μg/L);(4)低氧+HMGB1(100 μg/L) +EP(胞外HMGB1特异性抑制剂)。参照以往文献及前期预实验结果[4]:HMGB1的最佳处理浓度为100 μg/L;低氧培养条件:低氧混合气(1% O2,5% CO2,94% N2)购自南大恒通气体厂,低氧培养时将细胞置于密封的低氧培养盒中,用低氧混合气平衡10 min,然后转移到37 ℃培养箱中培养。处理72 h后,将上述3组细胞在显微镜下观察肿瘤细胞的形态学变化。
1.3 AnnexinV/PI检测细胞凋亡 将以上步骤中各组细胞消化、离心、收集细胞,弃去上清,3 ml预冷的PBS漂洗2次,将细胞重悬于预冷的70%乙醇中,4 ℃固定1~2 h,离心弃去固定液,3 ml PBS重悬,400目筛网过滤、离心收集好细胞后,向细胞中加入含有1 μl PI和5 μl AnnexinV的缓冲液,在室温下放置15 min,加入400 μl的缓冲液,混匀后利用流式细胞仪进行细胞凋亡的检测。
1.4 Transwell迁移试验 将以上步骤中各组细胞消化,用PBS洗2遍,无血清的DF-12培养基重悬,调整细胞密度至5×105/ml。均匀加入400 μl细胞悬液至Transwell板上室,按照以上分组分别加入HMGB1及EP处理;下室加入含10% FBS的DMEM/F12培养基600 μl,每组设置3个复孔,低氧条件下培养箱中培养24 h。取出上室,用棉签擦去上室细胞,多聚甲醛固定15 min,弃固定液,0.1%结晶紫染液染色10 min,PBS洗3遍,显微镜下摄片并计数。
1.5 Western-blotting检测相关蛋白的表达 收集以上各组细胞,PBS清洗2遍,加入细胞裂解液及蛋白酶抑制剂, 提取细胞总蛋白并测浓度, 以等量蛋白质样品与蛋白上样缓冲液按1∶1混合于100 ℃沸水中煮10 min,冷却后置于-20 ℃保存。然后在SDS-PAGE胶中进行电泳,每孔加样10 μl蛋白样品,电泳后将蛋白转移到PVDF膜上,用5%的脱脂奶粉进行封闭处理1 h后,孵育一抗4 ℃过夜(E-cadherin、MMP-9均为兔抗人抗体,Bcl-2为鼠抗人抗体,工作浓度均为1∶400,兔抗人β-actin工作浓度为1∶500)。24 h后经TBST(150 mmol/L NaCl,10 mmol/L Tris,0.1% Tween-20,pH 7.6)洗膜10 min×3次后,常温下孵二抗1 h,再次经TBST漂洗5 min×3次后,用ECL化学发光液进行曝光。
1.6 HMGB1细胞因子检测 细胞上清内HMGB1含量检测采用酶联免疫吸附试验(ELISA),按试剂盒说明进行操作。
1.7 统计学处理 应用SPSS 16.0统计学软件对统计数据进行分析,数据用均数±标准差(x±s)表示,每组实验独立重复3次后,两样本均数比较采用t检验,多样本均数间比较采用单因素方差分析,检验水准α=0.01。P<0.05为差异有统计学意义。
2 结果
2.1 常氧及低氧条件下细胞形态及HMGB1释放在正常氧含量培养条件下,SW1990呈梭形生长;低氧培养后,部分细胞呈圆形生长,细胞生长速度减慢(图1A)。ELISA检测常氧及低氧培养条件下,2组细胞上清检测HMGB1表达含量,结果显示低氧培养上清中HMGB1表达含量为常氧条件下的5倍,2组比较差异有统计学意义(P<0.05,图1B)。

注:图A:a.常氧组细胞形态;b.低氧组细胞形态;图B:HMGB1的释放。与常氧组比较aP<0.05。HMGB1:高迁移率组蛋白B1图1 SW1990在常氧及低氧条件下细胞形态及HGMB1的释放
2.2 HMGB1对低氧SW1990细胞凋亡抵抗作用 AnnexinV/PI染色检测细胞凋亡率结果显示, 用PBS、HMGB1、HMGB1+EP分别处理SW1990,低氧条件培养72 h后,细胞凋亡率分别为(23.47±2.20)%、(6.57±1.20)%、(20.03±1.89)%;HMGB1处理组比其他2组细胞凋亡率明显降低,差异具有统计学意义(P<0.05)。
2.3 HMGB1对低氧条件下SW1990细胞迁移作用Transwell实验显示,低氧条件下,PBS、HMGB1、HMGB1+EP处理后各组SW1990细胞低倍镜下(×100)迁移至下室的细胞数分别为(161.3±16.0)、(399.7±13.0)、(184.3±16.0)个,HMGB1处理组迁移细胞要比其他实验组细胞数明显增多,与其他2组比较差异有统计学意义(P<0.05,图2)。

注:a:PBS处理组;b:HMGB1处理组;c:HMGB1+EP处理组。HMGB1:高迁移率组蛋白B1图2 HMGB1对SW1990细胞迁移的影响
2.4 HMGB1对低氧SW1990细胞迁移及凋亡相关蛋白表达 低氧条件下,HMGB1处理SW1990细胞6 h后,Western-blot结果显示,抗凋亡蛋白Bcl-2及迁移相关蛋白MMP-9表达增高,而E-Cadherin表达降低,与PBS、HMGB1+EP 2组比较,差异均有统计学意义(P<0.05),见图3。
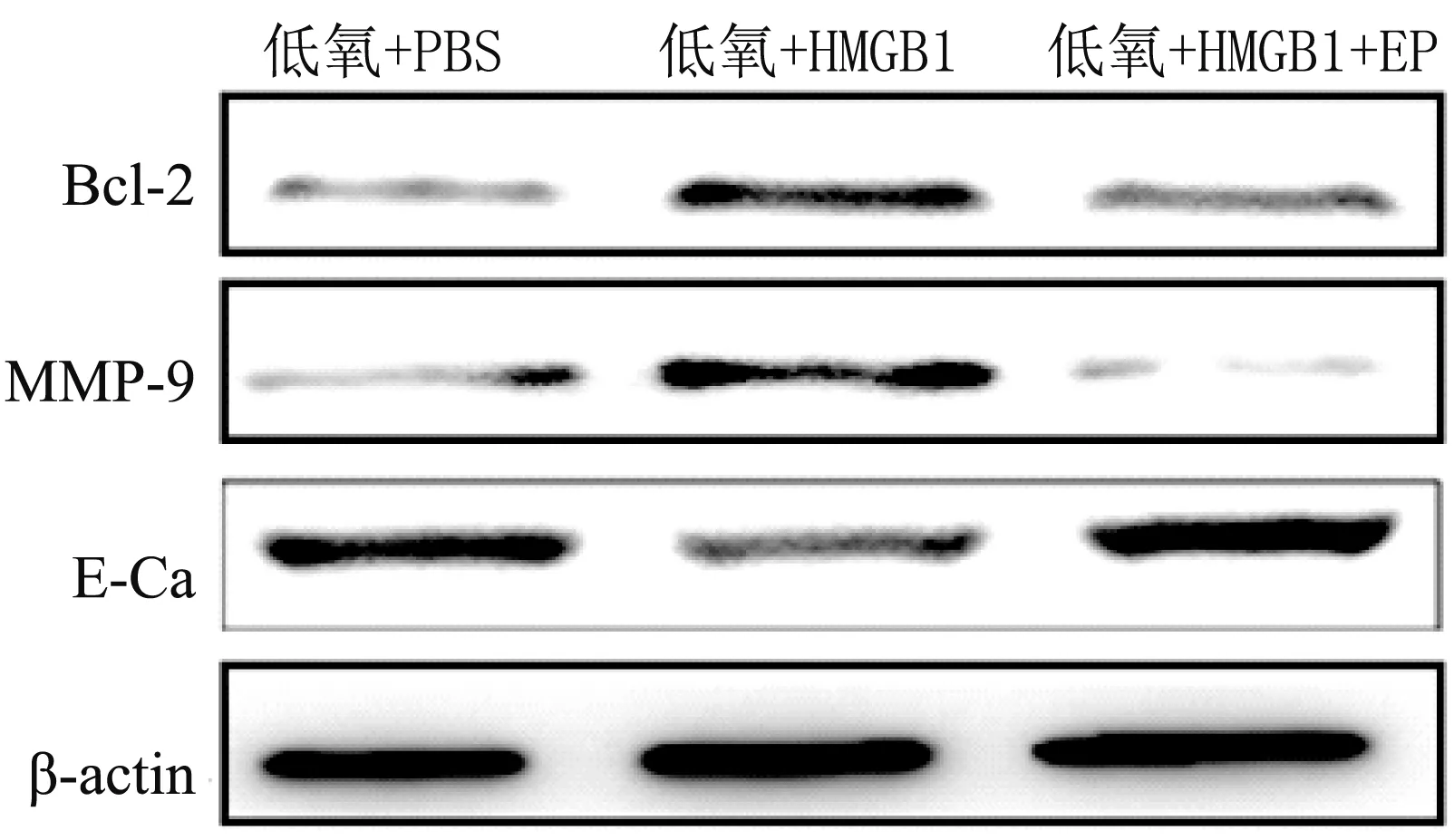
图3 Western-blotting检测细胞相关蛋白含量的表达
3 讨论
胰腺癌位居因肿瘤而导致死亡的第四位,具有早期转移,治疗效果及预后极差等特点,恶性程度极高、总体5年生存率不足5%[2];胰腺癌的发生与环境、饮食以及慢性炎症等众多的因素有关,长期的炎症刺激会导致细胞化生,如长期的消化道功能紊乱,这一点在海上作业人员表现的尤为突出。胰腺癌的各种生物学行为是肿瘤细胞与肿瘤微环境相互作用的结果。低氧是包括胰腺癌在内的多种实体肿瘤共同特征,主要由于肿瘤细胞快速分裂和血管微环境异常造成血液供应不足而导致缺氧。近年来,越来越多的研究证实,低氧与肿瘤的治疗后复发、转移及肿瘤干细胞维持等密切相关[5-6]。然而,低氧诱导胰腺癌转移的确切机制却仍不十分明确,因此对其进行深入研究具有非常重要的临床意义。低氧引发组织损伤和坏死所释放的大量组织细胞碎片和蛋白质等,均可使组织局部堆积大量所谓损伤相关模式(damage associated molecular patterns,DAMPs)分子,这些分子包括透明质酸、HMGB1等。研究结果[7]显示,在低氧培养条件下,胰腺癌细胞培养上清中HMGB1的表达量明显增高,提示HMGB1在低氧诱导的胰腺癌各种生物学行为中起着重要作用。
作为危险信号分子及炎症介质,HMGB1首先必须通过主动分泌或被动释放方式被运输到胞外。胞外HMGB1可以介导一系列重要的生物学功能,包括触发炎症、激活固有及获得性免疫应答,促进细胞的生长、发育、增殖、凋亡等过程[7-8]。在肿瘤组织中,HMGB1具有“双刃剑”的作用,既可以通过诱导肿瘤新生血管的形成促进肿瘤发展,也可以触发保护性的抗肿瘤T淋巴细胞应答而抑制肿瘤[9]。AnnexinV/PI 及Transwell实验结果提示:低氧条件下,胞外HMGB1可以促进体外培养的肿瘤细胞凋亡抵抗,并促进肿瘤细胞迁移、转移。胰腺癌细胞向远处转移是一个复杂的旅程,必须克服一系列的障碍才能在远处形成转移灶。肿瘤转移有3个基本步骤:(1)通过EMT转换,降低癌细胞之间的黏附性,从而脱离原发灶;(2)在迁移过程中抵抗各种凋亡信号的刺激,到达转移部位;(3)在转移组织增殖形成转移灶。因此,HMGB1在肿瘤转移的过程中发挥重要作用。为进一步证实HMGB1促进细胞转移的确切机制,本研究检测了EMT相关蛋白(MMP-9)及凋亡相关蛋白(Bcl-2)的表达。EMT是一个复杂的分子过程,该过程中上皮细胞失去极性,细胞间连接疏松,顶面-底侧极性消失,获得间质表型和主动转移的特性。EMT过程的标志是上皮标记E-cadherin的下调以及间质标记(MMP-9)的上调,导致上皮细胞间连接松解而使细胞获得主动转移和浸润特性[10]。结果显示,HMGB1刺激后SW1990细胞MMP-9及抗凋亡蛋白Bcl-2表达量明显增高,E-cadherin表达量明显降低,从分子水平上说明了HMGB1可能调控胰腺癌细胞EMT转换及凋亡抵抗而发挥其促进肿瘤转移的作用。
本研究表明低氧条件下胰腺癌细胞主动分泌大量的HMGB1,分泌至胞外的HGMB1主要通过诱导细胞EMT转换及表达抗凋亡蛋白而促进胰腺癌细胞转移及凋亡抵抗,本研究为针对胰腺癌微环境的靶向治疗提供了更多的依据。
[1] Siegel R, Ma J, Zou Z, et al. Cancer statistics[J]. CA Cancer J Clin, 2014,64(1): 9-29.
[2] Zhang Z, Liu S, Xiong H, et al. Electrospun Pla/Mwcnts composite nanofibers for combined chemo- and photothermal therapy[J]. Acta Biomater, 2015, 26:115-123.
[3] Eales KL, Hollinshead KER, Tennant DA. Hypoxia and metabolic adaptation of cancer cells[J]. Oncogenesis, 2016, 5(1):e190. DOI:10.1038/oncsis.2015.50.
[4] Wang FP, Li L, Li J, et al. High mobility group box-1 promotes the proliferation and migration of hepatic stellate cells via TLR4-dependent signal pathways of PIK3/Akt and JNK[J]. PLoS One 2013, 8(4): e64373.
[5] Lu X, Yan CH, Yuan M, et al. In vivo dynamics and distinct functions of hypoxia in primary tumor growth and organotropic metastasis of breast cancer[J]. Cancer Res, 2010,70(10):3905-3914.
[6] Conley SJ, Gheordunescu E, Kakarala P, et al. Antiangiogenic agents increase breast cancer stem cells via the generation of tumor hypoxia[J]. Proc Natl Acad Sci USA, 2012,109(8):2784-2789.
[7] Sims GP, Rowe DC, Rietdijk ST, et al. HMGB1 and RAGE in inflammation and cancer[J]. Annu Rev Immunol, 2010,28(3): 367-388.
[8] Tang D, Kang R, Cheh CW, et al. HMGB1 release and redox regulates autophagy and apoptosis in cancer cells[J]. Oncogene, 2010,29(4): 5299-5310.
[9] Tang D, Kang R, Zeh HJ, et al. High-mobility group box 1 and cancer[J]. Biochim Biophys Acta, 2010,1799: 131-140.
[10] Thiery JP. Epithelial-mesenchymal transitions in tumour progression[J]. Nat Rev Cancer, 2002,2(5):442-454.
(本文编辑:张阵阵)
Effects of hypoxia-induced HMGB1 on the anti-apoptosis and metastasis of pancreatic cancer cellsSu
Zhaoliang, Liu Yanfang, Song Lian, Chen Xuelian, Shi Hui, Jiang Yujie, Zhang Lirong, Zhu Haitao, Wang Dongqing
(Department of Immunology, Jiangsu University, Zhenjiang 212001, China)
Objective To observe the effects of hypoxia-induced HMGB1 secreted in the human pancreatic cancer cell line (SW1990), and also to investigate the role of HMGB1 in the anti-apoptosis and metastasis of pancreatic cancer cells.Methods The cell line SW1990 in logarithmic growth phase was divided into 4 groups in accordance with different treatment methods, i.e. the normoxia + PBS group (or group 1), the hypoxia +PBS group (or group 2), the hypoxia + HMGB1 (100ng/ml) group (or group 3) and the hypoxia + HMGB1(100 ng/ml)+ EP (inhibitor of HMGB1) group (or group 4). Seventy-two hours after treatment, ELISA was used to detect the level of HMGB1 in the supernatant of the culture medium in group 1 and group 2. AnnexinV/PI was used to monitor the apoptosis of groups 1, 2 and 3. Transwell assay was employed to detect the differences in the metastasis of the cells in groups 1, 2 and 3. Western-blotting was employed to detect expression levels of E-Cadherin, MMP-9 and Bcl-2 in groups 1, 2 and 3.Results ELISA results showed that the HMGB1 expression level in the supernatant of the culture medium was elevated, which was 5 times higher than that of the normoxia group. AnnexinV/PI flow cytometry indicated that the rates of apoptosis in the above 3 groups were respectively (23.47±2.2)%, (6.57±1.2)% and (20.03±1.89)%. The apoptosis of the hypoxia + HMGB1 group was significantly lower than that of the other 2 groups, and statistical significance could be seen, when comparisons were made between them(P<0.05). Transwell chemotaxis assay indicated that the cells of different groups that migrated to the lower chamber were respectively 161.3±16.04, 399.7±13.01 and 184.3±16.04, indicating that HMGB1 could significantly promote the migration of human pancreatic carcinoma cells SW1990 under hypoxic conditions. Western-blotting showed that the expressions of Bcl-2 and MMP-9 in the HMGB1 group were increased, while the expressions of E-cadherin was decreased(P<0.05).Conclusion Hypoxia could induce the secretion of HMGB1 in SW1990 and HGMB1 could prompt the apoptosis of pancreatic carcinoma cells.
Hypoxia; high mobility group protein B1; Pancreatic carcinoma; Migration
国家自然基金项目(81502663);江苏省社会发展项目(BE2015668);镇江市社会发展项目(SH2014053、SH2013024,SH2015053);镇江市重点实验室基金项目(SS2013017);江苏省六大人才高峰基金项目(2013-WSN-002, 2015-WSN-005)
212001 江苏 镇江,江苏大学医学院免疫学系(苏兆亮);江苏大学附属医院影像科(宋濂、陈雪莲、石卉、姜玉洁、张礼荣、朱海涛、王冬青);江苏大学附属人民医院中心实验室(刘嫣方)
张礼荣,电子信箱:tianzchen684@163.com
R735.9
A [DOI] 10.3969/j.issn.1009-0754.2016.05.010
2016-01-10)

