老年患者肺切除术后肺部并发症的相关危险因素
高 宝 杨志广 刘韵鹏 张 鹏 刘 行 钱本鑫 邵国光
(吉林大学白求恩第一医院胸外科,吉林 长春 130000)
老年患者肺切除术后肺部并发症的相关危险因素
高 宝 杨志广 刘韵鹏 张 鹏 刘 行 钱本鑫 邵国光
(吉林大学白求恩第一医院胸外科,吉林 长春 130000)
目的 探究老年患者肺切除术后肺部并发症(PPCs)的相关危险因素。方法 收集92例老年肺切除术病例的临床资料,包括:肺部并发症发生情况、年龄、性别、血清白蛋白、贫血情况、体重、慢性疾病、肺基础病、吸烟史、术前气道准备时间、肺功能、手术方式、切除范围、手术时间、术中失血,行单因素分析并筛选出有统计学意义的项目,然后进行非条件Logistic回归分析。结果 选取的92例患者中有26例术后出现PPCs,发生率为28.26%。经筛选后发现:年龄≥70岁、血清白蛋白<40 g/L、贫血、超重、患有糖尿病、原有肺部基础疾病、有吸烟史、FEV1%<70%、术前准备时间<5 d、开胸手术、切除范围≥1个肺叶、手术时间>3 h、术中失血>100 ml是老年患者术后出现PPCs的危险因素,其中年龄≥70岁、贫血、超重、吸烟史、FEV1%降低、开胸手术为独立危险因素。结论 老年患者术后出现PPCs的相关危险因素较多,对危险因素积极进行分层干预可以减少PPCs的发生,降低围手术期死亡率,促进术后快速康复。
肺切除术;术后肺部并发症
随着胸腔镜微创手术的开展以及重症监护技术的提高,单纯高龄已不再是胸外科手术的禁区,越来越多的老年肺部疾病患者通过手术延长了生命、提高了生活质量。但是,老年人往往合并心肺等多方面疾病,一定程度上提高了麻醉与手术难度以及围术期风险。有研究显示,60~69岁和70~79岁患者发生术后肺部并发症(PPCs)的概率分别为60岁以下患者的2倍和3倍〔1〕。本研究探究可能导致PPCs的相关因素,以期规避这些危险因素,减少PPCs的发生。
1 资料与方法
1.1 基本资料 收集我医疗组2015年1月1日至2016年1月1日期间收治的患者426例,经筛选后有92例老年患者入选年龄60~79岁,平均(65.8±4.9)岁;男62例,女30例;全部为择期或限期行亚肺叶切除或全肺切除患者。排除标准:年龄<60岁;临床资料不全或互有矛盾者;术前即存在严重肺部感染,经积极处理仍未完全纠正者。
1.2 治疗方法 入组患者术前常规完善查体、血液、肝肾功能、心电图、肺功能、血气分析、胸部CT、头部CT、骨显像、上腹部及肾上腺彩超检查;通过雾化吸入药物进行气道准备(黏液溶解剂氨溴索45 mg、糖皮质激素布地奈德2 mg、支气管扩张剂异丙托溴铵1 mg);于双腔管插管全麻下通过直接开胸方式或在胸腔镜辅助下进入胸腔,应用直线切割缝合器处理肺的静脉、动脉、支气管甚至肺实质,根据病变大小、位置及心肺功能承受程度决定手术切除范围,关胸前常规置入接水封瓶的引流管并应用罗哌卡因封闭肋间神经;术后入重症监护病房监测生命体征至少12 h,应用视觉模拟评分法(VAS)测定疼痛程度,应用非甾体类抗炎药(氟比洛芬酯100 mg 2次/d)、氨酚羟考酮(口服)、阿片类药物(曲马多300~500 mg/d)进行联合镇痛,开胸或者术前非甾体类抗炎药物成瘾者加用经静脉自控镇痛(PCIA);对于手术时间长、术中肺组织捻挫较重患者应用乌司他丁(30万IU 2次/d),对于无抗凝禁忌且预期卧床时间较长的老年患者应用抗凝药物。针对全肺切除术后患者,控制输液总量(术后24 h不超过27 ml/kg)及速度(20~30滴/min),术后第1天行床头胸片检查;对可疑存在PPCs患者抽取血常规,行引流液或气道分泌物培养或进一步影像学检查。
1.3 观察指标 收集可能导致老年患者PPCs的16个术前及术中危险因素:性别、年龄、血清白蛋白水平、贫血、超重〔体重指数(BMI)>25 kg/m2〕、糖尿病史、高血压病史、心脏病史、原有肺部基础疾病史、吸烟史、气道准备时间、FEV1%、手术方式(传统开胸或胸腔镜手术)、切除范围、手术时间、术中失血量分别计算整理。
1.4 PPCs的定义 PPCs是指术后发生的有临床表现的肺部异常,对疾病的进程有负面影响〔2〕。结合相关文献报道,具体包括:(1)术后呼吸衰竭,术后需要持续机械通气>72 h或任意时间需要重新机械通气。(2)急性肺损伤,突然出现PaO2/FiO2≤300 mmHg,胸部影像显示浸润性病变,但须排除左房高压。(3)肺炎,体温>38℃,浓痰,新出现的或持续存在的肺浸润性病变。(4)脓胸,胸膜腔存在脓性物质。(5)支气管胸膜瘘。(6)肺栓塞,由对比增强肺部CT确认。(7)胸腔出血,输注红细胞悬液超过4U或有再次开胸止血指征。(8)胸腔积液,每日积液引出较多或患者自觉症状明显,严重者需行穿刺引流或重新置入闭式引流管。(9)肺不张,影像学显示肺叶或全肺不张,部分患者需行支气管镜检查或治疗后确诊。(10)气胸,影像学上确诊,穿刺抽气无效,需再次置入闭式引流管进行治疗。(11)支气管痉挛,有咳嗽、气喘等症状,呼气相延长,听诊闻及干啰音,需应用解痉药物缓解并除外心源性哮喘。(12)肺持续漏气,漏气时间多于5 d〔3,4〕。
1.5 统计学方法 采用SPSS22.0软件,二分类变量采用χ2检验或校正χ2检验;对单因素分析中P<0.05的因素纳入非条件Logistic回归分析,通过应用步入法进行多因素分析从而确定独立危险因素,估测OR值与95%可信区间(CI)。
2 结 果
92例老年肺部患者中26例患者术后出现36例次肺部并发症,发生率为28.26%。其中7例患者合并2种或以上并发症,最常见的3种并发症分别为肺持续漏气、胸腔积液及肺炎。
2.1 PPCs单因素分析 16项影响因素中,年龄、血清白蛋白水平、贫血、超重、糖尿病、肺基础病、吸烟史、FEV1%、术前准备时间、切除范围、手术方式、手术时间、术中失血存在统计学差异(P<0.05),见表1。
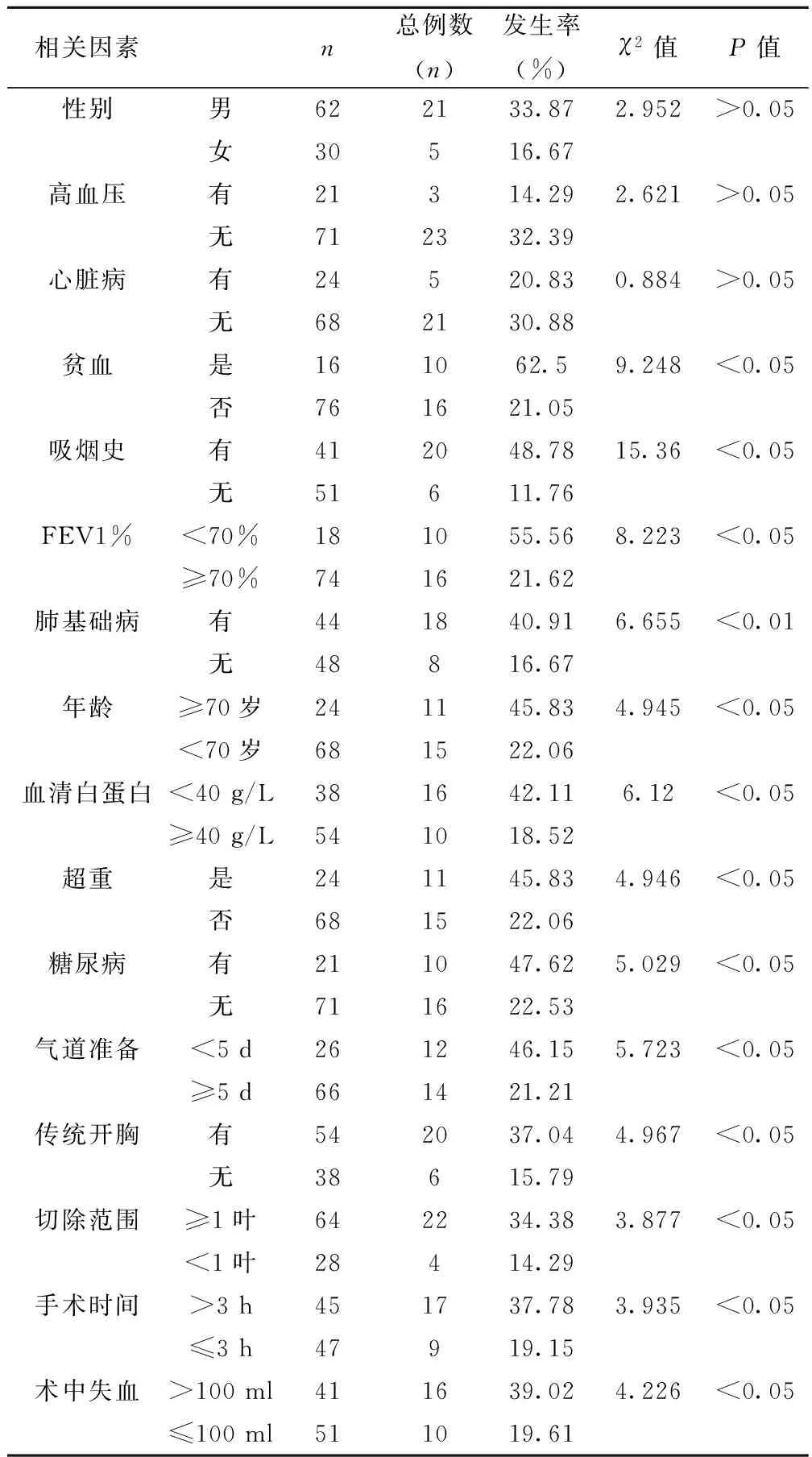
表1 PPCs患者术前及术中危险因素单因素分析
2.2 PPCs多因素分析 以是否发生肺部并发症为因变量,单因素分析中存在统计学差异的因素为自变量,进行二分类非条件Logistic回归分析,结果显示年龄≥70岁、贫血、超重、吸烟史、FEV1%<70%以及开胸手术为影响PPCs的独立危险因素(P<0.05)。见表2。
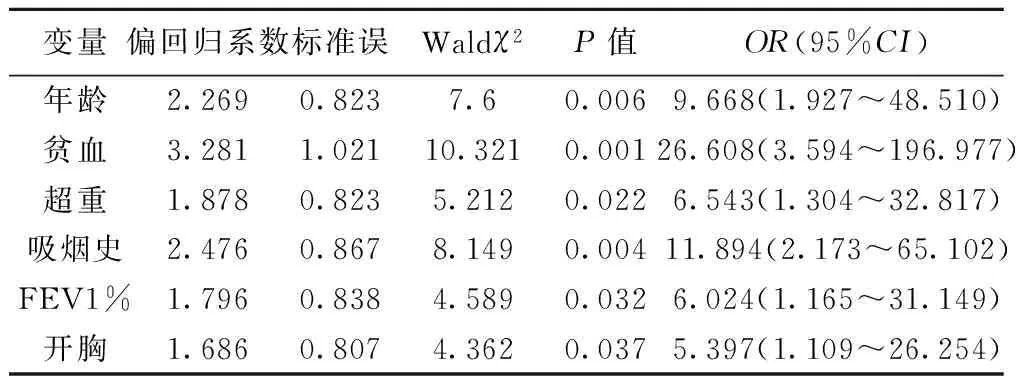
表2 PPCs患者术前及术中危险因素多因素Logistic分析
3 讨 论
本研究涉及的92例患者均来自于同一医疗组,手术习惯及术后管理模式较为固定,因此形成的差异主要来源于患者自身因素及由此影响的术中因素。
在很多研究中,年龄因素都被认为是影响术后并发症的一项重要因素,但对年龄节点的选择却大相径庭,有的设置为65岁,有的为70岁,甚至部分研究达到80岁以上〔5〕。本文将年龄节点设置为70岁,只要涉及肺部的手术都纳入在内,术后并发症只选择了肺部并发症,而将心脑血管并发症等排除在外,最终研究结果基本上能够与先前研究达到一致。老年患者与年轻人相比最明显的变化就是各器官功能的衰退,而与肺癌术后相关联的则是肺功能的减退。随着年龄增大,肺实质内部纤维结缔组织增多,导致肺的顺应性降低,呼吸阻力增加,换气功能减弱,再加上手术过程会造成肺容量下降、膈肌功能紊乱,导致换气、咳嗽、呼吸道自洁作用受到影响,最终造成微小肺不张及低血氧〔6〕。如果以上情况不能得到及时纠正及处理,则肺炎、脓胸、呼吸衰竭将伴随而来。因此,术前通过呼吸锻炼改善肺通换气功能、术中减少肺组织捻挫、术后及时发现并积极处理并发症,将会极大改善并发症的出现率。
吸烟史在PPCs发生危险因素中如此重要主要源于两方面原因:首先,它是一个术前可以获得的预测因子;其次,戒烟时长术前可控。吸烟史由以下方面构成:是否吸烟、戒烟时长、包年指数(PYI)。Mason等〔7〕在本文研究中,由于患者吸烟史在客观记录中信息有限,仅将患者是否存在吸烟史列为影响因素,而对患者戒烟与否、戒烟时间未作进一步细化。在对肺癌患者研究时,无吸烟经历的患者院内死亡率为0.3%,有吸烟经历患者院内死亡率升高到1.5%,此外,无论戒烟时长,有吸烟史患者发生肺部并发症更频繁。很多学者针对戒烟时长与肺部并发症的关系作了研究,在刚开始戒烟的几天,一些患者反映清理气道分泌物变得困难,可能原因为痰量增多、痰液更黏稠以及吸烟引发的咳嗽刺激减少。这些问题引发了:手术前短时间戒烟是否会增加术后并发症发生率的担忧〔8〕。Bluman等〔9〕在对多种外科干预形式下患者的研究中指出,戒烟时间少于2 w会使肺部并发症发生更频繁。Moores等〔10〕坚持认为手术前最佳戒烟时长是6~8 w。欧洲呼吸协会(ERS)指南建议术前最好戒烟2~4 w。针对PYI的研究中,Barrera等〔11〕认为吸烟指数超过60包1年是发生肺部并发症的危险因素。对将要手术的患者进行戒烟宣教仍然必需,但是推迟手术以确保较长的戒烟时长似乎并无必要〔12〕。结合以上研究结果,对于老年肺癌患者,戒烟时长达到2 w基本可以在限期手术与确保安全之间达到了一个平衡。
贫血往往反映患者更衰老或存在肾病等慢性疾病,而且有可能营养不良,即使抛开这些合并因素,贫血本身也是一个独立危险因素。贫血患者血液携氧能力降低,导致组织灌注不足、创伤愈合能力差,尤其在涉及支气管残端愈合问题时此影响因素更加突出,支气管残端本身易存在血供不足等情形,若合并贫血,则导致血供不足加剧,感染因素增加,愈合更差,易出现支气管残端瘘,这是全肺切除术后最严重的并发症。此外,术前贫血患者输血概率增加。而输血与并发症发生率、死亡率升高相关,同种异型输血通过抑制受体的免疫调节能力,造成了感染及其他并发症的发生〔13〕。本研究中未将患者术前接受的肿瘤治疗史纳入研究范围。事实上,为达到术中R0切除,一些患者需行术前新辅助放疗或化疗,接受这些治疗后,患者较常见的改变就是血细胞或血红蛋白下降,这些患者较易出现并发症,一方面折射出术前贫血问题,另一方面也折射出术前治疗史的影响,因此对此方面的研究有待于进一步的深入。
肥胖与很多疾病伴随,包括高血压、糖尿病及冠心病,它的存在也提升了癌症发生率,如乳腺癌、肠癌、子宫内膜癌及肾癌〔15,16〕。有研究表明,除去吸烟因素,肥胖也与肺癌发生紧密相关。肥胖被认为是很多外科手术预后不良的一个危险因素,包括泌尿外科、妇产科、心外科及胰腺外科〔17,18〕。关于BMI升高对肺癌切除术后死亡率与并发症率的研究目前有限,有2个回顾性研究指出,肥胖对死亡率无影响,但使并发症发生率提高〔19,20〕。肥胖或超重患者由于膈肌上移,肺功能受到一定程度影响,特别是在胸部术后,这种影响尤为突出,在一定程度上增加了肺不张的发生风险。因此对于超重或肥胖患者应该格外注意其可能发生肺部并发症的风险。
Cattaneo等〔21〕报道,在老年患者中,传统肋骨牵开开胸手术切除肺叶并发症率为45%,而应用胸腔镜后,该比率降为28%。传统开胸手术影响了术后早期肺功能的恢复,其可能机制为:疼痛导致呼吸功能受限;疼痛导致有效咳嗽减少;肺泡液渗出增多导致阻塞性呼吸功能障碍;肋间肌离断导致的呼吸功能受损〔22〕。相比传统开胸,胸腔镜手术基本修正了上述存在的问题,有着较低的侵入性,对肺功能影响少,尤其肺功能受损患者,胸腔镜下的肺叶切除较为安全〔23〕。然而胸腔镜技术并非适用于所有情况,在肿瘤体积大、肿瘤靠近中心需要心包内处理血管、有较高出血风险的手术胸腔镜手术不适合。同时,分期更晚以及经过新辅助化疗、放疗的患者,如果开胸进行手术似乎能够获得更加完整的肿瘤切除、降低手术难度以及缩短手术时间〔24〕。
对于肺部手术患者而言,术前需常规行肺功能检查。术前大量的指标被用于评估其肺功能,其中预测价值最高的是FEV1%。在预测传统肺叶切除风险中,FEV1%较FEV1更有优势。Iizasa等〔25〕在对肺功能研究中发现,100例术前肺功能<70%的肺癌患者中,有35例术后死于非癌症原因,死亡率35%,而在302例肺功能超过70%的患者中,仅有23例死亡,死亡率7.6%,因此得出结论,FEV1%是预测早期非小细胞肺癌患者预后指标的重要因素。本文研究结果发现,对于预测术后肺部并发症,FEV1%也是一个重要的因素,术前评估患者肺功能并对肺功能明显受损患者进行有针对性的锻炼将能够明显减少并发症的发生。
1 Qaseem A,Snow V,Fiuerman N,etal.Risk assessment for and strategies to reduce perioperative pulmonary complications for patients undergoing noncardiothoracic surgery:a guideline from the American College of Physicians〔J〕.Ann Intern Med,2006;144(8):575-80.
2 Overend TJ,Anderson CM,Lusy SD,etal.The effect of incentive spirometry on postoperative pulmonary complications:a systematic review〔J〕.Chest,2002;120(3):971-8.
3 Marret E,Miled F,Bazelly B,etal.Risk and protective factors for major complications after pneumonectomy for lung cancer〔J〕.Interactive Cardiovasc Thorac Surg,2010;10(6):936-9.
4 王邵华,阮 征,郑 健,等.肺切除术后肺部并发症发生的危险因素分析〔J〕.中国胸心血管外科临床杂志,2010;17(4):301-6.
5 Boffa DJ,Allen MS,Grab JD,etal.Data from The Society of Thoracic Surgeons General Thoracic Surgery database:the surgical management of primary lung tumors〔J〕.J Thorac Cardiovasc Surg,2008;135:247-54.
6 Wright CD,Gaissert HA,Grab JD,etal.Predictors of prolongated length of stay after lobectomy for lung cancer:a Society of Thoracic Surgeons General Thoracic Surgery Database risk-adjustment model〔J〕.Ann Thorac Surg,2008;85:1857-65.
7 Mason DP,Subramanian S,Nowicki ER,etal.Impact of smoking cessation before resection of lung cancer:a society of thoracic surgeons general thoracic surgery database study〔J〕.Ann Thorac Surg,2009;88:362-70;discussion 370-1.
8 Groth SS,Whitson BA,Kuskowski MA,etal.Impact of preoperative smoking status on postoperative complication rates and pulmonary function test results 1-year following pulmonary resection for non-small cell lung cancer〔J〕.Lung Cancer,2009;64:352-7.
9 Bluman LG,Mosca L,Newman N,etal.Preoperative smoking habits and postoperative pulmonary complications〔J〕.Chest,1998;113:883-9.
10 Moores LK.Smoking and postoperative pulmonary complications.An evidence-based review of the recent literature〔J〕.Clin Chest Med,2000; 21:139-46.
11 Barrera R,Shi W,Amar D,etal.Smoking and ti ming of cessation:impact on pulmonary complications after thoracotomy〔J〕.Chest,2005;127:1977-83.
12 Seok Y,Hong N,Lee E.Impact of smoking history on postoperative pulmonary complications:a review of recent lung cancer patients〔J〕.Ann Thorac Cardiovasc Surg,2014;20(2):123-8.
13 Viola J,Gomez MM,Restrepo C,etal.Preoperative anemia increases postoperative complications and mortality following total joint arthroplasty〔J〕.J Arthrop,2015;30(5):846-8.
14 World Health Organization.Physical status:The use and interpretation of anthropometry〔M〕.Geneva,Switzerland:World Health Organization,1995:30-5.
15 DeMaria EJ,Carmody BJ.Perioperative management of special populations:obesity〔J〕.Surg Clin North Am,2005;85:1283-9.
16 Larsson SC,Orsini N,Wolk A.Body mass index and pancreatic cancer risk:a meta-analysis of prospective studies〔J〕.Int J Cancer,2007;120:1993-8.
17 Ramsey AM,Martin RC.Body mass index and outcomes from pancreatic resection:a review and meta-analysis〔J〕.J Gastrointest Surg,2011;15:1633-42.
18 Wigfield CH,Lindsey JD,Munoz A,etal.Is extreme obesity a risk factor for cardiac surgery? an analysis of patients with a BMI>or 40〔J〕.Eur J Cardiothorac Surg,2006;29:434-40.
19 Suemitsu R,Sakoguchi T,Morikawa K,etal.Effect of body mass index on perioperative complications in thoracic surgery〔J〕.Asian Cardiovasc Thorac Ann,2008;16:463-7.
20 Petrella F,Radice D,Borri A,etal.The impact of preoperative body mass index on respiratory complications after pneumonectomy for non-small-cell lung cancer:results from a series of 154 consecutive standard pneumonectomies〔J〕.Eur J Cardiothorac Surg,2011;39:738-44.
21 Cattaneo SM,Park BJ,Wilton AS,etal.Use of video-assisted thoracic surgery for lobectomy in the elderly results in fewer complications〔J〕.Ann Thorac Surg,2008;85:231-5.
22 Zhang Z,Liu D,Guo Y,etal.The common causes of conversion of VATS during operation for 248 nonsmall cell lung cancers〔J〕.Zhongguo Fei Ai Za Zhi,2011;14:523.
23 Wang Z,Zhang J,Cheng Z,etal.Factors affecting major morbidity after video-assisted thoracic surgery for lung cancer〔J〕.J Surg Res,2014;192(2):628-34.
24 Ceppa DP,Kosinski AS,Berry MF,etal.Thoracoscopic lobectomy has increasing benefit in patients with poor pulmonary function:a society of thoracic surgeons database analysis〔J〕.Ann Surg,2012;256(3):487-93.
25 Iizasa T,Suzuki M,Yasufuku K,etal.Preoperative pulmonary function as a prognostic factor for stage I non-small cell lung carcinoma〔J〕.Ann Thorac Surg,2004;77(6):1896-902.
〔2016-04-14修回〕
(编辑 郭 菁)
邵国光(1960-),男,教授,博士生导师,主要从事肺癌的分子生物机制研究。
高 宝(1990-),男,住院医师,硕士,主要从事肺癌的临床诊治研究。
R655.3
A
1005-9202(2016)20-5085-04;
10.3969/j.issn.1005-9202.2016.20.069

