诱导茄子花药通过胚胎发生途径再生植株
杜碧云+崔慧琳+崔群香+周显忠+张天雨+吴飞泽+何成荣
摘要:以9份茄子花药为试材进行诱导培养。结果发现,茄子花药培养能通过胚胎发生途径再生出植株;9份材料均诱导产生了胚状体,但不同材料胚状体诱导频率存在差异,15-黑冠诱导率最高,为17%;91个胚状体中,12个萌发成植株,萌发率为13%;12个植株中,7株移栽成活并现蕾开花,其中5株为单倍体,1株为二倍体,1株为四倍体;虽然2号诱导培养基上花药膨大率高于1号培养基上的花药,但后者随后会产生更多成熟且发育一致的胚胎。结果表明,如何促使胚状体发育成熟、提高单倍体加倍频率、确定胚状体的细胞起源,是制约茄子花药育种实际应用的关键问题。
关键词:茄子;花药;胚胎发生;植株再生
中图分类号: S641.104+.3 文献标志码: A
文章编号:1002-1302(2016)09-0192-04
植物花药和花粉(小孢子)培养是生产单倍体和双单倍体的有效手段,在育种研究中可以大大缩短育种年限。自Guha(1964)和Maheshwar(1982)利用毛叶蔓陀罗(Datura innoxia)进行花药培养获得胚状体及其再生植株后,至今已有200多种植物通过花药培养获得了再生植株[1]。茄子(Solanum melongena L.)花药培养的研究开始于 20世纪70年代初[2],从那以后从花药和花粉培养均成功获得了单倍体植株[3]。茄子花药和花粉培养中,再生植株多数经由愈伤组织通过器官发生途径获得[4-9],少数报道茄子能够通过胚胎萌发产生植株[10-12]。研究表明,茄子花药培养能够获得花粉细胞起源的再生植株,再加上茄子花粉培养常需从预培养的花药中游离小孢子培养,整个过程比花药培养技术更加复杂,因此国内茄子单倍体技术育种研究者以花药培养研究为主。
本研究以金陵科技学院茄子育种课题组所收集的优异茄子花药为材料,开展培养,以期获得花粉起源的植株,建立稳定可靠的茄子花药培养再生体系,为创制茄子遗传育种新种质奠定基础。
1 材料与方法
1.1 材料
供试材料为金陵科技学院蔬菜育种组收集的茄子8个商品种的低世代自交系,1个F1代品种聚合杂交的后代,以及田间生长的不知名品种的植株。材料编号分别为14-24、14-25、14-55、14-84、15-231、15-232、15-234、15-黑冠、15-混杂。14-24、14-25、14-55、14-84为2013年底育苗,2014年种植;其余材料为2014年底育苗,2015年种植;所有植株春季栽培结束后,在8月份剪枝再生。定植植株或剪枝再生植株现蕾开花后,选取花瓣距离花萼裂片±2 mm的未开放花蕾进行花药培养试验。
1.2 方法
1.2.1 花蕾采集和消毒
采取符合标准的花蕾,在4 ℃冰箱中保湿条件下低温处理1~2 d后取出,整理后去除花萼裂片,按常规方法在超净工作台上进行消毒,先用75%乙醇浸泡2 min,再用6.5%次氯酸钠加入1滴吐温-80震荡消毒15 min,最后用无菌水清洗4~5次。
1.2.2 花药培养
消毒处理后的花蕾,放在无菌滤纸上,用镊子和剪刀剥去其中的花药,接种到预处理培养基中,先在36 ℃ 条件下暗培养6 d,然后将未出现污染的花药转接到诱导培养基中,在25 ℃℃、光周期16 h/8 h的光照培养箱内培养,20 d后转到分化培养基中,每20 d继代1次,直至出现愈伤组织或胚状体,将发育较充分的胚胎及时转到生根培养基中,分化和生根培养条件同诱导培养。在培养过程中调查花药膨大率和胚胎发生的频率。
基本培养基均为MS培养基并加以改良,添加不同种类和浓度的植物生长调节剂形成预诱导培养基、诱导培养基、分化培养基和生根培养基,pH值为5.8,121 ℃,在0.1~0.15 MPa 压力进行灭菌15 min。培养基具体配方如下:
(1)预处理培养基:MS+0.2 mg/L 2,4-D+8.0 mg/L 维生素C+1.0 mg/L KT+30 g/L蔗糖+8 g/L琼脂粉;
(2)诱导培养基1:MS+2.0 mg/L KT+10 g/L聚乙二醇(PEG-4000)+15 g/L蔗糖+8 g/L琼脂粉; 诱导培养基2:MS+1.0 mg/L BA+1.0 mg/L NAA+2.0 mg/L KT+30 g/L蔗糖+8 g/L琼脂粉;
(3)胚状体分化培养基:MS+0.1 mg/L NAA+2 mg/LZT+800 mg/L Glu+30 mg/L GSH+100 mg/L L-Ser+30 g/L 蔗糖+8 g/L琼脂粉;
(4)生根培养基:1/2MS+0.2 mg/L IBA+20 g/L蔗糖+8 g/L 琼脂粉。
1.2.3 再生植株开花结实性和倍性鉴定
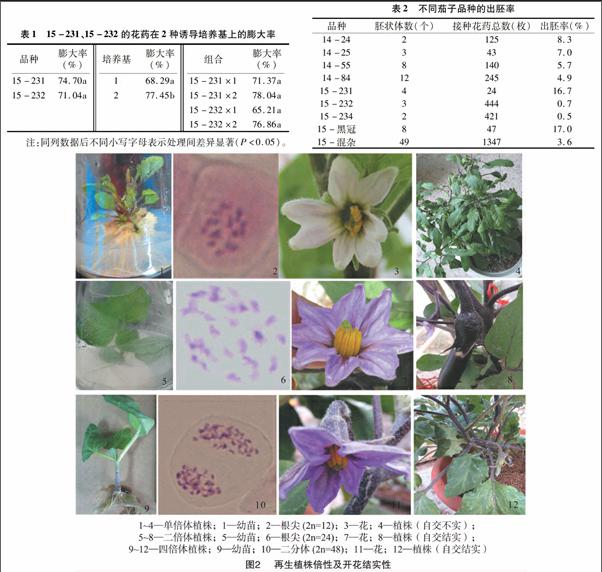
炼苗移栽前,从每个试管苗上剪取3~4条长3~4 cm的根,或现蕾开花时采取小花蕾,将根或花蕾用卡诺固定液固定24 h,系列浓度的乙醇清洗后,放在75%乙醇中保存备用。采用根尖染色体计数或花粉母细胞减数分裂观察法鉴定植株的倍性,根尖或花蕾用卡宝-品红染液染色,压片法制片,并用Nikon80i显微镜在可见光下观察和拍照。根据根尖染色体数目或减数分裂各时期染色体数目,结合开花结实情况,确定植株的倍性。开花后观察各植株花朵的大小、花粉的有无以及能否结实,并拍照。
2 结果与分析
2.1 花药培养胚胎发生和再生植株的过程
刚接种的花药为淡绿色(图1-1),经过热处理后,多数花药保持原来的形态,颜色由淡黄绿色变为浅褐色,部分花药周围的培养基上出现污染的菌斑(图1-2);花药转移到诱导培养基上以后,部分花药仍旧保持原来的形态,部分花药开始膨大(图1-3),由残存花丝产生的愈伤组织致密,而疏松的愈伤组织往往从花药中部或远离花丝的花药端产生,并且能够产生胚胎的花药多数也能产生疏松的愈伤组织(图1-4)。花药在转入分化培养约2周后产生胚胎,一般1枚花药会产生0~3个胚状体(图1-5),最多时1枚花药可以产生7个胚状体(图1-6),胚状体发育不同步,成熟的胚状体子叶、胚根和根毛结构清晰。胚状体转入生根培养基后,多数褐化或重新愈伤组织化(图1-7),少数成熟的胚状体能够萌发,经2后左右长成小苗(图1-8)。
2.2 不同诱导培养基对胚胎发生的影响
试验中发现只有在诱导培养基上发生膨大的花药才能最终产生愈伤组织和胚胎,对花蕾数量较多、消毒效果较好材料是15-231、15-232,进行了2种诱导培养基诱导花药膨大效果的试验,每品种每培养基接种10皿,每皿内接种17~21枚花药,诱导培养结束后统计膨大率(每皿膨大花药数/每皿接种花药数×100%),并进行方差分析。结果(表1)表明,不同品种的花药膨大率没有显著差异,品种与培养基之间不存在显著的互作效应,但2种诱导培养基之间膨大率存在显著差异,其中诱导培养基2中的花药膨大率平均为77.45%,显著大于诱导培养基1中的68.29% 。
2.3 不同基因型材料胚胎发生频率
花药转接到分化培养基后,约有半数花药能够产生愈伤组织,少数的花药能够产生胚状体,由于继代过程中仍旧会出现污染,无法精确地依据品种和诱导培养基以及膨大花药来统计各材料的胚胎发生频率,只能根据各品种最初接种的花药总数以及最终出现的胚状体数统计不同品种的出胚频率。所有供试品种在培养过程中均出现了胚状体,但频率不同,15-黑冠出胚频率最高,为17.0%;其次是15-231,频率为16.7%;15-234、15-232出胚频率均低于1%(表2),说明基因型影响花药胚胎发生频率。胚胎转移到生根培养基上以后,仅有14-55、14-84、15-231、混杂材料的胚胎萌发形成现蕾开花的植株。
2.4 再生植株倍性及性状观测
试验过程中出现的胚状体,分次转入生根培养基后,多数褐化死亡,或者重新愈伤化,转入调整生长调节剂浓度和种类的各种诱导不定芽的培养基后,没有成功诱导出芽和植株,而少数发育成熟的胚状体则能够直接萌发形成植株,最终获得了萌发的小植株12株,移栽成活并开花的植株7株,还有2株正待移栽,其余3株则在移栽过程中死亡。
成活的植株经过根尖染色体数目和减数分裂过程中二分体(中期Ⅱ)染色体数目鉴定,确定了植株的倍性:5株为单倍体,1株为二倍体,1株为四倍体。单倍体、二倍体、四倍体植株均能开花,个别单倍体花朵能够产生少量花粉,但所有单倍体植株自交均不结实(图2-1至图2-4);二倍体植株则能够开花,并自交结实,已获得自交种子(图2-5至图2-8),该二倍体植株的花粉给系谱法选育出的茄子二倍体自交系授粉也能结子;四倍体植株则能开花散粉,已经自交结实(图2-9至图2-12)。
3 结论与讨论
影响茄子花药培养的因素很多,包括花蕾预处理、基本培养基种类、花蕾生理状态、花粉发育时期、培养基中激素种类及其配比、活性碳和硝酸银的添加等等[3,13-15],茄子花药培养多用MS培养基作为基本培养基[16],适宜进行花药培养的茄子花蕾特征为花瓣长与花蕾萼裂基部之差在 0~2 mm[17],采用先低温后高温的变温处理[18],进行培养容易取得成功。本研究在前人工作的基础上,采用MS基本培养基,选用花瓣长与花蕾萼裂基部之差在 0~2 mm的花蕾,对花药先低温预处理12~48 h,再在36 ℃下处理6 d,随后在25 ℃下恒温培养,最终获得了愈伤组织和胚状体,并通过胚状体直接萌发产生了植株,进一步验证了前人的研究成果。通胚胎发生的方式,从花药培养到产生成熟胚状体,最早仅需42 d,胚状体萌发产生的植株半年内开花,二倍体和四倍体能够形成自交株系。与种子播种到开花结实采子所需时间一致,比通过愈伤组织器官发生途径产生植株时间更短,效率更高。
宋彦平等研究发现,茄子在盛花期,采摘的适宜花蕾胚诱导率最高,始花期次之,末花期最低[7]。本研究中所采用的花蕾,既有来源于春季栽培而秋季剪枝再生的植株,也有当年春季定植后生长中各个时期植株上的花蕾,而以剪枝再生植株上的花蕾培养产生的胚状体更多,胚状体更易发育成苗。刘独臣等在研究中发现,茄子花药产生胚状体受基因型影响,其所采用的10个品种,只有2个品种产生了胚状体,最高胚胎诱导率为18%[14]。而本试验中所采用的9份材料均再生出了胚胎,2份材料的最高出胚率也接近18%,但最低的则只有0.5%,与刘独臣等的研究结果[12]基本一致,但基因型反应频率更高,可能与选用材料遗传背景不同有关。
本研究中共获得了91个比较大的茄子状体,前期获得的胚状体由于培养条件和配方不合适等原因,多数褐变死亡,或愈伤化后不再分化出不定芽,最终无法形成完整植株,后期经过改进,尤其是通过调整培养基的配方、改进培养条件,已经能使更多的成熟胚状体直接发育成植株,最终使12个胚状体成苗。
聚乙二醇为长链乙醇聚合物,水溶性好,在溶液中不分解为离子,是一种较为理想的水势调节剂,被广泛应用作渗透调节剂[19-20],研究人员在进行茄子花药直接游离小孢子培养时,将培养基中的一半碳源用聚乙二醇代替后诱导出了更多的胚状体[9]。本试验中发现虽然诱导培养基2诱导花药膨大频率显著高于诱导培养基1,但产生胚状体最多的花药是从诱导培养基1转入分化培养基上的花药(图1-6),且 7个胚胎发育基本一致。2种培养基的差别在于诱导培养基1中添加了聚乙二醇,是否因聚乙二醇的添加而促使茄子花药和花粉培养中产生的胚状体同步发育并成熟,需要进一步深入研究。
植株的加倍技术[21]是制约单倍体植株保存和利用的关键,笔者参照北京市农业科学院蔬菜所单倍体组[11]的方法,对获得的单倍体植株进行了加倍处理,但未加倍成功,如何提高茄子单倍体植株加倍频率有待于进一步研究。
邓立平等通过花药培养获得了加倍单倍体植株,并用于茄子新品种选育[22],本试验中得到的茄子二倍体和四倍体植株能否用作选育杂交种品种的亲本,还需要进一步鉴定所获得的胚状体是配子起源还是体细胞起源。
参考文献:
[1]王延玲,丰 震,赵兰勇. 植物花药培养研究进展[J]. 山东农业大学学报:自然科学版,2006,37(1):149-151.
[2]Raina S K,Iyer R D. Differentiation of diploid plants from pollencallus in anther cultures of Solanum melongena L.[J]. Journal of Plant Breeding,1973,70(4):275-280.
[3]齐卫强,郭玲娟,孙治强. 茄子花药和花粉培养技术研究进展[J]. 安徽农业科学,2008,36(12):4929-4931.
[4]顾淑荣. 茄子(Solanum melongena L.)花粉粒离体培养获得植株[J]. 植物学报,1979,21(1):31-35.
[5]Miyoshi K. Callus induction and plantlet formation through culture of isolated microspores of eggplant (Solanum melongena L.)[J]. Plant Cell Reports,1996,15(6):391-395.
[6]连 勇,刘富中,陈钰辉,等. 茄子体细胞杂种游离小孢子培养获得再生植株[J]. 园艺学报,2004,31(2):233-235.
[7]宋彦平,申书兴,王彦华,等. 茄子游离小孢子培养获得愈伤组织的研究[J]. 河北农业大学学报,2007,30(3):32-35.
[8]朱朝辉,钟开勤,黄建都,等. 茄子游离小孢子培养初探[J]. 热带作物学报,2011,32(10):1883-1887.
[9]Corral-Martínez P,Seguí-Simarro J M. Efficient production ofcallus-derived doubled haploids through isolated microspore culture in eggplant (Solanum melongena L.)[J]. Euphytica,2012,187(1):47-61.
[10]北京市农业科学院蔬菜研究所单倍体育种组,中国科学院北京植物研究所五室形态组.茄子(Solanum melongena L.)花药培养的研究[J]. 植物学报,1975,17(4):323-325.
[11]北京市农科院蔬菜所单倍体组.茄子花药培养和加倍技术的研究[J]. 农业新技术,1977(5):38-41.
[12]刘独臣,房 超,李跃建,等. 茄子花药培养诱导胚状体成苗[J]. 西南农业学报,2008,21(6):1643-1646.
[13]马 欣,申书兴,连 勇,等. 茄子花药和游离小孢子培养技术研究进展[J]. 长江蔬菜,2006(7):39-41.
[14]刘独臣,房 超,刘小俊,等. 茄子花药培养研究进展[J]. 长江蔬菜,2006(7):42-44.
[15]李文泽,胡 含. 在花药花粉培养中预处理的作用机理[J]. 遗传,1995(增刊1):13-18.
[16]Kumar S,Singh M,Prabhavathi K,et al. In vitro induction of haploid in eggplant(Solanum melongena L.) [J]. Capsieum and Eggplant Newsletter,2003,22:147-150.
[17]马 欣. 茄子游离小孢子培养及其形态发育学观察[D]. 保定:河北农业大学,2006.
[18]Rotino G L,Falavigna A,Restaino F. Production of anther-derived plantlets of eggplant[J]. Capsicum News Letter,1987(6):89-90.
[19]张 霁,赵青红,郭兰萍,等. 聚乙二醇的渗透调节作用在药用植物育种研究中的应用[J]. 中草药,2010,41(8):1399-1403.
[20]冯艳秋,岳 桦. PEG-6000模拟干旱胁迫对朝鲜落新妇的影响[J]. 江苏农业科学,2015,43(5):184-187.
[21]王玉英,李光宏,李志敏,等. 野生黄蝉兰多倍体诱导初报[J]. 江苏农业科学,2014,42(4):132-134.
[22]邓立平,郭亚华. 茄子花药培养及单倍体育种[J]. 生物技术,1991(5):30-34.

