淡黄花百合珠芽诱导脱分化的研究
张翔宇+陈杰+吉云+严显进+王彩云+阮培均+王永


摘要:以淡黄花百合珠芽为试验材料,采用完全试验设计方法,研究不同浓度的6-BA、NAA组合对淡黄花百合珠芽愈伤组织诱导的影响。结果表明:淡黄花百合珠芽诱导愈伤组织的最佳培养基为MS+0.3 mg/LNAA+1.0 mg/L6-BA,其诱导萌发时间为11 d,萌发率为100%,愈伤组织月平均直径增长量3 cm以上。
关键词:淡黄花百合;珠芽;脱分化
中图分类号: S567.23+9.043 文献标志码: A
文章编号:1002-1302(2016)09-0058-03
淡黄花百合(Lilium sulphureum.Baker)为百合科百合属多年生草本植物,集药食两用及观赏于一身[1]。其花、梗、鳞茎均可入药,花和梗可用作止血药,鳞茎可预防和治疗肺结核、慢性气管炎、咳嗽、肺气肿、肺嗽咯血、体虚肿弱、疮痈肿瘤等症,若服食清蒸百合,还可治胃病、肝病、贫血等,是多种滋补药的主药[2]。百合的传统繁殖方式主要有珠芽繁殖、子球繁殖、鳞片繁殖3种[3]。采用现代组织培养方式进行百合种苗扩繁,因其繁殖系数高而成为重要的繁殖方式之一,通过组织培养可快速得到大量百合种苗,是百合产业发展的一大趋势。而要使百合组织培养与生产衔接,关键是要针对不同品种制定与之相匹配的组培快繁方案[4]。组织培养方法可促进百合商品种球的生产和百合新品种的培育[5]。
目前对百合诱导脱分化的报道较多。刘芬等用花丝诱导兰州百合愈伤组织时发现,MS+1.0 mg/L 6-BA+0.5 mg/L NAA是诱导兰州百合花丝愈伤组织形成的理想培养基[6];申玉华等以西伯利亚百合花托为外植体进行组织培养发现,MS+1.0 mg/L 6-BA+2.0 mg/L NAA是诱导愈伤组织的最佳培养基[7];李黛等以淡黄花百合鳞茎为外植体进行诱导,发现其诱导愈伤组织增殖的最适培养基为MS+0.5 mg/L6-BA+1 mg/L NAA+3%蔗糖[8];郭海滨等以卷丹百合鳞片及珠芽为外植体进行研究认为,MS+1.5 mg/L 6-BA+0.2 mg/L NAA诱导不定芽和愈伤组织数量较多,生长势强,愈伤组织颗粒出现时间为20 d[9]。以上研究表明,对百合愈伤组织诱导大部分以MS为基本培养基附加不同浓度的6-BA和NAA,但不同种类百合愈伤组织诱导所用的6-BA与NAA的比例有较大差异。同时,没有针对愈伤组织不同时期的增长量及生长情况的研究报道。由于愈伤组织不同时期的增长量及生长情况对于后期大规模诱导再分化出不定芽直至生产组培苗具有至关重要的影响。因此,本研究以淡黄花百合珠芽为外植体,研究不同浓度的6-BA和NAA组合对其愈伤组织诱导和愈伤组织直径月平均生长量的影响,以期为淡黄花百合大规模组培育苗提供技术支撑。
1 材料与方法
1.1 材料
1.1.1 外植体 野生淡黄花百合珠芽采自贵州省毕节市大方县羊场镇2年生淡黄花百合植株。
1.1.2 培养基 以MS为基本培养基,其中每个配方添加25 g/L 蔗糖,pH值为5.8~6.0,琼脂添加量6.5 g/L。
1.2 方法
1.2.1 外植体灭菌 将采集的淡黄花百合珠芽带回实验室,用自来水冲洗3 h,用镊子将外层小鳞片剥下,放入烧杯中,加入1~2滴吐温20,用玻棒搅拌2~3 min,放置30 min,将水倒掉,用纱布将外植体包好,用自来水冲洗1~2 h后,于超净工作台上用75%乙醇浸泡30 s左右,用无菌水冲洗3~4次,然后用0.1%氯化汞消毒8 min,无菌水冲洗6次以上,最后将灭菌后的外植体放入事先准备好的无菌不锈钢盘中,用滤纸吸干表面水分,即可得到接种用外植体。
1.2.2 外植体接种 用镊子将准备好的无菌外植体接种于不同植物生长调节剂组合的培养基上(表1),每组接种5瓶,每瓶接种5个,每组3个重复。
1.2.3 培养 接种后放在培养架上培养,培养条件:白天(25±3)℃,晚上(20±3)℃,湿度(85±5)%,光照度为1 000~1 200 lx,光照时间12 h /d。
1.2.4 试验设计 采用2因素5水平完全设计方案(表1)。
1.3 项目测定
诱导时间t:外植体开始萌动时的时间。
1.4 数据处理
所得数据均采用 IBM SPSS Statistics 20软件进行分析。
2 结果与分析
2.1 不同浓度6-BA与NAA组合对愈伤组织诱导时间的影响
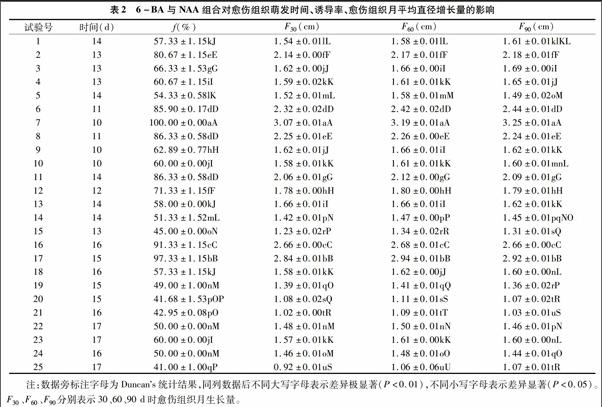
不同浓度的6-BA与NAA组合对愈伤组织诱导时间的影响较大。通过对表2中诱导时间的直观分析表明,处理7、处理9、处理10均可在10 d诱导珠芽愈伤组织萌动,而其他处理的诱导时间相对延迟,其中处理22、处理23、处理25均需要17 d才可以诱导愈伤组织萌动。由表3中诱导时间的Ⅲ型平方和可以看出,NAA的Ⅲ型平方和为334.080,大于6-BA 的7.680,这表明对淡黄花百合珠芽愈伤组织萌发时间的影响中,NAA起主要作用,6-BA起次要作用。从表2可看出,不同浓度NAA和6-BA对萌发时间的影响不同,低浓度的NAA诱导萌发的时间较短,高浓度NAA诱导萌发的时间较长,0.3 mg/L NAA与1.0 mg/L 6-BA组合能够最快诱导产生愈伤组织。
2.2 不同浓度6-BA与NAA组合对愈伤组织诱导率的影响
不同浓度的6-BA与NAA组合对愈伤组织诱导率具有显著性差异。从表2可以看出,处理15、处理20、处理21、处理25的诱导率较差,诱导率不到50%;而处理7、处理16、处理17的诱导率较好,均超过90%,其中处理7的诱导率可达100%。由表3中诱导率的Ⅲ型平方和可以看出,NAA的Ⅲ型平方和为7 055.290,小于6-BA的9 888.965,这表明对淡黄花百合珠芽愈伤组织诱导率的影响中,6-BA起主要作用, NAA起次要作用。0.3 mg/LNAA与1.0 mg/L 6-BA组合对珠芽愈伤组织的诱导率最高,可达100%。
2.3 不同浓度6-BA与NAA组合对愈伤组织月平均增长量的影响
不同浓度的6-BA与NAA组合对愈伤组织月平均增长量的影响具有显著性差异。由表2可以看出,在第1个月,处理25的增长量最小,只有(0.92±0.01)cm,而处理7的增长量最大,可达(3.07±0.01)cm;在第2个月,处理25的增长量仍然最小,只有(1.06±0.06)cm,而处理7的增长量仍然最大,为(3.19±0.01)cm;在第3个月,处理21的增长量最小,为(1.03±0.01)cm,而处理7的增长量仍然最大,为(3.25±0.01)cm。不管是第1个月、第2个月还是第3个月,0.3 mg/L NAA与1.0 mg/L 6-BA组合的月平均直径增长量均最大,其增长量均达3 cm以上。从表3中愈伤组织月平均增长量的Ⅲ型平方和可以看出,6-BA的影响均大于NAA,说明对于淡黄花百合珠芽愈伤组织的生长,6-BA起主要作用。从表4中愈伤组织生长情况来看,30 d时,愈伤组织颜色均为黄绿色,随着培养时间的增加,诱导率高于70%的组合颜色能够保持较好的生长色,愈伤组织比较疏松,利于增殖和分化(图1-A)。而诱导率低于70%的组合颜色不能保持好的生长色,逐渐开始褐化,愈伤组织的生长状态开始变得紧密,不利于增殖和分化(图1-B)。结合表2和表4可以看出,虽然诱导率高于70%的组合颜色能够保持再好的生长色,但随着培养时间的增加,愈伤组织的月增长量出现规律性,即前60 d呈现生长加快的趋势,60 d之后生长开始变缓。
3 结论与讨论
本试验采用珠芽为外植体,以MS为基本培养基,采用2因素5水平完全试验设计方案考察不同浓度NAA和6-BA组合对淡黄花百合珠芽诱导愈伤组织的影响。结果表明,MS+0.3 mg/L NAA+1.0 mg/L 6-BA为淡黄花百合珠芽诱导愈伤组织的最佳培养基,该培养基不管是在诱导率、诱导时间,还是诱导愈伤组织月增长量方面均达到了最佳。研究还发现,低浓度的NAA诱导时间较快,高浓度NAA诱导时间较慢,NAA在诱导时间方面起主要作用,但在愈伤组织诱导率及愈伤组织的生长过程中6-BA却起主要作用,这种现象在现有文献中未提及。
刘芬等研究表明,诱导兰州百合花丝愈伤组织形成的理想培养基是 MS+1.0 mg/L 6-BA+0.5 mg/L NAA[6]; 申玉华等研究表明,诱导西伯利亚百合花托产生愈伤组织的最佳培养基是MS+1.0 mg/L 6-BA+2.0 mg/L NAA[7];郭海滨等研究表明,诱导卷丹百合鳞片及珠芽产生愈伤组织的理想培养基为 MS+1.5 mg/L 6-BA+0.2 mg/L NAA[9];周晓波等采用卷丹百合珠芽进行脱毒快繁研究发现,MS+2.0 mg/L 6-BA+2.0 mg/L 2,4-D+0.1 mg/L NAA为诱导愈伤组织最佳培养基,而只使用6-BA与NAA组合的培养基诱导愈伤组织少甚至没有[10]。张文娥等的研究表明,MS+0.1 mg/L NAA+1.0 mg/L 6-BA的诱导率为90.6%,而本试验中,MS+0.1 mg/L NAA+1.0 mg/L 6-BA组合的诱导率为80%左右,诱导率相差10%左右[11]。李黛等的研究表明,诱导愈伤组织增殖的最适培养基为MS+0.5 mg/L6-BA+1 mg/L NAA+3%蔗糖[8],这与本研究在NAA和6-BA 的使用量方面有较大差异,这可能是由所用外植体不同所致。结合本试验结果及上述分析认为, 不同种类百合诱导愈伤组织时添加的植物生长调节剂种类和浓度差异较大,在进行百合工厂化大规模育苗时,须根据所使用百合的种类,筛选出适宜的植物生长调节剂种类及浓度组合。研究结果还表明,愈伤组织在不同时期的增长量及生长情况对于后期大规模诱导再分化出不定芽直至生产组培苗具有至关重要的影响。
参考文献:
[1]李 黛,曾艳玲,魏福伦. 淡黄百合的离体保存[J]. 贵阳学院学报:自然科学版,2006,1(3):45-47.
[2]杨 晶,商万有. 百合的药用价值研究[J]. 吉林农业,2011(7):271.
[3]周春华,尤 超,陈凝华. 百合组织培养研究进展[J]. 北方园艺,2013(14):193-195.
[4]袁丽丽,刘青林. 从第二届国际百合属研讨会看世界百合研究趋势[J]. 中国花卉园艺,2010(22):13-15.
[5]杨春起,李邱华. 东方百合和亚洲百合鳞片组培试验[J]. 中国花卉园艺,2007(12):40-41.
[6]刘 芬,王发林. 兰州百合花丝组培诱导完整植株的研究[J]. 甘肃农业科技,2001(6):29-30
[7]申玉华,段永平,李 超,等. 西伯利亚百合花托的组织培养与离体快繁[J]. 江苏农业科学,2009(2):79-80,87.
[8]李 黛,谈 锋,祝顺琴. 淡黄花百合的组织培养[J]. 种子,2005,24(9):27-29.
[9]郭海滨,雷家军. 卷丹百合鳞片及珠芽组织培养研究[J]. 农业生物技术学报,2006,22(2):72-74.
[10]周晓波,吴艺飞,丁茁荑. 卷丹百合脱毒快繁技术研究[J]. 中国农学通,2012,28(31):201- 205.
[11]张文娥,潘学军,胥青青,等. 贵州野生淡黄花百合离体快繁研究[J]. 安徽农业科学,2008,36(14):5770-5772,5827.

