新生儿重症监护病房新生儿鼻部金黄色葡萄球菌定植和菌株的分子特征
李文婷 耿文静 姚开虎 史 伟 齐宇洁 沈叙庄
·论著·
新生儿重症监护病房新生儿鼻部金黄色葡萄球菌定植和菌株的分子特征
李文婷1,3耿文静2,3姚开虎1史 伟1齐宇洁2沈叙庄1
目的 探讨NICU患儿鼻部金黄色葡萄球菌(简称金葡菌)的定植情况及分离株的基因型和毒力特征。方法 采集NICU患儿的鼻拭子,分离培养金葡菌,采用头孢西丁纸片法和mecA检测鉴定甲氧西林耐药金葡菌(MRSA)或敏感金葡菌(MSSA);分析所有菌株MLST和spa分型,并对MRSA菌株进行SCCmec分型,采用PCR方法检测pvl和sasX和21种超抗原毒力基因。结果 从429例鼻拭子标本分离出79株金葡菌,定植率18.4%,其中MRSA 22株(27.8%)。79株金葡菌共检测出17种MLST型和29种spa型,最常见型分别为ST59(31.6%)和t437(22.8%)。22株MRSA最常见的SCCmec型为Ⅳa(81.8%)。ST59-Ⅳa-t437(63.6%)和ST188-t189(15.8%)分别是MRSA、MSSA最常见的流行克隆。最主要的毒力基因型为seb-sek-seq(10.1%)。MRSA株seb、sek、seq和pvl的携带率明显高于MSSA株,而sei携带率明显低于MSSA株。结论 NICU患儿鼻部金葡菌定植率较高,ST59-Ⅳa-t437和ST188-t189分别是MRSA、MSSA最常见的流行克隆;分离株毒力基因携带率较高,MRSA与MSSA菌株的毒力基因型存在差异。
金黄色葡萄球菌; 定植; 新生儿; 毒力; 基因型
金黄色葡萄球菌(简称金葡菌)具有共生菌和致病菌双重特性,鼻前庭是金葡菌最主要的定植部位,而鼻腔定植也是金葡菌感染的高风险指标之一[1],有报道显示约80%的金葡菌感染起源于内源性定植菌株[2]。NICU集中收治的危重新生儿,常伴多种高危因素,加大了定植金葡菌感染的风险。本课题组前期收集金葡菌感染的临床分离株,基因型和毒力分布研究显示,MRSA感染株最主要基因型为ST59 -SCCmecⅣa-t437,毒力基因携带率高, 最常见的毒力基因组合为seb-sek-seq,但缺少儿童定植金葡菌的相关研究[3]。为了解NICU金葡菌的定植状况及定植菌株的基因型和毒力特征,本研究从NICU患新生儿鼻部分离金葡菌,对菌株进行多位点序列分型、spa分型、葡萄球菌染色体盒分型以及19种肠毒素、2种剥脱毒素及pvl和sasX基因检测,现报告如下。
1 方法
1.1 纳入标准 ①2015年5月至12月首都医科大学附属北京儿童医院(我院)NICU新生儿,②入我院24 h以内采集了鼻拭子标本行金葡菌分离培养。
1.2 排除标准 现存的或潜在的可能会影响鼻拭子的结果的疾病,重度呼吸窘迫和其他临床医师认定的因素。
1.3 采集鼻拭子标本方法和保存 新生儿平卧位状态下,将棉签拭子用无菌生理盐水湿润后伸入双侧鼻腔约1 cm接触鼻黏膜,旋转3 周后放入无菌转运管。采集的鼻拭子标本于-20℃低温贮藏,每5 d在冷冻状态下转运至我院微生物实验室进行细菌分离培养。
1.4 金葡菌分离培养与甲氧西林敏感性检测 通过菌落形态学、凝固酶试验及nuc基因检测对可疑菌落进行金葡菌鉴定,采用头孢西丁纸片(30 Pg,Oxoid)法和mecA基因检测筛查耐甲氧西林金葡菌(MRSA)。头孢西丁纸片法按照CLSI(Clinical and Laboratory Standards Institute)2016年标准判定,抑菌环直径≤21 mm为MRSA,>21 mm为甲氧西林敏感金葡菌(MSSA)。
1.5 DNA提取 采用硅胶模型TM 基因组DNA试剂盒(北京赛百盛基因技术有限公司)提取细菌基因组DNA,步骤按试剂盒说明书操作。
1.6 多位点序列分型 PCR扩增金葡菌7个管家基因(arcC、aroE、glpF、gmk、pta、tpi、yqil)。扩增引物参照Enright等[4]的设计。所得目的片段由北京天一辉远生物技术有限公司进行测序。测序结果在多位点序列分型数据网站( http://saureus.mlst.net) 上比对等位基因的序列型别。
1.7 SCCmec及其亚型分型 多重PCR引物和反应体系参照Milheirico 和 Oliveira的设计[5],每一SCCmec型产生特异的扩增模式。SCCmec Ⅳ菌株根据J1区的多样性采用另一PCR引物进行亚型分型,分为Ⅳa、 Ⅳb、Ⅳc、 Ⅳd、 Ⅳg和 Ⅳh[6]。如菌株出现多余或缺少扩增片段时则定义为无法分型。SCCmec分型质控菌株由日本顺天堂大学Teruyo Ito教授赠送。
1.8 spa分型 通过PCR扩增spa目的片段,上游引物SpaF: 5'-GACGATCCTTCAGTGAGCAAAG-3'; 下游引物SpaR: 5'-GCAGCAATTTTGTCAGCAGTAG-3'。扩增片段送北京天一辉远生物技术有限公司测序,通过与spa分型数据库(http://www.ridom.de/spaserver/)比对确定分型。
1.9 毒力基因检测 参照Holtfreter[7]的实验方法依次进行5组多重PCR反应,检测分离菌株是否携带有19种肠毒素基因(sea~see、seg~ser、seu、tsst-1)和2种剥脱毒素基因(eta、etd),扩增引物序列和多重PCR分组见文献[7]。质控菌株由德国Greifswald大学Bröker教授馈赠。分别参照Lina[8]和Li等[9]设计PCR检测pvl基因和sasX基因。PCR 产物在含溴乙啶的1.5% 的琼脂糖凝胶中电泳,用凝胶成像仪观察和保存扩增结果。
1.10 统计学分析 用SPSS19.0 软件进行统计分析。率的比较用χ2检验或Fisher's 确切概率法。P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 符合本文纳入和排除标准的新生儿429例,男262例,女167例,年龄生后1 h至28 d。每例新生儿取得1 份鼻拭子标本,429份鼻拭子标本分离到金葡菌79株,分离率为18.4%;男女新生儿分离率分别为14.5%(38/262)和24.6%(41/167),差异有统计学意义(χ2=6.85 ,P<0.009);早期新生儿(1 h至7 d)分离率为7.3%(16/219),晚期新生儿(~28 d)分离率为30.0%(63/210),差异有统计学意义(χ2= 36.75,P<0.001)。5~12月份分别分离金葡菌28.6%(6/21)、12.9(9/7O)、20.2%(18/89)、12.8%(5/39)、20.0%(12/60)、23.5%(12/51)、20.7%(12/58)和12.2(5/41)。
2.2 临床资料 79例分离出金葡菌的新生儿入院时诊断,感染性疾病41例(51.9%),其中败血症15例,肺炎12例,淋巴结炎、化脓性脑炎、泪囊炎各1例,其他感染11例;皮肤软组织感染9例(11.4%),其中蜂窝织炎和脓疱病各4例,葡萄球菌性烫伤样皮肤综合征1例;惊厥6例;黄疸5例;先天性疾病5例(先天性肾上腺皮质增多症2例,先天性喉软骨软化病1例,新生儿脑血管畸形2例);皮肤软组织损伤、低血糖和新生儿腹泻病各3例;咽下综合征、新生儿缺血缺氧性脑病、休克和十二指肠侧侧吻合术后各1例。
2.3 基因型特征 79株金葡菌中MRSA 22株(27.8%),MSSA 57株(72.2%)。MRSA均为mecA阳性,且头孢西丁抑菌圈≤21mm,mecA检测与头孢西丁纸片法筛查结果一致。
79株金葡菌中多位点序列分型共17种,①MRSA菌株中序列型别59(19株)、22(1株)、398(1株)、630(1株);②MSSA菌株中序列型别188(9株)、5(9株)、398(7株)、59(6株)、15(6株)、7(5株)、6(3株)、1(3株)、8(2株)、25(2株)、1281(2株)、20(1株)、121(1株)和2793(1株)。
79株金葡菌中spa型共有29种,①MRSA菌株中spa型别t437(15株)、t1751(2株)、t3523(2株)、t309(1株)、t034(1株)、t4549(1株); ②MSSA菌株中序列型别t189(9株) 、t571(7株)、t437(3株)、t701(3株)、t164(3株)、t002(3株)、t010(2株)、t084(2株)、t127(2株)、t163(2株)、t796(2株)、t803(2株)、t9101(2株)、t034(1株)、t078(1株)、t091(1株)、t227(1株)、t328(1株)、t393(1株)、t548(1株)、t867(1株)、t954(1株)、t948(1株)、t1425(1株)和t4911(1株),另有3株spa无法分型。
79株金葡菌中MRSA 22株均可明确SCCmec分型,分别为SCCmec Ⅳ(18株)、Ⅴ(3株)和Ⅲ(1株)型,其中SCCmec Ⅳ型全部为Ⅳa亚型。
综合上述基因分型,MRSA最常见的流行克隆为ST59-Ⅳa-t437(63.6%,15/22),MSSA最常见的流行克隆为ST188-t189(15.8%,9/57)。
2.4 毒力基因 表1显示,检测的19种肠毒素基因和2种剥脱毒素基因中,79例分离出金葡菌的新生儿中有68例(86.1%)至少携带一种毒力基因,未检出see和tsst-1基因;在携带有毒力基因的68株菌株中发现了45种毒力基因组合,其中seb-sek-seq10.1% (8/79),seq-sej和seb各5.1%(4/79),pvl的阳性率为16.5%(13/79),未检测到sasX。
2.5 MRSA与MSSA菌株携带毒力基因的差异 表1显示,MRSA和MSSA菌株毒力基因整体携带率分别为81.8%(18/22)和87.7%(50/57),两者主要的毒力基因分别是seq(63.6%,14/22)和sei(35.1%,20/57)。MRSA株seb、sek、seq和pvl的携带率明显高于MSSA株(P<0.05),而sei携带率明显低于MSSA株(P<0.05)。sec、seh、sel、sen、seu、eta仅见于MSSA株。属于seb-sek-seq超抗原基因型的菌株主要是MRSA,占75%。
3 讨论
鼻前庭是金葡菌最主要的定植部位,约20%的成人鼻部有金葡菌的持续定植,30%有间歇定植[2]。鼻拭子培养对监测NICU新生儿金葡菌定植的敏感性达70%~97%[10~12]。Seybold等[13]的研究中,3.5%的NICU新生儿存在鼻前庭MRSA定植,美国国家儿童医疗中心NICU连续4年的研究中MRSA定植率为5.6%[10],郑州大学第一附属医院2013年报道NICU金葡菌和MRSA定植率分别为21.1%和3.69%[14]。本研究中,429例NICU新生儿金葡菌的定植率为18.4%,MRSA定植率为5.1%,与国内、外NICU定植情况基本一致。Song等[10]报道显示,30%的新生儿MRSA携带者住院期间发展为MRSA感染,金葡菌的定植不但可以引发自身感染,还可作为重要的传染源在院内传播,因而加强NICU细菌定植检测是控制医院感染的重要环节。
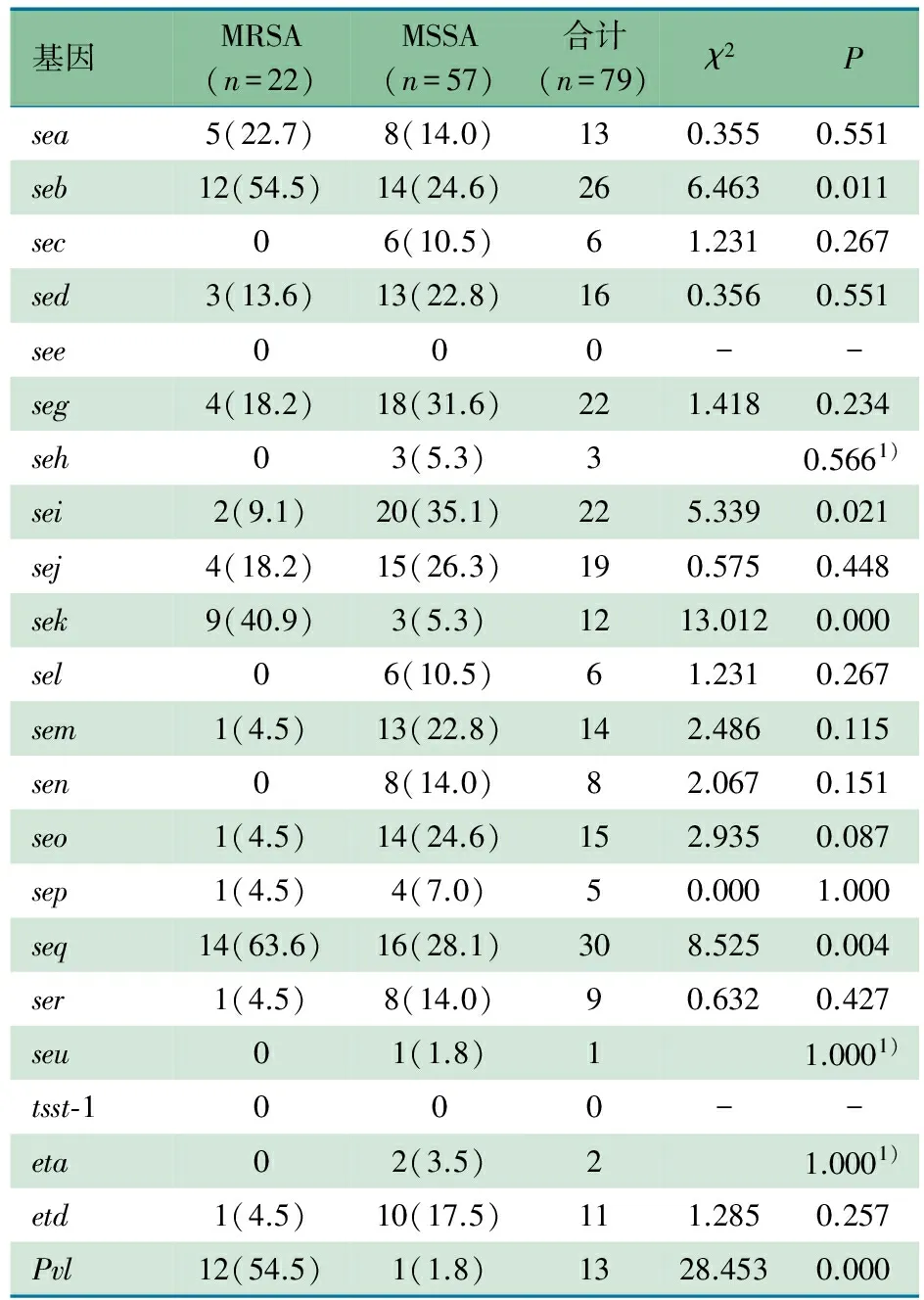
表1 毒力基因携带情况及MRSA与MSSA菌株间差异[n(%)]
注 1)Fisher检验
金葡菌的定植与年龄密切相关,新生儿易产生金葡菌定植[15,16]。Patel等[16]对≤6个月的婴儿进行了金葡菌定植情况的持续研究显示,1月龄定植率最高(25%),6月龄仅12%。但目前还没有对早期和晚期新生儿定植率的差异的报道,本研究显示,晚期新生儿金葡菌定植率明显高于早期新生儿(30.3%vs7.3%),可能与晚期新生儿与外界接触时间更长有关。值得注意的是,本研究中女新生儿定植率明显高于男新生儿(24.6%vs14.5%),而成人金葡菌定植的报道,男性定植率更高[17]。更多报道和研究显示新生儿金葡菌定植率与性别不相关[10,12,14,18]。
前期有关中国大陆儿童金葡菌感染分离株分子特征的研究显示,MRSA 主要ST型为ST59,而MSSA则主要为 ST88、ST25、ST7和ST188[19]。本研究中金葡菌最常见的ST型为ST59,MRSA与MSSA最常见的流行克隆分别为ST59-Ⅳa-t437和ST188-t189,与前期研究中感染分离株的主要ST型基本一致。值得注意的是,本研究未检测到ST239,此ST型是医院环境金葡菌的常见ST型。
人类以往的研究数据已经表明超抗原基因参与金葡菌的定植[20],本研究检测了19种肠毒素、2种剥脱毒素基因及pvl、sasX在住院儿童定植菌中的分布情况。本课题组前期研究报道[21]88.9%的金葡菌携带毒力基因,最常见的依次为sek、seq和seb。本研究中,分离株携带率最高的超抗原为86.1%携带毒力基因,最常携带的毒力基因为seq、seb和seg,最主要的毒力基因型为seb-sek-seq,这与临床感染分离株的特征基本一致。sasX主要存在于医院环境内致病性的金葡菌中,而在健康人鼻腔内分离的金葡菌中sasX的阳性率仅为0.6%[22],本课题组前期研究中,中国儿童MRSA感染株的sasX携带率为10.7%[23],约70%的sasX阳性菌株为ST239,本研究中MRSA分离株未检测到sasX,推测与本地区流行的ST型有关。
携带者的早期筛查是金葡菌感染预防计划的关键,并已在多地区展开实施[24~27]。中国台湾Huang等[27]主动筛查NICU新生儿金葡菌定植情况并进行了莫匹罗星去定植治疗,有效地降低金葡菌感染的发生率、病死率和相关医疗成本。中国大陆还没有针对住院患儿金葡菌定植的主动监测及定植儿童的干预规范,临床有必要对此予以重视。
[1]Wertheim HF, Melles DC, Vos MC, et al. The role of nasal carriage in Staphylococcus aureus infections. Lancet Infect Dis, 2005, 5(12): 751-762
[2]Werttheim HF, Vos MC, Ott A, et al. Risk and outcome of nosocomial Staphylococcus aureus bacteraemia in nasal carriers versus non-carriers . Lancet, 2004, 364(9435): 703-705
[3]Li S, Ning X, Song W, et al. Clinical and molecular characteristics of community-acquired methicillin-resistant Staphylococcus aureus infections in Chinese neonates. APMIS Acta Pathol Microbiol Immunol Scand,2015,123: 28-36
[4]Enright MC, Day NP, Davies CE, et al. Multilocus sequence typing for characterization of methicillin-resistant and methicillin-susceptible clones of Staphylococcus aureus. J Clin Microbiol, 2000, 38(3): 1008-1015
[5]Milheirico C, Oliveira DC, de Lencastre H. Update to the multiplex PCR strategy for assignment of mec element types in Staphylococcus aureus. Antimicrob Agents Chemother, 2007, 51(9): 3374-3377
[6]Milheirico C, Oliveira DC, de Lencastre H. Multiplex PCR strategy for subtyping the staphylococcal cassette chromosome mec type IV in methicillin-resistant Staphylococcus aureus: 'SCCmec IV multiplex'. J Antimicrob Chemother, 2007,60(1): 42-48
[7]Holtfreter S, Grumann D, Schmudde M, et al. Clonal distribution of superantigen genes in clinical Staphylococcus aureus isolates. J Clin Microbiol, 2007,45, 2669-2680 [8]Lina G, Piemont Y, Godail-Gamot F, et al. Involvement of Panton-Valentine leukocidin-producing Staphylococcus aureus in primary skin infections and pneumonia. Clin Infect Dis, 1999, 29(5): 1128-1132
[9]Li M, Du X, Villaruz AE, et al. MRSA epidemic linked to a quickly spreading colonization and virulence determinant. Nat Med, 2012,18:816-819
[10]Song X,Perencevich E,Campos J,et al.Clinical and economic impact of methicillin-resistant Staphylococcus aureus colonization or infection on neonates in intensive care units.Infeet Control Hosp Epidemiol,2010,31(2):177-182
[11]Rosenthal A, White D, Churilla S, et al. Optimal surveillance culture sites for detection of methicillin-resistant Staphylococcusaureus in newborns. J Clin Microbiol, 2006,44(11):4234-4236
[12]Huang YC, Chou YH, Su LH, et al. Methicillin-resistant Staphylococcus aureus colonization and its association with infection among infants hospitalized in neonatal intensive care units. Pediatrics, 2006,118(2):469-474 [13]Seybold U,Halvosa JS,White N,et al.Emergence of and risk factors for methicillin-resistant Staphylococcus aureus of community origin in intensive care nurseries.Pediatrics,2008,122(5):1039-1046
[14]郭宏湘, 魏文金, 张茜,等. 新生儿重症监护病房耐甲氧西林金黄色葡萄球菌定植率和危险因素分析. 中华实用儿科临床杂志, 2013, 28(10):752-755
[15]Sollid JU, Furberg AS, Hanssen AM, et al. Staphylococcus aureus: determinants of human carriage. Infect Genet Evol, 2014,21:531-541
[16]Patel JA, Alvarez-Fernandez P, Jennings K, et al. Factors affecting Staphylococcus aureus colonization of the nasopharynx in the first 6 months of life. Pediatr Infect Dis J, 2015, 34:826-830
[17]van Belkum A.Verkaik NJ, de Vogel CP, et al. Reclassification of Staphylococcus aureus nasal carriage types. J Infect Dis, 2009,199(12):1820-1826
[18]Peacock SJ, Justice A, Griffiths D, et al. Determinants of acquisition and carriage of Staphylococcus aureus in infancy . J Clin Microbiol, 2003, 41: 5718- 5725
[19]Qiao Y, Ning X, Chen Q, et al. Clinical and molecular characteristics of invasive community-acquired Staphylococcus aureus infections in Chinese children. BMC Infect Dis, 2014,14(1):582
[20]Xu SX, Kasper KJ, Zeppa JJ, et al. Superantigens modulate bacterial density during staphylococcus aureus nasal colonization. Toxins,2015,7:1821-1836
[21]Wu D, Li X, Yang Y, et al. Superantigen gene profiles and presence of exfoliative toxin genes in community-acquired meticillin-resistant Staphylococcus aureus isolated from Chinese children. J Med Microbiol,2011,60(Pt 1):35-45
[22]杜昕,宋燕,田月如. 新的细胞壁锚定蛋白编码基因sasX在金黄色葡萄球菌中的分布.中华检验医学杂志, 2011,34(12):1093-1097
[23]Li S, Sun J, Zhang J, et al. Comparative analysis of the virulence characteristics of epidemic methicillin-resistant Staphylococcus aureus (MRSA) strains isolated from Chinese children: ST59 MRSA highly expresses core gene-encoded toxin. APMIS, 2014,122:101-114
[24]Victor O. Popoola, Elizabeth Colantuoni, et al. Active Surveillance Cultures and Decolonization to Reduce Staphylococcus aureus Infections in the Neonatal Intensive Care Unit. Infection Control & Hospital Epidemiology,201,37: 381-387
[25]Lamy Filho F, de Sousa SH, Freitas IJ, et al. Effect of maternal skin-to-skin contact on decolonization of Methicillin-Oxacillin-Resistant Staphylococcus in neonatal intensive care units: a randomized controlled trial. BMC Pregnancy Childbirth,2015,15:63
[26]You JH, Chan CY, Wong MY, et al. Active surveillance and decolonization of methicillin-resistant Staphylococcus aureus on admission to neonatal intensive care units in Hong Kong: a cost-effectiveness analysis. Infect Control Hosp Epidemiol, 2012,33:1024-1030
[27]Huang YC, Lien RI, Lin TY. Effect of mupirocin decolonization on subsequent methicillin-resistant Staphylococcus aureus infection in infants in neonatal intensive care units.Pediatr Infect Dis J, 2015,34(3):241-245
(本文编辑:张崇凡)
Nasal carriage and molecular characteristics of Staphylococcus aureus isolates from neonates in neonatal intensive care unit
LI Wen-ting1,3, GENG Wen-jing2,3, YAO Kai-hu1, SHI Wei1, QI Yu-jie2, SHEN Xu-zhuang1
(1 Beijing Children′s Hospital, Capital Medical University,Beijing Pediatric Research Institute,National Key Subjects of Pediatrics,Key Laboratory of Major Disease of the Ministry of Education, Beijing 100045; 2 Department of Neonatology, Beijing Children′s Hospital, Capital Medical University, Beijing 100045, China;3 Co-first author)
SHEN Xu-zhuang,E-mail:xuzhuangshen@163.com
Objective To investigate the nasal carriage rate and molecular characteristics ofStaphylococcusaureus(S. aureus) isolates among neonates in neonatal intensive care unit(NICU) of Beijing Children's Hospital.MethodsSurveillance of nasal swabs from neonates were conducted in NICU of Beijing Children's Hospital from May to December of 2015.Bacterial culture was performed.Methicillin-resistantStaphylococcusaureus(MRSA) and Methillin-susceptibleStaphylococcusaureus(MSSA) were identified by cefoxitin disc diffusion and detection of mecA.Isolates were analyzed by MLST,SCCmec,spa typing ,followed by detection ofpvl,sasXand 21 toxin genes by PCR.ResultsSeventy-nine (18.4%) of 429 neonates had nasal carriage of S. Aureus. MRSA accounted for 27.8% .17 sequence types and 29 spa types were detected and the most frequent types were ST59(31.6%)and t189 (22.8%) respectively. The most common SCCmec type was Ⅳa (81.8%)among 22 MRSA strains. ST59-Ⅳa-t437(63.6%) and ST188-t189 (15.8%) were the most common clones of MSSA and MRSA, respectively. Of 79 isolates,seb-sek-seq(10.1%) was the most common virulence genotypes.seb、sek、seqandpvlgene were more associated with MRSA than with MSSA ,whileseigene was more associated with MSSA.ConclusionThe nasal carriage rate of S. aureus was high among neonates in NICU of Beijing Children's Hospital. ST59-Ⅳa-t437 and ST188-t189 were the most common clones of MSSA and MRSA. The rate of toxin genes in carriage strains of S. aureus was high, and visible differences existed between MRSA and MSSA strains.
Staphylococcusaureus; Carriage; Neonates; Toxin; Genotype
国家自然科学基金资助项目: 81171648,81061160509;北京市优秀人才青年骨干个人资助项目:2014000021469g243;首都医科大学附属北京儿童医院第二批临床-科研复合型人才苗圃计划项目:BCHYIPB-2016-05
1 首都医科大学附属北京儿童医院、北京市儿科研究所,儿科学国家重点学科,教育部儿科重大疾病研究重点实验室,国家呼吸系统疾病临床医学研究中心,儿童呼吸道感染性疾病研究北京市重点实验室;2 首都医科大学附属北京儿童医院新生儿中心;北京 100045;3 共同第一作者
沈叙庄,E-mail: xuzhuangshen@163.com
10.3969/j.issn.1673-5501.2016.05.010
2016-07-30
2016-09-30)

