基于高迁移率族蛋白B1对老鼠生物碱A抗肝纤维化作用机制的研究
莫思燕,韦明中,邱金慧,朱勋帅,刘 林,林 军
(广西医科大学药学院药理学教研室,广西 南宁 530021)
莫思燕,韦明中,邱金慧,朱勋帅,刘 林,林 军
(广西医科大学药学院药理学教研室,广西 南宁 530021)
目的 基于高迁移率族蛋白B1(HMGB1)探讨老鼠簕生物碱A(HBOA) 抗大鼠肝纤维化的作用机制。方法 采用四氯化碳(CCl4)橄榄油溶液灌胃12周,建立大鼠肝纤维化模型。第8周确定建模成功后,将其随机分为模型对照组、秋水仙碱组、HBOA高剂量组、HBOA低剂量组,从第9周起,相应药物干预4周后,取肝组织切片行HE染色及Masson染色;测定血清中ALT、AST、T-BIL、HMGB1、IL-1β、TNF-α 的含量;免疫组化法检测肝组织中HMGB1 蛋白的表达;实时荧光定量PCR 法测定肝组织中HMGB1 mRNA表达量。结果 与模型对照组相比,HBOA 高、低剂量均明显减轻CCl4所致肝组织病变程度,降低血清中ALT、AST、T-BIL、HMGB1、 IL-1β、TNF-α含量,减少肝组织中HMGB1蛋白及 mRNA 表达,且血清HMGB1水平与IL-1β、TNF-α、ALT、AST、T-BIL呈正相关。结论 HBOA对CCl4诱导的大鼠肝纤维化有一定的改善,其作用机制可能与降低致炎因子HMGB1有关。
高迁移率族蛋白 B1;老鼠簕生物碱A;肝纤维化;CCl4;炎症因子;大鼠老鼠簕(AcanthusilicifoliusL.)是爵床科老鼠簕属的植物,为重要药用红树林植物,我国民间主要用于治疗急慢性肝炎、淋巴结肿胀、肝脾肿大、胃痛、咳嗽、哮喘等[1]。本课题组前期研究表明,老鼠簕药理活性成分主要为老鼠簕生物碱,具有保肝作用[2]。其中,老鼠簕生物碱A[4-羟基苯并噁唑-2-酮,英文名4-hydroxy-2(3H)-benzoxazolone,简称HBOA]是老鼠簕生物碱中的1个活性单体。
肝纤维化(hepatic fibrosis,HF)是肝硬化发生的前奏和必经的中间环节,是慢性肝病的重要病理特征,也是临床治疗慢性肝病的关键环节。研究证实,慢性炎症反应是肝纤维化发生、发展的重要因素[3]。近年来,人们对细胞因子在炎症反应中的作用有了较深入的研究,高迁移率族蛋白 B1(high mobility group box 1,HMGB1)是一种晚期致炎因子,可能参与了多种组织器官如肺、肝的纤维化进程[4]。由于其具有作用持久的特点,针对HMGB1的治疗比其他早期炎症因子具有更宽泛的治疗窗口期。所以,以HMGB1为靶点的抗炎治疗引起人们的极大兴趣[5]。本实验拟通过CCl4诱导的大鼠肝纤维化模型,检测大鼠血清及肝组织中HMGB1的含量,观察大鼠肝组织病理学及血清肝功能指标、早期炎症因子的变化,并探索其中的内在联系,初步探讨老鼠簕生物碱A基于HMGB1 抗肝纤维化的作用机制。
1 材料与方法
1.1 材料
1.1.1 受试药物与试剂 HBOA 由广西医科大学药学院药物化学教研室合成,纯度为0.9937;秋水仙碱购于西双版纳药业有限责任公司(批号:140515);CCl4、羧甲基纤维素钠购于西陇化工股份有限公司;ALT、AST及T-BIL试剂盒购于南京建成生物工程研究所;大鼠HMGB1、IL-1β及TNF-α ELISA 试剂盒、HMGB1兔多克隆抗体、兔IgG-免疫组化试剂盒、DAB显色试剂盒均购于武汉博士德生物工程有限公司;引物、RNAiso Plus、Prime Script RT Master Mix、SYBR Premix Ex TaqTM Ⅱ购于日本TaKaRa公司。
1.1.2 仪器 TGL-16G-A高速冷冻离心机(上海安享科学仪器厂);电热恒温水浴箱(北京塞多利斯仪器系统有限公司);ND-2010 型紫外可见分光光度计(美国Thermo Fisher Scientific);连续光谱扫描式酶标仪(香港分子仪器公司);CX-41型倒置显微镜(日本Olympus公司);ABI7300实时荧光定量PCR仪(应用生物系统公司)。
1.1.3 动物 SD大鼠,60只,♂,180 g~220 g,由广西医科大学实验动物中心提供(许可证号:SCXK桂 2015-0002,实验单位使用许可证编号:SYXK桂 2011-0005)。于室温(23±2)℃、湿度(60±20)%、标准光线环境下饲以我校实验动物中心提供的专业饲料,饲养期间大鼠均自由摄食、饮水。
1.2 方法
1.2.1 动物分组与干预 60只SD大鼠适应饲养1周后,其中50只大鼠灌胃予以体积分数为0.40的CCl4橄榄油溶液3 mL·kg-1建立肝纤维化模型,首剂加倍,每周2次,共12周。剩余10只大鼠设为正常对照组,仅灌胃相应体积生理盐水。第8周,取10只模型对照组大鼠HE 染色病理检测结果证实大鼠肝纤维化模型成立后,将大鼠随机分为模型对照组(MC)、秋水仙碱组(Colchicine)、HBOA 高剂量组(HH)、HBOA 低剂量组(HL),每组各10只,以及正常对照组(NC)10只。从第9周开始,秋水仙碱组灌胃给予秋水仙碱混悬液(0.4 mg·kg-1);HBOA高剂量组(100 mg·kg-1)、HBOA 低剂量组(50 mg·kg-1)灌胃予以质量浓度为6 g·L-1的羧甲基纤维素钠(CMC-Na)配制成的HBOA混悬液(溶液现配现用);模型对照组及正常对照组灌胃给予相应体积CMC-Na 溶液10 mL·kg-1,连续4周。
1.2.2 取材 12周后,大鼠用10%的水合氯醛麻醉,腹主动脉抽血,经3 000 r·min-1离心10 min后,分离血清于-80 ℃保存备用。同时取相同部位肝左叶约1 cm×1 cm 大小,用10%的福尔马林固定,石蜡包埋切片,病理切片行常规HE及Masson染色,光镜下观察肝组织病理变化。将部分肝组织用4%的多聚甲醛保存,用于制作免疫组化切片,其余肝脏置于-80 ℃冰箱备用。
1.2.3 血清观察指标 肝功能指标 ALT、AST、T-BIL严格根据试剂盒说明书指示方法检测。酶联免疫吸附法(ELISA)测定血清中HMGB1、IL-1β、TNF-α 的水平。
1.2.4 大鼠肝组织中HMGB1蛋白及mRNA表达分析 采用免疫组化SP法测定肝组织中HMGB1蛋白的表达,脱蜡、抗原修复、阻断内源性过氧化物酶、封闭、滴加一抗及二抗、染色均严格按照说明书步骤操作。采用自来水浸泡10 min返蓝后,梯度酒精脱水,二甲苯透明,中性树胶封片,镜检。采用Image-Pro Plus软件分析免疫组化图片光密度(IOD)值。 根据Genbank大鼠HMGB1、GAPDH引物序列设计HMGB1及GAPDH的上、下游引物(Tab 1)。严格根据RNAiso Plus 试剂盒说明书提取大鼠肝脏总RNA,紫外分光光度计测定RNA浓度,A260/280均为1.8~2.0,纯度符合要求。通过RNA 20 μL逆转录体系,在37 ℃15 min、85 ℃ 5 s、4 ℃条件下逆转录得到cDNA。实时荧光定量PCR 采用两步法:95℃ 30 s预变性;95 ℃ 5 s变性、60 ℃ 31 s退火, 共40个循环进行cDNA扩增。
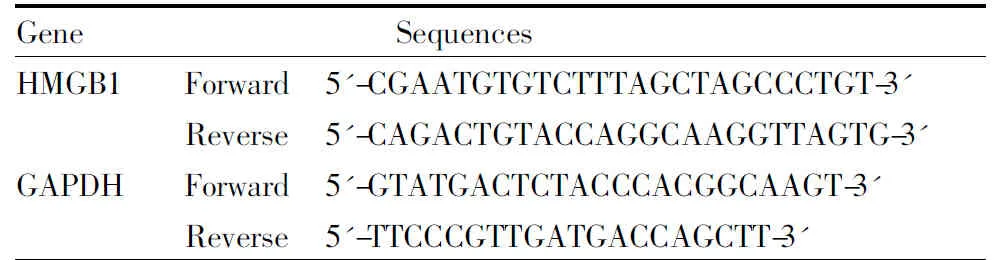
Tab 1 Primer sequences of HMGB1 and GAPDH

2 结果
2.1 肝组织病理学变化 HE染色结果可见,正常对照组肝小叶的结构完整,肝细胞排列整齐,肝索结构清晰,无炎症细胞浸润(Fig 1A);模型对照组可见肝小叶被破坏,肝细胞结节、脂肪变性、气球样变性及坏死,炎症细胞浸润,肝索排列紊乱,伴肝纤维化(Fig 1B);秋水仙碱组及HBOA高、低剂量组对纤维组织增生情况均有明显的改善,肝组织肝小叶结构已恢复至正常,肝细胞变性、坏死及炎性细胞浸润程度也明显减少(Fig 1C、Fig 1D、Fig 1E)。Masson染色结果显示,正常对照组大鼠肝细胞完整,仅于汇管区及中央静脉有少量胶原纤维存在,无纤维组织增生(Fig 2A); 模型对照组大鼠肝组织中大量胶原纤维增生,汇管区呈明显的桥样纤维化,并向肝小叶内延伸,形成较粗大的纤维间隔(Fig 2B);秋水仙碱组及 HBOA 高、低剂量组大鼠肝组织中胶原纤维增生较模型对照组明显减少,仅分布于汇管区及血管周围,且纤维间隔薄,不完全分割肝小叶,其中HBOA 高剂量组肝组织结构趋向正常(Fig 2C、2D、 2E)。 各组大鼠肝纤维化程度按Ishak 评分系统分期及计分。分期结果显示,模型对照组主要分布在F4-F5期,秋水仙碱组主要分布在F2-F3期,HBOA高剂量组分布在F0-F1期,HBOA低剂量组主要分布在F2-F4期(Tab 2)。
2.2 HBOA降低CCl4性肝纤维化大鼠血清中的AST、ALT 及T-BIL 与正常对照组比较,模型对照组血清中的AST、ALT 及T-BIL含量明显升高(P<0.01);与模型对照组比较,HBOA 高剂量组可降低血清中的AST、ALT 及T-BIL 水平(P<0.01)(Fig 3)。
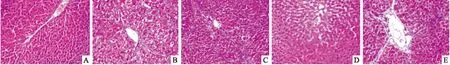
Fig 1 Rat liver histopathological changes observed by HE staining in different groups(×100)
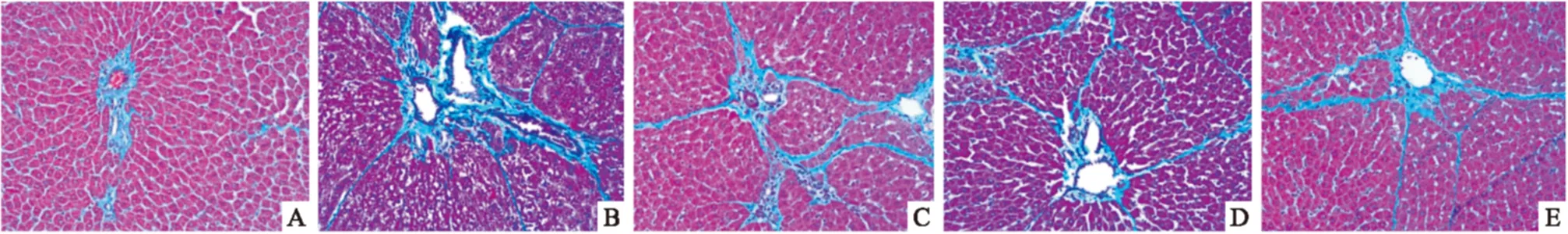
Fig 2 Changes of rat liver tissue collagen observed by Masson staining in different groups(×100)
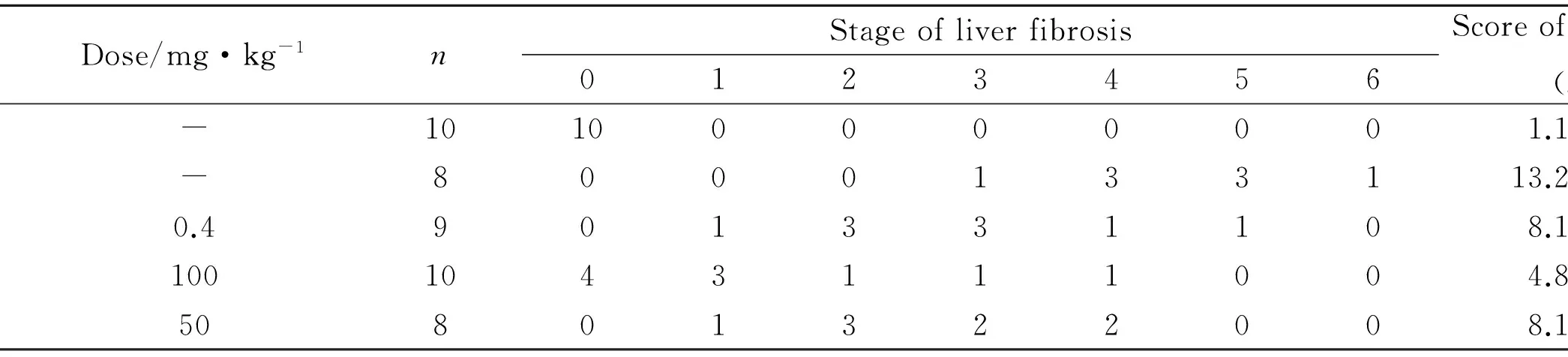
GroupDose/mg·kg-1nStageofliverfibrosis0123456Scoreofliverfibrosis(x±s)Normal-10100000001.10±1.52Model-8000133113.25±3.24**Colchicine0.4901331108.11±3.44##HBOA1001043111004.80±4.05##50801322008.13±3.52##
**P<0.01vsnormal;##P<0.01vsmodel
2.3 HBOA 降低CCl4性肝纤维化大鼠血清中的炎症因子含量 由ELISA结果可见,与正常对照组比较,模型对照组血清中的HMGB1、IL-1β及TNF-α含量明显升高(P<0.01);与模型对照组比较,HBOA高剂量组明显降低血清中的HMGB1、IL-1β及TNF-α水平(P<0.01)(Fig 4)。
2.4 HBOA减少CCl4性肝纤维化大鼠肝组织中HMGB1蛋白及mRNA的表达 免疫组化法结果可见(Fig 5A),与正常对照组比较,模型对照组肝组织中的HMGB1 含量明显升高(P<0.01);与模型对照组比较,HBOA高、低剂量组均明显降低肝组织中的HMGB1水平(P<0.01)。同时,实时荧光定量PCR结果可见(Fig 5B),与正常对照组比较,模型对照组肝组织中HMGB1 mRNA表达水平明显升高(P<0.01);与模型对照组比较,HBOA高、低剂量组均明显降低肝组织中的HMGB1 mRNA表达水平(P<0.01)。
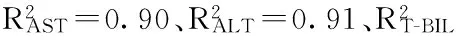
3 讨论
肝星状细胞(hepatic stellate cells,HSCs)是肝纤维化的关键细胞,在肝纤维化的发生、发展过程中发挥核心作用,其活化调控被视为抗肝纤维化的治疗靶标[6]。当肝脏受到各种急、慢性炎症刺激后,可激活HSCs,使其变为肌成纤维细胞,最终合成及分泌大量的细胞外基质(ECM)沉积于肝脏内,启动肝纤维化的病理过程[7]。可见,慢性炎症反应是肝纤维化发生、发展的重要因素。
炎症因子HMGB1是一种高度保守的染色体相关蛋白,具有出现晚、作用持久的特点。在正常情况下,HMGB1在细胞核内不参与炎症反应。然而,当机体受到刺激而产生反应时,HMGB1不仅可由激活的巨噬细胞、成熟的树突细胞(mDC)及自然杀伤(NK)细胞主动分泌,还可由坏死细胞被动释放至细胞外,在胞外作为损伤相关分子模式(DAMPs)成员之一,具有强大的致炎细胞因子活性,在细胞外参与多种病理过程[8]。在肝纤维化的发生、发展中,HMGB1作为晚期炎症介质,成为慢性炎症持续存在并持久激活HSCs的基础。HMGB1可通过晚期糖基化受体(RAGE)及 Toll 样受体(TLRs)启动和增强多个通路[9-10],如 TLR4-MyD88-NF-κB 通路,激活内皮细胞,促使其产生炎症细胞因子如IL-1β、TNF-α 等,而产生的IL-1β、TNF-α 又可与HMGB1相互刺激、促进,致使HMGB1 大量释放,最终形成一个完整的回路,引起瀑布样的级联反应,造成炎症反应的失控迁延,增强肝脏损伤和炎症[11]。
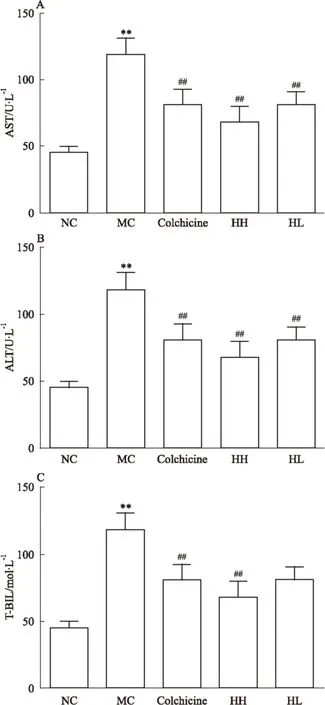
Fig 3 Effects of HBOA on serum AST,ALT and T-BIL in CCl4-induced liver fibrosis rats
A: AST; B: ALT; C: T-BIL.**P<0.01vsnormal control;##P<0.01vsmodel control
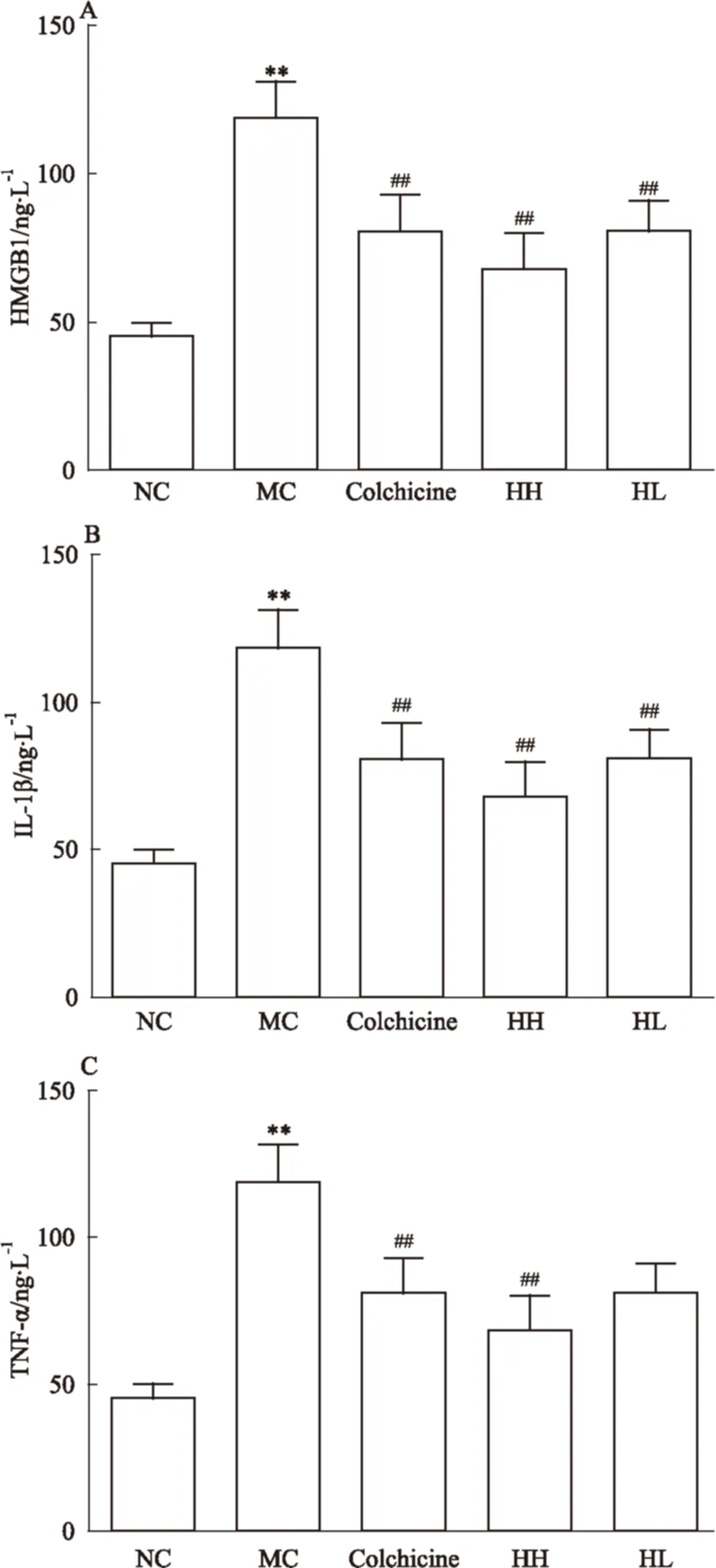
Fig 4 Effects of HBOA on serum HMGB1,IL-1β and TNF-α in CCl4-induced liver fibrosis rats
A:HMGB1;B:IL-1β;C:TNF-α.**P<0.01vsnormal control;##P<0.01vsmodel control
Bai等[12]发现,抑制HMGB1 能降低IL-1β、TNF-α 的表达,减轻肝脏炎性反应,减轻肝纤维化程度。然而,仅给予早期炎症因子例如IL-1β、TNF-α 的拮抗剂,并不能阻止肝纤维化病情进展[13]。所以,考虑是否是HMGB1的大量释放,导致HSCs持续激活,致使ECM 堆积,导致肝纤维化的发生。
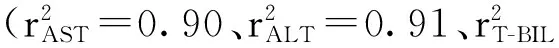
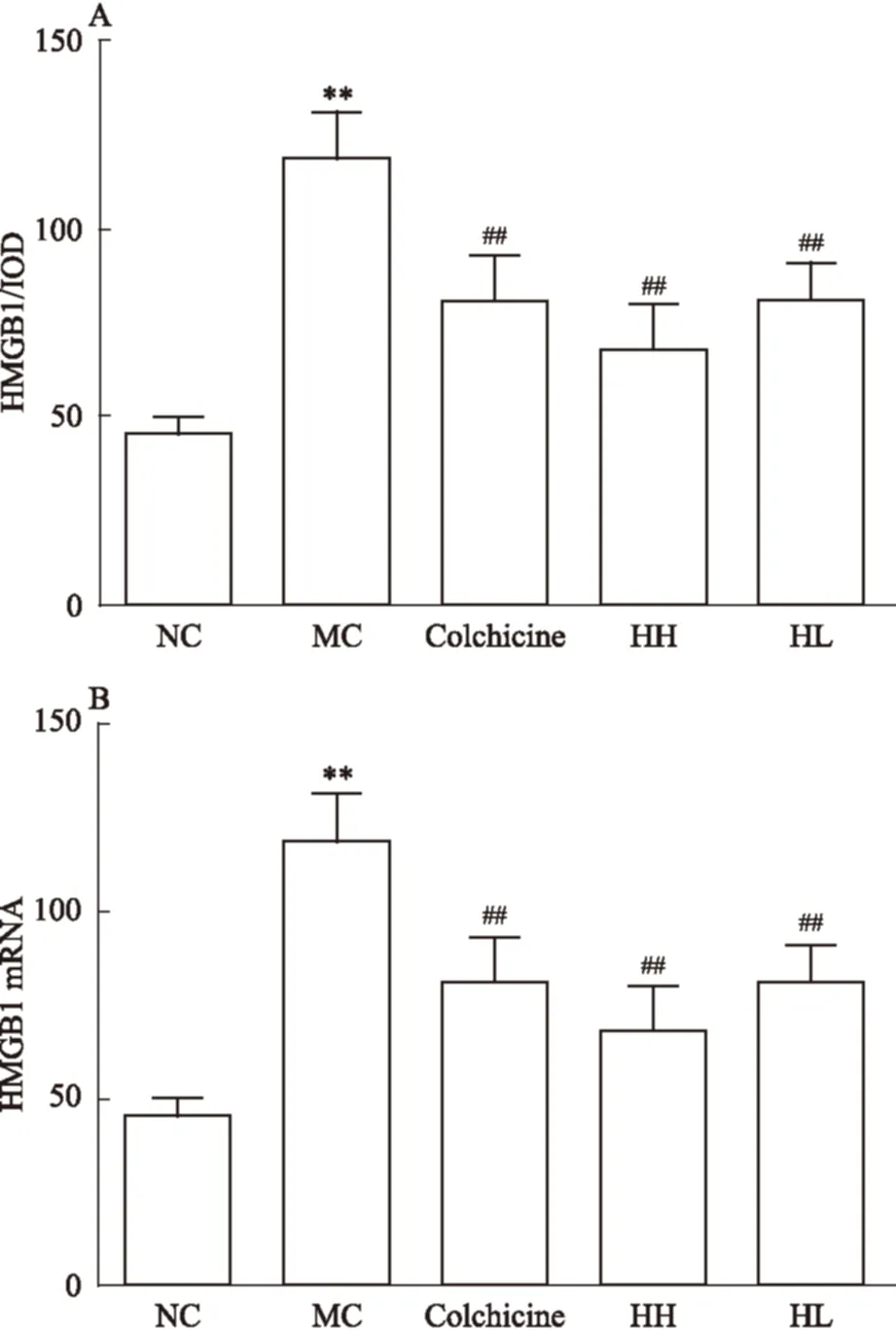
Fig 5 Effect of HBOA on tissue expression of HMGB1 protein and mRNA in CCl4-induced liver fibrosis rats
A:HMGB1 protein; B: HMGB1 mRNA.**P<0.01vsnormal control;##P<0.01vsmodel control
综上所述,HBOA能够减轻CCl4所致大鼠肝纤维化程度,其作用机制可能与抑制晚期炎症因子HMGB1表达有关。最终通过上游通路减少其他炎症因子IL-1β 、TNF-α 等的释放,又通过下游通路减少细胞损伤引起的肝细胞凋亡、坏死及巨噬细胞系统激活而产生HMGB1,降低炎症反应,从而减少HSC活化,抑制ECM产生,最终减轻肝纤维化程度。然而,其具体的分子生物学机制还有待进一步研究。
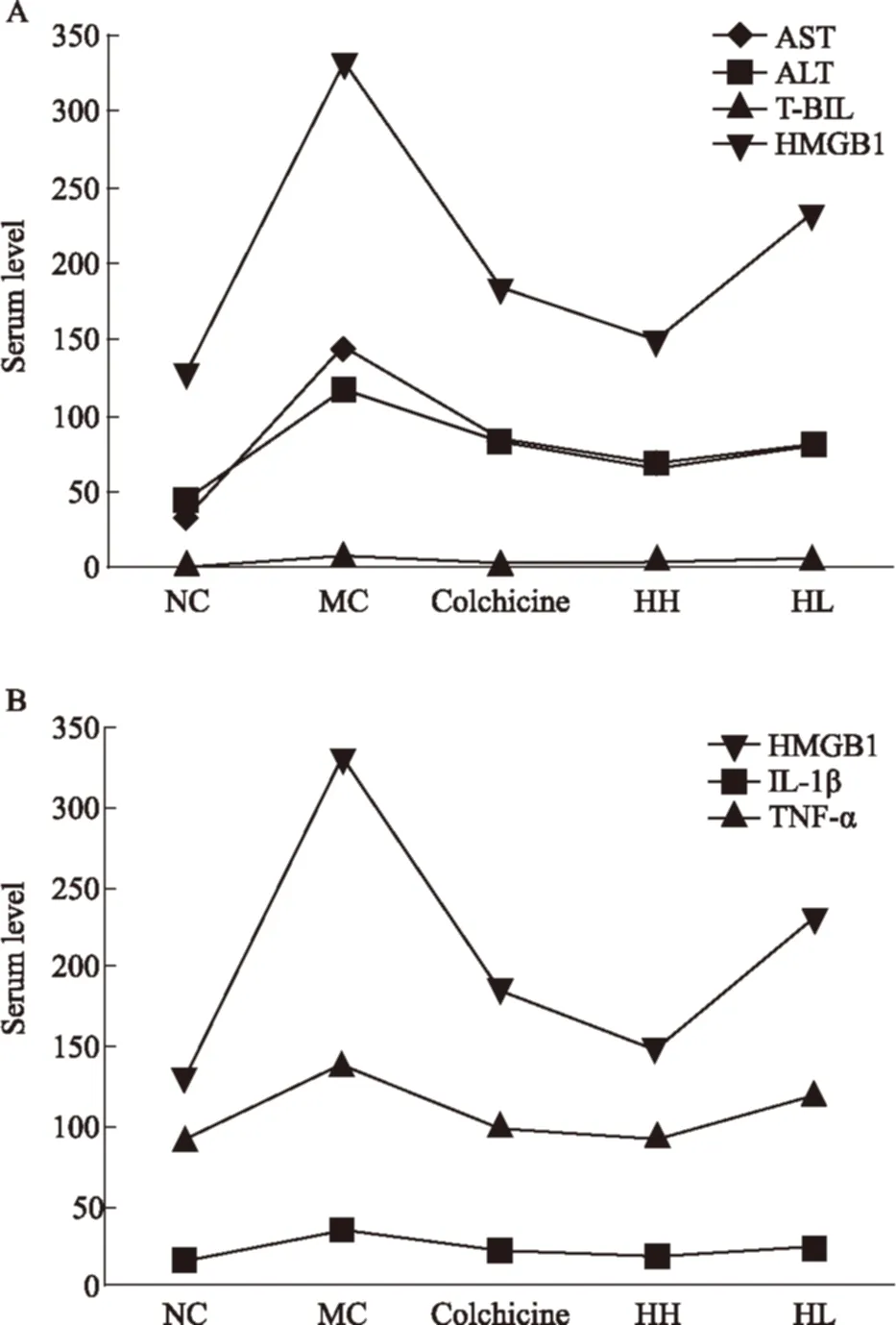
Fig 6 Relation between serum HMGB1 level and liver function,inflammatory cytokines
A: The relation of HMGB1 to liver function index; B: The relation of HMGB1 to IL-1β and TNF-α
(致谢:本实验在广西医科大学药理学实验室、实验动物中心及医学科学实验中心完成。感谢实验室老师们在实验期间的帮助。)
[1] 《全国中草药汇编》编写组.全国中草药汇编[M].北京:人民卫生出版社,1978:231.
[1] Chinese herbal medicine collection editors.Chineseherbalmedicinecollection[M].Beijing:People′s Medical Publishing House,1978:231.
[2] Wai K K,Liang Y E,Zhou L J,et al.The protective effects ofAcanthusilicifoliusalkaloid A and its derivatives on pro- and anti-inflammatory cytokines in rats with hepatic fibrosis[J].BiotechnolApplBiochem,2015,62(4):537-46.
[3] 张自力,赵士峰,许文萱,等. 细胞因子信号转导抑制分子-3 在肝纤维化中的作用及研究进展[J].中国药理学通报, 2015,31(12):1646-51.
[3] Zhang Z L,Zhao S F,Xu W X,et al. Research progress of role of SOCS-3 in treating liver fibrosis[J].ChinPharmacolBull, 2015,31(12):1646-51.
[4] 李留成,高 建,李 俊.HMGB1在呼吸系统疾病中的作用及其机制[J].中国药理学通报,2015,31(1):15-8.
[4] Li L C,Gao J,Li J. Role and mechanisms of HMGB1 in respiratory diseases[J].ChinPharmacolBull, 2015, 31(1):15-8.
[5] Yang H,Tracey K J.Targeting HMGB1 in inflammation[J].BiochimBiophysActa,2010,1799(1-2):149-56.
[6] Lee J H,Jang E J,Seo H L,et al.Sauchinone attenuates liver fibrosis and hepatic stellate cell activation through TGF-β/Smad signaling pathway[J].ChemBiolInteract,2014, 224:58-67.
[7] 陈 琴,陈连云,金欢欢,等.肝脏树突状细胞在肝纤维化中的作用[J].中国药理学通报,2015,31(8):1053-6.
[7] Chen Q, Chen L Y, Jin H H, et al. Role of dendritic cells in hepatic fibrosis[J].ChinPharmacolBull, 2015, 31(8):1053-6.
[8] 汶海琪,罗 勇,陈瑞芳,等.HMGB1 基因沉默对氧糖剥夺/复氧所致星形胶质细胞损伤的保护作用[J].解放军医学杂志, 2014, 39(4):302-6.
[8] Wen H Q, Luo Y, Chen R F, et al. Protective effect of HMGBl gene silence on astrocyte injury caused by oxygen-glucose deprivation/reoxygenation[J].MedJChinPLA, 2014, 39(4):302-6.
[9] 邢 媛,赵中夫,刘明社,等.高迁移率族蛋白B1与晚期糖基化终末产物受体结合对激活肝星状细胞的作用[J].中国药物与临床,2011,11(11):1251-3.
[9] Xing Y,Zhao Z F,Liu M S,et al. Activating hepatic stellate cell by high mobility protein B1 contacting to RAGE[J].ChinRemedClin, 2011,11(11): 1251-3.
[10]Kim T H,Yoon S J,Lee S M.Genipin attenuates sepsis by inhibiting Toll-like receptor signaling[J].MolMed,2012,18:455-65.
[11]Carbone M,Yang H. Molecular pathways:targeting mechanisms of asbestos and erionite carcinogenesis in mesothelioma[J].ClinCancerRes,2012,18(3):598-604.
[12]Bai L,Kong M,Zheng Q,et al.Inhibition of the translocation and extracellular release of high-mobility group box 1 alleviates liver damage in fibrotic mice in response to D-galactosamine/lipopolysaccharide challenge[J].MolMedRep,2016, 13(5):3835-41.
[13]杨新英.高迁移率族蛋白B1 抑制剂防治肝纤维化的实验研究[D].石家庄:河北医科大学, 2011.
[13]Yang X Y. The relevance of high mobility group protein B 1 and remedial potential of inhibition with hepatic fibrosis[D].Shijiazhuang: Hebei Medical University,2011.
[14]梅 燕,侯软玲,林 军.老鼠簕对四氯化碳致肝纤维化大鼠Toll样受体4表达的影响[J].新乡医学院学报,2012,29(2):93-5.
[14]Mei Y,Hou R L,Lin J.Effect ofAcanthusilicifoliusLinnseus on Toll-like receptor 4 expressions of hepatic fibrosis induced by carbon tetrachloride in rats[J].JXinxiangMedColl, 2012,29(2):93-5.
Anti-hepatic fibrotic mechanism ofAcanthusilicifoliusalkaloid A involved in high mobility group box 1
MO Si-yan, WEI Ming-zhong, QIU Jin-hui, ZHU Xun-shuai, LIU Lin, LIN Jun
(DeptofPharmacology,SchoolofPharmacy,GuangxiMedicalUniversity,Nanning530021,China)
Aim To investigate anti-hepatic fibrotic mechanism ofAcanthusilicifoliusalkaloid A(HBOA)involved in high mobility group box 1(HMGB1).Methods A hepatic fibrosis model of rat was established by the olive oil of CCl4for 12 weeks. Then, at the 8th week,the successful model rats were randomly divided into model control group,colchicine group, HBOA high-dose group and HBOA low-dose group. From the 9th week,the rats in each group were treated with the drugs daily for 4 weeks respectively. The changes of liver histopathology and collagen were observed by HE staining and Masson staining, and the serum indicators including aspartate aminotransferase(AST),alanine aminotransferase(ALT) , total bilirubin(T-BIL), HMGB1,interleukin-1β(IL-1β) and tumor necrosis factor-α(TNF-α) were determined. Moreover, the protein of HMGB1 in liver was examined by immunohistochemistry, and the expression of HMGB1 mRNA was measured by real-time fluorescence quantitative PCR.Results Compared with the model control group,HBOA high-dose and HBOA low-dose groups significantly attenuated the fibrotic degree induced by CCl4, markedly decreased the levels of ALT,AST,T-BIL, HMGB1, IL-1β,TNF-α. Moreover, the expression of HMGB1 protein and mRNA in liver was decreased. And furthermore, serum HMGB1 level had significant positive correlation with IL-1β,TNF-α,ALT,AST and T-BIL.Conclusion HBOA has beneficial effects against liver fibrosis in rat which is induced by CCl4, the mechanisms may be related to the inhibition of inflammatory response to HMGB1.
high mobility group box 1;Acanthusilicifoliusalkaloid A; hepatic fibrosis; CCl4; inflammatory factor;rat
2016-07-14,
2016-08-13
广西高校科学技术研究项目(No 201106LX095);广西省自然科学基金资助项目(No 2013YB054)
莫思燕(1988-),女,硕士生,研究方向:中药药理学,E-mail:d-v-wade2007@163.com;
林 军(1962-),男,博士,教授,研究方向:中药药理学,通讯作者,Tel:0771-5358272,E-mail: junlin989@sina.com
时间:2016-10-20 10:29
http://www.cnki.net/kcms/detail/34.1086.R.20161020.1029.030.html
10.3969/j.issn.1001-1978.2016.11.015
A
1001-1978(2016)11-1553-06
R-332;R322.47;R392.12;R575.2;R977.6

