衰老相关分泌表型的研究进展
郭慧宁,凌 霜,刘 俊,李玉凤,王淑荣,党延启,陈小淼,许锦文
(上海中医药大学穆拉德中药现代化研究中心,上海 201203)
衰老相关分泌表型的研究进展
郭慧宁,凌 霜,刘 俊,李玉凤,王淑荣,党延启,陈小淼,许锦文
(上海中医药大学穆拉德中药现代化研究中心,上海 201203)
细胞衰老;衰老相关分泌表型;SASP;炎症;衰老机制;衰老相关疾病
细胞衰老是一个细胞进入永久性细胞周期阻滞的过程。细胞衰老常伴随许多病理学特征,炎症便是其中之一。Franceschi等[1]在2000年首次提出炎性衰老(inflamm-aging)的概念,它是衰老研究大家族的一个新成员。正常的炎症反应是用来保护人类不受致命伤害的一种非特异性免疫反应,而非正常的、过度的炎症反应则是引起众多老年疾病的主要因素。炎症反应参与了衰老相关疾病的病理过程,包括糖尿病、心血管疾病、老年痴呆、阿尔茨海默症等。炎症对癌症的发生、发展、侵袭和转移也起着决定性作用。这提示我们,有效地控制衰老相关炎症可能是干预衰老和衰老相关疾病的途径之一。
1 衰老与衰老相关分泌表型(senescence-associated secretory phenotype,SASP)
细胞衰老发生于受损细胞,并防止其在生物体增殖。细胞损伤本身并不直接导致明显的衰老迹象,而是当损伤累积和达到一定的限度,细胞停止增殖,导致肉眼可见的组织衰弱和生理上的衰老表型[2]。
SASP的概念是由Coppe等[3]在2008年首次提出的,他们发现衰老细胞能通过分泌炎症及癌基因相关因子促进邻近癌前细胞发生癌变,并称这些因子为SASP。衰老细胞在各个器官积累的同时伴随一系列复杂的SASP,它是不同种类细胞因子的表达和分泌明显增加的表型,是衰老细胞产生的最重要的环境效应。SASP包括促炎细胞因子(如IL-1α、IL-1β、IL-6和IL-8),生长因子(如HGF、TGF-β和GM-CSF),趋化因子(如CXCL-1/3和CXCL-10)和基质重塑酶(如金属蛋白酶)等[4],SASP的构成成分诱导出的不同的生物学活性表明它与其他细胞作用并构成一个机制调节组织局部微环境,可能导致或加剧衰老相关疾病。
SASP虽然是衰老细胞的共同特征,但不同刺激诱导的衰老或不同种类细胞其SASP成分的表达各有差异。如复制衰老、阿霉素诱导衰老、H2O2诱导衰老和5-氮-2′-脱氧胞苷诱导衰老,这4种衰老共同的通路与炎症和先天免疫系统有关,转录组测序分析表明,SASP是所有4种衰老的一种共同特征[5]。而复制性衰老(RS)、压力诱导早衰(SIPS)和蛋白酶体抑制诱导早衰(PIIPS)中,RS和SIPS较PIIPS 衰老相关分泌表型特征更为明显。SIPS和RS中SASP大部分细胞因子分泌增加,而在PIIPS中只有小部分分泌增加[6]。这说明衰老相关的分泌表型取决于不同的衰老诱导刺激。尽管SASP的组成成分取决于不同的细胞和环境,但在不同种类的细胞中仍有一些基础的重叠部分,例如,IL-6和IL-8是最固定的因子,能刺激血管新生,破坏细胞信号传导,阻碍巨噬细胞功能,诱导固有免疫应答,促进上皮和内皮细胞迁移和侵袭。肝细胞SASP除了特征因子IL-8和IL-6外,则出现了新的成分如SAA4、IL-32和纤维蛋白原[7]。
衰老和SASP与免疫关系密切。我们认为衰老细胞积累是免疫监视缺陷的结果,因为当使用免疫刺激剂时衰老细胞的去除率将明显升高。最近的一些研究表明自噬和SASP有密切的关联,自噬可以减弱由SASP高蛋白合成率所引起的蛋白毒性压力[8]。SASP与衰老所带来的毒副作用有关,并且通过自分泌和旁分泌增强表型,SASP也免疫性清除一些衰老细胞。
2 SASP的生物学功能
SASP有一个为人熟知的生物学功能便是促肿瘤效应,人类衰老成纤维细胞可以促进癌变前或恶性上皮细胞在体外增殖和在体内形成肿瘤。在某种程度上,这种功能是受被增殖衰竭、致癌基因Ras、p14ARF或过氧化氢等刺激的衰老细胞所分泌的可溶或不可溶的细胞因子所促进。此外,SASP对由基因毒性所导致的干细胞样癌症细胞的出现、保持和转移有促进作用。这些都有助于解释SASP的促肿瘤效应。在癌变前细胞中,p53的损失或增加致癌的Ras都会加剧SASP的致瘤效果,包括上皮间质转换和侵袭,这些可能与IL-6和IL-8的旁分泌调节有关。
SASP具有双面性,在促肿瘤的同时,一些SASP成分反而对衰老反应的肿瘤抑制起作用。例如,IL-6、IL-8、IGFBP7、GROα 和WNT16B在致癌基因激活后,加强细胞的衰老状态,防止恶变[9]。
SASP除了促肿瘤,改变组织微环境,进一步促进衰老[10]这些消极的方面外,对人体也有有益的一面。例如激活免疫系统,促进伤口愈合和组织修复,加强衰老逮捕, 引发衰老细胞的免疫监控[11];与表观遗传调控协同作用,维持一个稳定的衰老表型[12];通过分泌血小板衍生生长因子AA(PDGF-AA)诱导肌纤维细胞分化,从而加速伤口闭合[13]。衰老也是一种发育机制,有助于胚胎的发育和成形,胚胎发育伴随着细胞衰老和SASP, 衰老细胞通过SASP分泌各种细胞因子,有助于组织的构建和重塑[14-15],这也帮助我们理解SASP进化的原因。
3 SASP分泌的调节
研究显示[16],一些物质或基因会上调细胞SASP相关因子的分泌。经过LPS处理的骨髓基质血管细胞也出现SASP,TNF-α、IL-1β、IL-6、MCP-1和VEGF的表达均升高。HuR不仅调节复制寿命,也调节小鼠成纤维细胞SASP相关细胞因子的表达,RNAi-介导的HuR抑制导致SASP相关细胞因子的增加[17]。果蝇成虫上皮细胞中,线粒体功能障碍或激活Ras可以导致细胞衰老和SASP[18]。PKCη通过上调细胞周期抑制剂p21Cip1和 p27Kip1的表达和增强IL-6的转录和分泌来促进衰老,然而 IL-8的表达则受PKCη的特殊抑制[19]。 基于SASP大部分发挥的都是促进慢性炎症、促衰老及加速肿瘤发展等作用,研究如何抑制SASP的发展和分泌,有助于延缓衰老和衰老相关疾病。
TNF-α是SASP的主要组成成分,生物治疗药物阿达木单抗(adalimumab)是可以直接抑制TNF-α的单克隆抗体,它可以抑制SASP的分泌,使IL-6的释放量明显减少,eNOS和miR-126-3p的表达水平明显增高。阿达木单抗还可以诱导衰老细胞的表观遗传修饰,从而减弱SASP的促癌作用[20]。
研究表明,某些特定的黄酮类化合物可以抑制SASP的产生,部分和NF-κB p65以及 IκBζ信号通路有关,可以有效地保护或减轻退行性疾病(如心血管疾病和晚期癌症)中的慢性低度炎症[21]。天然黄酮类化合物芹黄素和山柰酚可以强烈抑制SASP的表达,这些类黄酮通过IRAK1/IκBα的信号通路上调IκBζ表达,从而抑制NF-κB p65活性。抑制IκBζ表达则会减少SASP的表达。体内实验中,口服芹黄素可以使老年大鼠肾脏中SASP明显降低,并升高IκBζ mRNA的水平。
JAK抑制剂可以减少脂肪前体细胞和脐静脉内皮细胞(HUVEC)中SASP的分泌,由此推断JAK 通路可能是对抗衰老相关功能障碍的一个潜在靶点[22]。TRIM28对IL-6、IL-8和其他SASP的成分有正向调节的作用, 当TRIM28耗尽,分泌表型则受到强烈的抑制[23]。
辛伐他汀是HMG-CoA还原酶抑制剂,现在已知可以减缓炎症,防止某些癌症。研究表明,辛伐他汀通过抑制蛋白质异戊烯化,降低衰老人成纤维细胞的SASP,而不影响衰老生长停滞。同时,辛伐他汀可以减轻衰老的条件培养基对乳腺癌细胞增殖和内分泌耐药的影响[24]。
最近研究表明,mTOR抑制剂雷帕霉素是一个强有力的SASP抑制剂。mTOR通过调节IL-1α和MAPKAPK2的翻译来控制SASP,反过来,在衰老过程中,p38下游信号MAPKAPK2磷酸化RNA结合蛋白ZFP36L1,从而防止SASP转录物的降解。当mTOR抑制时,ZFP36L1降低SASP转录和废除IL-1α反馈环路。所以,p38MAP激酶和MK2的小分子抑制剂可以抑制人成纤维细胞的SASP[25-26]。雷帕霉素降低IL-6和其他细胞因子mRNA水平,并选择性地抑制膜结合细胞因子IL-1α的翻译,分泌减少的IL-1α对 NF-κB转录活性刺激也降低,而NF-κB对SASP有着更多的调控作用,这揭示了mTOR抑制剂雷帕霉素的抗衰老作用。同时,雷帕霉素可以抑制衰老成纤维细胞刺激小鼠前列腺肿瘤生长的能力,因此,雷帕霉素可能通过抑制衰老相关炎症,改善年龄相关的疾病,包括癌症晚期[27,31]。
4 SASP的机制研究
一些衰老诱导因素(包括DNA损伤、致癌突变、活性代谢产物、高促分裂原和营养信号增加mTOR活动、蛋白毒性压力)可以单独或协同作用于细胞,通过p16INK4a/Rb、p53/p21通路或其他路径导致细胞衰老。这些可能导致普遍的基因表达变化和染色质重塑(异染色质的形成),这些是SASP、衰老相关生长停滞以及形态学变化的基础[32]。MacroH2A1和ATM在旁分泌衰老和SASP中扮演对立的角色。实验表明,macroH2A在SASP基因表达的调节中是一个关键控制点[33]。因为异常过表达p21或者p16 INK4a所导致的细胞衰老会出现生长停滞和表现出一系列衰老表型特征,但并不发展为SASP。另外,抑制p53或Rb途径也未能阻止促衰老激酶的SASP诱导作用,说明SASP不是通过p53或Rb途径。SASP会经历数天缓慢发展,主要是由于持续的DNA损伤信号,它已经明确由DNA损伤反应(DDR)上游信号的几个蛋白所调控,如ATM、NBS1 和CHK2。SASP也受NF-κB和C / EBP-β的调控,它们都是调节免疫和炎症反应的转录因子。
衰老细胞中DDR激活促进获得SASP,进而引起邻近的细胞DDR和SASP的激活,从而创造一个先在局部扩展,最终发展至全身的促炎的环境。某些miRNAs,如miR-146、miR-155、miR-21,被发现在DDR中具有调控细胞衰老和炎症的核心作用。识别衰老相关miRNAs的功能有望阐明衰老过程和如何延缓衰老相关疾病的发展[34]。有研究称IκBζ(一个非经典的NF-κB抑制蛋白和特定NF-κB目标基因选择性共激活剂)也是SASP表达的一个重要调节者。DNA损伤的几个模型和癌基因诱导衰老揭示了一个IκBζ表达有力的证据。RNAi-介导IκBζ基因敲除将使IL-6和IL-8表达受损,而转入IκBζ基因会导致SASP细胞因子表达增强。因此,无论是在DNA损伤或癌基因诱导的衰老中, IκBζ 在SASP的形成中都扮演了一个重要的角色[35]。体细胞研究结果提示,SIRT1通过催化其下游信号蛋白的去乙酰化发挥抗衰老作用;在不同应激状态下,SIRT1含量及活性下降,可导致细胞衰老改变[36]。而在细胞衰老过程中,SIRT1的表达减少,SASP组成成分的表达反而增加[37]。所以,SIRT1可能通过组蛋白在其启动子区域的脱乙酰作用抑制SASP的表达,从而发挥抗衰老作用。有人建立离散逻辑模型,通过一系列的数据分析指出p38MAPK在调控衰老和SASP中起着核心的作用[38]。
最近,有报道称转录因子GATA4是一个新的衰老调节基因,是SASP所必需的。有害刺激后,GATA4激活转录因子NF-κB, 发起SASP并促进衰老的进程。与既往的研究相一致,GATA4是由DNA损伤应答所激活,而不是由传统的衰老通路p53或p16INK4a激活[39](Fig 1)。
5 SASP与相关疾病
5.1 SASP与肿瘤 细胞衰老是一个有效的抗癌机制,阻止有丝分裂感受态细胞的增殖,从而防止恶变。促衰老疗法最近成为一个治疗癌症的新治疗方法,然而,这一观念与衰老肿瘤细胞的SASP相冲突,因为SASP可以促肿瘤,然而衰老细胞具有抑制肿瘤的效果。在PTEN基因缺失的肿瘤细胞中,激活JAK2/STAT3通路,建立了免疫抑制肿瘤微环境,导致肿瘤生长和抗药性。通过下调蛋白质酪氨酸磷酸酶PTPN11/SHP2,激活PTEN缺失肿瘤中JAK2/STAT3信号通路,该激活通路是稳定的,这为存在一个新的PTEN/SHP2轴提供了证据。重要的是,用多烯紫杉醇联合JAK2抑制剂作用于PTEN缺失肿瘤,将改变SASP并提高多烯紫杉醇诱导衰老的效率。这些说明衰老肿瘤细胞的免疫监视可以在特殊遗传背景下被抑制,但是也可能被药物治疗所诱发。衰老细胞分泌的蛋白质取决于衰老肿瘤细胞的基因背景。尽管SASP对肿瘤生物学具有重要的意义,但是它如何调控肿瘤仍然相对不明确[40]。
SASP在小鼠肥胖相关肝细胞癌的发展过程中发挥重要的促进作用。饮食或遗传肥胖导致肠道菌群改变,从而使脱氢胆酸(DCA)水平升高,它是一种可以导致DNA损伤的肠道细菌代谢物。DCA的肝肠循环引发肝星状细胞(HSCs)SASP表型,进而在肝脏中分泌各种炎症和促癌因子,从而促进暴露于化学致癌物的小鼠肝癌的发展。值得注意的是,阻止DCA的产生或减少肠道肥胖老鼠的细菌可有效防止肝癌发展。当小鼠缺乏一个SASP诱导物或减少衰老肝星状细胞时也观察到类似的结果,这表明DCA-SASP轴在肝星状细胞在肥胖相关肝细胞癌发展中有关键作用。此外,非酒精性脂肪肝的肝癌患者也有SASP的迹象,表示人类肥胖相关肝细胞癌也可能是相同的通路。这些研究结果为肥胖相关癌症提供了有价值的新见解,并为如何控制开辟了一个新的可能[41]。
5.2 SASP与心血管疾病 慢性心血管疾病和肾脏疾病会对内皮祖细胞造成伤害而出现早衰和特殊功能衰退。SASP的释放会影响邻近细胞,使再生能力进一步恶化,从而加重病情。正是因为这些原因, 超过150例的内皮祖细胞移植正在被不同的心血管疾病临床试验所使用[42]。
5.3 SASP与慢性阻塞性肺病(COPD) 气道的慢性炎症和肺泡腔以及肺组织破坏是COPD的标志。最近研究显示,细胞衰老可能在COPD发病机制中发挥作用。当衰老诱导DNA损伤时,就会出现SASP。SASP可能是慢性炎症的重要驱动力,它会加重COPD[43]。
5.4 SASP与骨关节炎 衰老是骨关节炎(OA)发展的一个重要因素, 机制是多方面的,“炎性衰老”可能是机制之一。年龄相关炎症可以是系统性的,也可以是局部性的。脂肪组织的衰老变化可以促进系统性炎症,可促进IL-6和TNF-α等细胞因子的增加,而IL-6是SASP重要组成成分。众多研究显示随着年龄增加,血液中IL-6水平也随之增加,高水平的IL-6将增加膝骨关节炎的患病风险[44]。连接骨组织的细胞,包括软骨细胞和半月板细胞,以及膝关节邻近的髌下脂肪,都可能随着年龄增加而导致骨关节炎。增加的促炎介质(包括细胞因子、趋化因子以及基质降解酶)在联合组织损坏过程中也起了重要的作用,这都是细胞衰老和SASP的结果。需要进行进一步的研究以便更好地了解炎性衰老在骨关节炎中所扮演的角色,这样就可以制定针对炎症新的干预措施,不仅可以减少骨联合组织的破坏,而且可以减轻老年骨关节炎患者的疼痛和残疾状况。
5.5 SASP与糖尿病 衰老细胞可能通过直接影响胰岛β细胞、SASP调节组织损伤、参与脂肪组织的功能障碍在2型糖尿病的发病机制中发挥作用。反过来,糖尿病中的代谢和信号的变化,例如高流通葡萄糖、脂质代谢的改变和生长激素轴的变动,可以促进衰老细胞的形成[45]。衰老细胞和SASP对2型糖尿病及并发症的预防和治疗有着重要的意义。
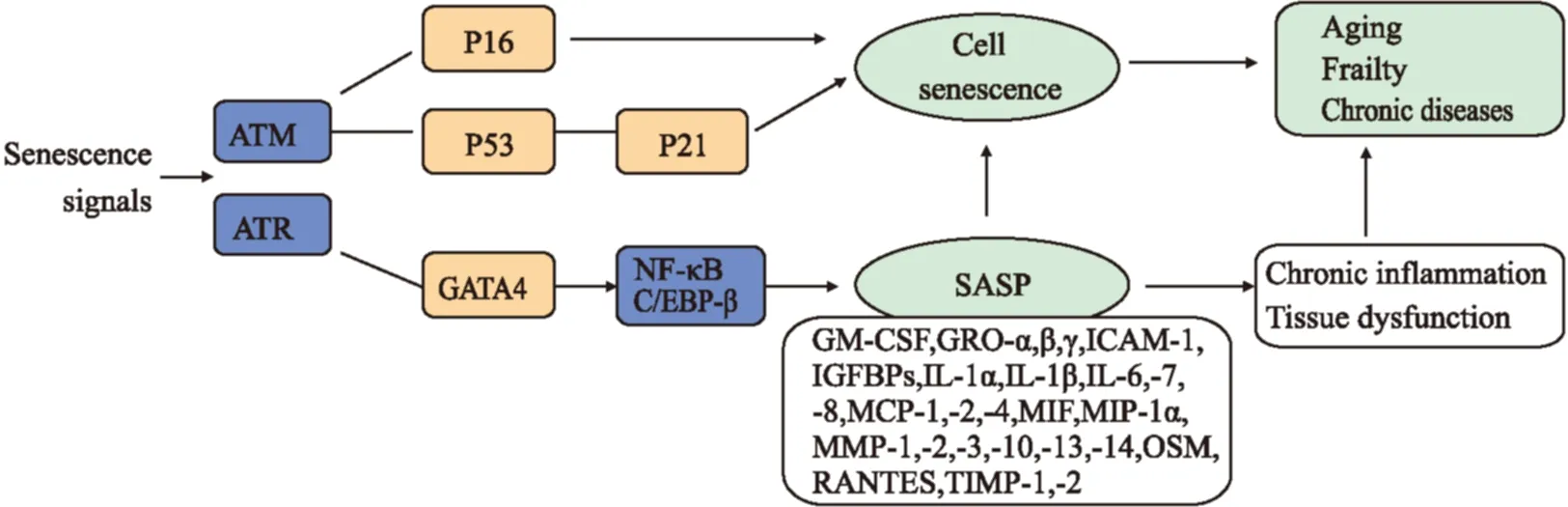
Fig 1 Relationship between SASP and aging and mechanism of SASP
6 展望
衰老是许多慢性疾病或残疾最主要的危险因素,包括中风、心脏病、癌症、痴呆、骨质疏松、代谢综合征、肾功能衰竭、失明等。新的发现表明,衰老是一种可改变的危险因素,通过调节基本的衰老机制来推迟衰老相关疾病是可行的。细胞衰老通过SASP导致慢性炎症。回顾诱导衰老和SASP的机制,它们与慢性疾病和生理衰弱相关联,临床干预可以以细胞衰老和SASP作为治疗目标,根据不同的疾病,找准对应靶点,制定有效的治疗方案。通过研究找出控制炎性衰老相关基因,从而作为靶点进行药物干预,切断炎症触发因子来延缓多种年龄相关慢性疾病的发病,则能改善衰老机体的健康,并降低随着老龄化人口增长所带来的医疗保健费用,具有重要的社会学意义。
[1] Franceschi C, BonafèM, Valensin S, et al. Inflamm-aging. An evolutionary perspective on immunosenescence[J].AnnNYAcadSci, 2000,908: 244-54.
[2] Byun H O, Lee Y K, Kim J M, et al.From cell senescence to age-related diseases: differential mechanisms of action of senescence-associated secretory phenotypes[J].BMBRep,2015,48(10):549-58.
[3] Coppe J P,Patil C K,Rodier F,et al.Senescence-associated secretory phenotypes reveal cell-nonautonomous functions of oncogenic RAS and the p53 tumor suppressor[J].PLoSBiol,2008,6(12):2853-68.
[4] Ovadya Y, Krizhanovsk V. Senescent cells:SASP ected drivers of age-related pathologies[J].Biogerontology,2014,15(6):627-42.
[5] Purcell M,Kruger A,Tainsky M A. Gene expression profiling of replicative andinduced senescence[J].CellCycle,2014,13(24):3927-37.
[6] Maciel-Barón L A, Morales-Rosales S L, Aquino-Cruz A A, et al.Senescence associated secretory phenotype profilefrom primary lung mice fibroblasts depends on the senescenceinduction stimuli[J].Age(Dordr),2016,38(1):26.
[7] Irvine K M, Skoien R, Bokil N J,et al. Senescent human hepatocytes express a unique secretory phenotype and promote macrophage migration[J].WorldJGastroenterol,2014,20(47):17851-62.
[8] Deschênes-Simard X, Lessard F, Gaumont-Leclerc M F, et al.Cellular senescence and protein degradation: breaking down cancer[J].CellCycle,2014;13(12):1840-58.
[9] Loaiza N,Demaria M.Cellular senescence and tumor promotion: is aging the key[J]?BiochimBiophysActa,2016,1865(2):155-67.
[10]Childs B G, Baker D J, Kirkland J L, et al.Senescence and apoptosis:dueling orcomplementary cell fates[J]?EMBORep,2014,15(11):1139-53.
[11]Chien Y, Scuoppo C, Wang X, et al. Control of the senescence-associated secretory phenotype by NF-κB promotes senescence and enhances chemosensitivity[J].GenesDev,2011,25(20):2125-36.
[12]Jin H J, Lee H J, Heo J,et al.Senescence-associated MCP-1 secretion is dependent on a decline in BMI1 in human mesenchymal stromal cells[J].AntioxidRedoxSignal,2016,24(9):471-85.
[13]Demaria M, Ohtani N, Youssef S A, et al.An essential role for senescent cells in optimal wound healing through secretion of PDGF-AA[J].DevCell,2014,31(6):722-33.
[14]Storerl M, Keyes W M. Developing senescence to remodel the embryo[J].CommunIntegrBiol,2014,7(5).doi:10.4161/cib.29098.
[15]Storer M, Mas A,Robert-Moreno A, et al.Senescence is a developmental mechanism that contributes to embryonic growth and patterning[J].Cell,2013,155(5):1119-30.
[16]Zhao M, Chen X.Effect of lipopolysaccharides on adipogenic potential and premature senescence of adipocyte progenitors[J].AmJPhysiolEndocrinolMetab,2015,309(4):E334-44.
[17]Hashimoto M,Tsugawa T,Kawagishi H,et al.Loss of HuR leads to senescence-like cytokine induction in rodent fibroblasts by activating NF-κB[J].BiochimBiophysActa,2014,1840(10): 3079-87.
[18] Nakamura M, Ohsawa S, Igaki T. Mitochondrial defects trigger proliferation of neighbouring cells via a senescence-associatedsecretory phenotype in Drosophila[J].NatCommun,2014,5:5264.
[19]Zurgil U, Ben-Ari A, Atias K, et al.PKCη promotes senescence induced by oxidative stress and chemotherapy[J].CellDeathDis,2014,5:e1531.
[20]Prattichizzol F, Giuliani A, Recchioni R, et al.Anti-TNF-α treatment modulates SASP and SASP-related microRNAs in endothelial cells and in circulating angiogenic cells[J].Oncotarget,2016,7(11):11945-58.
[21]Lim H, Park H, Kim H P. Effects of flavonoids on senescence-associated secretory phenotype formation from bleomycin-induced senescence in BJ fibroblasts[J].BiochemPharmacol,2015,96(4):337-48.
[22]Xu M, Tchkonia T, Ding H,et al.JAK inhibition alleviates the cellular senescence associated secretory phenotype and frailty in old age[J].ProcNatlAcadSciUSA,2015,112(46): E6301-10.
[23]Santos J, Gil J. TRIM28/KAP1 regulates senescence[J].ImmunolLett,2014,162(1 Pt B):281-9.
[24]Liu S, Uppal H, Demaria M, et al. Simvastatin suppresses breast cancer cell proliferation induced by senescent cells[J].SciRep,2015,5:17895.
[25]Alimbetov D,Davis T,Brook A J,et al. Suppression of the senescence-associated secretory phenotype(SASP) in human fibroblasts using small molecule inhibitors of p38 MAP kinase and MK2[J].Biogerontology,2016,17(2):305-15.
[26]Wu Z S, Yu Y, Liu C, et al.Role of p38 mitogen-activated protein kinase in vascular endothelial aging: interaction with Arginase-Ⅱ and S6K1 signaling pathway[J].Aging(AlbanyNY),2015,7(1):70-81.
[27]Serrano M.The inflammTORy powers of senescence[J].TrendsCellBiol,2015,25(11):634-6.
[28]Tomimatsu K, Narita M. Translating the effects of mTOR on secretory senescence[J].NatCellBiol,2015,17(10):1230-2.
[29]Herranz N, Gallage S, Mellone M, et al.mTOR regulates MAPKAPK2 translation to control the senescence-associated secretory phenotype[J].NatCellBiol,2015,17(9):1205-17.
[30]Herranz N, Gallage S, Gil J. TORn about SASP regulation[J].CellCycle,2015,14(24):3771-2.
[31]Laberge R M, Sun Y, Orjalo A V, et al. MacroH2A1 and ATM play opposing roles in paracrine senescence and the senescence-associated secretory phenotype[J].NatCellBiol,2015,17(8):1049-61.
[32]Tchkonia T, Zhu Y, van Deursen J, et al. Cellular senescence and the senescent secretory phenotype: therapeutic opportunities[J].JClinInvest,2013,123(3):966-72.
[33]Chen H, Ruiz P D, McKimpson W M, et al.MacroH2A1 and ATM play opposing roles in paracrine senescence and the senescence-associated secretory phenotype[J].MolCell,2015,59(5):719-31.
[34]Olivieri F, Albertini M C, Orciani M, et al. DNA damage response(DDR) and senescence: shuttled inflamma-miRNAs on the stage of inflamm-aging[J].Oncotarget,2015,6(34):35509-21.
[35]Alexander E, Hildebrand D G, Kriebs A, et al.IκBζ is a regulator of the senescence-associated secretory phenotype in DNA damage-and oncogene induced senescence[J].JCellSci,2013,126(Pt 16): 3738-45.
[36]翟志斌,孟爱民. SIRT1与成体干细胞衰老[J].中国药理学通报, 2011 ,27(1):140-2.
[36]Zhai Z B,Meng A M. SIRT1 and adult stem cell senescence[J].ChinPharmacolBull,2011,27(1):140-2.
[37]Hayakawa T, Iwail M, Aoki S, et al.SIRT1 suppresses the senescence-associated secretory phenotype through epigenetic gene regulation[J].PLoSOne,2015,10(1):e0116480.
[38]Mombachl J C, Vendrusculo B, Bugs C A. A model for p38MAPK-induced astrocyte senescence[J].PLoSOne,2015,10(5):e0125217.
[39]Kang C, Xu Q, Martin T D, et al.The DNA damage response induces inflammation and senescence by inhibiting autophagy of GATA4[J].Science,2015,349(6255):aaa5612.
[40]Toso A, Revandkar A, Mitri D D, et al. Enhancing chemotherapy efficacy in Pten-deficient prostate tumors by activating the senescence-associated antitumor immunity[J].CellRep,2014,9(1): 75-89.
[41]Yoshimoto S, Loo T M, Atarashi K, et al.Obesity-induced gut microbial metabolite promotes liver cancer through senescence secretome[J].Nature,2013,499(7456):97-101.
[42]Goligorsky M S. Endothelial progenitor cells: from senescence to rejuvenation[J].SeminNephrol,2014,34(4):365-73.
[43]Kumar M, Seeger W,Voswinckel R. Senescence-associated secretory phenotype and its possible role in chronic obstructive pulmonary disease[J].AmJRespirCellMolBiol,2014,51(3): 323-33.
[44]Greene M A, Loeser R F. Aging-related inflammation in osteoarthritis[J].OsteoarthritisCartilage,2015,23(11):1966-71.
[45]Palmer A K, Tchkonia T, LeBrasseur N K, et al.Cellular senescence in type 2 diabetes: a therapeutic opportunity[J].Diabetes,2015,64(7):2289-98.
The research progress of senescence-associated secretory phenotype
GUO Hui-ning,LING Shuang,LIU Jun,LI Yu-feng,WANG Shu-rong,DANG Yan-qi,CHEN Xiao-miao,XU Jin-wen
(MuradResearchInstituteforModernizedChineseMedicine,ShanghaiUniversityofTraditionalChineseMedicine,Shanghai201203,China)
When senescence induction is based on DNA damage, senescent cells display a unique phenotype, which has been termed “senescence-associated secretory phenotype”(SASP). SASP, including proinflammatory cytokines, growth factors, chemokines, matrix remodeling enzymes and other cytokines, may be an important driver of chronic inflammation and therefore may be part of a vicious cycle of inflammation, DNA damage and senescence. Senescence-associated secretory products released by such cells can affect the neighboring cells and further exacerbate their regenerative capacity. SASP is associated with many chronic age-related diseases.
cellular senescence; senescence-associated secretory phenotype; SASP; inflammation; aging mechanism; age-related diseases
2016-06-04,
2016-06-24
国家自然科学基金资助项目(No 81274130);上海市教委085项目高等教育内涵建设基金项目(No 085ZY1202)
郭慧宁(1987-),女,博士生,研究方向:心血管中药药理学,E-mail:perfectning_2000@163.com;
许锦文(1959-),男,博士,教授,博士生导师,研究方向:心血管中药药理学,通讯作者,E-mail:jinwen.xu88@gmail.com
时间:2016-10-20 10:29
http://www.cnki.net/kcms/detail/34.1086.R.20161020.1029.012.html
10.3969/j.issn.1001-1978.2016.11.006
A
1001-1978(2016)11-1505-05
R-05;R329.25;R339.38;R364.5;R394.2摘要:细胞衰老的同时常伴随着衰老相关分泌表型(senescence-associated secretory phenotype,SASP)的产生。SASP由促炎细胞因子、生长因子、趋化因子和基质重塑酶等一系列细胞因子组成,它们可以导致机体慢性低度炎症和疾病,并可以反作用于衰老细胞及其邻近细胞加速它们的衰老进程,并可作为新的细胞衰老效应机制。该文通过对SASP生物学功效、分泌调节、机制、以及与相关疾病关联的探讨,提高我们对SASP的认知,引发我们对SASP相关疾病疗法的思考。

