NOXs在肝纤维化中的作用机制研究
卞勉励,陈星燃,张晨曦,金欢欢,赵士峰,张 峰,3,郑仕中, 3
(1. 南京中医药大学药学院,2. 南京中医药大学中药学一级学科,3. 江苏省中药药效与安全性评价重点实验室,江苏 南京 210023)
NOXs在肝纤维化中的作用机制研究
卞勉励1, 2,陈星燃1, 2,张晨曦1, 2,金欢欢1, 2,赵士峰1, 2,张 峰1, 2,3,郑仕中1, 2, 3
(1. 南京中医药大学药学院,2. 南京中医药大学中药学一级学科,3. 江苏省中药药效与安全性评价重点实验室,江苏 南京 210023)
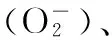
肝纤维化;NOXs;肝细胞凋亡;炎症反应;氧化应激;内质网应激;IRE1α-XBP1信号通路
在肝纤维化发生发展过程中常伴有继发性的炎症反应,而作为肝脏中的固有免疫细胞,肝脏炎症反应过程中,枯否细胞(Kupfer cell, KC)大量活化并释放多种促炎因子,同时还可分泌趋化因子,募集其他炎性细胞聚集于损伤部位,从而进一步加重炎症损伤[1]。其释放的细胞因子如活性氧簇(reactive oxygen species, ROS),能直接刺激静息态肝星状细胞(hepatic stellate cells, HSC)活化并转化为肌成纤维细胞(myofibroblast, MFB),后者大量增殖并合成胞外基质(extracellular matrix, ECM),从而导致肝纤维化的形成[2]。此外,ROS还能使促纤维化因子大量合成,如转化生长因子-β(transforming growth factor-beta, TGF-β)、肿瘤坏死因子-α(tumor necrosis factor -α, TNF-α)等,并刺激HSC发生表型转化,ECM进一步合成增多,炎症因子表达增加[3]。
新近研究发现,还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶(nicotinamide adenine dinucleotide phosphate oxidase, NOXs)产生的ROS能够介导细胞内多种信号通路的激活,进而调控肝细胞的生长、增殖、分化、迁移、衰老及凋亡等生理活动[4-5]。
1 NOXs的分类及功能调控
NOXs参与调控HSC的活化和肝细胞的凋亡,在不同种类的细胞中特异性表达NOXs的催化亚基,分别为NOX1、NOX2、NOX3、NOX4、NOX5、DUOX1、DUOX2,后统称为NOX蛋白家族[5]。NOX蛋白家族广泛表达于各种哺乳动物细胞中,且其活性普遍受到还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate, NADPH)膜结合酶类的调节。其中,肝细胞和HSC表达NOX1、NOX2、NOX4、DUOX1和DUOX2;血管内皮细胞主要表达NOX1、NOX2和NOX4;KC主要表达NOX2[6]。
NOXs是调节机体产生ROS的重要酶类,主要分布于内皮、血管平滑肌等非吞噬细胞中。在TGF-β、TNF-α、炎症介质、钙离子、重金属、部分药物等刺激时,通过激活NOXs进一步诱导ROS的大量产生,参与多种疾病的发生和发展[7-8]。此外,NOXs极易受细胞外环境变化刺激,Paik等[9]研究表明,高氧、缺氧、高温、高糖及胞外酸性环境变化等能够使胞质内p47phox磷酸化,与细胞色素b558结合,进而激活NOXs,导致一系列疾病的发生。
2 NOXs与肝纤维化
Piskounova等[5]研究发现,NOXs在肝纤维化的发生发展中扮演重要角色。在丙型肝炎病毒和非酒精性脂肪肝病(nonalcoholic fatty liver disease, NAFLD)患者中,NOX4的水平明显升高,而NOX4 的升高又进一步依赖性上调TGF-β/Smad3下游调节因子,促进HSC活化及胶原的形成,进而加重肝纤维化[10-11]。NOX1主要介导内源性肝细胞的促纤维化作用,通过抑癌基因(phosphatase and tensin homolog deleted on chromosome ten, PTEN)的失活及上调Akt/FOXO4/p27信号传导途径,进一步引发炎症反应,从而促进环氧合酶-2表达和前列腺素的合成[12]。
各种NOXs激动剂能够刺激HSC和MFB中促纤维化因子的释放,从而诱发肝纤维化反应,在细胞内直接对细胞膜、蛋白质等进行攻击,造成氧化损伤或间接激活氧化还原信号途径,进而诱导肝细胞的凋亡[13]。NOXs作为ROS 的主要供体,介导氧化应激和内质网损伤,分泌细胞因子、趋化因子和微粒,触发KC和HSC的活化[14]。HSC在转变成MFB的同时,激活NOX2,诱发肝细胞凋亡小体发挥吞噬作用,从而加重肝纤维化[15-16]。
基于NOXs在肝纤维化发生发展中的重要作用,进一步证实NOXs在肝脏疾病演变过程中存在多种致病机制。本文接下来将对其进行重点阐述。
2.1 NOXs与炎症反应 研究发现[17],NOXs介导的炎症反应参与多种疾病的发生发展。肝纤维化是肝脏遭遇损伤后,通过许多细胞因子的释放诱发的一种慢性炎症反应,并伴有大量炎症细胞的渗入。巨噬细胞、淋巴细胞和嗜酸性细胞等广泛参与肝纤维化的炎症反应过程。其中,淋巴细胞可通过释放淋巴因子激活巨噬细胞,反过来,巨噬细胞又能够分泌TNF-α进一步刺激淋巴细胞、MFB和其他炎症细胞,从而加剧炎症反应[18]。有研究表明,NOXs在肝脏缺血/再灌注、过度饮酒、异源物质或重金属中毒、细菌、病毒及寄生虫感染诱发的肝脏炎症反应过程中发挥了重要作用[13, 19]。
Foo等[20]研究表明,不同细胞内NOXs的激活主要由肝纤维化炎性因子TGF-β所诱导,进一步通过ROS的大量产生介导胞内不同信号传导途径的激活。TGF-β促进HSC转化为MFB的过程也依赖于NOXs诱导ROS的产生、基质金属蛋白酶(matrix metalloproteinases, MMPs)和基质金属蛋白酶抑制剂(matrix metalloproteinase inhibitors, TIMPs)的平衡来调节ECM大量沉积[21]。在胆管结扎(bile duct ligation, BDL)和CCl4诱导的肝纤维化模型中,运用NOX4/NOX1抑制剂GKT137831处理后,肝纤维化标志物表达明显降低、肝细胞炎症反应也明显减轻[22]。此外,NOX4抑制剂也能够明显抑制肝细胞中TGF-β信号的表达,降低ROS产生,进一步使纤维黏连蛋白和胶原产生降低[23]。因此,抑制NOXs功能的发挥,能够有效缓解肝纤维化过程中的炎症反应。
2.2 NOXs与氧化应激 Altenhöfer 等[24]研究发现,ROS与促炎症介质的过度表达有着密切的联系,主要表现在其可以激活多种炎症转录因子,进一步导致ROS 过量产生和堆积。而细胞内ROS的产生又主要依赖于NOXs的介导[25-26]。这提示,NOXs可通过促进ROS的产生诱发机体内环境失衡,导致细胞器功能失调,如内质网钙稳态遭到破坏、蛋白质的加工转运能力及生理状态发生紊乱,进而参与宿主细胞生长发育、死亡和衰老等生命过程中的氧化应激反应[27]。
2.2.1 NOXs调控ROS产生介导内质网应激的发生 肝纤维化形成过程中,活化型HSC产生大量的ECM,蛋白质的大量合成增加了对内质网折叠能力的需求,扰乱内质网功能,ROS可以改变内质网的稳态激活细胞未折叠蛋白响应(unfolded protein response, UPR)机制[28]。肝细胞具有丰富的内质网结构,是蛋白质折叠加工与质量监控的重要细胞器,其稳态平衡对于维持肝细胞功能至关重要。当肝细胞受到各种化学、物理等刺激时,极易诱发蛋白质代谢障碍,进而引起内质网应激(endoplasmic reticulum stress, ERS)[29]。研究发现,当内质网不能承担蛋白折叠的高负荷时,HSC中NOXs所介导ROS产生,将引发ERS,从而启动细胞UPR信号,激活抗氧化应答基因NOXs的表达,进一步增强内质网在蛋白质折叠、组装和运输方面的功能[30]。
当肝细胞受到外源性刺激时,细胞作为一个整体对外界各种刺激发生反应,在细胞内部,细胞器也会发生相应的应激反应,进而影响蛋白的正常表达和修饰,导致蛋白的错误折叠以及未折叠蛋白在内质网腔内的异常聚集[31]。肝纤维化过程中伴有ROS的大量生成,影响核氧化还原状态并诱导核蛋白修饰[32]。其中,UPR相关激酶c-Jun氨基端激酶(c-Jun-NH2-terminal kinase, JNK)的活化,JNK 的活化通过参与ERS的激活,进而促进MFB的活化[33]。
新近研究强调内质网谷胱甘肽超氧化物清除剂在ERS中发挥关键作用,并表明在其与谷胱甘肽共同作用下可以在脂肪性肝炎和肝脏纤维化中抑制氯离子通道中超氧阴离子自由基对HSC活化的刺激[34]。此外,天然抗氧化剂,如千层纸素,可通过调控ROS产生,影响细胞内Ca2+稳态,调节蛋白质磷酸化以及影响信号通路的级联传递及转录因子的表达,从而有效逆转肝纤维化[35-36]。
2.2.2 NOXs 调控 ROS 产生介导 IRE1α-XBP1信号通路的激活 在肝纤维化发展过程中,HSC大量活化与增殖的同时,NOXs的表达也明显增加,抗氧化防御系统逐渐被破坏,使ROS产生增加,进而激活特定的信号传导通路,如IRE1α-XBP1(inositol-requiring enzyme 1 alpha, IRE1α; X-box binding protein 1, XBP1)信号通路[37]。纵观UPR的3条通路中,IRE1α-XBP1通路发挥作用的时间最短、启动时间最晚,这充分表明了机体对其调节最为敏感[30]。此外,IRE1α以单体的形式表达于内质网膜上,同时具备蛋白激酶和RNA内切酶双重活性。当内质网受到压力刺激时,其单体发生二聚化,通过自体磷酸化方式被激活,继而激活其核酸酶活性,对其下游的底物进行剪切,翻译成有活性的转录因子入核,并激活下游转录因子,行使其缓解内质网压力的功能[38-39]。目前,最为明确的IRE1α核酸酶底物是XBP1 mRNA;另有研究表明,IRE1α的核酸酶活性能够介导某些特定mRNA的降解[37]。IRE1α自体磷酸化诱导RNA酶的活性增加,是HSC/ MFB以及间质干细胞(mesenchymal stem cells, MSC)定向迁移的一个重要因素[40]。
抑制IRE1α-XBP1信号通路及p38蛋白激酶活性能够降低HSC活化及自噬的产生,从而有效逆转肝纤维化[41]。IRE1α-XBP1信号通路的活化可诱导ERS,进而导致细胞凋亡[42]。另有文献报道,IRE1α-XBP1抑制剂MKC-3946通过作用于核糖核酸内切酶结构域,有效抑制ERS的发生[43-45]。
3 结语
在疾病的发生和发展过程中,关于肝纤维化病理机制的研究多与炎症反应及氧化应激相关。不同药物诱发的慢性肝损伤中,ROS的产生机制并不相同,研究发现,NOXs广泛参与肝纤维化的多种过程,如MFB形成、肝细胞死亡的调控等[46]。此外,预防ROS产生有助于更好地理解ERS在细胞内转导途径中的作用。未来有望通过使用安全有效的NOXs抑制剂来抑制HSC活化,进而发挥肝细胞保护作用。基于肝纤维化发生过程中严重的炎症反应,通过调控NOXs在炎症反应中的生物学作用,可为未来发展预防或治疗肝纤维化提供新的途径。
[1] Page A, Paoli P, Moran S, et al. Hepatic stellate cell transdifferentiation involves genome-wide remodeling of the DNA methylation landscape [J].JHepatol, 2016, 64(3): 661-73.
[2] Bhowmick N A, Neilson E G, Moses H L. Stromal fibroblasts in cancer initiation and progression [J].Nature, 2004, 432(7015):332-7.
[3] 张自力,赵士峰,许文萱,等. 细胞因子信号转导抑制分子-3在肝纤维化中的作用及研究进展[J]. 中国药理学通报, 2015,31(12):1646-51.
[3] Zhang Z L, Zhao S F, Xu W X, et al. The role of cytokine signal transduction inhibitor-3 in hepatic fibrosis and its research progress [J].ChinPharmacolBull, 2015, 31(12): 1646-51.
[4] Crosas-Molist E, Bertran E, Fabregat I. Cross-talk between TGF-beta and NADPH oxidases during liver fibrosis and hepatocarcinogenesis [J].CurrPharmDes, 2015, 21(41): 5964-76.
[5] Piskounova E. Oxidative stress inhibits distant metastasis by human melanoma cells [J].Nature, 2015, 527(7577):186-91.
[6] Cui W, Matsuno K, Iwata K, et al. NOX1/ nicotinamide adenine dinucleotide phosphate, reduced form (NADPH) oxidase promotes proliferation of stellate cells and aggravates liver fibrosis induced by bile duct ligation [J].Hepatology, 2011, 54(3):949-58.
[7] Samarakoon R, Dobberfuhl A D, Cooley C, et al. EGFR activation, p53 and reactive oxygen species [J].CellSignal, 2013, 25(11): 2198-209.
[8] Abhilash P A, Harikrishnan R, Indira M. Ascorbic acid supplementation downregulates the alcohol induced oxidative stress, hepatic stellate cell activation, cytotoxicity and mRNA levels of selected fibrotic genes in guinea pigs [J].FreeRadic,2012, 46(2): 204-13.
[9] Paik Y H, Iwaisako K, Seki E, et al. The nicotinamide adenine dinucleotide phosphate oxidase (NOX) homologues NOX1 and NOX2/gp91(phox) mediate hepatic fibrosis in mice[J].Hepatology, 2011,53(5): 1730-41.
[10] Sancho P, Martín P, Fabregat I. Reciprocal regulation of NADPH oxidases and the cyclooxygenase-2 pathway [J].Hepatology, 2011, 51(9):1789-98.
[11] Schuppan D, Kim Y O. Evolving therapies for liver fibrosis [J].ClinInvest, 2013, 123(5):1887-901.
[12] De Minicis S, Seki E, Paik Y H, et al. Role and cellular source of nicotinamide adenine dinucleotide phosphate oxidase in hepatic fibrosis[J].Hepatology, 2010, 52(4): 1420-30.
[13] Jia D, Duan F, Peng P, et al. Pyrroloquinoline-quinone suppresses liver fibrogenesis in mice [J].PLoSOne, 2015, 10(3): e0121939.
[14] Hernández-Gea V, Hilscher M, Rozenfeld R, et al. Endoplasmic reticulum stress induces fibrogenic activity in hepatic stellate cells through autophagy [J].Hepatology, 2013, 59(1): 98-104.
[15] Von M C, Matias N, Fernandez A, et al. Mitochondrial GSH determines the toxic or therapeutic potential of superoxide scavenging in steatohepatitis [J].Hepatology, 2012, 57(4): 852-9.
[16] Sancho P, Fabregat I. The NADPH oxidase inhibitor VAS2870 impairs cell growth and enhances TGF-β-induced apoptosis of liver tumor cells [J].BiochemPharmacol, 2011, 81(7): 917-24.
[17] Jiang J X, Venugopal S, Serizawa N, et al. Reduced nicotinamide adenine dinucleotide phosphate oxidase 2 plays a key role in stellate cell activation and liver fibrogenesisinvivo[J].Gastroenterology, 2010, 139(4): 1375-84.
[18] 陈 琴,陈连云,金欢欢,等. 肝脏树突状细胞在肝纤维化中的作用[J]. 中国药理学通报, 2015, 31(8):1053-6.
[18] Chen Q, Chen L Y, Jin H H, et al. Role of dendritic cells in liver fibrosis [J].ChinPharmacolBull, 2015, 31(8): 1053-6.
[19] Den H G, Qi S, Tilburg J H O, Koek A. Superoxide anion radicals activate hepatic stellate cells after entry through chloride channels: a new target in liver fibrosis [J].Gut, 2014, 724: 140- 4.
[20] Foo N P, Lin S H, Lee Y H, et al. α-Lipoic acid inhibits liver fibrosis through the attenuation of ROS-triggered signaling in hepatic stellate cells activated by PDGF and TGF-β [J].Toxicology, 2011, 282(4): 39-46.
[21] Lin W, Wu G, Li S, et al, HIV and HCV cooperatively promote hepatic fibrogenesis via induction of reactive oxygen species and NFkappaB [J].BiolChem, 2011, 286(4): 2665-74.
[22] Aoyama T, Paik Y H, Watanabe S, et al. Nicotinamide adenine dinucleotide phosphate oxidase (NOX) in experimental liver fibrosis: GKT137831 as a novel potential therapeutic agent [J].Hepatolology, 2012, 56(6): 2316-27.
[23] Chan E C, Peshavariya H M, Liu G S, et al. Nox4 modulates collagen production stimulated by transforming growth factor β1invivoandinvitro[J].BiochemBiophysResCommun, 2013, 430(3): 918-25.
[24] Altenhöfer S, Radermacher K A, Kleikers P W, et al. Evolution of NADPH oxidase inhibitors: selectivity and mechanisms for target engagement[J].AntioxidRedoxSignal, 2015 ,23(5):406-27.
[25] Novo E, Busletta C, Bonzo L V, et al. Intracellular reactive oxygen species are required for directional migration of resident and bone marrow-derived hepatic pro-fibrogenic cells [J].JHepatol, 2011, 54(5): 964-74.
[26] Serviddio G, Bellanti F, Stanca E, et al. Silybin exerts antioxidant effects and induces mitochondrial biogenesis in liver of rat with secondary biliary cirrhosis [J].FreeRadicBiolMed, 2014, 73: 117-26.
[27] Dunning S, Rehman A, Tiebosch M H, et al. Glutathione and antioxidant enzymes serve complementary roles in protecting activated hepatic stellate cells against hydrogen peroxide-induced cell death [J].BiochimBiophysActa, 2013, 1832(12): 2027-34.
[28] Han X, Busletta C, Rehman A, et al. IRE1alpha dissociates with BiP and inhibits ER stress-mediated apoptosis in cartilage development[J].CellSignal, 2013, 25(11): 2136-46.
[29] Pina F J. Reticulons regulate the ER inheritance block during ER stress [J].DevCell, 2016, 37(3): 279-88.
[30] Chen W. Targeted deletion of ER chaperone GRP94 in the liver results in injury, repopulation of GRP94-positive hepatocytes, and spontaneous hepatocellular carcinoma development in aged mice [J].Neoplasia, 2014, 16(8): 617-26.
[31] Park H W, Yang Z, Kamata H, et al. Hepatoprotective role of Sestrin2 against chronic ER stress [J].NatCommun, 2014, 5: e4233.
[32] Yang Y, Zhao Z, Liu Y, et al. Suppression of oxidative stress and improvement of liver functions in mice by ursolic acid via LKB1- AMP-activated protein kinase signaling [J].JGastroenterolHepatol, 2015, 30(3): 609-18.
[33] Chang L, Kamata H, Solinas G, et al. The E3 ubiquitin ligase itch couples JNK activation to TNFalpha-induced cell death by inducing c-FLIP(L) turnover [J].Cell, 2006, 124(3): 601-13.
[34] Anavi S, Ni Z, Tirosh O, et al. Steatosis-induced proteins adducts with lipid peroxidation products and nuclear electrophilic stress in hepatocytes [J].RedoxBiol, 2015, 4: 158-68.
[35] Bettaieb A, Jiang J X, Sasaki Y, et al. Hepatocyte NADPH oxidase 4 regulates stress signaling, fibrosis, and insulin sensitivity during development of steatohepatitis in mice [J].Gastroenterology, 2015, 149(2): 468-80.
[36] 许文萱,张自力,赵士峰,等. 法尼酯衍生物X受体在慢性肝病中的作用及机制研究进展[J]. 中国药理学通报, 2016, 32(3):314-9.
[36] Xu W X, Zhang Z L, Zhao S F, et al. Research progress in chronic liver disease the effect and mechanism of farnesoid X receptor [J].ChinPharmacolBull, 2016, 32(3): 314-9.
[37] Senturk S, Mumcuoglu M, Gursoy O, et al. Transforming growth factor-beta induces senescence in hepatocellular carcinoma cells and inhibits tumor growth [J].Hepatology, 2010, 52(3): 966-74.
[38] Hetz C. The unfolded protein response: controlling cell fate decisions under ER stress and beyond [J].MolCell, 2012, 13(2):89-102.
[39] Kim Y S, Morgan M J, Choksi S, et al. TNF-induced activation of the Nox1 NADPH oxidase and its role in the induction of necrotic cell death [J].MolCell, 2007, 26(5):675-87.
[40] Jiang F, Liu G S, Dusting G J, et al. NADPH oxidase-dependent redox signaling in TGF-β-mediated fibrotic responses [J].RedoxBiol, 2014, 2: 267-72.
[41] Crosas E, Molist E, Bertran P, et al. The NADPH oxidase NOX4 inhibits hepatocyte proliferation and liver cancer progression [J].JHepatol, 2014, 69: 338-47.
[42] Mimura N. Blockade of XBP1 splicing by inhibition of IRE1alpha is a promising therapeutic option in multiple myeloma [J].Blood, 2012, 119(24): 5772-81.
[43] Davenport E L, Moore H E, Dunlop A S, et al. Heat shock protein inhibition is associated with activation of the unfolded protein response pathway in myeloma plasma cells [J].Blood, 2007, 110(7):2641-9.
[44] Brenner C, Galluzzi L, Kepp O, et al. Decoding cell death signals in liver inflammation [J].JHepatol, 2013, 59(3): 583-94.
[45] Ding B S, Cao Z, Lis R, et al. Divergent angiocrine signals from vascular niche balance liver regeneration and fibrosis [J].Nature, 2014, 505(7481):97-102.
[46] Birkenfeld A L, Shulman G I. Nonalcoholic fatty liver disease, hepatic insulin resistance, and type 2 diabetes [J].Hepatology,2014, 59(2):713-23.
Study on mechanism of NOXs in liver fibrosis
BIAN Mian-li1, 2, CHEN Xing-ran1, 2, ZHANG Chen-xi1, 2, JIN Huan-huan1, 2,ZHAO Shi-feng1, 2, ZHANG Feng1, 2,3, ZHENG Shi-zhong1, 2,3
(1.CollegeofPharmacy,NanjingUniversityofChineseMedicine,Nanjing210023,China; 2.NationalFirst-ClassKeyDisciplineforTraditionalChineseMedicine,NanjingUniversityofChineseMedicine,Nanjing210023,China;3.JiangsuKeyLaboratoryforPharmacologyandSafetyEvaluationofChineseMateriaMedica,NanjingUniversityofChineseMedicine,Nanjing210023,China)
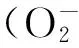
liver fibrosis; NOXs; hepatocyte apoptosis; inflammation; oxidative stress; endoplasmic reticulum stress; IRE1α-XBP1 signaling pathway
2016-06-23,
2016-07-29
国家自然科学基金资助项目(No 81270514,31401210,31571455);江苏省自然科学基金青年基金资助项目(No BK20140955);江苏省高校自然科学研究面上项目(No 14KJB310011);2013年江苏高校优秀科技创新团队计划;江苏高校优势学科建设工程资助项目(No ysxk-2010);南京市医学科技发展项目(No YKK14143)
卞勉励(1992- ),女,硕士生,研究方向: 天然药物预防和治疗肿瘤与肝纤维化,Tel:025-85811246,E-mail:1300506693@qq.com;
郑仕中(1962- ),男,博士,教授,博士生导师,研究方向:天然药物预防和治疗肿瘤与肝纤维化,通讯作者,Tel/Fax:025-85811246,E-mail:nytws@163.com
时间:2016-10-20 10:29
http://www.cnki.net/kcms/detail/34.1086.R.20161020.1029.006.html
10.3969/j.issn.1001-1978.2016.11.003
A
1001-1978(2016)11-1490-04
R-05;R329.24;R329.25;R345.4;R575.2;R977.3

