真菌AT9对禾谷孢囊线虫的寄生作用及种类鉴定
坚晋卓,徐鹏刚,张虎忠,李健荣,赵鹏,李惠霞
(1.甘肃农业大学草业学院,草业生态系统教育部重点实验室,甘肃省草业工程实验室,中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070;2.甘肃省秦安县职业中等专业学校,甘肃 秦安 741600)
真菌AT9对禾谷孢囊线虫的寄生作用及种类鉴定
坚晋卓1,徐鹏刚1,张虎忠2,李健荣1,赵鹏1,李惠霞1
(1.甘肃农业大学草业学院,草业生态系统教育部重点实验室,甘肃省草业工程实验室,中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070;2.甘肃省秦安县职业中等专业学校,甘肃 秦安 741600)
【目的】 小麦孢囊线虫病是一种土传病害,用化学药剂防治存在毒性大、易残留等问题,所以筛选对该病害有生防作用的菌株,对该虫病的防治具有重要意义.【方法】 通过室内试验测定菌株AT9分生孢子悬浮液对小麦禾谷孢囊线虫卵的寄生作用和对孵化的抑制作用,并进行形态学和rDNA-ITS分子鉴定.【结果】 不同浓度AT9分生孢子悬浮液对卵具有明显的寄生和抑制孵化作用,且不同浓度之间存在差异;寄生率和孵化抑制率随着AT9分生孢子悬浮液浓度的增加而增大;时间越长,寄生和抑制孵化作用越明显.在第12天浓度为4.42×107CFU/mL的AT9分生孢子悬浮液对卵的寄生率为76.17%,卵孵化的相对抑制率为60.83%.菌株AT9鉴定为土曲霉Aspergillusterreus.【结论】 菌株 AT9是防治小麦禾谷孢囊线虫病具有较大潜在开发价值的生防菌株.
小麦禾谷孢囊线虫;寄生率;孵化抑制率
小麦是甘肃省主要粮食作物,其种植面积仅次于玉米,目前稳定在80万hm2左右[1].禾谷孢囊线虫是小麦生产上一类重要的有害生物,我国已经发现的禾谷孢囊线虫主要有2种,分别为燕麦孢囊线虫又名小麦孢囊线虫(Heteroderaavenae)和菲利普孢囊线虫(Heteroderafilipijevi)[2],其中小麦孢囊线虫(Heteroderaavenae,Wollen-weber),是其中分布最广为害最重的一类,它可为害32属60余种禾本科(Gramineae)和40多种早熟禾科(Poaceae)植物[3].1874年该线虫在德国首次发现,现已报道发生的国家有50多个[4-6],可造成小麦的严重减产.该病害一般可使小麦减产23%~50%,严重时达73%~89%[7-8].1989年我国在湖北天门县小麦上首次发现禾谷孢囊线虫[5],目前该线虫广泛地分布于华北、西北、华东、华中和西南的16个省市自治区,发病面积约400万hm2[7-12].据调查禾谷孢囊线虫为害病田可减产20%~40%[13],其中黄淮麦区发病最重,并且有加速蔓延的趋势[14].在河南省的18个省辖市中已有16个市发生该病害,发病面积达170万hm2以上,造成严重的经济损失[15].柳永娥等[16]2009~2012年对甘肃省小麦种植区12个市(州)的50个县区进行了调查,小麦孢囊线虫的检出率为57.9%.12个市(州)都发现了禾谷孢囊线虫,其中土壤含卵量超过经济阈值的有酒泉市、武威市、兰州市、白银市、天水市和陇南市.另外,小麦禾谷孢囊线虫的侵染还能引起土壤丝核菌(Rhizoctoniasolani)的为害加重[17].
禾谷孢囊线虫地理分布和寄主范围非常广泛,国内多数小麦品种表现感病.由于轮作在许多麦区难以实施,化学杀线剂又伴随毒性大、易残留、成本高等问题,所以生物防治是控制该病害较理想的方法.有些生防微生物如淡紫拟青霉(Paecilomyceslilacinus)、厚垣轮枝孢菌(Verticilliumchlamydosporium)已经开发出相应的生防产品[18].在我国植物寄生线虫的生防研究起步较晚,目前研究较多的是利用淡紫拟青霉防治大豆孢囊线虫和南方根结线虫,以及利用厚垣孢轮枝菌防治南方根结线虫病,而针对防治禾谷孢囊线虫的生防菌株研究相对较少.如陈井生等[19]从土壤中分离获得5个对大豆胞囊线虫胞囊孵化和J2 (二龄幼虫)具有抑制活性的菌株,分别是Dq012、Dq059、Dq003、Dq030和Dq101.赵晓晖等[20]在中国科学院海伦农业生态试验站筛选出了5个种和1个变种的大豆胞囊线虫优势寄生真菌.汪来发等[21]从福建等地筛选出了10个对南方根结线虫卵的寄生率超过50%的菌株;王鹏等[22]研究了丛枝菌根真菌对黄瓜根结线虫的防治作用,研究发现,在南方根结线虫侵染黄瓜后,接种AM真菌可显著降低黄瓜根系虫瘿数和根结指数,从而降低根结线虫病的发病指数.王明祖等[23]从湖北省筛选出了两株对根结线虫(Meloidogynespp.)有较强寄生能力的真菌.Kerry等[24]研究了厚垣孢普奇尼亚霉(P.chlamydosporia)对燕麦孢囊线虫的致病性,发现某些菌株可使线虫雌虫数量减少65%.张树武等[25]通过室内试验测定了长枝木霉对禾谷胞囊线虫卵的寄生和毒杀作用,并通过盆栽试验测定了长枝木霉分生孢子悬浮液对小麦禾谷胞囊线虫卵的防治效果.研究表明,12 d后长枝木霉对小麦禾谷胞囊线虫卵的寄生率和卵孵化的相对抑制率达到最高,分别为91.33%和88.35%;对土壤中胞囊、线虫和根系中线虫的相对防治效果分别为89.84%、92.67%和 88.30%.近年来小麦禾谷孢囊线虫的防治开始受到了人们的关注,寻找一种安全而高效的生防制剂来防治小麦禾谷孢囊线虫病害,已经成为国内外研究的热点.但有关甘肃省小麦禾谷孢囊线虫生防菌株的研究报道较少,王明祖等[23]的研究表明,不同地理位置、不同生境存在着不同致病菌群,因此本研究以甘肃省禾谷孢囊线虫为研究对象,测定了菌株AT9对H.avenae卵的寄生作用和对其孵化的抑制作用,以期为我省该病害的生物防治和生防产品研发提供理论指导.
1 材料与方法
1.1 试验材料
供试菌株AT9由甘肃农业大学植物病理学实验室提供.
试验试剂:NaClO、Tween-80、Tris酚、氯仿、异戊醇、FPCB、异丙醇等.
1.2 试验方法
1.2.1 孢囊的分离 2014年6月~2015年8月,在甘肃省武威市天祝县和兰州市永登县等小麦禾谷孢囊线虫发生较严重的地块,用Z字形取样法采集土样,去除表土,取0~20 cm层的土壤,将多点土样混合后装入封口塑料袋,带回实验室置于4 ℃冰箱中备用.土样处理用改良的淘洗-过筛法[26].取土样加入适量水搅拌均匀,使土样完全溶解,静置2~3 min后,把悬浮液倒入26目和65目套筛中过筛,重复此操作3次.倾去上层26目网筛上的残余物,用细流水把65目网筛上的沉积物中的泥沙冲去,剩余物用水流收集在干净的培养皿中,然后在解剖镜下用镊子挑取新鲜饱满的棕色孢囊,放入4 ℃冰箱中备用.
1.2.2 菌株AT9分生孢子悬浮液的制备 取在PDA平板上培养7 d的菌株,加入一滴Tween-80和2 mL无菌水冲洗,使其分生孢子脱落在无菌水中,即得到分生孢子悬浮液,用血球计数板计数原液的浓度为4.42×107CFU/mL(指单位体积中的活菌个数)备用.
1.2.3 线虫卵悬浮液的制备 将孢囊用75%的酒精消毒3 min,再用1%NaClO消毒1 min,然后用无菌水冲洗4~5次,放入组织研磨器中加水研磨破壁,将混合液倒入200目和500目套筛,在500目筛上收集卵.然后用35%蔗糖溶液,2 500 r/min离心5 min,500目筛网上收集禾谷孢囊线虫卵[27],加水制备卵悬液,将卵悬浮液浓度调整为1 000粒/mL.
1.2.4 菌株AT9对卵的寄生和孵化的抑制作用 在灭菌的96孔细胞培养板中加入200 μL的小麦禾谷孢囊线虫卵悬浮液,然后加入100 μL浓度分别为4.42×107、2.21×107、4.42×106、2.21×106、4.42×105CFU/mL的真菌孢子悬浮液,以加入100 μL无菌水作为对照,每个处理重复3次.其中卵寄生试验在分别15、20 ℃和25 ℃下进行.因该线虫最适的孵化温度为15~16 ℃,故卵孵化的抑制试验在15 ℃下进行.菌株AT9对卵的寄生和对孵化的抑制作用均每隔2 d在显微镜下观察1次,8 d后镜检、记录各处理中卵的寄生和对孵化情况,并计算卵寄生率和卵孵化的相对抑制率.计算公式如下:
卵相对寄生率(%)=
卵孵化相对抑制率(%)=
1.2.5 菌株AT9形态学鉴定 挑取菌株AT9菌丝于PDA培养基上,在25 ℃条件下培养7 d后,观察并记录菌株生长速度、菌落颜色及表面特征等,测量孢子大小,在显微镜下进行分生孢子梗形态观察,记载菌株的形态特征.参照魏景超[28]、孔华忠等[29]的方法进行形态学鉴定.
1.2.6 菌株AT9分子生物学鉴定 采用改良的CTAB法[30]提取真菌DNA.称取50~100 mg待鉴定菌株的菌丝体,加液氮充分研磨后,迅速转移至2 mL离心管中,加入800 μL FPCB(裂解液)震荡,然后放入65 ℃的水浴锅中水浴1 h左右,期间经常震荡几下.加入Tris酚·氯仿·异戊醇800 μL(25∶24∶1),震荡1 min左右,静置2 min左右,12 000 r/min离心10 min,取上清液于2 mL离心管中,再重复上面操作1次,最后将上清液吸入1.5 mL离心管中.加与1.5 mL离心管中液体等量的异丙醇,轻轻摇匀,-20 ℃沉淀20 min(絮状物量少的话,如量多则不需要),12 000 r/min离心10 min,倒掉上清.加入75%的乙醇800 μL洗涤,将DNA弹起,12 000 r/min离心2 min,再重复1次上述步骤,离心后倒掉乙醇,放置5 min让乙醇挥发干净(加热促进挥发).加入50 μL ddH20溶解DNA,-20 ℃保存备用.采用通用引物ITS4(5′-TCCTCCGCTTATTGATATGC-3′)和ITS1F(5′-CTTGGTCATTTAGAGGGAAGTAA-3′)扩增DNA模板,PCR反应程序为:94 ℃预变性3 min;94 ℃变性30 s,52 ℃复性30 s,72 ℃延伸30 s为一个循环,35个循环;最后72 ℃延伸10 min.扩增产物送上海生物技术有限公司测序,在NCBI数据库上通过BLAST比对分析.
2 结果与分析
2.1 菌株AT9孢子悬浮液对小麦禾谷孢囊线虫卵的寄生作用
室内测定的15、20、25 ℃条件下菌株AT9对禾谷孢囊线虫卵的寄生试验结果见表1.由表1可知,不同浓度AT9孢子悬浮液对孢囊线虫均具有较强的寄生作用.同一时间相同的温度条件下,不同浓度的孢子悬浮液对卵的寄生作用差异显著,其中20 ℃条件下处理12 d后,不同浓度AT9孢子悬浮液对孢囊线虫卵的寄生作用也不同.其中浓度为4.42×107CFU/mL的分生孢子悬浮液对卵的相对寄生作用最强,寄生率可达76.17%,显著高于其他4个浓度,4.42×105CFU/mL浓度下孢子悬浮液对卵的寄生作用较差,寄生率仅为15.67%.
同一浓度相同的处理时间,在不同的温度条件下对卵的寄生率也存在差异.其中浓度为4.42×107CFU/mL的分生孢子悬浮液处理12 d后,15、20、25 ℃条件下的相对寄生率分别为75.00%、76.17%和58.33%.由此可见,20 ℃条件下菌株AT9对卵的寄生作用最强,其次为15 ℃,25 ℃寄生作用较差.
同一浓度相同的温度条件下,不同时间的寄生率也不同.寄生率随着时间的延长整体呈上升趋势,处理后12 d卵的寄生率达到最高,此时菌株AT9的分生孢子吸附或粘着于卵的体表,并且萌发长出大量的菌丝围绕于卵的四周且穿透卵壳(图1-a),而在对照组中则无菌丝的形成(图1-b);寄生菌丝围绕于线虫的四周且穿透线虫体壁(图1-c);而在对照组中无杂菌生长(图1-d).

表 1 不同浓度AT9分生孢子悬浮液在不同温度下对H.avenae卵的相对寄生率


a:被寄生的卵;b:对照卵粒;c:被寄生的J2;d:对照J2图1 小麦禾谷胞囊线虫卵和J2被菌株AT9寄生后的形态特征Fig.1 Morphological characteristics of wheat cereal cyst nematode eggs and J2 are parasitized by fungus of AT9
2.2 菌株AT9孢子悬浮液对孢囊线虫卵孵化的影响
菌株AT9孢子悬浮液对孢囊线虫卵孵化的影响试验结果见表2.由表2可知,与对照相比,不同浓度的AT9分生孢子悬浮液对小麦禾谷孢囊线虫卵孵化的相对抑制率随着浓度的增大而增大.在处理12 d后的相对抑制率较高,浓度4.42×107CFU/mL处理对小麦禾谷孢囊线虫卵孵化的相对抑制作用最强,相对抑制率达到60.83%,而4.42×105CFU/mL浓度的相对抑制率仅为44.57%.处理8 d后的相对抑制作用较弱,浓度为4.42×107CFU/mL和2.21×107CFU/mL处理的卵孵化相对抑制率均在55%以上,浓度为4.42×105CFU/mL的孵化抑制率仅为39%.

表2 不同浓度AT9孢子悬浮液对禾谷孢囊线虫卵孵化的抑制作用
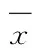
2.3 生防菌株AT9的鉴定
2.3.1 形态学鉴定 AT9菌株:菌落在PDA培养基上25 ℃条件下培养7 d,菌落直径5.4 cm,菌落中间呈砖红色,中央有突起的白色菌丝,后期有黄色色素产生,菌落背面呈深褐色,分生孢子大量产生,长1.5~3.5 μm(平均2.2 μm),宽1.3~3.0 μm(平均1.9 μm)(图2).分生孢子梗直立,顶端膨大成圆形或椭圆形,上面着生1~2层放射状分布的瓶状小梗,分生孢子梗顶端呈头状.每个瓶梗向茎地产生一条球形、有色、不分隔的分生孢子链.初步鉴定为曲霉属的土曲霉(Aspergillusterreus).
2.3.2 ITS序列分析 测定了菌株AT9的ITS序列.经与NCBI数据库进行BLAST比对分析,用MEGA6.0中的UPGMA法构建系统发育树.由图3可知,在亲缘关系上所有的序列聚为4个分支,AT9和KC119206.1,FJ011536.1,JX188057.1,KC119198.1,JQ717327.1,JQ717316.1,AJ413985.1,JX290029.1,AB369899.1,AF455426.1聚为一支,序列相似度达到99%,与其相似性最高的属种为土曲霉(Aspergillusterreus).真菌AT9形态学与分子生物学方法鉴定结果一致.

A:菌落正面;B:菌落背面;C:分生孢子梗;D:分生孢子.图2 菌株AT9的培养性状及形态特征Fig.2 Cultural characteristics and morphology of AT9 strain

图3 UPGMA法聚类分析树状图Fig.3 The tree of cluster analysis by UPGMA
3 讨论与结论
生物农药具有选择性强,对人畜低毒安全,对生态环境影响小等优点[31],所以通过筛选真菌、细菌以及放线菌等微生物来控制线虫具有非常重要意义.有些生物制剂已大量生产并用于孢囊线虫的防治,如穿刺芽孢杆菌(Pasteuriapenetrans)、淡紫色拟青霉(Paecilomyceslilacinus)[32]及一些相似的产品.
本研究筛选得到1株对禾谷孢囊线虫具有较强寄生作用的菌株AT9,通过形态学和rDNA-ITS分子生物学的方法鉴定为土曲霉Aspergillusterreus.ATP孢子悬浮液对卵的寄生性试验结果表明,寄生率随着处理时间的延长和孢子悬浮液浓度的增大而增大;同一浓度在不同的温度条件下寄生率也不同,其中在20 ℃下,各浓度的孢子悬浮液处理的卵寄生作用较好;不同浓度孢子悬浮液对卵孵化的相对抑制率随着浓度的增大而增大,并且随着处理时间的延长整体呈上升趋势.孢子悬浮液对H.avenae卵的寄生率随着时间延长,寄生率越高,这与赵英淑等[33]报道的结果基本一致.鲍亮亮[34]通过盆栽试验和对孢囊孵化的影响,筛选得到2株防效较好的真菌Z2和Z4,卵寄生率试验表明Z2和Z4对卵寄生率分别为10.9%和27.3%.将这2种真菌鉴定为子囊菌科格孢腔菌目和拟青霉属真菌.高学彪等[35]通过室内测定得到淡紫拟青霉MCWAl8菌株对南方根结线虫卵的相对寄生率为92.6%.这与本试验结果得到的寄生率最高76.17%相比存在差异.刘国坤等[36]报道认为不同分离物对卵的寄生率影响不同,其原因可能是由温度、菌株来源和作用对象的不同引起的[37-38].
张树武等[25]研究表明,长枝木霉分生孢子悬浮液对小麦禾谷胞囊线虫卵孵化的相对抑制率随着浓度的增大而增大.刘霆等[39]研究发现,在Snf907真菌原液、5×、10×稀释液浓度下,对大豆胞囊线虫分散卵粒孵化的相对抑制率分别是98.86%、92.66%和84.19%.这与本试验结果基本一致,卵孵化的相对抑制率随着稀释倍数的增加而减小.
本试验筛选得到1株对H.avenae具有较强寄生作用的菌株AT9,其孢子悬浮液对卵有较高的寄生率和孵化抑制率,表现出在植物寄生线虫生物防治上的巨大潜力.但对于菌株AT9产生的生物活性物质及对线虫J2的作用机理和田间防效等还有待于进一步的研究.
[1] 张彦军,苟作旺,王兴荣,等.甘肃省干旱地区抗逆农作物种质资源调查与分析[J].植物遗传资源学报,2015(6):1252-1257
[2] 李秀花,马娟,高波,等.部分国内外小麦种质资源对燕麦孢囊线虫的抗病性[J].麦类作物学报,2013,33(6):1277-1283
[3] 刘伟志.植物病原线虫学[M].北京:中国农业出版社,2000
[4] 陈品三,彭德良,文学.小麦禾谷胞囊线虫病[J].植物保护,1992(6):37-38
[5] Stirling G R,Kerry B R.Antagonists of the cereal cyst nematodeHeteroderaavenaeWoll in Australian soils [J].Australian Journal of Experimental Agriculture ,1983,23(122):318-324
[6] Miller L I.Economic importance of Cyst Nematode in North America[M]//Cyst Nematodes.Springer US,1986:373-385
[7] Brown R H.Cultural practices and their effects on Heterodera avenae and grain yields of wheat in Victoria,Australia[J].Bulletin OEPP-European and Mediterranean Plant Protection Organization,1982,12(4):477-484
[8] Boer R F,Kollmorgen J F,Macauley B J,et al.Effects of cultivation on rhizoctonia root rot,cereal cyst nematode,common root rot and yield of wheat in the Victorian Mallee[J].Animal Production Science,1991,31(3):367-372
[9] 陈品三,王明祖,彭德良.我国小麦禾谷孢囊线虫(HeteroderaavenaeWollenweber)的发现与鉴定初报[J].中国农业科学,1991,24(5):89-91
[10] 王明祖,彭德良,武学勤.小麦孢囊线虫病的研究I.病原鉴定[J].华中农业大学学报,1991,10(4):352-356
[11] 王明祖,向子钧.华中地区小麦禾谷孢囊线虫分布特点[J].湖北植保,1997(5):4-5
[12] 郑经武,林茂松.安徽省小麦上两个孢囊线虫群体的鉴定[J].江苏农业学报,1996,12(1):31-35
[13] 刘维志,刘修勇,栾兆杰.山东省荷泽市郊麦田发现燕麦胞囊线虫(Heteroderaavenae)[J].莱阳农学院学报,2006,22(4):266-269
[14] 冉永正,张振诚,王翠萍,等.济南地区小麦田小麦胞囊线虫的发生及调查分析[J].植物检疫,2007,21(2):118-119
[15] 王振跃,施艳,袁虹霞,等.不同营养元素对小麦禾谷孢囊线虫孵化及二龄幼虫存活的影响[J].植物病理学报,2013,43(3):333-336
[16] 柳永娥.甘肃省禾谷孢囊线虫病原学及发生动态研究[D].兰州:甘肃农业大学,2013
[17] 阎乃红,陈静,余懋群.小麦禾谷孢囊线虫及抗线虫性基因研究进展[J].麦类作物学报,2003,23(1):90-94
[18] 孙漫红,刘杏忠,晋治波.淡紫拟青霉对大豆胞囊线虫卵及2龄幼虫的影响[J].植物保护学报,2002,29(1):57-61
[19] 陈井生,李肖白,李泽宇,等.不同抑制性土壤真菌菌株对大豆胞囊线虫的抑制作用[J].河南农业科学,2011(7):90-92
[20] 赵晓晖.大豆胞囊线虫抑制性土壤中寄生真菌及其作用研究[D].哈尔滨:东北林业大学,2011
[21] 汪来发,杨宝君,李传道.寄生真菌对根结线虫的致病力评价[J].林业科学,1999,03:43-49
[22] 王鹏,邹国元,张淑彬,等.丛枝菌根真菌对黄瓜南方根结线虫病的影响[J].甘肃农业大学学报,2009,44(2):90-93
[23] 王明祖,吴秋芳.根结线虫卵寄生真菌的研究 I.卵寄生真菌的筛选[J].华中农业大学学报,1990(3):225-229
[24] 刘杏忠,张克勤,李天飞.植物寄生线虫生物防治[M].北京:中国科学技术出版社,2004
[25] 张树武,徐秉良,古丽君,等.长枝木霉对禾谷胞囊线虫卵的寄生和毒杀作用及其机制[J].植物保护学报,2013(4):320-326
[26] 刘维志.植物线虫学研究技术[M].沈阳:辽宁科学技术出版社,1995
[27] 孙漫红,刘杏忠.淡紫拟青霉发酵滤液对大豆胞囊线虫趋化性的影响[J].植物病理学报,2004,34(4);376-379
[28] 魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979
[29] 孔华忠.中国真菌志(第35卷)—青霉属及其相关有性型属[M].北京:科学出版社,2007
[30] Doyle J J.A rapid DNA isolation procedure for small quantities of fresh leaf tissue[J].Phytochem Bull,1987,19:11-15
[31] Abawi G S,Widmer T L.Impact of soil health management practices on soilborne pathogens,nematodes and root diseases of vegetable crops[J].Applied Soil Ecology,2000,15(1):37-47
[32] 高军,王朝华,张书敏.小麦禾谷胞囊线虫病研究进展[J].中国植保导刊,2007,27(5):10-13
[33] 赵英淑.禾谷孢囊线虫寄生性真菌-轮枝菌的初步研究[D].北京:中国农业科学院,2002
[34] 鲍亮亮.内蒙古禾谷孢囊线虫的发生及生物防治[D].呼和浩特:内蒙古农业大学,2012
[35] 高学彪,邓穗儿,周慧娟,等.淡紫拟青霉MCWA18菌株对南方根结线虫的寄生和防治作用[J].中国生物防治,1998,14(4):163-166
[36] 刘国坤,肖顺,洪彩风,等.镰刀菌对南方根结线虫卵的寄生特性[J].福建农林大学学报:自然科学版,2006,35(5):459-462
[37] 林茂松,沈素文.厚壁孢子轮枝菌防治南方根结线虫研究初报[J].生物防治通报,1994,10(1):7-10
[38] 陈书霞,姜永华,刘宏久,等.AM真菌和根结线虫互作对黄瓜生长及生理特征的影响[J].植物保护学报,2012,39(3):253-258
[39] 刘霆,王莉,段玉玺,等.Snf907真菌代谢物对大豆胞囊线虫卵及二龄幼虫的影响[J].大豆科学,2006,25(3):325-328
(责任编辑 胡文忠)
Parasitic effects of strain AT9 onHeteroderaavenaeand species identification
JIAN Jin-zhuo1,XU Peng-gang1,ZHANG Hu-zhong2,LI Jian-rong1,ZHAO Peng1,LI Hui-xia1
(1.College of Pratacultural Science,Gansu Agricultural University,Key Laboratory of Grassland Ecosystem, Ministry of Education,Sino-U.S.Centers for Grazingland Ecosystem Sustainability,Lanzhou 730070, China;2.Secondary Vocational School of Qinan,Qin′an 741600,China)
【Objective】 Wheat cyst nematode is a soil-borne diseases.Chemical control exists high toxicity and pesticide residue,so screening the bio-control strains is a very important way to control the wheat cyst nematode.【Method】 The parasitic and hatching inhibition effect was determined by conidia suspension of AT9 strain on the eggs ofH.avenaeby indoor experiment and the morphological and molecular identification of rDNA-ITS of AT9 strain was carried out.【Result】 Different concentrations of AT9 strain conidia suspension had a significant parasitic and hatching inhibition effect on the egg,and the differences were significantly among different concentrations.Parasitism rate and hatching inhibition rate increased with increasing of AT9 conidia suspension concentration,the longer the experiment time,the more parasitic and hatching inhibiting effect.On the 12th day the parasitic rate of AT9 conidia suspension at the concentration of 4.42 × 107CFU / mL on eggs was 76.17% and the relative inhibition on eggs hatching was 60.8%.The strain AT9 was identified asAspergillusterreus.【Conclusion】 The strain AT9 as the bio-control strain for wheat cereal cyst nematode should be with greater potential development value.
wheat cereal cyst nematode;parasitism rate;hatching inhibition rate
坚晋卓(1990-),女,硕士研究生,研究方向禾谷孢囊线虫生物防治.E-mail:237645587@qq.com
李惠霞,女,副教授,硕士生导师,研究方向主要为植物线虫病害和真菌病害.E-mail:lihx@gsau.edu.cn
公益性行业(农业)专项科研专项(20150114);国家自然基金项目(31460463).
2016-03-01;
2016-03-31
S 435.122
A
1003-4315(2016)05-0071-07

