高产果胶酶酵母菌株筛选及产酶条件研究
贾兰兰,程超,王金鑫,王发亮,王婧
(甘肃农业大学食品科学与工程学院,甘肃省葡萄与葡萄酒工程学重点实验室,甘肃 兰州 730070)
高产果胶酶酵母菌株筛选及产酶条件研究
贾兰兰,程超,王金鑫,王发亮,王婧
(甘肃农业大学食品科学与工程学院,甘肃省葡萄与葡萄酒工程学重点实验室,甘肃 兰州 730070)
【目的】 筛选出具有地域特色高产果胶酶的酵母菌株,改善葡萄酒品质.【方法】 试验以156株酵母菌株为研究对象,经初筛、复筛选出酶活力较高的菌株MQFEC-2,并利用单因素试验和正交试验对该菌株的产酶条件进行优化.【结果】 当产酶培养基初始pH值为5.0,产酶温度为30 ℃,接种量为6.0%,产酶时间为72 h时,此菌株产酶的酶活力最高,通过验证试验得其产酶酶活为35.85 U/mL;各因素对酶活力影响大小依次为:产酶温度>培养基初始pH值>产酶时间>接种量.
果胶酶;酵母菌株;筛选;产酶条件
果胶酶是能分解果胶物质的一类酶的总称,主要包括原果胶酶、果胶脂酶、果胶裂解酶以及多聚半乳糖醛酸酶四大类,因其能有效分解果肉组织中的果胶物质,而广泛应用于食品加工及酿酒工业[1].在现代葡萄酒酿造中,果胶酶更是重要辅料,果胶酶能够提高葡萄出汁率,促进葡萄汁澄清,增强色素、单宁和果香的浸提效果,对葡萄酒品质的改善和提升具有十分重要的作用[2-3].果胶酶作为工业生产领域中的一种重要辅料,产酶菌种的获得一直是国内外研究热点之一[4].
酵母菌是葡萄酒酿造中的重要微生物,原产地环境中可以筛选出充分展现该地域特色的酵母,并酿出风格独特、具有品种典型性的葡萄酒.酵母筛选已经涉及到酵母菌株检测技术的发展,提高葡萄酒的色泽,香气和其他工艺性能等方面[5-8].葡萄酒酵母菌种性状的好坏直接关系到葡萄酒的口感和风味,决定葡萄酒品质的优劣,不同酵母菌种的代谢特征对葡萄酒酿造具有十分重要的意义[9].有研究表明,酵母产生的果胶酶能够分解果胶,破坏葡萄组织,不仅能提高葡萄的出汁率,有利于葡萄酒的澄清,还能促进色素的萃取和色泽的稳定[10-11].
目前已经获得了一些生产微生物果胶酶的菌种,包括细菌、霉菌、酵母菌和放线菌.国内对果胶酶研究始于20世纪60年代,目前仍然在果胶酶的菌种选育、生产工艺和应用方面不断研究.田英华等[12]选育了一株高产果胶酶的黑曲霉突变株HYA4,在优化的发酵条件下酶活力达1 285 U/g.杨辉等[13]以苹果渣为产酶诱导剂,利用黑曲霉菌株固态发酵产果胶酶活力为174.54 U/g.但对于葡萄酒酿造来说,葡萄汁或葡萄酒pH值介于2.9~3.5,只有酸性果胶酶能够得到较好的效果,而目前对于酸性果胶酶高产酵母菌株的筛选研究报道较少,因此,从葡萄酒产区环境中筛选具有高活力的果胶酶酵母菌株,是得到高产果胶酶菌株的最直接方法.
本试验通过对156株野生酵母菌株进行筛选和酶活测定,利用聚半乳糖醛酸琼脂培养基对其进行初步筛选,以橘皮粉为产酶诱导剂,经摇瓶发酵复筛并对其产酶条件进行研究,旨在筛选出具有地域特色高产果胶酶的酵母菌株,从而改善葡萄酒品质,为酿造出更优质的葡萄酒提供相关依据.
1 材料与方法
1.1 材料与试剂
1.1.1 菌株来源 甘肃省葡萄与葡萄酒工程学重点实验室收集保存的156株酿酒酵母菌株,继代培养15代所得菌株.
1.1.2 YEPD培养基 酵母膏1.0%,蛋白胨2.0%,葡萄糖2.0%,琼脂2.0%,121 ℃灭菌20 min.
1.1.3 聚半乳糖醛酸琼脂培养基 聚半乳糖醛酸12.5 g、磷酸二氢钾6.8 mL(pH 3.5)、酵母膏6.7 g、葡萄糖10 g、琼脂20 g、蒸馏水1 000 mL、121 ℃下灭菌20 min.
1.1.4 发酵培养基 桔皮粉2.0 g、硫酸铵0.2 g、酵母膏0.5 g、K2HPO40.2 g、MgSO40.2 g、NaCl 0.1 g、MnSO4·H2O 0.25 mg,FeSO4·7H2O 0.75 mg、蒸馏水100 mL、pH 6.0、121 ℃灭菌20 min.
聚半乳糖醛酸、半乳糖醛酸、钌红均购自美国Sigma公司,其他试剂均为国产分析纯.
1.2 仪器与设备
827型pH计(瑞士万通公司);TD5A-WS型台式低速离心机(长沙湘仪离心机仪器有限公司);CP214型电子天平(奥豪斯仪器(上海)有限公司);GZX-GF101-Ⅱ电热恒温鼓风干燥器(上海跃进医疗器械有限公司);HH-S型电热恒温水浴锅(金坛市恒丰仪器制造有限公司);紫外-可见分光光度计(Thermo Fisher scientific公司);SYQ-DSX-280B型手提式不锈钢压力蒸汽灭菌器(上海申安医疗器械厂);SW-CJ-2FD型洁净工作台(苏净集团苏州安泰空气技术有限公司);SPX-150-Ⅱ型生化培养箱(上海跃进医疗器械有限公司);NRY-200型恒温震荡培养器(上海南荣实验室设备有限公司).
1.3 试验方法
1.3.1 产酶菌株初筛 将分离纯化的酵母菌株接种于聚半乳糖醛酸琼脂培养基[14-16],30 ℃培养4 d.用蒸馏水冲去平板上的菌落后,用0.08 g/100 mL的钌红染色,2 h后观察其颜色变化,出现紫色圈的说明其产果胶酶,紫色的深浅代表产酶强弱.
1.3.2 产酶菌株复筛 将初筛得到的紫色圈颜色较深的菌株接种于产酶培养基中,在50 mL三角瓶中装入30 mL培养基,调节培养基初始pH为5.0,转速180 r/min,30 ℃培养48 h后,取产酶液8 000 r/min离心10 min,吸取上清液适当稀释后作为粗酶液,采用DNS法测定粗酶液中果胶酶活力,筛选出酶活力较高的菌株.
1.3.3 半乳糖醛酸标准曲线的绘制 参照王薇等[17]的方法并修改.精确称取1 g半乳糖醛酸用pH5.0的磷酸缓冲溶液定容至1 000 mL,获得1 mg/mL的半乳糖醛酸标准溶液.取6支15 mL的刻度试管编号,并按表1加入试剂,沸水浴10 min后立即用流水冷却,加蒸馏水定容至15 mL(以1号试管作为空白调零),在540 nm波长下比色测定吸光度.以吸光度为纵坐标,半乳糖醛酸含量为横坐标,绘制标准曲线.两次重复试验的均值用最小二乘法拟合一元线性方程y=ax+b,求出吸光度与半乳糖醛酸量的关系.

表1 标准样配制
1.3.4 酶活性测定 参照王薇等[17]的方法并修改.取15 mL离心管加入1%的果胶溶液0.8 mL,50 ℃预热3 min,加酶液0.2 mL,混合,50 ℃水解10 min,加DNS试剂2 mL,混合后于沸水浴中10 min,冷却定容至15 mL,2 000 r/min离心分离10 min,取上清10 mL,空白调零,540 nm测定吸光度值.1 min水解果胶产生1 μg还原糖(以半乳糖醛酸计)所需酶量定义为1个酶活力单位(U).
1.3.5 产酶条件单因素试验设计
1.3.5.1 培养基初始pH值对产酶的影响 调节产酶培养基的初始pH值分别为4.0、5.0、6.0、7.0和8.0,将菌悬液按5.0%的接种量分别接入装有30 mL不同pH值的产酶培养基中,30 ℃、180 r/min摇床培养48 h,取出产酶液,8 000 r/min离心10 min,取上清液分别测定酶活力.试验重复3次.
1.3.5.2 产酶温度对产酶的影响 将菌悬液按5.0%的接种量接入装有30 mL产酶培养基的50 mL三角瓶中,pH值为5.0,分别置于20 ℃、25 ℃、30 ℃和35 ℃下180 r/min摇床培养48 h,后续步骤同1.3.5.1.
1.3.5.3 产酶时间对产酶的影响 将菌悬液按5.0%的接种量接入装有30 mL产酶培养基的50 mL三角瓶中,pH值为5.0,30 ℃、180 r/min摇床培养,每隔24 h测定酶活.
1.3.5.4 接种量对果胶酶活性的影响 将菌悬液分别按3.0%、4.0%、5.0%、6.0%和7.0%的接种量接入装有30 mL产酶培养基的50 mL的三角瓶,pH值为5.0、30 ℃、180 r/min恒温摇床培养48 h,后续步骤同1.3.5.1.
1.3.6 正交试验设计 根据单因素试验结果确定菌株产酶条件的正交试验因素和水平,采用L9(34)正交试验设计,以酶活作为产酶条件优化选择的依据.试验重复3次.
1.4 数据处理
分析结果采用SPSS 17.0、Excel等软件进行处理.
2 结果与分析
2.1 高产果胶酶酵母菌株筛选
2.1.1 标准曲线的绘制 以半乳糖醛酸含量为横坐标,吸光值为纵坐标绘制标准曲线,结果如图1.半乳糖醛酸标准曲线回归方程为:y=1.077 1x-0.026 6,相关系数R2=0.997 8,吸光度与半乳糖醛酸含量呈良好的线性关系.

图1 半乳糖醛酸标准曲线Fig.1 Standard curve of galactose uronic acid
2.1.2 菌株筛选及酶活测定 从本实验室保存的酿酒酵母菌株中筛选分离产果胶酶菌株,由于聚半乳糖醛酸酶是果胶酶的重要组分,其活力在很大程度上代表了果胶酶的活力.因此利用它专一性地分解聚半乳糖醛酸中两个非酯化半乳糖醛酸间的糖苷键,使其很快从大分子降解为分子量较小的低聚糖类,由于钌红染料可与分子量较小的低聚糖形成紫色复合物,因此以形成的紫色圈直径大小为依据,进行平板初筛.通过初筛得到18株具有较深紫色圈的酵母菌株.将当选的菌株进一步进行摇瓶复筛,并测定摇瓶条件下的果胶酶活性大小,得到一株酶活相对较高的酵母菌株MQFEC-2,其酶活力为31.19 U/mL(表2).将选定菌株继代15代以上,进行后续试验.

表2 高产果胶酶菌株酶活
2.2 产酶条件优化试验结果
2.2.1 培养基初始pH值对菌株产酶的影响 由图2可知,该菌株酶活力在不同pH值范围呈现先上升后降低的趋势.当pH值为5.0时,菌株产酶能力最高,酶活力达到33.23 U/mL.pH值在5.0~8.0酶活力逐渐降低,且在7.0~8.0降低趋势较为明显.原因在于酵母菌株产生的果胶酶为酸性水解酶,pH值过低或过高会影响酶的活性,造成菌株产酶能力降低.因此,菌株最佳产酶pH值为5.0.

图2 初始pH值对菌株产酶的影响Fig.2 Effects of initial pH value on enzyme producing
2.2.2 产酶温度对菌株产酶的影响 由图3可知,该菌株酶活力在不同温度范围呈现先上升后下降的趋势,当温度达到30 ℃时酶活力最高,酶活力达到31.21 U/mL.温度在20~30 ℃酶活力逐渐升高,且在25~30 ℃增幅明显,在30~35 ℃酶活力逐渐降低.原因在于产酶温度过高或过低都不利于菌株生长,进而影响代谢产物果胶酶的产生和释放.因此,菌株的最佳产酶温度为30 ℃.

图3 产酶温度对菌株产酶的影响Fig.3 Effects of fermentation temperature on enzyme producing
2.2.3 产酶时间对菌株产酶的影响 由图4可知,该菌株酶活力在不同产酶时间范围呈现先上升后降低的趋势.当产酶时间为72 h时,菌株的产酶能力最高,酶活力可以达到32.82 U/mL.产酶时间在24~72 h时,酶活力升高;在72~120 h时,酶活力逐渐降低.说明产酶时间较短或较长都会影响菌株生长,进而影响果胶酶的产生.因此,菌株最佳产酶时间为72 h.

图4 产酶时间对菌株产酶的影响Fig.4 Effects of fermentation time on enzyme producing
2.2.4 接种量对菌株产酶的影响 由图5可知,该菌株酶活力在不同接种量范围呈现先上升后降低的趋势.当接种量为6.0%时,菌株的产酶能力最高,酶活力达到32.12 U/mL.接种量在3.0%~6.0%,酶活力升高;接种量在6.0%~7.0%酶活力逐渐降低,且在6.0%~7.0%降低的趋势较为明显.说明接种量过小,导致前期菌体生长过慢,使得产酶周期
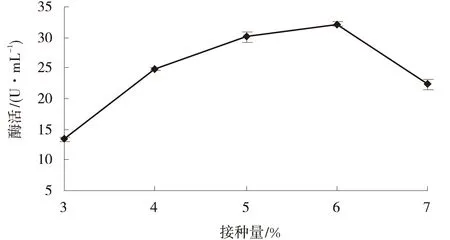
图5 接种量对菌株产酶的影响Fig.5 Effects of inoculum size on enzyme producing
延长;接种量过大,导致初期菌体生长迅速,营养物过多用于细胞合成,使酶合成下降.因此,菌株的最佳接种量为6.0%.
2.2.5 正交试验结果与分析 根据单因素试验结果,以酶活力为考察指标,对pH值(A)、温度(B)、接种量(C)和产酶时间(D)4个因素进行L9(34)正交试验设计,试验结果见表3.对试验结果进行统计分析,通过直观分析和极差分析得到最优组合,按照正交试验选择的最佳产酶条件进行菌株产酶试验,验证正交试验结果.

表3 L9(34)正交试验及结果
由表3的数据结果可得出影响酶活力变化因素的主次顺序为:B>A>D>C;由K值可以确定其正交试验的最优组合为A2B2C2D2.即产酶培养基初始pH值为5.0,产酶温度为30 ℃,接种量为6%,产酶时间为72 h.用SPSS 17.0统计软件对试验结果进行方差分析,结果见表4.由表4方差分析可知,因素A、B和D在P<0.05水平上有显著性差异,因素C差异不显著.

表4 正交试验方差分析结果
*表示差异显著(P<0.05).
2.2.6 验证试验结果 由于L9(34)正交试验得到的最优组合在L9(34)正交试验设计中未出现,所以需对正交试验得到的最优组合进行验证试验.在初始pH为5.0,产酶温度为30 ℃,接种量为6%,产酶时间为72 h的条件下进行验证,验证菌株产酶效果,重复3次.测得酶活力为35.85 U/mL,比正交试验中最优组合的产酶效果好.可见,经正交试验所确定的是最佳产酶条件.
3 讨论
本试验以橘皮粉为产酶诱导剂,经摇瓶发酵产果胶酶,而后采用DNS法测酶活力,研究表明:该菌株在培养基初始pH值为5.0,产酶温度为30 ℃,接种量为6%,产酶时间为72 h时,果胶酶酶活力最高,经验证试验得到果胶酶酶活力为35.85 U/mL.在菌种筛选中,国内外研究者通过测定酶作用产物中的还原糖含量来反应酶水解聚半乳糖醛酸的程度.原因在于以聚半乳糖醛酸为底物可突出果胶酶是通过水解果胶释放出可溶性的果胶物质,并且产物中都含有半缩醛羟基;酶对聚半乳糖醛酸的水解作用越大,得到半缩醛羟基就越多,也说明产物中的还原糖含量越高.华宝玉等[18]从桔子园土壤和腐烂的水果等处筛选得到1株产果胶酶活力较强的菌株M3,确定该菌株为聚多曲霉,其菌株的最佳产酶温度为30 ℃,这与本试验的研究结果相仿.张浩森等[19]从富含果胶质的果园土壤中筛选出一株产果胶酶活力较强的菌株,该菌株的最佳发酵产酶时间为72 h,这与本试验的结果基本一致.李喻等[20]从腐烂的苹果中定向分离筛选出一株适合液态发酵法生产果胶酶的菌株YL-9,初步鉴定为扩展青霉;通过正交试验结果可知,在此优化发酵条件下,酶活力可达8.52 U/mL,这与本试验筛选所得酵母所产的果胶酶酶活力有一定差异,主要是因为产酶菌种不同,对于果胶酶的酶活定义有所差别.此外试验数据说明接种量对试验结果的影响不明显,产酶时间对菌株产酶的影响试验中,72 h和最后得到的最优工艺是相符的,可是酶活力32.82 U/mL和最后验证试验结果酶活力35.85 U/mL,差距较大.原因在于当接种量为5%时,由于接种量相对较小会导致前期菌体生长过慢,使得产酶周期延长,故在72 h时产酶较少,酶活力不高;而当接种量为6%时,酵母菌体初期生长较为稳定,生长所需的营养物都用于细胞合成,酶的合成速率会提高,故接种量的改变会对酶活力产生一定影响.相比而言,产酶温度、培养基初始pH值和产酶时间对酶活力的影响是更大的,尤其是产酶温度.在单因素试验中通过观察图2-5可以初步发现产酶温度、培养基初始pH值和产酶时间的改变对酶活影响是较大的(折线图的变化趋势较为明显,酶活的增幅、减幅较为显著);并且表4方差分析结果也显示因素A、B和D在P<0.05水平上有显著性差异,更能说明产酶温度、培养基初始pH值和产酶时间对酶活力的影响更显著.
4 结论
本试验对156株酵母菌株通过平板初筛,得到18株具有较深紫色圈的酵母菌株,通过摇瓶发酵复筛,得到一株酶活较高的菌株MQFEC-2,酶活为31.19 U/mL.通过优化其产酶条件,得出该菌株最佳产酶条件为产酶培养基初始pH值5.0,产酶温度30 ℃,接种量6%,产酶时间72 h,在此条件下酶活达到了35.85 U/mL,提高了4.66 U/mL,各因素对酶活力影响大小依次为:产酶温度>培养基初始pH值>产酶时间>接种量.
[1] 彭珊珊,钟瑞敏.食品添加剂学[M].北京:中国轻工业出版社,2004
[2] 俞惠明,蔡建林.果胶酶在葡萄酒酿造中的作用及其实践应用[J].中外葡萄与葡萄酒,2010(4):65-68
[3] 李鸿玉,李祖明.果胶酶及其应用[M].北京:知识产权出版社,2010
[4] 许均华,李高阳,李志坚.高产果胶酶菌株的选育及其发酵生产的研究进展[J].食品与机械,2011,27(1):147-149
[5] 张珍.河西走廊产区高耐受性葡萄酒相关酵母筛选及其发酵性能研究[D].兰州:甘肃农业大学,2013
[6] 陈金丽,郭阳,薛洁,等.优良野生葡萄酒酵母的筛选及性能评价[J].食品与发酵工业,2012,38(5):106-111
[7] 朱丽霞,郭东起,侯旭杰,等.新疆慕萨莱思自然发酵过程中酵母菌表型多样性及优势菌分析[J].食品科学,2012,33(7):142-147
[8] 张志龙,韩舜愈,祝霞,等.武威地区‘黑比诺’干红葡萄酒挥发性香气成分分析[J].甘肃农业大学学报,2014,49(5):164-170
[9] 焦红茹.不同酿酒葡萄品种相关酵母菌的分离及分类鉴定[D].杨凌:西北农林科技大学,2008
[10] Trollope K.Investigation of resveratrol production by genetically engineered Saccharomyces cerevisiae strains [D].Stellenbosch:Stellenbosch University,2006
[11] Fleet G H.Wine yeasts for the future[J].FEMS Yeast Res,2008,8(7):979-995
[12] 田英华,刘晓兰,邓永平.果胶酶高产菌Aspergillus nigerHYA4的选育[J].齐齐哈尔大学学报,2005(1):12-14
[13] 杨辉,石振海,代春吉.苹果渣固体发酵生产果胶酶的研究[J].陕西科技大学学报,2003(4):1-5
[14] Orilic S,Vojvoda T,Babic K H,et al.Diversity and oenological characterization of indigenous Saccharomyces cerevisiae associated[J].World J Microbio Biotechnol,2010,26(8):1483-1489
[15] Strauss M L A,Jolly N P,Lambrechts M G,et al.Screening for the production of extracellular hydrolytic enzymes by non-Saccharomyces wine yeasts[J].Journal of Applied Microbiology,2001,91(1):182-190
[16] Benedictis M D,Bleve G,Grieco F,et al..An optimized procedure for the enological selection of non-Saccharomyces startercultures[J].Antonie van Leeuwenhoek,2010,99(99):189-200
[17] 王薇,张琇.果胶酶产生菌的分离及其产酶条件研究[J].安徽农业科学,2011,39(19):11944-11946
[18] 华宝玉,林娟,严芬,等.产果胶酶菌株的筛选鉴定及其产酶条件的研究[J].福州大学学报:自然科学版,2012(3):412-417
[19] 张浩森,缪静,余晓斌.果胶酶高产菌株的筛选及产酶条件的研究[J].生物学杂志,2008(1):28-30
[20] 李瑜.腐烂苹果中产果胶酶菌株的分离及产酶条件的优化[D].杨凌:西北农林科技大学,2009
(责任编辑 赵晓倩)
Screening of high pectinase-producing yeast strain and optimization of its fermentation condition
JIA Lan-lan,CHENG Chao,WANG Jin-xing,WANG Fa-liang,WANG Jing
(College of Food Science and Engineering,Gansu Key Lab of Viticulture and Enology,Lanzhou 730070,China)
【Objective】 In order to screen higher pectinaseproducing yeast strain to improve the quality of wine.【Method】 The MQFEC-2 strain with a higher enzyme activity was selected through primary and secondary screening from 156 wild yeast strains,its fermentation condition was optimized by single factor and orthogonal tests.【Result】 The highest enzyme activity with 35.85 U/mL was obtained when the initial pH value of fermentation medium was 5.0,fermentation temperature was 30 ℃,inoculum amount was 6% and fermentation time was 72 h.The order of importance of factors on enzyme activity was as follows: fermentation temperature,initial media pH value,fermentation time and inoculum amount.
pectinase;yeast strain;screening;fermentation condition
贾兰兰(1991-),女,本科生,研究方向为生物工程.E-mail:jiall11@homelink.com.cn
王婧,女,副教授,博士,硕士生导师,研究方向为食品安全及发酵微生物.E-mail:wangjing@gsau.edu.cn
2014年甘肃农业大学SRTP科研训练计划(20141017).
2015-09-01;
2015-12-02
TS 261.1+1
A
1003-4315(2016)05-0154-07
——α-葡萄糖醛酸酶的研究进展*

