‘荷斯坦奶牛’产后期乳汁差异蛋白质组学研究
刘姗姗,陶金忠,赵国顺,赵兴绪,杨永新
(1.甘肃农业大学生命科学技术学院,甘肃 兰州 730070;2.宁夏大学农学院,宁夏 银川 750021;3.天水市动物疫病预防控制中心,甘肃 天水 741000;4.甘肃农业大学动物医学院,甘肃兰州 730070;5.安徽农科院畜牧兽医研究所,安徽 合肥 230031)
‘荷斯坦奶牛’产后期乳汁差异蛋白质组学研究
刘姗姗1,陶金忠2,赵国顺3,赵兴绪4,杨永新5
(1.甘肃农业大学生命科学技术学院,甘肃 兰州 730070;2.宁夏大学农学院,宁夏 银川 750021;3.天水市动物疫病预防控制中心,甘肃 天水 741000;4.甘肃农业大学动物医学院,甘肃兰州 730070;5.安徽农科院畜牧兽医研究所,安徽 合肥 230031)
【目的】 为了比较‘荷斯坦奶牛’产后期乳汁中蛋白质组表达的差异.【方法】 应用双向电泳(2-DE)技术构建荷斯坦奶牛分娩当天,分娩后7 d,分娩后15 d,分娩后28 d和分娩后35 d乳汁二维凝胶电泳图谱,凝胶经考马斯亮蓝染色后,以3倍以上的表达变化用PDQuest 8.0分析.【结果】 在这5个不同的时期共发现了8种差异蛋白,经MADIL-TOF-TOF串联质谱法分析发现这8种蛋白分别是:α-S2酪蛋白前体、β-酪蛋白、κ-酪蛋白前体、免疫球蛋白重链前体、白蛋白、血清白蛋白前体、cGMP磷酸二酯酶的α亚基、角蛋白I型细胞骨架10.【结论】 根据这几种蛋白质的已有文献研究和蛋白含量在不同时期的变化趋势,表明这些蛋白可能与初乳的被动免疫、物质运输和泌乳有关.
荷斯坦奶牛;产后期;乳汁;蛋白质组
奶牛生产后的能量需求会随着泌乳的变化而出现相应的变化,以适应泌乳的需求[1].随着犊牛的生长,所需的营养物质也会发生变化,牛奶中的营养物质也会发生改变.蛋白质是牛奶中最主要的营养物质.通过比较犊牛生长初期,牛奶中蛋白的变化不仅对于了解母牛的生理变化有帮助,而且还可以帮助我们了解犊牛的营养需求.蛋白质组学不仅能够呈现完整的蛋白质图谱还能够发现不同时期中差异表达的蛋白质.Senda等[2]利用双向电泳技术研究了荷斯坦奶牛分娩后10 d内乳清蛋白质组的变化,结果发现乳清蛋白、酪蛋白和免疫球蛋白在产后期乳汁中的含量发生较大的变化,且大多数含量较小的乳清蛋白在牛初乳中与新生犊牛的被动免疫有关,其中一些蛋白对牛犊的营养补充很重要.Zhang等[3]运用蛋白质组学技术对分娩后9 d内7个时间点的乳样蛋白质组进行分析,结果发现有三分之一的蛋白质的含量随着时间的延长而减少,免疫球蛋白甚至达到40倍.杨永新等[4]也做了牛初乳和常乳差异蛋白质组学研究,发现了一些差异蛋白,但是目前还没有关于产后期较长时间,多时间点的乳汁蛋白质组的研究,因此,本研究拟通过比较奶牛产后期乳汁蛋白质差异变化,以期为奶牛产后生理变化和犊牛的饲养管理的研究奠定一定基础.
1 材料与方法
1.1 仪器及试剂
17 cm线性固相化梯度胶条(PH4-7)Bio-Rad公司产品;尿素、四甲基乙二胺(TEMED)、过硫酸胺(Ap)、碘乙酰胺、考马斯亮蓝 G-250、二硫苏糖醇(DTT)和溴酚蓝为Sigma公司产品;CHAPS、矿物油、十二烷基硫酸钠(SDS)和低熔点琼脂糖为Amresco公司产品;三(羟甲基)氨基甲烷(Tris base)和甘氨酸为NOVON公司产品;30%丙烯酰胺/甲叉双丙烯酰胺溶液(29∶1)和Tris-HCl(pH 8.8)为生工生物工程(上海)股份有限公司产品;其余药品均为国产分析纯试剂.
PROTEAN IEF Cell等电聚焦系统、PROTEAN Ⅱ xi凝胶电泳系统、PDQUest 8.0图像分析软件系统为Bio-Rad公司产品,5417R高速低温离心机为Eppendorf公司产品,U2800紫外可见分光光度计为HITACHI公司产品,扫描仪为台湾UMAX公司产品.
1.2 试验方法
1.2.1 样品采集 在宁夏银川某奶牛场分别于分娩当天,分娩后7 d,分娩后15 d,分娩后28 d,分娩后35 d采集奶牛的乳样.对每管样品编号分组,低温带回实验室后-80 ℃保存.
1.2.2 蛋白预处理 奶牛分娩后不同时期的乳样按分娩后天数不同分为5组,每组分别随机抽取4管.同一组的乳样冰上溶解后每管分别吸取4 mL混合.然后3 000×g,离心15 min,弃去上层脂肪.用乙酸调pH至4.6沉淀酪蛋白[5],11 400×g,离心30 min取上清.100 μL每管分装,按组别标记,将分娩当天,分娩后7 d,分娩后15 d,分娩后28 d,分娩后35 d的血浆分别标记为Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ,-80 ℃保存.Bradford法定量.
1.2.3 双向电泳 每组样品蛋白上样量为300 μg,与上样缓冲液混合后,4 ℃ 10 000×g/min,离心10 min,吸上清进行等电聚焦,设置等电聚焦程序:50 V,15 h(主动水化);250 V(线性),1 h;1 000 V(线性),1 h;10 000 V(线性),6 h;10 000 V(线性),8 h; 500 V(快速),任意时间.分别用5 mL的胶条平衡缓冲A液和5 mL的胶条平衡缓冲B液平衡14 min.然后用12% SDS-PAGE凝胶电泳分离蛋白,设置电泳程序:50 V,30 min;然后调至200 V,待溴酚蓝至玻璃板底部停止电泳.
1.2.4 染色与图像分析 凝胶用考马斯亮蓝染色后,用去离子水脱色至背景干净,用扫描仪扫描.用PDQuest 8.0软件以蛋白表达谱上的蛋白点表达量3倍以上的变化为标准进行差异分析,检测差异蛋白点,并根据差异蛋白点3次重复的平均值绘制不同时期差异蛋白点的变化趋势.
1.2.5 质谱检测 切取差异蛋白点,由上海中科新生命生物科技有限公司完成差异蛋白点的测序.步骤如下:将差异蛋白点脱色和胰酶消化后,用MALDI-TOF/TOF-MS分析,用Mascot软件搜索NCBInr蛋白质数据库,根据protein score CI% >95%和样品的物种判定差异蛋白种类.
2 结果与分析
2.1 双向电泳结果分析
每组样品进行3次重复,经PDQuest 8.0软件分析.根据蛋白点表达量3倍以上变化标准及蛋白点在3次试验中的重复性,共筛选出28个蛋白差异点见图1.这些蛋白差异点在发情及配种后不同时期的测值变化趋势见图2.
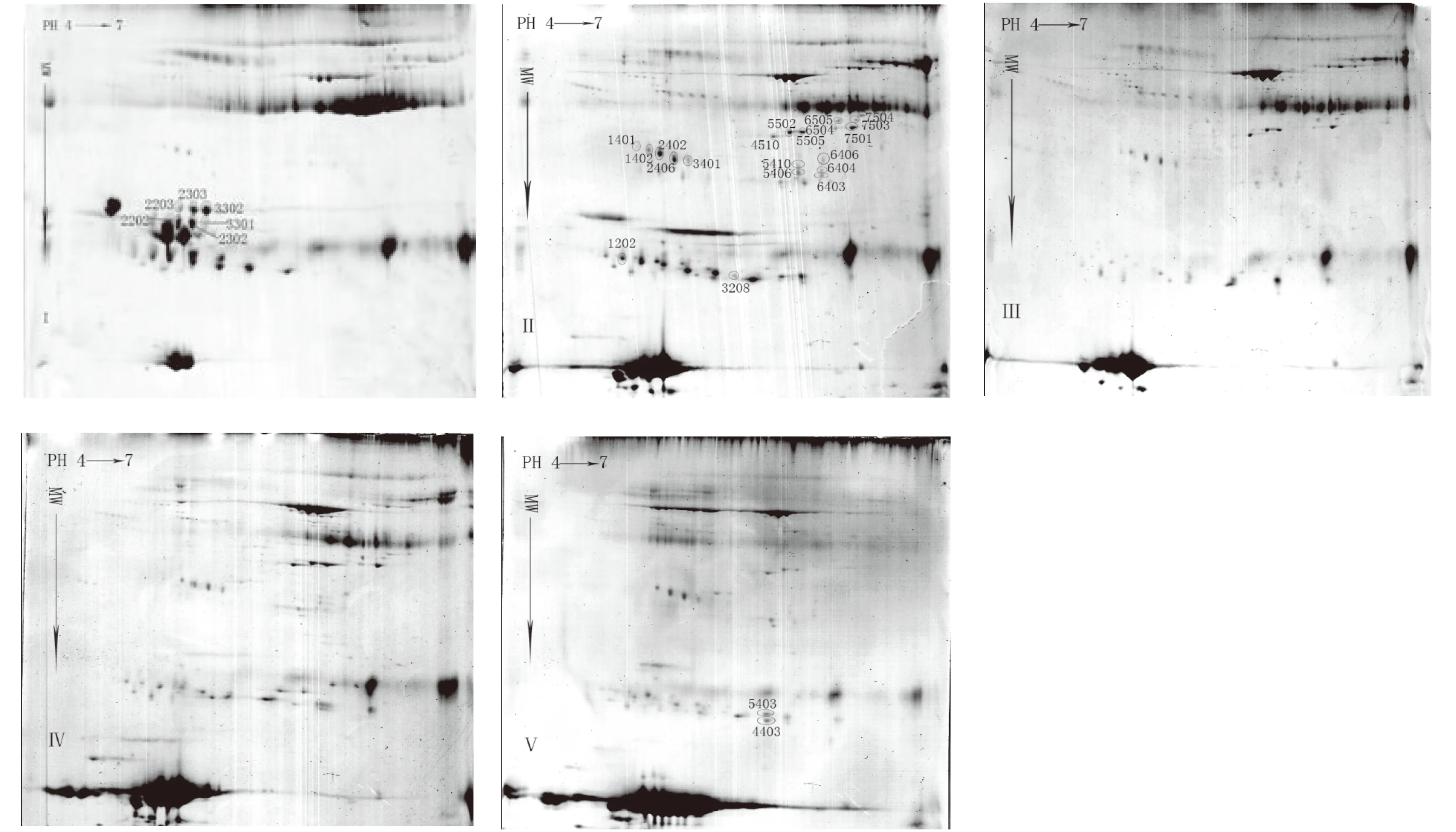
Ⅰ:‘荷斯坦奶牛’分娩当天乳汁双向电泳图谱;Ⅱ:‘荷斯坦奶牛’分娩后第7 d乳汁双向电泳图谱;Ⅲ:‘荷斯坦奶牛’分娩后第15 d乳汁双向电泳图谱;Ⅳ:‘荷斯坦奶牛’分娩后第28 d乳汁双向电泳图谱;Ⅴ:‘荷斯坦奶牛’分娩后第35 d乳汁双向电泳图谱;蛋白编号由PDQuest 8.0软件自动生成.图1 ‘荷斯坦奶牛’产后不同时期乳样双向电泳图谱Fig.1 2-DE gel profile of milk from Holstein cows in different period after delivery
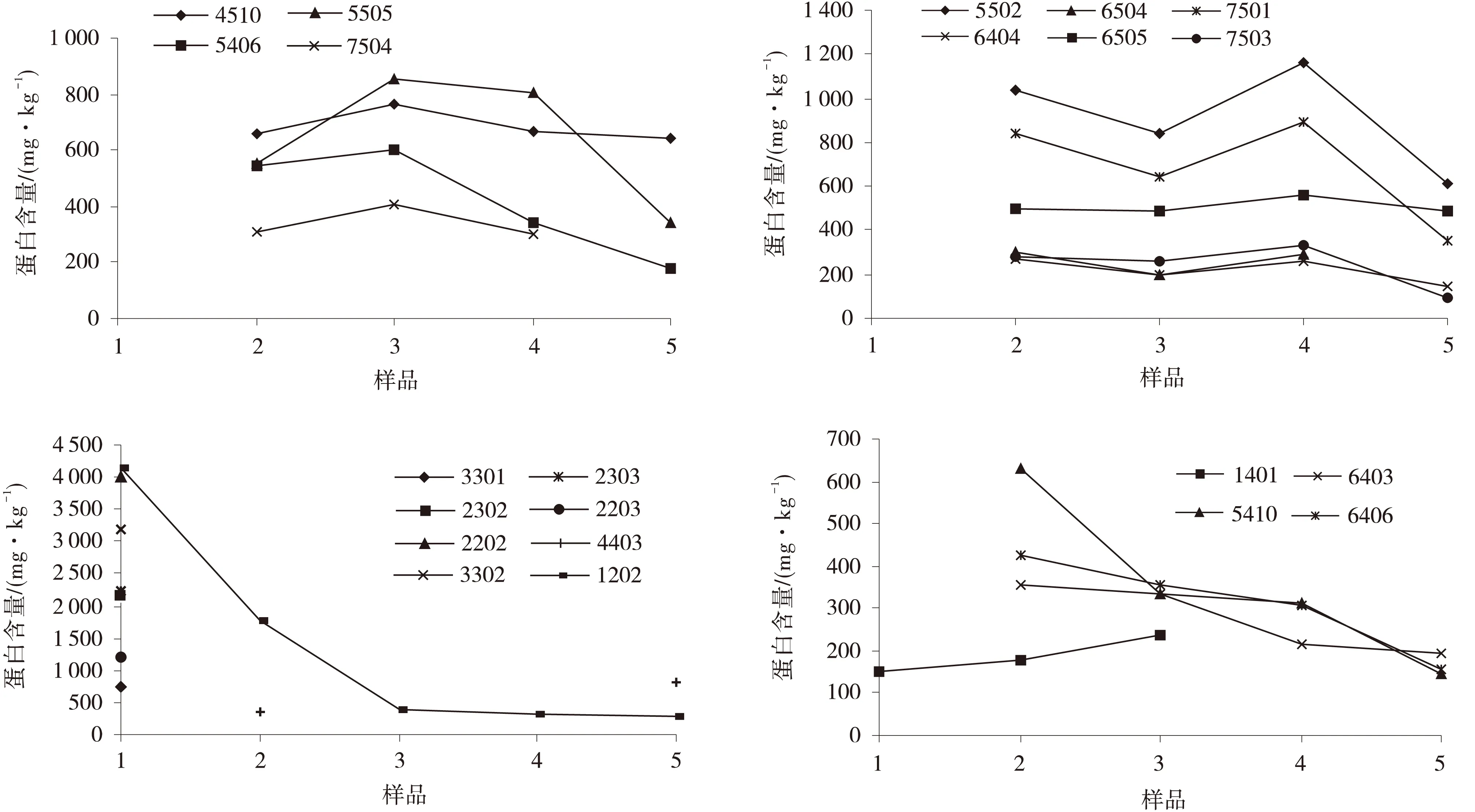
图2 ‘荷斯坦奶牛’分娩后不同时期乳样差异蛋白点测值变化趋势Fig.2 The variation tendency of the differential proteins from Holstein cows’ milk in different periods after delivery
2.2 质谱分析结果
质谱分析结果见表1.差异点1402,2402,3208,5403,3401,2406未鉴定成功.4510、5505为血清白蛋白前体(serum albumin precursor(Bostaurus)),5502、6505、7501、7503为白蛋白(albumin(Bostaurus)),5406、5410、6403、6404和6406为免疫球蛋白重链前体(Ig heavy chain precursor(B/MT.4A.17.H5.A5)-bovine),2202、2203、2302、2303、3301和3302为α-S2酪蛋白前体(alpha-s2-like casein precursor(Bostaurus)),4403为β-酪蛋白(beta-casein(Bostaurus)),1202为κ-酪蛋白前体(kappa-casein precursor(Bostaurus)),7504为cGMP的磷酸二酯酶α亚基(cGMP phosphodiesterase alpha subunit(PDE)(EC3.1.4.17)(Bostaurus)),1401和6504为角蛋白I型细胞骨架10 (Keratin,type I cytoskeletal10).

表1 ‘荷斯坦奶牛’分娩后不同时期乳样差异蛋白点的MALDI-TOF-TOF质谱鉴定
α-S2酪蛋白前体只在分娩当天乳样中检测到,β-酪蛋白在分娩后7 d和分娩后35 d检测到,且在分娩后35 d的表达量比分娩后7天高,κ-酪蛋白前体在分娩当天表达量最高,之后表达量快速下降,在分娩后15 d至分娩后35 d表达量平稳.免疫球蛋白重链前体存在于分娩后分娩后7 d,分娩后15 d,分娩后28 d,分娩后35 d的乳样中存在,且表现出下降的趋势,在分娩后35 d的乳样中表达量最低.白蛋白在产后期7 d到28 d的表达量基本保持不变,但在产后28 d到35 d过程中慢慢降低,在分娩后35 d的表达量最低.cGMP磷酸二酯酶的α亚基在分娩后7 d,分娩后15 d,分娩后28 d的表达量呈先上升后下降的趋势,角蛋白I型细胞骨架10在分娩当天到分娩后28 d表达量的变化趋势平稳.
3 讨论
3.1 α-S2酪蛋白前体、β-酪蛋白、κ-酪蛋白前体
酪蛋白是组成大多数哺乳动物乳汁的主要蛋白成分,主要包括4种蛋白质:α-S1-酪蛋白,α-S2-酪蛋白,β-酪蛋白和κ-酪蛋白.在试验过程中,分娩当天乳样即牛初乳经过3 000×g/min,离心15 min,弃去上层脂肪.用酸度计调pH至4.6沉淀酪蛋白,11 400×g/min,离心30 min取上清处理后,仍然为乳白色液体,而其他时期的乳样通过相同方法处理后为淡黄色澄清液体.由此表明初乳中酪蛋白的含量显著高于其他时期乳样中的含量,用此方法不能彻底去除.由于酪蛋白,白蛋白在初乳中含量较高,掩盖了其他低丰度蛋白,因此本试验中在分娩当天的乳样中主要检测到了α-S2酪蛋白前体和κ-酪蛋白前体这两种差异蛋白.本实验发现α-S2酪蛋白前体只在分娩当天乳样中检测到,β-酪蛋白只在分娩后7 d和35 d检测到,且在分娩后35 d的表达量比分娩后7 d高,而Yamada等[6]利用免疫吸附技术结合双向电泳、微测序和质谱对牛初乳和产后50 d的成熟乳的低丰度蛋白进行差异蛋白质组学研究,结果发现在哺乳期β-酪蛋白片段的水平显著增加.Visker等[7]检测牛的新多态性β-酪蛋白(β-CN)基因,发现β-酪蛋白变体I显著与蛋白比例,蛋白产量,α-s1-酪蛋白、α-s2-酪蛋白、κ-酪蛋白、α-乳白蛋白、β-乳球蛋白、酪蛋白指数和酪蛋白产量相关.本研究发现κ-酪蛋白前体在分娩当天表达量最高,之后表达量快速下降,在分娩后15 d到35 d表达量平稳.人乳腺组织中的κ-酪蛋白mRNA的含量在它的功能分化过程中增加,而催乳素可能调节κ-酪蛋白mRNA的产生[8].这3种酪蛋白含量的变化到底是与试验处理的方法有关,还是机体自身的机理使然还有待研究.
3.2 免疫球蛋白重链前体
牛初乳具有很高的营养价值和生理功能,研究发现牛初乳中IgG,IgA和IgM的水平较常乳中高[9],它们具有结合抗原、活化补体、中和毒素等诸多生理功能,能够为新生犊牛提供被动免疫保护,增强新生仔畜抗感染能力和维持正常的生长发育[4].在一些物种(人类,兔子等)中,母体的免疫球蛋白从子宫内跨胎盘或卵黄囊膜转运至胎儿血液;而在其它物种,包括反刍动物,母体的免疫球蛋白则通过初乳转运到新生儿[10].毛永江等[11]对7头中国‘荷斯坦奶牛’泌乳早期乳蛋白组分相对质量分数的检测,结果发现免疫球蛋白的含量在产犊后1 h最高,至第5天时接近常乳水平.杨永新等[4]研究发现奶牛初乳中的IgG是常乳的50~100倍,为最主要的免疫球蛋白.Zhang等[3]运用蛋白质组学技术对分娩后9 d内7个时间点的初乳和成熟乳的蛋白质组变化进行分析.结果发现所定量三分之一的蛋白质含量在产犊后9 d较第1天相比都有所下降,特别是免疫球蛋白高达40倍.Zhang等[12]运用2-DE结合LC-MS-MS技术研究奶牛产后1、3、7、21 d中奶牛乳清蛋白质的变化,结果也发现IgG表达量逐渐下降.
本试验中免疫球蛋白重链前体蛋白点在分娩当天的乳样的双向电泳图中不存在,但是存在于分娩后分娩后7、15、28、35 d的乳样中,且总体表现为一种下降的趋势.这与其他学者的研究有所差别,这可能是因为初乳中酪蛋白、免疫球蛋白和白蛋白浓度过高,聚集阻塞凝胶孔隙,造成免疫球蛋白重链前体不能在第二项SDS-PAGE中向下迁移.
3.3 血清白蛋白前体和白蛋白
白蛋白是由肝实质细胞合成,是血浆中含量最为丰富的蛋白,白蛋白是血浆中的主要的载体物质,能与体内许多难溶性的小分子有机物及其他生物活性物质可逆地结合.Zhang[12]等比较1、3、7、21 d中奶牛乳清蛋白质的变化.结果发现白蛋白含量在产后1-7 d没有变化,而在产后7开始下降.
本试验中血清白蛋白前体在分娩后7-28 d表达量基本保持不变,但在产后28 d到35 d过程中慢慢降低,在分娩后35 d的表达量最低.在分娩当天并未检出白蛋白,这可能是由于初乳中高丰度蛋白浓度过高,特别是酪蛋白浓度较高,不能通过等电点沉淀法完全去除,所以阻碍了其他蛋白在SDS-PAGE中的迁移,这可能是造成未在分娩当天的乳样中检测到白蛋白和血清白蛋白前体的原因.
白蛋白作为一种转运蛋白,在奶牛泌乳的初期阶段其含量较高可能与犊牛生长发育需要较多的营养物质有关,白蛋白需要运输这些物质进入乳中,以发挥增强免疫和促生长发育的功能[13].而为何在产后28-35 d其含量逐渐下降还有待进一步研究.
3.4 cGMP的磷酸二酯酶α亚基
环磷酸腺苷cAMP和环鸟苷酸cGMP是具有细胞内信息传递作用的小分子,被称为细胞内第二信使,主要作用于信号级联反应下游元件:蛋白激酶G、cGMP依赖性磷酸二酯酶及cGMP门控离子通道,参与血管舒缩、神经信号传递、抑制血小板凝集及细胞增殖与调亡等调节[13].cAMP和cGMP的细胞内的浓度水平由膜上的腺苷环化酶的合成和磷酸二酯酶的降解共同调控.磷酸二酯酶PDEs可将cAMP、cGMP水解为无活力的5′-AMP和5′-GMP,从而调控机体多种生理病理过程.PDEs由11种各具特性的同工酶家族组成,该家族参与大量的生理学过程,包括心肌收缩、神经退行性病变、细胞凋亡、脂肪生成、糖原分解和糖异生作用等.因此,PDE具有成为多种疾病治疗靶点的潜力,包括抑郁、哮喘、炎症与勃起功能障碍等[14].不过PDEs调控机体生理活动的具体机制仍不明确[15].
磷酸二酯酶家族的各亚型因水解能力的不同,PDE4、7、8主要特异性水解cAMP,PDE5、6、9特异性水解cGMP,而PDE1、2、3、10、11则对cAMP和cGMP均起作用[16].PDE3抑制剂ORG9935可以阻止卵母细胞中cAMP的降解,防止灵长类动物怀孕.cGMP是PDE3A的生理抑制剂,产生于卵丘细胞,并通过间隙连接进入卵母细胞.针对性的抑制PDE5可以减少抑制卵母细胞体外成熟所需要的ORG9935的剂量.因此,结合PDE抑制剂可能有避孕的潜力[17].PDE5存在于大鼠子宫壁,在整个孕期PDE5蛋白表达没有变化.本试验中cGMP磷酸二酯酶的α亚基在分娩后7、15、28 d的表达量呈先上升后下降的趋势,在分娩后当天和35 d都没有检测到cGMP磷酸二酯酶.目前国内外没有研究关于cGMP磷酸二酯酶与犊牛生长发育相关的报道,其还有待进一步研究.
3.5 角蛋白I型细胞骨架10
角蛋白是皮肤、毛发和指甲等组织的重要组成成分,而Han等[18]对妊娠30~50 d的奶牛和非妊娠奶牛的乳汁进行研究,发现上皮角蛋白10为妊娠特异性蛋白.目前还没有更多关于角蛋白10和生殖的研究.不过,Bartek等[19]研究发现在成年人的乳腺大部分的腔上皮细胞表达角蛋白19(K19 +),而乳腺上皮细胞的功能与数量很大程度的决定了泌乳奶牛的生产性能[20],而角蛋白19缺失的细胞(K19-)似乎具有高增殖潜能,具有比K19 +细胞低的分泌活性,K19-管腔细胞少分化,并且可能是K19+管腔细胞的前体.K19 +管腔细胞代表完全分化的表型,能响应激素的刺激产生牛奶[19].
本试验中角蛋白I型细胞骨架10在分娩当天到分娩后28 d表达量的变化趋势平稳,目前国内外对角蛋白角蛋白I型细胞骨架10的功能的研究报道较少,根据对角蛋白19的研究,推测其可能与激素刺激产生牛奶有关,不过还有待进一步研究.
4 结论
利用双向电泳结合质谱技术在荷斯坦奶牛分娩当天,分娩后7、15、28、35 d的乳汁中共发现28个差异蛋白点,检测出8种蛋白.分别是:α-S2酪蛋白前体、β-酪蛋白、κ-酪蛋白前体、免疫球蛋白重链前体、血清白蛋白前体、白蛋白、cGMP磷酸二酯酶的α亚基和角蛋白I型细胞骨架10.角蛋白I型细胞骨架10可能与牛奶分泌有关,其他蛋白的发现对于产后母牛的生理变化和犊牛的生长管理提供一定的理论基础.
[1] 黄云飞,侯小露,杜玉兰,等.奶牛产后部分血液指标的动态监测及相关分析[J].南方农业学报,2014,45(6):1094-1097
[2] Zhang L,Boeren S,Hageman J A,et al.Bovine milk proteome in the first 9 days:protein interactions in maturation of the immune and digestive system of the newborn[J].PloS one,2015,10(2):e0116710
[3] Senda A,Fukuda K,Ishii T,et al.Changes in the bovine whey proteome during the early lactation period[J].Animal Science Journal,2011,82(5):698-706
[4] 杨永新,王加启,卜登攀,等.奶牛初乳与常乳乳蛋白变化的比较蛋白质组学研究[J].中国农业大学学报,2010,15(2):47-52
[5] Mier M,Ibanez ROrtiz I.Influence of process variables on the production of bovine milk casein by electrodialysis with bipolar membranes[J].Biochemical Engineering Journal,2008,40(2):304-311
[6] Yamada M,Murakami K,Wallingford J C,et al.Identification of low-abundance proteins of bovine colostral and mature milk using two-dimensional electrophoresis followed by microsequencing and mass spectrometry[J].Electrophoresis,2002,23(7-8):1153-1160
[7] Visker M,Dibbits B,Kinders S,et al.Association of bovineβ-casein protein variant I with milk production and milk protein composition[J].Animal genetics,2011,42(2):212-218
[8] Nakhasi H,Grantham F,Gullino P.Expression of kappa-casein in normal and neoplastic rat mammary gland is under the control of prolactin[J].Journal of Biological Chemistry,1984,259(23):14894-14898
[9] Smolenski G,Haines S,Kwan F Y-S,et al.Characterisation of host defence proteins in milk using a proteomic approach[J].Journal of Proteome Research,2007,6(1):207-215
[10] Larson B,Heary H,Devery J.Immunoglobulin production and transport by the mammary gland[J].Journal of Dairy Science,1980,63(4):665-671
[11] 毛永江,杨章平,王杏龙,等.中国荷斯坦牛泌乳早期乳常规成分及乳蛋白组分变化规律的研究[J].中国乳品工业,2004,32(8):3-6
[12] Zhang L Y,Wang J Q,Yang Y X,et al.Comparative proteomic analysis of changes in the bovine whey proteome during the transition from colostrum to milk[J].Asian-Australasian Journal of Animal Sciences,2011,24(2):272-278
[13] 王正朝,潘晓燕,庞训胜.哺乳动物可溶性鸟苷酸环化酶的表达及其调控[J].医学分子生物学杂志,2006,3(5):379-382
[14] 王晨泉,李运曼,马晓慧.磷酸二酯酶与疾病相关的药理学研究进展[J].医学综述,2011,17(18):2806-2808
[15] 陈昌亮,黄爽.磷酸二酯酶及其抑制剂的研究进展[J].中国药理学通报,2014,30(2):283-286
[16] 张莉,杜冠华.磷酸二酯酶 7,一个新的抗炎免疫药物靶点研究进展[J].中国药理学通报,2009,25(1):1-4
[17] Hanna C B,Yao S,Jensen J T.Combination phosphodiesterase (PDE) inhibition:a novel approach to non-hormonal female contraception[J].Fertility and Sterility,2012,98(3):S6
[18] Han R,Kim H-R,Naruse K,et al.Identification of bovine pregnancy-specific milk proteins using proteomics[J].Biology of Reproduction,2008,78(1 Supplement):143
[19] Bartek J,Bartkova J,Taylor-Papadimitriou J.Keratin 19 expression in the adult and developing human mammary gland[J].The Histochemical Journal,1990,22(10):537-544
[20] 高海娜,韩荣伟,郑楠,等.赖氨酸对原代奶牛乳腺上皮细胞中酪蛋白及mTOR信号通路相关基因表达的影响[J].甘肃农业大学学报,2015,50(3):7-15
(责任编辑 李辛)
Differential proteomic analysis of milk in the postpartum period of Holstein cows
LIU Shan-shan1,TAO Jin-zhong2,ZHAO Guo-shun3,ZHAO Xing-xu4,YANG Yong-xin5
(1.College of Life Science and Technology,Gansu Agricultural University,Lanzhou 730070,China;2.College of Agonomy, Ningxia University,Yinchuan 750021,China;3.Tianshui Centre for Animal Disease Control and Prevention,Tianshui 741000,China;4.College of Veterinary Medicine,Gansu Agricultural University,Lanzhou 730070,China; 5.Institute of Animal Science,Anhui Academy of Agricultural Sciences,Hefei 230031,China)
【Objective】 To compare the difference in proteome expression of milk among Holstein cows in the postpartum period.【Method】 The map of 0,7,15,28,35 days after delivery were performed using two-dimensional gel electrophoresis (2-DE) method.Differential protein spots were detected by PDQuest 8.0 software after staining with commassie blue.【Result】 These spots were identified by MALDI-TOF/TOF-MS and eight differential proteins were found,which were alpha-s2-like casein precursor,beta-casein,kappa-casein precursor,immunoglobulin heavy chain precursor (B/MT.4A.17.H5.A5)-bovine,albumin,serum albumin precursor,cGMP phosphodiesterase alpha subunit and keratin I cytoskeletal 10.【Conclusion】 According to reference research on the proteins and the changing trend of protein content in different period,these proteins may be related to the passive immunization of colostrums,material transport and lactation.
Holstein cows;postpartum;milk;proteome
刘姗姗(1989-),女,硕士研究生,主要从事发育生物学、蛋白质组学的研究.E-mail:liushanshan0214@163.com
陶金忠,男,博士,副教授,主要从事动物生殖生理、动物繁殖障碍研究和蛋白组学研究.E-mail:tao_jz@nxu.edu.cn
国家自然科学基金项目(31160523).
2015-06-29;
2016-04-18
S 823.9+1
A
1003-4315(2016)05-0007-07

