单管多重RT-PCR同时检测大豆种子中三种检疫性植物病毒
易汪雪, 宋绍祎, 吴东妮, 代欢欢, 杨翠云, 于 翠*
(1. 上海出入境检验检疫局动植物与食品检验检疫技术中心, 上海 200135; 2. 中国科学院上海生命科学研究院, 上海生命科学信息中心, 上海 200031; 3. 合肥师范学院, 合肥 230601)

实验方法与技术ExperimentalMethod&Technology
单管多重RT-PCR同时检测大豆种子中三种检疫性植物病毒
易汪雪1, 宋绍祎1, 吴东妮2, 代欢欢3, 杨翠云1, 于 翠1*
(1. 上海出入境检验检疫局动植物与食品检验检疫技术中心, 上海 200135; 2. 中国科学院上海生命科学研究院, 上海生命科学信息中心, 上海 200031; 3. 合肥师范学院, 合肥 230601)
我国大豆年进口量持续增长,快速、准确地检测进境大豆种子中可能携带的病原物是防止检疫性有害生物入境传播和扩散的有效手段。菜豆荚斑驳病毒(BPMV)、烟草环斑病毒(TRSV)和番茄环斑病毒(ToRSV)均是被大豆种子携带的检疫性有害生物。本研究建立了在单一PCR管中同时检测这3种检疫性植物病毒及大豆内源基因Bd-30 K的多重RT-PCR方法。研究结果表明,所建立的多重RT-PCR方法具有较好的特异性和灵敏度,检测含BPMV、TRSV和ToRSV RNA的最低浓度分别为0.45、0.0093和0.004 ng/μL,从大豆种子中同时检测3种病毒的最低RNA浓度为0.58 ng/μL。
菜豆荚斑驳病毒; 烟草环斑病毒; 番茄环斑病毒; 多重RT-PCR; 同时检测
RT-PCR技术是当前口岸检疫性病毒检测的重要手段之一,具有准确、快速、灵敏、操作简单和经济实用等优点。尽管已有利用多重PCR技术对数种植物病毒同时检测的研究报道[4-6],但这些研究所用的试验样品多为感病叶片材料,在国内尚未见直接从大豆种子中同时检测多种检疫性植物病毒的报道。为了应对国际贸易中快速、准确地对多种检疫性植物病毒同时检测的需要,我们开展了从大豆种子中同时检测BPMV、TRSV和ToRSV的检测方法研究,同时为控制整个试验过程,我们设置了大豆内源基因Bd 30K作为内控对照。本文报道单管多重RT-PCR同时检测这3种检疫性植物病毒的方法。
1 材料和方法
1.1 供试材料
带有BPMV的大豆由上海出入境检验检疫局口岸截获。TRSV和ToRSV毒源由实验室保存,在隔离检疫温室中将两种病毒分别接种大豆幼叶,待其结籽后获得。南方菜豆花叶病毒(Southernbeanmosaicvirus,SBMV)和花生矮化病毒(Peanutstuntvirus,PSV)作为特异性对照,购自Agdia公司,于实验室-20 ℃冰箱保存。
1.2 引物的设计
根据GenBank发表的TRSV(GenBank登录号:AF461163,AY363727,AY787756,L09205,NC-005096)和ToRSV(GenBank登录号:AF135407,AB451183,FJ577795,EF370299和NC-003839)CP基因的序列保守区分别设计特异性引物,BPMV和大豆内源基因Bd 30K的引物按照文献[7-8],均由上海Invitrogen生物技术有限公司合成。引物的序列及扩增片段的长度见表1。
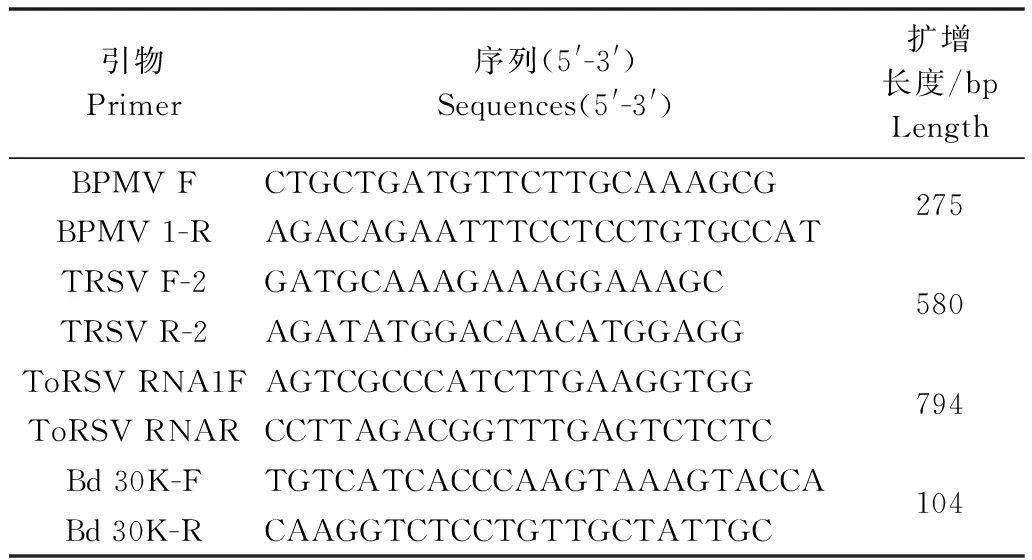
表1 检测BPMV、TRSV、ToRSV和大豆内源基因 Bd 30K的引物序列及扩增长度Table 1 Sequences of primers used for PCR detection of BPMV, TRSV, ToRSV and Bd 30K
1.3 RNA提取
将携带BPMV、TRSV、ToRSV及健康的大豆种子粉碎成大豆粉后,分别称取60 mg,利用Tiangen公司的RNAprep植物总RNA提取试剂盒提取总RNA,用于建立单个病毒及内源基因RT-PCR方法。
准确地表征涂层界面性能是了解界面性质并进而控制和改善最重要的基础之一,但由于界面通常受界面断裂韧性和应力状态等较多因素的影响,迄今为止对涂层界面的结合强度还没有标准的测定方法。可以预料,随着现代测定方法和喷涂设备的改进人们对涂层界面的认识将不断深化,并用于指导和控制界面和材料性能,达到提高界面结合强度的目的,以满足不同使用条件的要求。
分别称取30 mg携带BPMV、TRSV、ToRSV的大豆粉,两两混合后,利用Tiangen公司的RNAprep植物总RNA提取试剂盒提取总RNA,用于建立双重RT-PCR方法。
分别称取20 mg携带BPMV、TRSV、ToRSV的大豆粉,三者混合后,利用Tiangen公司的RNAprep植物总RNA提取试剂盒提取总RNA。用于建立3种病毒的三重RT-PCR方法及3种病毒和大豆内源基因Bd 30K的四重RT-PCR方法。
1.4 cDNA第一链的合成
单一反应cDNA的合成:每种病毒各自进行反转录。反转录体系:2 μL模板RNA、1 μL AMV反转录酶(10 U/μL,Promega)、0.25 μL RNase抑制剂(40 U/μL,Promega)、0.5 μL下游引物(20 μmol/L)、4 μL dNTPs(各2.5 mmol/ L)和5 μL 5×AMV buffer,加水补足25 μL。
双重和多重反应cDNA的合成:提取含混合病毒样本的总RNA,在单一管中进行反转录。反转录体系同单一反应cDNA的合成,但需同时加入合成相应病毒cDNA的下游引物。
1.5 PCR检测
单一PCR检测:分别完成3种病毒和内源基因Bd 30K的PCR检测。PCR检测体系:cDNA 1 μL、10×buffer (含Mg2+) 3 μL、dNTPs (2.5 mmoL/L) 4 μL、上下游引物(20 μmoL/L)各0.25 μL、rTaq0.25 μL,灭菌水补足30 μL。PCR条件:94℃预变性3 min;94℃变性30 s,55℃复性45 s,72℃延伸45 s,35个循环;72℃ 7 min后保存于4℃。
双重和多重PCR:在同一管中完成双重或多重PCR反应。其反应体系和条件基本同单一PCR检测,但在添加引物时,需同时加入扩增相应目的基因的引物,如检测内源基因,其引物浓度为病毒引物浓度的2倍。
1.6 引物的特异性试验
分别提取带有BPMV、TRSV、ToRSV的大豆粉总RNA,侵染大豆的SBMV、PSV阳性对照RNA,及健康大豆种子的总RNA,以BPMV、TRSV、ToRSV及Bd 30K引物分别进行扩增,检测4对引物的特异性。
1.7 PCR检测灵敏度
将分别携带BPMV、TRSV、ToRSV的大豆总RNA和健康的大豆总RNA,利用分光光度计测定总RNA的浓度分别为0.045、0.093、0.004和0.19 μg/μL。将提取的总RNA进行10倍梯度稀释,用于单一病毒RT-PCR灵敏度测定。
将同时含有3种病毒的大豆总RNA(浓度为0.058 μg/μL)进行10倍梯度稀释,用于四重RT-PCR灵敏度测定。
2 结果与分析
2.1 RT-PCR检测的特异性
分别从携带BPMV、TRSV、ToRSV及健康的大
豆种子中提取总RNA进行反转录后,以设计的特异引物对其RT-PCR检测,结果均能扩增出预期大小的DNA条带,而从南方菜豆花叶病毒(图1)、花生矮化病毒、健康大豆中未能扩增到病毒特异条带(图片未显示),表明针对BPMV、TRSV、ToRSV设计的引物特异性好。

图1 BPMV、TRSV、ToRSV和Bd 30K引物特异性的检测Fig.1 Specificity of primers for detection of BPMV, TRSV, ToRSV and Bd 30K in soybean seeds
2.2 双重和多重RT-PCR检测结果
将携带BPMV、TRSV、ToRSV的大豆种子两两混合和三者混合后提取总RNA进行反转录,以相应引物进行双重或多重PCR反应,结果每个双重RT-PCR反应都能扩增到2条预期大小的DNA条带(见图2a),在三重RT-PCR中均能扩增出3条预期大小的DNA条带(见图2b),在四重RT-PCR中能扩增出BPMV、TRSV、ToRSV和内源基因的特异性片段(见图2c)。多重RT-PCR均能扩增出目的片段,为在实践中进行病毒的检测节省了成本和时间,同时以内源基因作为参照,避免了假阴性结果的产生。
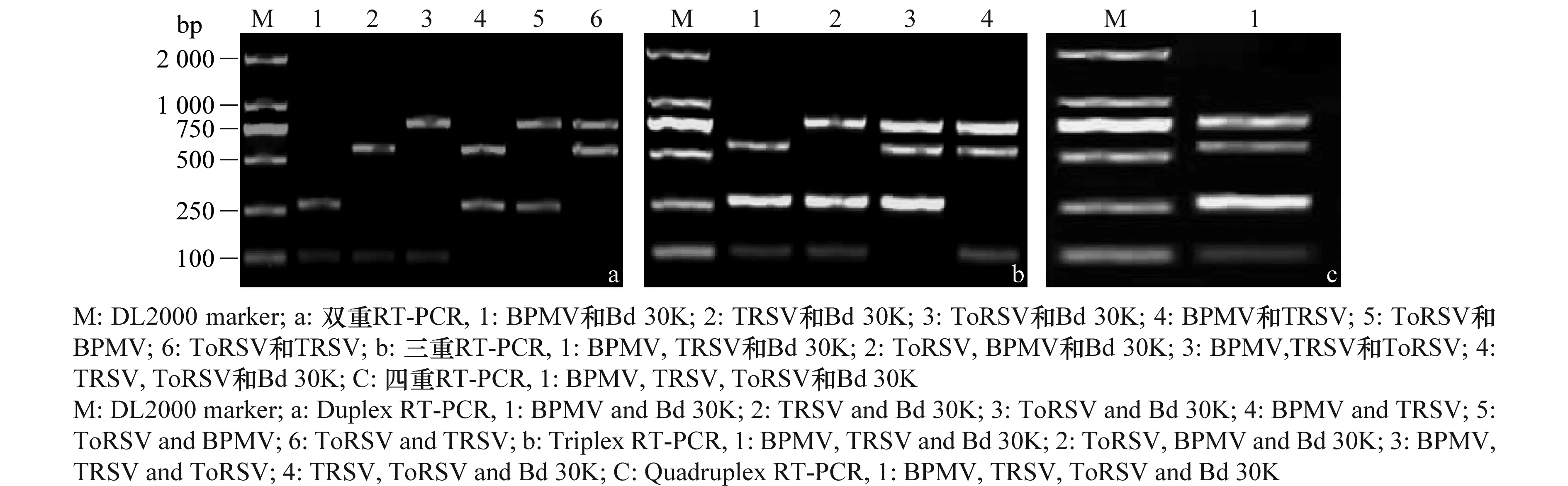
图2 两重、三重和四重RT-PCR的建立Fig.2 Development of multiplex RT-PCR
2.3 单一RT-PCR与多重RT-PCR灵敏度比较
将提取的含单一病毒的RNA、混合病毒RNA及健康大豆RNA按10倍梯度稀释后反转录成cDNA进行单一和多重RT-PCR灵敏度检测。结果表明随着RNA含量的逐渐减少,扩增条带也越来越弱。当含有BPMV、TRSV、ToRSV和Bd 30K的RNA分别稀释至10-2、10-4、10-3和10-2时,条带开始变弱(图3a~d),即单一RT-PCR检测BPMV、TRSV、ToRSV和Bd 30K RNA最低浓度分别是0.45、0.009 3、0.004和1.9 ng/μL。含有3种病毒及大豆内源基因的RNA稀释低于10-2时,则只能扩增TRSV的特异性条带,及多重RT-PCR检测的最低浓度为 0.58 ng/μL(图3e)。

图3 单一RT-PCR和多重RT-PCR检测灵敏度测定Fig.3 Sensitivity of detection for BPMV, TRSV, ToRSV and Bd 30K by single RT-PCR and multiplex RT-PCR
3 讨论
此前针对大豆携带病毒的检测已有较多的分子检测方法研究[9-10],但大多是针对单一病毒研究建立RT-PCR或实时荧光RT-PCR方法。进境大豆主要是以种子的形式入境,所以针对种子建立快速、灵敏的检测方法是既实现快速通关又防止检疫性有害生物传播的有效途径。但由于病毒在种子中的含量很低且分布不均匀,建立多重RT-PCR检测方法需要从RNA提取、引物配对筛选等方面进行优化。同时在对样品的检测过程中,极有可能造成假阴性的结果。因此我们在设计多重RT-PCR试验时,以大豆的一个内源基因作为参照,以保证整个PCR过程正确,防止由于操作失误引起假阴性结果。
尽管多重实时荧光RT-PCR检测的灵敏度更高,在医学检测上也有采用三重以上的实时荧光RT-PCR方法[11-12],此前我们也建立过双重实时荧光RT-PCR方法,灵敏度高[13],操作简便,但如果在此试验中再增加一种病毒,其灵敏度会显著下降。此外,多重实时荧光RT-PCR方法还需在探针上标记不同的荧光集团,费用较高,保存期限短,因此采用多重RT-PCR方法是一种满足口岸实际检测需求的方法。本研究利用4对特异性引物,在一次RT-PCR反应中扩增出病毒BPMV(275 bp)、TRSV(580 bp)、ToRSV(794 bp)及内源基因Bd 30K(104 bp)的特异性片段,建立了BPMV、TRSV、ToRSV、Bd 30K的四重PCR检测方法,结果表明该方法的特异性和灵敏度能达到检测要求,比单项检测减少了70%左右的时间和2/3左右的试剂,对这3种植物病毒的鉴别诊断和混合感染检测具有重要的应用价值。
[1] 廖芳, 郭京泽, 刘鹏,等. RT-PCR和实时荧光RT-PCR一步法检测大豆中菜豆荚斑驳病毒[J]. 植物保护学报, 2009, 36(2):141-145.
[2] 闻伟刚,崔俊霞,盛蕾. 进境大豆种子种烟草环斑病毒的快速检测[J]. 大豆科学, 2007, 26(5):748-751.
[3] 魏梅生. 美国大豆种传病毒简介[J]. 植物检疫, 2003, 17(S1): 13-18.
[4] Ito T, Leki H, Ozaki K.Simultaneous detection of six citrus viroids andApplestemgroovingvirusfrom citrus plants by multiplex reverse transcription polymerase chain reaction [J]. Journal of Virological Methods, 2002, 106(2): 235-239.
[5] Thompson J R, Wetzel S, Klerks M M, et al. Multiplex RT-PCR detection of four aphid-borne strawberry viruses inFragariaspp. in combination with a plant mRNA specific internal control [J]. Journal of Virological Methods, 2003, 111(2): 85-93.
[6] Menzel W, Jelkmann W, Maiss E.Detection of four apple viruses by multiplex RT-PCR assays with complification of plant mRNA as internal control [J]. Journal of Virological Methods, 2002, 99: 81-92.
[7] 闻伟刚, 崔俊霞, 赵秀玲, 等. 半巢式RT-PCR检测进口大豆中菜豆荚斑驳病毒的研究[J]. 植物病理学报, 2006, 36(4): 296-300.
[8] Torp A M, Olesen A, Sten E, et al. Specific, semi-quantitative detection of the soybean allergen Gly m Bd 30K DNA by PCR [J]. Food Control, 2006,17:30-36.
[9] 李彬,吴新华,粟寒,等. 进境美国大豆幼苗中菜豆荚斑驳病毒的检测和鉴定[J].南京农业大学学报,2007,30(2): 139-141.
[10]杨翠云, 于翠, 沈禹飞, 等. 番茄环斑病毒的普通RT-PCR和巢式RT-PCR检测方法[J]. 上海交通大学学报(农业科学版), 2005, 23(4): 396-400.
[11]Templeton K E, Scheltinga S A, Beersma M F C, et al. Rapid and sensitive method using multiplex real-time PCR for diagnosis of infections by influenza A and influenza B viruses, respiratory syncytial virus, and parainfluenza viruses 1, 2, 3, and 4 [J]. Journal of Clinical Microbiology, 2004, 42(4): 1564-1569.
[12]Suwannakarn K, Payungporn S, Chieochansin T, et al. Typing (A/B) and subtyping (H1/H3/H5) of influenza A viruses by multiplex real-time RT-PCR assays [J]. Journal of Virological Methods, 2008, 152(1/2): 25-31.
[13]易汪雪, 陈舜胜, 杨翠云, 等. 单管实时荧光RT-PCR方法同时检测大豆种子中的菜豆荚斑驳病毒和烟草环斑病毒[J]. 植物病理学报, 2011, 41(1): 85-92.
(责任编辑:田 喆)
Simultaneous detection of three quarantine plant viruses from soybean seeds by multiplex RT-PCR in single PCR tube
Yi Wangxue1, Song Shaoyi1, Wu Dongni2, Dai Huanhuan3, Yang Cuiyun1, Yu Cui1
(1. Technical Center for Animal, Plant and Food Inspection and Quarantine, Shanghai Entry-Exit Inspection and Quarantine Bureau, Shanghai 200135, China; 2. Shanghai Information Center for Life Sciences, Shanghai Institutes for Biological Sciences, Chinese Academy of Sciences,Shanghai 200031, China; 3. Hefei Normal College, Hefei 230601, China)
The quantity of soybean seeds imported were continually increased in recent years. Rapid detection of seed-borne pathogens is essential to efficiently prevent pest invading and spreading.Beanpotmosaicvirus(BPMV),Tobaccoringspotvirus(TRSV) andTomatoringspotvirus(ToRSV) are the quarantine pest which could be carried by the soybean seeds. We developed the multiplex RT-PCR approach for simultaneous detection of BPMV, TRSV, ToRSV and one endogenous gene Bd 30K in the single PCR tube from soybean seeds. The results indicated that good specificity and sensitivity for simultaneous detection were obtained. The limit detection of RNA with BPMV, TRSV and ToRSV were 0.45 ng/μL, 0.009 3 ng/μL and 0.004 ng/μL, respectively. The limit detection of RNA with three viruses mixture was 0.58 ng/μL.
Beanpodmottlevirus;Tobaccoringspotvirus;Tomatoringspotvirus; multiplex RT-PCR; simultaneous detection
2015-11-06
2015-12-24
上海市科技兴农重点攻关项目[沪农科攻字(2012)第2-8号];上海出入境检验检疫局科研项目(HK005-2014)
S 435.651,S 432.41
A
10.3969/j.issn.0529-1542.2016.05.019
* 通信作者 E-mail:yuc@shciq.gov.cn

