甘肃省桃果实褐斑病病原鉴定
何苏琴, 白 滨, 文朝慧, 荆卓琼
(1. 甘肃省农业科学院植物保护研究所, 兰州 730070;2. 甘肃省农业科学院农业质量标准与检测技术研究所, 兰州 730070; 3. 甘肃出入境检验检疫局, 兰州 730020)
甘肃省桃果实褐斑病病原鉴定
何苏琴1*, 白 滨2, 文朝慧3, 荆卓琼1
(1. 甘肃省农业科学院植物保护研究所, 兰州 730070;2. 甘肃省农业科学院农业质量标准与检测技术研究所, 兰州 730070; 3. 甘肃出入境检验检疫局, 兰州 730020)
近年来,桃果实褐斑病在甘肃省中部的兰州、临洮等地的桃园中危害严重。在疏于防治的桃园,受害严重的中晚熟桃,病果率超过70%。经病原菌分离培养、柯赫氏法则证病,及病原菌形态学和分子生物学鉴定(GenBank accession number:KT002183),明确其病原为Thyrostromacarpophilum(Lév.) B.Sutton。在罹病桃果实上,病斑圆形,褐色,散生,稍凹陷,直径0.5~1.5 cm,病斑上有时可见环生的黑色粉粒状分生孢子座;病菌分生孢子淡褐色至褐色,聚集时呈黑色,梭形或蠕虫形,端细胞锥状或钝圆,具2~9个横隔膜,偶见1~2个斜隔膜,分隔处缢缩,孢子大小为(24.68~72.21) μm×(9.36~14.94) μm,平均(53.58±8.95) μm×(12.65±1.15) μm。病菌适宜生长温度为20℃;30℃几乎不生长;35℃培养7 d,部分培养物即死亡。
桃; 果实褐斑病;Thyrostromacarpophilum; 形态特征; ITS序列
甘肃是桃的原产地之一,桃树栽培历史悠久[1-3]。2005 年甘肃省桃树栽培面积达14 167 hm2,产量10.2万t,桃已成为甘肃省优势果树产业之一[4]。近年来,桃果实褐斑病在甘肃省中部的兰州、临洮等地的桃园中危害严重。在疏于防治的桃园,受害严重的中晚熟桃,病果率超过70%。套袋桃果实在取袋(9月上旬)后,亦可被侵染。病斑生于果实表面,褐色,圆形,散生或相连成片,严重影响了果实的商品性。经病原菌分离培养、柯赫氏法则证病,及病原菌形态特征和分子生物学鉴定,明确了病原菌种类,同时对病原菌适宜生长温度进行了测定。研究结果报道如下。
1 材料与方法
1.1 用于病原菌分离的标样来源
罹病桃果实(品种:‘中华寿桃’):5枚,2006年10月25日采集自甘肃省临洮县;罹病桃果实(品种:‘岗山白’):2枚,2007年9月5日采集自甘肃省皋兰县;罹病桃果实(品种:‘岗山白’):3枚,2012年9月5日采集自甘肃省皋兰县。
1.2 培养基配方
PDA:马铃薯200 g,葡萄糖15 g,琼脂粉12 g,自来水1 000 mL。PSA:马铃薯200 g,蔗糖15 g,琼脂粉12 g,自来水1 000 mL。PD培养液:马铃薯200 g,葡萄糖15 g,自来水1 000 mL。
1.3 病原菌分离
采用组织分离法和孢子稀释法分离病原[5]。新鲜病组织经75%乙醇表面消毒,灭菌水冲洗4次,置于PDA平板上;或自病斑表面挑取少许孢子,用灭菌水稀释后,取1 mL涂于PDA平板上。25℃培养,挑取菌落尖端菌丝或单孢子菌落进行纯化后留存并用于后续的试验。
1.4 Koch’s法则证病
在PDA平板上,接种菌株gt-1-1 25℃下培养4~5 d,切取5 mm×5 mm菌丝块,贴接于桃果实上,每个果实贴接1个菌丝块;切取2 mm×2 mm菌丝块,分别贴接于桃叶片正面和背面,每个叶片贴接4个菌丝块;室温(22~24℃)下保湿培养(接菌果实置于盛水的干燥器内保湿培养;接菌叶片置于皿径18 cm的放有湿滤纸的培养皿内保湿培养),每处理9枚果实或叶片(共3个处理:接种于果实、叶片正面和叶片背面),以不接菌为对照。每天观察发病情况,对发病叶片和果实进行病原菌的重分离。
1.5 病原菌形态特征观察
观察描述病菌在自然寄主上的显微形态特征和试验菌株在PDA平板上25℃培养15 d的培养特征,依据病菌形态特征进行种类鉴定。
1.6 病原菌分子生物学鉴定
取在PD营养液中20~25℃培养7 d的菌株gt-1-1的菌丝,利用Universal Genomic DNA Extraction Kit (大连宝生物工程有限公司)提取总DNA。选用真菌通用引物ITS4(5′- TCCTCCGCTTATTGATATGC-3′)和 ITS5(5′-GGAAGTAAAAGTCGTAACAAGG-3′)扩增其ITS基因。反应体系包括10×PCR reaction buffer 2.5 μL,1.5 mmol/L MgCl22 μL,dNTPs (2.5 mmol/L) 1 μL,引物(10 μmol/L)各0.5 μL,TaqDNA聚合酶 (5 U/μL) 0.3 μL,DNA模板2 μL,ddH2O 16.2 μL。反应条件:94℃预变性3 min;94℃ 30 s,55℃ 45 s,72℃ 1 min,30个循环;72℃延伸10 min,4℃保存。PCR产物经1.0%琼脂糖电泳检测。扩增产物回收后,送生工生物工程(上海)股份有限公司测序。测序结果在http:∥www.ncbi.nlm.nih.gov数据库进行Blastn分析。
1.7 病原菌生长温度测定
设置 5、10、15、20、25、30和35℃ 7 个温度。菌株gt-1-1和gt-2-2在PSA 平板上25℃黑暗培养14 d后,自菌落边缘取直径5 mm的菌饼,接种于 PSA 平板中央,置不同温度下恒温黑暗培养,3次重复。培养7 d后用十字交叉法测量菌落直径。在30℃ 和35℃下培养7 d的试验处理,转放至20℃继续培养,15 d后,观察试验菌株恢复生长的情况。其余处理连续培养至15~25 d,观察不同温度条件下菌落形态及产孢情况。
2 结果与分析
2.1 田间病害症状
病斑生于果实表面,圆形,褐色,散生,严重时相连成片,病斑稍凹陷,有或无紫红色晕圈,直径0.5~1.5 cm,病斑上有时可见环生的黑色粉粒状分生孢子座(图1 a~f)。
2.2 病原菌分离
通过对10个病果进行直接镜检和病原菌分离,共分离得到20个显微形态相近的真菌菌株,病原菌分出率达100%。将显微形态一致而菌落形态不同的gt-1-1和gt-2-2作为代表菌株用于后续的试验。
2.3 Koch’s法则证病
在22~24℃下,桃果实和叶片于接种后48 h内显症;病斑褐色,近圆形,果实上的病斑略下陷(图1g~i)。桃果实接种后8 d,病斑直径最大可达13 mm,发病率达100%;桃叶片接种后8 d,病斑直径最大可达12 mm,侵染率16.7%~80.6%,叶背面接种的侵染率高于叶正面。对照未发病。对发病组织进行病原菌的再分离,原接种菌的分离率达100%。

图1 桃果实褐斑病自然发病症状及人工接菌后发病症状Fig.1 Symptoms of peach fruit brown spot caused by Thyrostroma carpophilum in orchards and after inoculation
2.4 病原菌形态特征
在自然寄主上,病菌分生孢子淡褐色至褐色,聚集时呈黑色,梭形或蠕虫形,偶见“Y”形孢子,端细胞锥状或钝圆,具2~9个横隔膜,偶见1~2个斜隔膜,分隔处缢缩,孢子大小为(24.68~72.21) μm×(9.36~14.94) μm,平均(53.58±8.95) μm×(12.65±1.15) μm。分生孢子可再育多次,产生新的分生孢子(图2 a~f)。
病菌在PDA平板,25℃培养15 d,菌落薄毡状,气生菌丝近白色至灰黄褐色,菌落边缘整齐或不齐,分生孢子座散生,菌落背面土黄色至灰褐色;分生孢子形态与自然寄主上相近,多数孢子具2~4个横隔膜;顶生或间生于菌丝上的厚垣孢子黄褐色,柱状,多细胞(图2g~i)。
病菌形态特征与Thyrostromacarpophilum(Lév.) B.Sutton [异名:HelminthosporiumcarpophilumLév.;Clasterosporiumcarpophilum(Lév.) Aderh.;Coryneumcarpophilum(Lév.) Jauch;Stigminacarpophila(Lév.) M.B.Ellis;Sciniatosporiumcarpophilum(Lév.) Morgan-Jones;Sporocaduscarpophilus(Lév.) Arx;Wilsonomycescarpophilus(Lév.) Adask., J.M. Ogawa & E.E.Butler;MacrosporiumrhabdiferumBerk.;PassalorabrunaudiiSacc.;CoryneumbeyerinckiiOudem.]形态特征基本一致[6-7]。
2.5 病原菌分子生物学鉴定
扩增出的ITS序列(GenBank accession:KT002183)测序后(550 bp),BLASTn分析结果表明,该序列与Thyrostromacarpophilum(Genbank accession:HM107423和JN208892)的18S rRNA部分序列、ITS1、5.8S rRNA、ITS2及28S rRNA部分序列同源性达99%,分子生物学鉴定结果与形态学鉴定结果一致。
依据病菌形态特征和分子生物学鉴定结果,将甘肃省桃果实褐斑病的病原鉴定为Thyrostromacarpophilum(Lév.) B.Sutton。

图2 病原菌光学显微形态Fig.2 Light micrographs of the pathogen
2.6 病原菌适宜生长温度测定
试验菌株菌丝生长的适宜温度为20℃;30℃基本不生长(菌落不扩展但接种菌块上可见少许萌动菌丝);35℃不生长。在30℃ 和35℃下培养7 d的试验处理,转放至20℃培养15 d:30℃的所有试验处理均可恢复正常生长;35℃的试验处理,gt-1-1的3枚菌丝块均未恢复生长,gt-2-2有1/3的菌丝块恢复生长。结果见图3。
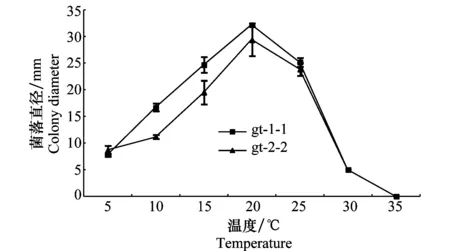
图3 培养温度对桃果实褐斑病菌的2个菌株菌落 生长的影响(PSA,7 d)Fig.3 Effects of culture temperature on colonial growth of two strains of Thyrostroma carpophilum (PSA, 7 d)
试验菌株在不同温度下菌落形态差异较大:5~15℃培养,菌落呈豆沙色至酒红色;20~25℃培养,菌落呈黄褐色至灰褐色。不同菌株,甚至同一菌株的不同重复间,菌落形态和产孢特性也存在差异。15~25℃培养7~10 d病菌即可大量产生分生孢子,而10℃需培养25 d、5℃需培养54 d病菌方可产孢(5℃和10℃ 培养15 d,部分接种菌丝块上可产孢)(图4)。
3 讨论
Thyrostromacarpophilum侵染桃树引起的病害曾被称为棒盘孢病、穿孔病、疱疹斑病等,最早于1843年发现于法国,随后在南、北美洲,非洲,澳大利亚和新西兰,伊朗发现[8-9]。其自然寄主均为李属、桃属、杏属植物(PrunusL.,AmygdalusL.,ArmeniacaL.),桃(Amygdaluspersica)、杏(Armeniacavulgaris)、油桃(Amygdaluspersicavar.nectarina)、扁桃(A.communis)、甜樱桃(P.avium)为其主要寄主,其他已知的寄主还包括欧李(P.domestica)、野生樱桃(P.serótina,P.virginiana,和Padusracemosa)、桂樱(P.laurocerasus),及山桃(Amygdalusdavidiana)等[8]。病菌可侵染寄主植物休眠的叶芽、花芽、花、叶、果实及枝条[8]。

图4 不同培养温度下菌株gt-1-1和gt-2-2的菌落形态Fig.4 Colony morphology of Thyrostroma carpophilum strains gt-1-1 and gt-2-2 cultured at different temperatures
关于病害发生规律和病菌生物学特性等国外已有较多的研究报道。在美国,枝条和芽的侵染率及在初侵染中的作用在不同寄主上存在差异:在杏树上,枝条很少被侵染,染病的休眠芽是主要的初侵染源;对桃和油桃树而言,染病的枝条和芽是同等重要的初侵染源;在扁桃树上,染病的包含花蕾的短枝(spurs)可能比染病的芽是更为重要的初侵染源;由于在果斑上很少产生分生孢子,因此病果不是主要的初侵染源[8, 10]。在伊朗,不同地区的T.carpophilum菌株具有高水平的遗传多样性;病菌适宜生长温度为21℃,低于5℃和高于30℃不生长,在PDA、APDA 和MEA培养基上易于产生厚垣孢子[9,11]。
凉爽的温度和持续的湿润(降雨或灌溉)是病害发生的有利条件,在持续湿润的条件下,当温度低至2.2℃时,病菌24 h就可在寄主组织中定殖,当温度达到25℃时,只需6 h就能形成侵染[12]。较高的温度(22℃)比低温(15℃和8℃)条件下,叶片上的病斑更易脱落形成穿孔症状[13]。
在我国的甘肃、新疆、河北、河南、吉林、四川、安徽、湖北、江苏等省区,该病菌(嗜果刀孢菌Clasterosporiumcarpophilum(Lév.) Aderh.)记载生于桃、杏、李等李属植物上[14],可危害叶片、果实和枝梢[15]。从我们的研究结果来看,甘肃桃果实褐斑病菌的适宜生长温度及最高生长温度与分离自美国、伊朗和罗马尼亚的菌株相近[7, 11, 16];病害发生特点与国外已有报道存在差异,如在果实上较易产生分生孢子。
保存于PDA和PSA试管斜面上(以聚丙烯薄膜封口)的试验菌株,在室温(15~30℃)和低温(5~10℃)条件下贮存7个月即死亡,试验菌株的意外死亡影响了试验的完整性。
病菌在自然条件下的存活时间和初侵染源有待于今后的试验研究。在病区进一步开展病害发生规律的研究,对有效地进行病害防治,减轻病害损失具有积极作用。
[1] 吴耕民. 中国的桃[J]. 生物学通报, 1958(3): 14-18.
[2] 汪祖华, 庄恩及. 中国果树志·桃卷[M]. 北京: 中国林业出版社, 2001: 1-326.
[3] 罗桂环. 关于桃的栽培起源及其发展[J]. 农业考古, 2001(3): 200-203.
[4] 陈建军, 赵秀梅, 王玉安, 等. 甘肃桃、油桃新品系选育初报[C]∥中国园艺学会桃分会成立暨学术研讨会论文集. 河南郑州: 中国园艺学会桃分会, 2007: 117-119.
[5] 方中达. 植病研究方法[M].第3版. 北京: 中国农业出版社, 1998: 122-126.
[6] Editor.Thyrostromacarpophilum[EB/OL]. (2015-03-30)[2015-5-30]. http:∥www.mycobank.org/Biolomics.aspx?Table=Mycobank&MycoBankNr_=443000.
[7] Adaskaveg J E, Ogawa J M, Butler E E.Morphology and ontogeny of conidia inWilsonomycescarpophilus, gen. nov. and comb. nov., causal pathogen of shot hole disease ofPrunusspecies [J]. Mycotaxon, 1990, 37: 275-290.
[8] Wilson E E.Coryneumblight of stone fruits [M]∥Yearbook of Agriculture. Washington D C: United States Department of Agriculture, 1953: 705-710.
[9] Ahmadpour A, Ghosta Y, Javan-Nikkhah M, et al. Isolation and pathogenicity tests of Iranian cultures of the shot hole pathogen ofPrunusspecies,Wilsonomycescarpophilus[J]. Australasian Plant Disease Notes, 2009, 4(1): 133-134[10]Adaskaveg J E, Duncan R A, Hasey J K, et al. Peach shot hole disease. UC IPM Pest Management Guidelines: Peach, UC ANR Publication 3454 [EB/OL]. (2012-4-10)[2015-9-21]. http:∥www.ipm.ucdavis.edu/PMG/r602100711.html.
[11]Ahmadpour A, Ghosta Y, Javan-Nikkhah M, et al. Study on morphology, pathogenicity and genetic diversity ofWilsonomycescarpophilusisolates, the causal agent of shot hole of stone fruit trees based on RAPD-PCR in Iran [J]. Archives of Phytopathology and Plant Protection, 2012, 45(17): 2076-2086.
[12]Evans K, Frank E, Gunnell J D, et al.Coryneumor shot hole blight. Utah Pests Fact Sheet, PLP-008, Utah State University Extension and Utah Plant Pest Diagnostic Laboratory [EB/OL]. (2008-06-26)[2015-11-5]. http:∥extension.usu.edu/files/publications/factsheet/coryneum-blight08.pdf.
[13]Shaw D A, Adaskaveg J E, Ogawa J M. Influence of wetness period and temperature on infection and development of shot hole disease of almond caused byWilsonomycescarpophilus[J]. Phytopathology, 1990, 80(8): 749-756.
[14]戴芳澜. 中国真菌总汇[M]. 北京: 科学出版社, 1979: 914.
[15]戚佩坤, 白金铠, 朱桂香. 吉林省栽培植物真菌病害志[M]. 北京: 科学出版社, 1966: 196-209.
[16]Vacaroiu C, Zala C R, Cristea S, et al. Research regarding the influence of temperature, atmospheric humidity and light upon the biology of theStigminacarpophilafungus [J]. Scientific Papers (USAMV Bucharest), 2009, Series A, Vol. LII: 398-403.
(责任编辑:田 喆)
Identification of the pathogen of the brown spot of peach fruit in Gansu, China
He Suqin1, Bai Bin2, Wen Zhaohui3, Jing Zhuoqiong1
(1. Institute of Plant Protection, Gansu Academy of Agricultural Sciences, Lanzhou 730070, China; 2. Institute of Agricultural Quality Standards and Testing Technology, Gansu Academy of Agricultural Sciences,Lanzhou 730070, China; 3. Gansu Entry-exit Inspection and Quarantine Bureau, Lanzhou 730020, China)
In recent years, the brown spot disease of peach fruit has caused serious damages in Lanzhou area and Lintao County in central Gansu Province, and diseased fruit incidences were more than 70% in peach orchards without control measures. Through the pathogen isolation and culture, the disease was confirmed by Koch’s rule, and based on the morphological and molecular identification (GenBank accession no. KT002183), the pathogen was identified asThyrostromacarpophilum(Lév.) B.Sutton. On the fruits, lesions were brown, circular, scattered, slightly concaved, 0.5-1.5 cm in diameter, sometimes with visible black powdery sporodochia and circle on the surface of lesions. Conidia were light brown to brown, black in mass, fusiform or silkworm-shaped, with tapering or obtuse terminal cells, 2-9 dark transverse septa and occasionally 1-2 oblique septa, usually constricted at septa; they were (24.68-72.21)μm×(9.36-14.94)μm in size, (53.58±8.95)μm×(12.65±1.15)μm on average. The optimum growth temperature of the pathogen was 20℃; almost no growth was observed at 30℃, and part of the cultures were dead when cultured for 7 d at 35℃.
Amygdaluspersica; brown spot of peach fruit;Thyrostromacarpophilum; morphological character; ITS sequence
2015-11-09
2015-12-23
S 436.61
A
10.3969/j.issn.0529-1542.2016.05.008
* 通信作者 E-mail:gshesuqin@sina.com

