脑肿瘤单纯放疗或术后放疗后占位形成的再手术
张龙 张功义 侯玉武 赵庆 孟庆勇 阮金成 秦东旭
(解放军第152医院神经外科,河南 平顶山 467000)
·经验交流·
脑肿瘤单纯放疗或术后放疗后占位形成的再手术
张龙*张功义 侯玉武 赵庆 孟庆勇 阮金成 秦东旭
(解放军第152医院神经外科,河南 平顶山 467000)
脑肿瘤; 放射治疗; 复发; 手术
目前放射治疗是脑肿瘤手术切除治疗外的主要辅助手段,对延缓肿瘤的复发起到重大作用;但仍有较多患者出现脑肿瘤综合治疗后的复发和/或假性进展,而出现临床症状加重、甚至意识进行性加深等颅高压症状,再次开颅手术则成为脱水、激素等治疗失败后有效而且是唯一的选择。本文对我院2011年6月至2015年5月间接受放疗后再开颅手术的30例病例进行了回顾性分析,总结如下:
一、对象与方法
1.一般资料:本组再开颅手术的30例患者中男18例、女12例;年龄17~63岁,平均45岁;病情再加重时间为放疗后4个月至7年,平均病程为23.5个月。本组患者中为首次手术者6例、第二次手术者22例、第三次手术者2例。患者均有程度不同的头痛、精神差或意识障碍症状,其中6例还伴发有癫痫。
2.影像学检查:本组所有病例均有至少一次的CT检查,
有多次的磁共振平扫及增强扫描、其中12例还在本次术前进行了磁共振波谱分析检查,其中9例报告为肿瘤复发。呈单发病灶位于额叶、额颞叶、颞枕叶者22例、小脑者3例;多发肿瘤且其一较大病灶位于额颞部者5例;首次手术全切或次全切后病理性质明确的胶质瘤24例(Ⅱ级者15例、Ⅱ~Ⅲ级者6例、Ⅳ级者3例)、直接放疗无病理结果者6例(影像可疑脑胶质瘤3例行伽马刀定向放疗;可疑多发脑转移瘤2例、脑室多发脑膜瘤1例者行直线加速器放疗)。本次术前MRI影像可见:病灶体积均较其首次治疗前明显增大,尤其磁共振T2加权相更趋明显、病灶与脑组织界限不清,病灶多为混杂信号,病灶内均有不同程度和不同大小的强化,与首次治疗前影像比较均有不同程度的强化灶增大或数量变多;该组中有明显病灶占位效应且中线移位者23例,术前影像拟诊肿瘤复发者15例。
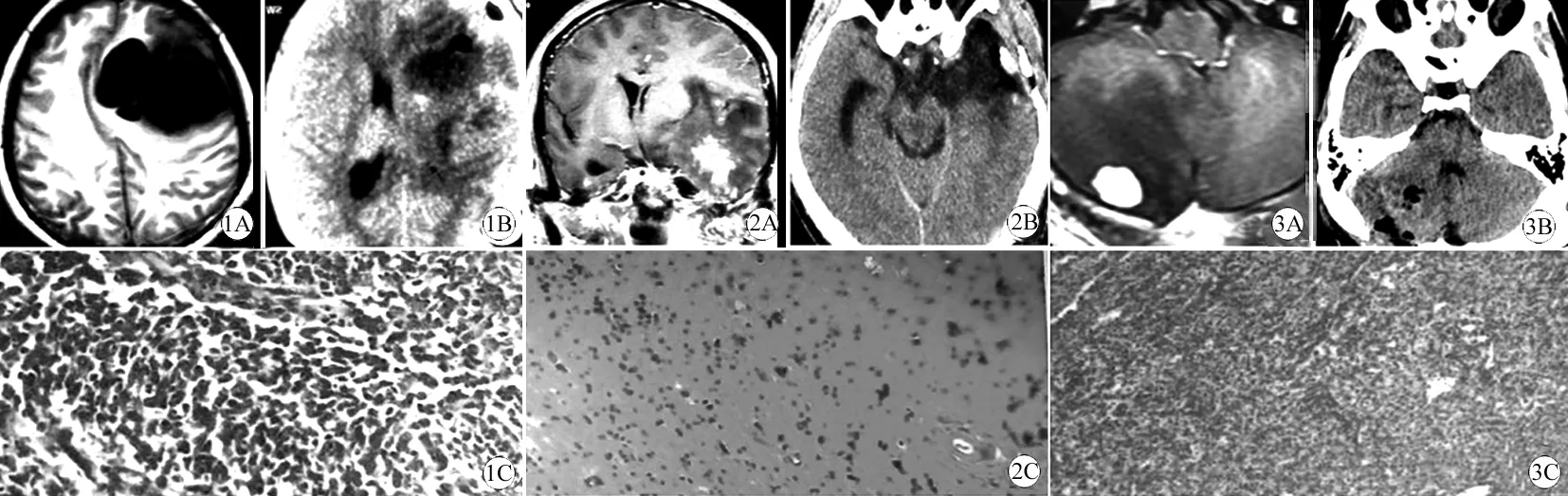
图1 手术并放疗后左额叶病灶,二次术前可疑为胶质母细胞瘤复发
A: 二次术前T1MRI增强轴位像,可见左额叶较大囊性占位、病灶无强化;B: 术后CT平扫,显示囊性肿瘤切除后部分额叶脑水肿; C: 二次术后病理见细胞分化差、呈多形性间质性特征,细胞密度高核特异性明显、可见瘤坏死和血管增生(HE, 10×10)。
图2 鼻咽癌手术并定向放疗后左颞叶病灶,术前可疑鼻咽癌转移
A: 术前T1MRI增强冠状位像、可见左颞叶强化性结节及周围显著的脑水肿;B: 术后CT平扫显示结节性病灶被完全切除;C: 二次术后病理可见大片退变、坏死、出血脑组织、胶质瘢痕及胶质结节形成,未见癌组织,证实为放射性脑坏死(HE, 10×10)。
图3 乳腺癌术后右小脑半球病灶并伽马刀放疗后,术前可疑乳腺癌转移
A: 术前T1MRI增强轴位像、可见右小脑半球孤立的强化病灶及其周围脑组织明显水肿;B: 术后CT平扫显示病灶被完全切除;C: 术后病理见空泡状间质细胞和丰富的毛细血管网(HE, 10×10)。
二、手术治疗及随访
1.手术及病理:依病灶部位不同,本组病例除3例小脑肿瘤者采用后正中入路的后颅窝大骨窗外,其余采用了较大的额颞瓣或颞枕瓣开颅,术中尽可能多地切除肉眼可见的复发肿瘤组织外,对明显水肿质脆的非功能区脑组织一并切除,术中见病灶组织呈明显灰白色的坏死、水肿改变,血供较差。其中12例做了额、颞极切除的内减压,术毕均行硬脑膜修补减张缝合,有20例本次已知为高级别胶质瘤或显著脑肿胀病例同时给予去骨瓣,术后常规给予脱水、预防感染、短期激素及支持治疗等措施。术后病理结果提示:胶质瘤复发18例(占该组病例的60%)(包括2例小脑肿瘤),其中有7例较首次术后的病理级别增高(占复发瘤的38.9%);转移瘤为肺癌和乳腺癌转移各2例;炎性反应6例分别为:胶质瘤手术及放疗后5例、以鼻咽癌及小脑血管母细胞瘤接受放疗者各1例;多发的中枢性淋巴瘤2例(图1~3)。
2.再手术后随访:本次术后随访患者27人,随访时间2~42个月,平均随访时间26个月,有24例术后无明显并发症,恢复良好;出现并发症者6例,包括不完全性失语2例,偏瘫加重2例;因术后脑水肿病情加重及切口感染不愈各1例,后期家属放弃治疗。
三、讨论
颅脑肿瘤首选手术切除,以期取得准确的病理性质并同时全切或尽可能多地切除肿瘤组织,为后续辅助治疗提供条件;但高级别脑胶质瘤及临近脑功能区肿瘤仍有较高的术后复发率,一些多发脑肿瘤、高龄体差、惧怕手术等脑瘤患者或愿将放化疗做为首选。但放疗后再复发或放射性脑损伤导致病灶扩大、占位效应显著的病例近年明显增多,再次开颅手术切除病灶并减压则成为最有效的方法。结合本组病例就相关问题讨论如下:
1.胶质瘤复发与再手术:胶质瘤是颅内常见的原发肿瘤,术后容易复发,如胶质母细胞瘤平均生存期约为12~15个月,间变性星形细胞瘤约为2~5年;为减缓复发,术后放疗则是目前胶质瘤最主要的辅助治疗手段之一,而放射性脑损伤是其主要并发症,鉴别术后胶质瘤是复发还是放射性损伤则直接影响患者的巩固性治疗和预后。放射性脑损伤(又称放射性脑病)是放射线对神经组织的直接作用,放射性脑损伤分为急性反应、亚急性(早期迟发性)反应和晚期迟发性反应,尤其晚期迟发性反应在临床表现为神经系统功能障碍且进行性加重,是不可逆性损伤,重则危及生命。目前对胶质瘤综合治疗后的复发亦或放射性损伤的鉴别主要依于其影像学改变,在常规影像检查中复发胶质瘤很难与晚期迟发反应性放射性脑损害相区分,其中依局部组织血供改变、血脑屏障破坏程度、组织代谢率等为基础的核磁共振检查(包括弥散张量成像、灌注成像、波谱分析等技术)或正电子断层扫描检查方法被证明准确性和特异性更高;磁共振灌注加权成像是反映组织微血管分布及血流灌注情况的磁共振检查技术,其检测指标中的局部脑血容量显著增高多被证明能提示肿瘤复发[1],应用动态对比增强磁共振成像技术也发现对比剂从血浆空间渗漏到血管外细胞外的转运系数、血管外细胞外空间容积分数这两个参数在复发胶质瘤中同样明显增高[2],能明显地区别于放射性损伤。值得一提的是近些年学术中常提到的肿瘤"假性进展"概念,是指胶质瘤治疗后在磁共振增强影像学上所表现的原肿瘤区域强化范围增加或出现新的强化灶,是一种与放化疗后肿瘤及其周边组织损伤、血脑屏障破坏、血管内皮细胞损伤有关的反应,引起的水肿及占位效应均不显著[3,4];一般出现在放射治疗后3个月左右,且多在放射治疗联合替莫唑胺同期化学治疗后发生。对放射性脑损伤或假性进展者可试用糖皮质激素、脱水剂、营养神经药物(依达拉奉)、高压氧等治疗。目前任何一种影像技术均不能完全鉴别肿瘤复发与假性进展或放射性脑损伤,最精确的诊断仍是术后的病理诊断;从本组病例可见术前影像与术后病理结果比较其误判率接近16%,也说明在患者临床症状进行性加重,影像又提示有明显占位效应者,及时的再次切除病灶及必要的减压手术对患者预后至关重要,甚至能及时挽救脑疝患者的生命。
2.脑转移瘤及多发肿瘤再手术:脑转移瘤是颅外恶性肿瘤累及脑实质、脑脊膜、脑神经和颅内血管的转移性肿瘤,脑实质内脑转移瘤中肺癌几乎占一半,其次为乳腺癌、消化道肿瘤、肾癌及黑色素瘤等,大部分的脑转移瘤呈多发转移病灶[5]。全脑放疗仍然是多发脑转移瘤的有效治疗手段,立体定向放疗在多发脑转移瘤的治疗中也发挥着越来越重要的作用,其最大的好处是单次剂量大、局部照射对周围正常组织影响小,特别是转移灶数目在3个以下、最大径lt;3 cm的患者,立体定向放疗可做为该类脑转移瘤患者的首选治疗。部分多发脑肿瘤早期可能发现不了原发灶或性质难定,建议首次术切可及的大病灶或定向活检后,再根据病理诊断给予必要的放化疗方案;本组中有两例多发脑瘤也是在放疗后出现病灶扩大,经术切大病灶后准确定性为中枢性淋巴瘤才得以施予合理辅助治疗。作者的体会是对于放疗后的多发肿瘤灶,当病灶明显扩大产生占位效应或保守治疗难以解除颅高压症状者,积极的开颅手术切除较大病灶多可达到事半功倍之效。
3.再手术适应证:复发脑肿瘤或严重放射性脑损伤患者,再次开颅手术对患者预后有积极意义,甚至是救命稻草。但必定该类患者多位肿瘤晚期,再次开颅手术必须评估其体质和心里的承受能力,应权衡利弊严格把握手术指征;我们总结的适应症为:①实质性病灶产生明显占位效应,且位于非重要功能区者可酌情施予病灶扩大切除及可能的内减压手术;②有明显占位效应的囊性病变;③颅内占位导致临床难以控制的癫痫发作;④小脑病变表现为脑干受压和阻塞性脑积水则及早再手术;⑤原发灶为放射不敏感肿瘤如结肠癌、肾肿瘤或黑色素瘤;⑥KPS(Karnofsky评分)70分以上,预计术后生存期6个月以上。
1白雪菲, 牛广明, 韩晓东. PWI对胶质瘤术后复发与放射性脑损伤的鉴别诊断价值 [J]. 内蒙古医科大学学报, 2014, 36(3): 274-277.
2白雪冬, 孙夕林, 王丹, 等. 动态对比增强MRI在鉴别胶质瘤复发及放射性脑损伤中的应用 [J]. 磁共振成像, 2014, 5(1): 1-6.
3周敏, 牛朝诗. 高级别胶质瘤放化疗后出现假性进展及放射性坏死的研究进展 [J]. 立体定向和功能性神经外科杂志, 2014, 27(2): 116-120.
4Motegi H, Kamoshima Y, Terasaka S, et al. IDH1 mutation as a potential novel biomarker for distinguishing pseudoprogression from true progression in patients with glioblastoma treated with temozolomide and radiotherapy [J]. Brain Tumor Pathol, 2013, 30(2): 67-72.
5Filder IJ. The role of the organ microenvironment in brain metastasis [J]. Semin Cancer Biol, 2011, 21(2): 107-112.
1671-2897(2016)15-448-02
R 651.15
B
张龙,主任医师,E-mail:dragon152@163.com
*通讯作者:张龙,主任医师,E-mail:dragon152@163.com
2015-07-20;
2015-10-20)

