原发性中枢神经系统淋巴瘤的前瞻性治疗研究
程岗 王亚明 董超 张雷鸣 于新 尹丰 赵明明 赵虎林 方丹东 王鹏 李海龙 郭志峰 李庆岗 王洪伟 贾博 刘锐 张剑宁
(海军总医院神经外科,北京 100048)
·脑肿瘤基础与临床研究·
原发性中枢神经系统淋巴瘤的前瞻性治疗研究
程岗 王亚明 董超 张雷鸣 于新 尹丰 赵明明 赵虎林 方丹东 王鹏 李海龙 郭志峰 李庆岗 王洪伟 贾博 刘锐 张剑宁*
(海军总医院神经外科,北京 100048)
目的通过前瞻性研究,寻找安全有效的原发性中枢神经系统淋巴瘤(PCNSL)治疗方法。方法2014年2月至2015年2月,共收治年龄75岁以下的PCNSL病例38例,给予甲氨蝶呤+替莫唑胺方案治疗,使用或不使用利妥昔单抗(MT-R方案),观察此方案的临床疗效及安全性。结果按照影像学判断标准,38例患者中2周期后达到PR的患者共31例,SD 3例,PD 1例,死亡3例,有效率为81.58%。按照美国东部肿瘤协作组(ECOG)评分标准,共28例患者的ECOG评分较治疗前减少1分或评分为1分以下,有效率为73.68%。恶心、呕吐症状最常见,6例出现白细胞降低。死亡3例。结论MT-R方案具有良好的安全性,临床效果满意,但是对于用药剂量及治疗周期仍需进行优化。
原发性中枢神经系统淋巴瘤; 甲氨蝶呤; 替莫唑胺; 利妥昔单抗
原发性中枢神经系统淋巴瘤(primary central nervous system lymphoma, PCNSL)是指原发于中枢神经系统的恶性淋巴瘤,近30年来本病的发病率增长速度已经超过脑胶质瘤,其增长速度无论在任何年龄组都居颅内各肿瘤之首。未经治疗的PCNSL患者中位生存期仅为1.5~3个月,经过正规治疗,PCNSL的 5年生存期目前可以达到30%~40%,而且越早开始正规治疗,临床预后越好。目前,PCNSL的首选治疗方法是以大剂量甲氨蝶呤为基础的联合化疗。自2013年6月以来,海军总医院神经外科与北京大学肿瘤医院淋巴瘤科联合开展了以MT-R为诱导方案,联合自体造血干细胞(autologous stem cell transplantation, ASCT)支持下的大剂量化疗(high-dose chemotherapy, HDC)(HDC+ASCT)的治疗研究,目前已经入组38例患者,取得了良好的临床疗效,由于多数患者的疗程尚无完成,本文仅对诱导期化疗的效果及安全性进行评价。
对象与方法
一、一般资料
2014年2月至2015年2月共入组PCNSL病例38例,其中男性及女性患者各19例,年龄29~75岁(平均54.7岁)。所有病例均通过立体定向活检获取病理标本,经病理检查确诊为弥漫大B细胞淋巴瘤,并经过胸部CT、腹部超声或全身PET-CT检查排除其他部位淋巴瘤可能性。
二、治疗方案
诱导化疗方案采用大剂量甲氨蝶呤(high-dose methotrexate, HD-MTX)+ 替莫唑胺( temozolomide, TMZ)±利妥昔单抗,第1天静滴利妥昔单抗,375 mg/m2,第2天静滴MTX,3.5 g/m2,第2天至第6天口服TMZ,100 mg/m2,21 d一个治疗周期,每两个周期评效一次,若化疗有效,则分离外周血干细胞,4个周期结束后择期行自体造血干细胞(autologous stem cell transplantation, ASCT)支持下的大剂量化疗(high-dose chemotherapy, HDC)(HDC+ASCT)。根据患者的实际情况酌情使用利妥昔单抗。
表1 ECOG评分标准
Tab 1 ECOG performance status
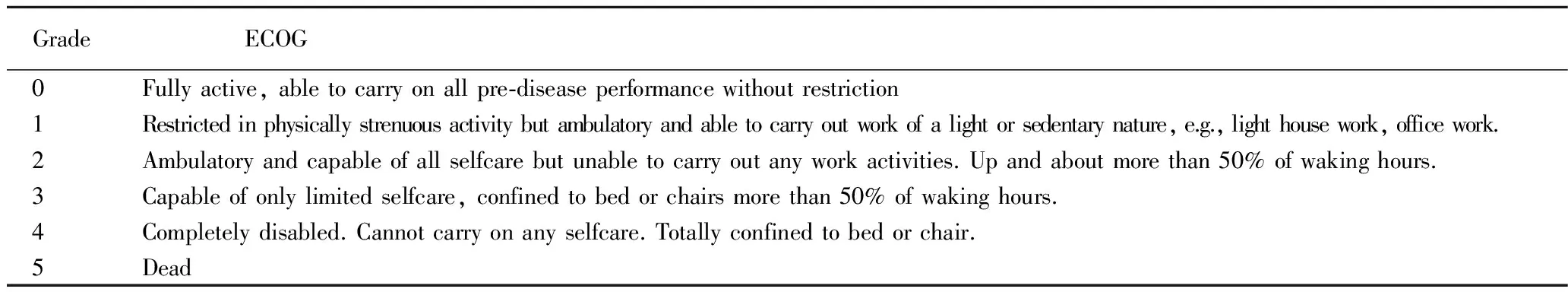
GradeECOG 0Fullyactive,abletocarryonallpre⁃diseaseperformancewithoutrestriction 1Restrictedinphysicallystrenuousactivitybutambulatoryandabletocarryoutworkofalightorsedentarynature,e.g.,lighthousework,officework. 2Ambulatoryandcapableofallselfcarebutunabletocarryoutanyworkactivities.Upandaboutmorethan50%ofwakinghours. 3Capableofonlylimitedselfcare,confinedtobedorchairsmorethan50%ofwakinghours. 4Completelydisabled.Cannotcarryonanyselfcare.Totallyconfinedtobedorchair. 5Dead
Oken MM, et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol, 1982, 5(6):649-655.
三、疗效判断
影像学判断标准:所有患者每2个周期后进行MRI增强扫描,根据检查结果判断疗效。具体如下:完全缓解(complete response, CR):无强化;部分缓解(partial response, PR):肿瘤体积缩小50%以上;病情稳定(stable disease, SD):肿瘤体积缩小不到50%,或增大不超过25%;疾病进展(progress disease, PD):肿瘤体积增大超过25%。由于此项研究开展时间较短,大部分患者并未完成整个治疗计划,因此暂时以2周期结束作为疗效判断的时间点。病情达PR以上为有效,SD以下为无效。
美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)评分标准:根据ECOG评分标准,治疗后2周期若患者的ECOG评分较治疗前减少1分或评分为1分以下视为有效,ECOG≤2视为无效。
结 果
一、临床疗效
按照影像学判断标准,38例患者中2周期后达到PR的患者共31例,SD 3例,PD 1例,死亡3例,有效率为81.58%。按照ECOG评分标准,共28例患者的ECOG评分较治疗前减少1分或评分为1分以下,有效率为73.68%。典型病例(图1~3)。共有3名患者在完成第一周期化疗后死亡,第一名患者病灶位于松果体区和中脑部位,第一周期结束后临床症状明显好转,但是回当地医院后出现梗阻性脑积水,未采取有效治疗措施,脑疝死亡。第二名患者病灶位于鞍区,手术切除后进行化疗,化疗后临床症状一度好转,但是出现明显的电解质紊乱以及血小板降低,全身状况逐渐变差,死亡。第三名患者接受化疗后MTX解毒效果不理想,用药2 w后MTX血药浓度仍高于正常范围,患者逐渐出现严重的骨髓抑制,并发肺部感染及呼吸衰竭死亡。
二、不良反应
恶心、呕吐症状是最常见的不良反应,所有患者均出现程度不等的恶心症状,但是相比而言,年轻患者耐受性明显较好,出现明显呕吐症状的患者较少。年龄越大,出现恶心、呕吐症状的几率越高。另外,同一患者在不同治疗周期内产生恶心、呕吐症状的情况并非完全一致,我们在治疗中发现一般在第三周期治疗期间恶心、呕吐症状最严重。7名患者有比较明显的头痛症状,一般在使用甲氨蝶呤期间症状明显。6名患者化疗期间出现白细胞降低,其中5名使用重组粒细胞集落刺激因子后很快恢复正常,并不影响正常的化疗,1名患者出现4度骨髓抑制,并发感染死亡。1名患者出现单纯血小板降低,给予输注血小板后效果不佳。4名患者出现明显的转氨酶升高,但是经过保肝治疗,停止使用化疗药后肝功能均逐渐恢复正常。

图1 病例1患者不同治疗周期后的头颅MRI检查结果,此患者已完成整个治疗方案(病变为箭头所示)
Fig 1 MRI results of case 1 in different treatment cycles and the patient has complete the whole treatment protocol (arrow head showed the lesion)
A: Before the treatment; B: 2 cycles after the treatment; C: 4 cycles after the treatment.
图2 病例20患者完成2周期化疗后MRI检查结果(病变为箭头所示)
Fig 2 MRI results of case 20 and the patient completed 2 cycles treatment (arrow head showed the lesion)
A: Before the treatment; B: 2 cycles after the treatment.
图3 病例24患者完成2周期化疗后MRI检查结果(病变为箭头所示)
Fig 3 MRI results of case 24 and the patient completed 2 cycles treatment (arrow head showed the lesion)
A: Before the treatment; B: 2 cycles after the treatment.
讨 论
长期以来,PCNSL缺乏规范的治疗方法,手术切除、全脑外放疗(whole-brain radiotherapy, WBRT)以及多种化疗方案都曾用于PCNSL的治疗。自从大剂量甲氨蝶呤 (≥1 g/m2) 被证实能够延长PCNSL患者的生存期,2 557名PCNSL患者流行病学调查显示,随着HD-MTX的应用,HIV阴性的患者中位生存期已经由上世纪70年代的7.5个月上升到2000~2010年的14个月。
以HD-MTX为基础的化疗已经成为治疗PCNSL的标准方案,但是有关MTX的最佳剂量、基于HD-MTX的最佳化疗组合都没有达成共识。在既往文献报道中,MTX 的使用剂量为1~8 g/m2之间,目前比较得到公认的剂量是≥3 g/m2,每10~21 d使用一次,能够获得较好的临床疗效和高浓度的脑脊液(cerebral spinal fluid, CSF)浓度。Abrey等[1]于2000年报道了有52名患者参加的临床试验,使用5个周期的MPV(MTX 3.5 g/m2、长春新碱1.4 mg/m2、甲基苄肼100 mg/m2)方案后CR率是58%,总生存(overall survival, OS)时间平均60个月,WBRT并不能延长OS的时间,此后多项临床试验都将此次试验结果作为疗效评定的参考。随后,Shah[2]将MTX的使用周期增加到7次,同时加用利妥昔单抗,结果显示30名受试者CR率提高到78%,2年的OS和无进展生存期(progression free survival, PFS)分别为67%和57%。在一项有6个国家24个中心参与的Ⅱ期临床试验中,79名患者被随机分为MTX单药治疗组和MTX+阿糖胞苷治疗组,进行4个周期的化疗后辅以WBRT,化疗结束时两组的CR率分别为18%和46%(P=0.006),总体反应率分别为40%和69%(P=0.009),在平均30个月的随访期内,分别有12名(32%)和20名(46%)患者存活,说明联合用药的疗效要好于MTX单药治疗,但是血液系统毒性会相应增加,这也是首个有关PCNSL治疗的随机化临床试验[3]。
除MTX之外,其他化疗药物的选择主要是考虑透过血脑屏障的能力以及是否对外周淋巴瘤有效。替莫唑胺是一种口服烷化剂,可自行代谢为甲嗪咪唑胺,从而使O6-甲基鸟嘌呤-DNA的甲基转移酶活性缺失,是治疗胶质母细胞瘤的一线药物。替莫唑胺可穿透血脑屏障,又可增加放疗的细胞毒性作用,而且所有年龄组的患者对本药都有良好的耐受性,因此可用于PCNSL的诱导缓解,维持治疗及作为放疗增敏剂。一项多中心的临床试验证实,HD-MTX治疗后复发或难治PCNSL患者应用替莫唑胺后,治疗有效率达26%,其中大部分为完全缓解[4]。单独使用替莫唑胺作为挽救治疗也有效果,总反应率为31%,1年生存率亦为31%,无进展生存期的中位数和总生存期分别为21和50个月[5]。
利妥昔单抗是针对B细胞表面特异性CD20抗原的嵌合型单克隆抗体,大剂量使用时,脑脊液中浓度也相应提高,同时安全性很好,由于绝大多数PCNSL是B细胞来源,因此利妥昔单抗适用于绝大多数PCNSL病例。多项临床试验表明,利妥昔单抗联合替莫唑胺具有很好的疗效和耐受性[6,7]。
本研究中联合HD-MTX、TMZ和利妥昔单抗作为PCNSL的诱导化疗,初步研究结果显示此方案具有良好的耐受性和安全性,最常见的不良反应是恶心、呕吐症状,从症状发生时间观察,MTX及TMZ均与患者的恶心、呕吐有关。头痛主要发生在MTX使用当天,应为MTX的不良反应。白细胞降低是最常见的血液系统毒性,多数发生在MTX解毒效果不佳的患者,其中一名死亡患者的原因就是由于MTX解毒效果不佳直接相关,提示MTX的充分解毒对于降低血液系统并发症至关重要。初步研究结果显示,按照影像学判断标准,MT-R方案的有效率为81.58%。按照ECOG评分标准,有效率为73.68%,提示临床效果较好。但是研究过程中也发现,部分患者的病情进展较快,在下一周期开始前病灶再次出现增大,因此治疗周期是否需要缩短、MTX及TMZ的用量是否需要调整需要在下一步治疗中进行调整。
近年来,多项临床试验显示大剂量化疗支持下的自体干细胞移植对进一步改善PCNSL患者临床预后有良好效果,而且不会产生WBRT带来的神经毒性,有望成为一种新的治疗方案。Cheng等[8]首次将HDC+ASCT用于新诊断的PCNSL治疗,虽然在诱导阶段仅有14%和86%的患者达到CR和PR,但是干细胞治疗后3年CR为100%,OS为50%,而且患者的神经功能得到明显改善,没有出现神经毒性。此后的临床试验对诱导方案、骨髓动员和大剂量化疗方案进行探索,近年来,越来越多的学者倾向于使用更高剂量的MTX单药作为诱导方案,因为这种方案引起神经毒性的几率相对较低,反应率较高,从而有更多患者有机会接受HSCT。有两个临床试验采用此方案,3年和5年的OS分别是77%和69%[9]。在一项有18个中心参加的研究中,共79名65岁以下免疫正常的PCNSL患者接受了HD-MTX (8 g/m2)为基础的化疗和ASCT。治疗后1年和2年的OS分别为92%和87%,共有5人死于感染。目前,国际结外淋巴瘤研究组(international extranodal lymphoma study group, IELSG)目前正在开展一项针对新诊断的PCNSL患者的随机化Ⅱ期临床试验,比较以MTX为基础的化疗联合放疗或ASCT之间的疗效差别。本研究中对于年龄≤65和ECOG≤2的患者,若诱导期化疗有效,则进行HDC+ASCT,有望进一步提高疗效,降低复发率。目前已经有3名患者完成整个化疗方案,正在随访中。
总之,由于PCNSL病例分散,目前国内尚无相关的前瞻性临床对照试验,因此我们利用本单位丰富的PCNSL病例资源,与北京大学肿瘤医院淋巴瘤科联合开展以HD-MTX为基础的诱导化疗联合HDC+ASCT,这也是我国首个基于HDC+ASCT的PCNSL前瞻性临床对照试验,该项研究成果有望为PCNSL治疗寻找有效的治疗方法,进一步提高PCNSL的临床疗效。
1Abrey LE, Yahalom J, DeAngelis LM. Treatment for primary CNS lymphoma: the next step [J]. J Clin Oncol, 2000, 18(17): 3144-3150.
2Shah GD, Yahalom J, Correa DD, et al. Combined immunochemotherapy with reduced whole-brain radiotherapy for newly diagnosed primary CNS lymphoma [J]. J Clin Oncol, 2007, 25(30): 4730-4735.
3Ferreri AJ, Reni M, Foppoli M, et al. High-dose cytarabine plus high-dose methotrexate versus high-dose methotrexate alone in patients with primary CNS lymphoma: a randomised phase 2 trial [J]. Lancet, 2009, 374(9700): 1512-1520.
4Makino K, Nakamura H, Hide T, et al. Salvage treatment with temozolomide in refractory or relapsed primary central nervous system lymphoma and assessment of the MGMT status [J]. J Neurooncol, 2012, 106(1): 155-160.
5Reni M, Zaja F, Mason W, et al. Temozolomide as salvage treatment in primary brain lymphomas [J]. Br J Cancer, 2007, 96(6): 864-867.
6Rubenstein JL, Hsi ED, Johnson JL, et al. Intensive chemotherapy and immunotherapy in patients with newly diagnosed primary CNS lymphoma: CALGB 50202 (Alliance 50202) [J]. J Clin Oncol, 2013, 31(25): 3061-3068.
7程岗, 章翔. 原发性中枢神经系统淋巴瘤 [J]. 中华神经外科疾病研究杂志, 2013, 12(4): 382-384.
8Cheng T, Forsyth P, Chaudhry A, et al. High-dose thiotepa, busulfan, cyclophosphamide and ASCT without whole-brain radiotherapy for poor prognosis primary CNS lymphoma [J]. Bone Marrow Transpl, 2003, 31(8): 679-685.
9Illerhaus G, Marks R, Ihorst G, et al. High-dose chemotherapy with autologous stem-cell transplantation and hyperfractionated radiotherapy as first-line treatment of primary CNS lymphoma [J]. J Clin Oncol, 2006, 24(24): 3865-3870.
Treatmentofprimarycentralnervoussystemlymphoma:aprospectivestudy
CHENGGang,WANGYaming,DONGChao,ZHANGLeiming,YUXin,YINFeng,ZHAOMingming,ZHAOHulin,FANGDandong,WANGPeng,LIHailong,GUOZhifeng,LIQinggang,WANGHongwei,JIABo,LIURui,ZHANGJianning
DepartmentofNeurosurgery,NavyGeneralHospitalofPLA,Beijing100048, China
ObjectiveA safe and effective treatment protocol for primary central nervous system lymphoma (PCNSL) in a prospective study is discussed.MethodsThirty-eight patients with PCNSL under 75 years were included in the study admitted to the hospital from February 2014 to February 2015. The patients were treated by methotrexate and temozolomide, and rituximab was used in some patients (MT-R protocol). Efficacy and safety of the protocol was investigated.ResultsAfter 2 cycles of treatment, PR was got in 31 patients, SD was achieved in 3 patients, and PD in 1 patient. There were 3 death cases. The effective rate was 81.58%. According to Eastern Cooperative Oncology Group (ECOG) performance status, 28 patients got 1 score after the treatment or the score was improved. The effective rate was 83.68%. Nausea and vomiting was common. Leucopenia happened in 6 patients. There were 3 death cases.ConclusionMT-R is a safe and effective treatment protocol for PCNSL. Dosage and treatment method need to be improved.
Primary central nervous system lymphoma; Methotrexate; Temozolomide; Rituximab
1671-2897(2016)15-005-04
R 739.4
A
程岗,主治医师,E-mail: yjscg2003@126.com
*通讯作者:张剑宁,主任医师,E-mail: jnzhang2005@163.com
2015-05-08;
2015-09-20)

