基于电子医疗档案的药品不良反应自动监测系统建设及应用
王啸宇,郭代红(解放军总医院药品保障中心,北京 100853)
基于电子医疗档案的药品不良反应自动监测系统建设及应用
王啸宇,郭代红(解放军总医院药品保障中心,北京 100853)
目的:了解基于电子医疗档案的药品不良反应自动监测系统发展概况,为ADR自动监测系统建设提供参考。方法:通过文献回顾性研究,归纳国内外ADR自动监测系统结构、标准、方法等方面研究与建设现状,思考并展望国内下一步工作趋向。结果:美欧开发的自动监测系统OMOP、MS、EU-ADR、PROTECT已应用多年,数据标准化、信号探测、流行病学方法创新、统计学模型开发等技术方面相对成熟。国内基于触发器技术的自动监测系统建设已有显著进步,但多属于科研团队在监测方法、管理模式等的探索性研究,尚没有成型的自动监测网络,文本识别技术应用尚待提升。结论:有待结合国情深化ADR事件侦测、方法学、质控标准、网络建设等研究,提高ADR自动监测效能,以获取详实的药物安全性评价数据。
药品不良反应;自动监测;电子医疗档案;统计学;触发器
自2011年我国《药品不良反应报告和监测管理办法》中要求开展药品重点监测,药品安全风险监管重心已由信息采集向技术评价转移。借助计算机信息化技术、基于触发器原理和文本信息识别技术、围绕电子医疗数据库开展的药品不良反应(adverse drug reaction,ADR)主动监测,称之为自动监测(automatic monitoring)更为准确。自动监测能够通过连续的预先设定程序收集ADR信息,达到全面获取ADR数量目的,具有病例基数大、病历资料详实、快速灵活等特点,迎合了医疗档案电子化的大趋势,不仅能得到真实世界准确的ADR发生率、进而获得相关风险评估数据,也能够转化临床提供用药风险的预警预测,为高水准安全风险评价奠定基础技术工作,近年来已得到快速发展。回顾国内外基于电子医疗数据库的ADR自动监测系统建设及应用情况,目前国际上较为成熟也已成为主流的有四个大型ADR自动监测网络,其他一些小型ADR自动监测系统虽各具特色,但研究思路多不出其右。本文综述该领域的研究现状,以期更好地开展药物安全评价,实施用药风险警示与防控。
1 医疗结果观测合作项目
由美国FDA、学术界、数据所有者、药企共同参与,美国国立卫生研究院资助的ADR主动监测网络研究公私合作计划——医疗结果观测合作项目(Observational Medical Outcomes Partnership,OMOP)是国际上最为重要的ADR主动监测系统。其目的是建立基于现有观察性数据库的全国性的药品安全主动监测网络,并提供数据结构模型、管理标准和方法学参考[1]。其研究的内容涉及主动监测网络建设的各方面,且透明度高,所有的课题内容、项目进度、研究成果均通过官方网站(http://omop.org/)向公众开放,信息共享。自2008年以来,OMOP取得很多重要成果。
1.1建立通用数据模型
真实世界中ADR主动监测系统的数据来源包括保险索赔数据库、医疗数据中心、电子病历系统等不同类型数据库,所采集的数据内容、数据格式差异明显,数据流通、集中处理难以实现。通用数据模型(Common Data Model,CDM)研究数据库内容、组织结构特点,建立库中词条与标准化词典的映射表,采集并处理患者人口学特征、诊断、用药情况等7类医疗数据,完成数据的标准化[2];所采用的标准化词典包括疾病词典SNOMED,药物词典RxNorm,不良事件词典LOINC。CDM的多中心数据流通性好,有利于数据库间的科研合作,但在随后的研究中发现,不同数据库的数据在使用CDM标准化后,异质性仍然会显著影响安全信号评估[3],仍需进一步优化。
1.2推进主动监测标准研究
基于数据库的ADR主动监测作为观察性研究,会受到目标结果的判断标准、统计学方法选择等多方面因素影响。为确保主动监测结果的准确性,OMOP发起了大量的主动监测相关标准的研究,可概括为2类:(1)ADR的诊断标准:OMOP在前人研究的基础上,以疾病编码系统为手段,整理了数据库中ADR事件的诊断标准,在实验中探索诊断标准对监测结果带来的影响[4]。(2)对照组选择的金标准:在观察性实验中,对照组的选择非常关键,极大地影响着实验结果。OMOP通过文献研究、统计学分析,确定了398个可供观察性实验选择的不良反应风险信号,其中包括164个阳性对照,234个阴性对照,涉及急性肝损伤、急性肾损伤、急性心肌梗死、上消化道出血4个ADR事件,7类181种怀疑药品[5]。
1.3开发主动监测相关方法
OMOP方法学实验室(http://omop.org/ methodlibrary)在现有的统计学模型的基础上,立足于CDM发展出一系列新的统计学方法。研究成果中可用于实践的统计学方法有13种,功能包括风险信号监测、ADR评估、偏倚控制等[6]。同时还评估了已有ADR自发上报系统的风险信号探测统计学模型,结果表明模型间的性能差异很小,但适用范围有所不同[7]。方法学与CDM及监测标准的研究是相辅相成的有机整体,CDM、监测标准为方法学的探索、应用提供条件,方法学又可评估前两者的建设水平,三者之间相互促进、验证,形成一个良好的科研生态系统。
2 迷你哨点
迷你哨点(Mini-Sentinel,MS)是美国FDA成立的Sentinel System的重要组成部分,其建立的初衷是基于大数据的主动监测方法对药物风险信号进行验证,由此发展成为集风险信号发现、验证、评估,数据结构及算法研究,政策评价于一身的大型ADR主动监测网络[8]。该系统可快捷、全面地提供监测结果,是ADR自发监测系统的有益补充,以其无法达到的视角分析ADR项目,弥补其不足。
2.1建成覆盖全国的主动监测网络
自2008年至今,MS已拥有18个数据伙伴,包括保险索赔数据库7个,医疗数据中心10个和独立电子病历系统1个,覆盖全美1.82亿人口,观察时间3.34亿人年。通过合作伙伴数据资源整合而成的离散型数据网络进行数据管理。为维护数据安全和尊重患者隐私,数据伙伴在各自防火墙内完成数据的提取、统计,然后只上传统计结果至运算中心进行汇总分析。MS在OMOP数据标准化研究的基础上结合各数据库特点完善了CDM,并开发集数据提取、统计运算功能于一体的模块化程序,作为数据收集工作的辅助[9]。这种离散型的数据网络极大地扩展了主动监测的数据覆盖范围,促进复杂实验设计和统计模型的使用。
2.2开展主动监测方法学研究
一是ADR选择、诊断标准的确定和验证,二是离散型数据网络中药品风险信号判定的统计学方法。由专家小组选定目标ADR,通过文献研究确定用于数据库病案检索的疾病编码及编码组合,测试疾病编码作为诊断标准的准确性[10]。照此路线,MS已确定了急性心肌梗死、过敏性休克、急性肝损伤等二十余个ADR诊断标准,并应用于主动监测。统计学方法研究方面,针对离散型数据网络这一特定数据结构进行的具有代表性的探索项目有:为解决离散统计结果汇总问题,探索病例中心制逻辑回归(case-centered logistic regression)、荟萃分析(Meta-analysis)应用范围、模型性能[11];为规定数据收集时间节点而进行的数据网络分组序贯分析、连续序贯分析统计效果的比较[12]。这些研究完善了MS的统计学理论基础和实践方法,对其他类型的数据网络研究亦具有借鉴意义。
2.3风险信号与政策评价
MS系统发起以来,已完成了对血管紧张素转换酶抑制剂与血管性水肿、达比加群与出血、戒烟药与心血管疾病、免疫球蛋白与溶血等诸多风险信号的评估,正在进行免疫球蛋白与血栓、胃肠道外铁剂与过敏反应等信号的深入挖掘。MS还研究了FDA关于长效β2受体使用与第二代抗精神病药的血糖监测指南[13]等行政行为在医疗行为中发挥的作用,对FDA政策的制定产生了一定的影响。
OMOP与MS同为FDA参与主动监测网络,但二者之间差异显著:前者专注于主动监测相关技术的开发与应用的基础研究,后者则针对真实世界ADR风险信号评价等现实开展工作。这种差异也表现在目标选择、对照选择等方面,OMOP对其目标ADR事件的所有相关药品进行分析,而MS采用专家小组咨询制度选择特定信号。而在流行病学和统计学设计上,OMOP多采用队列研究,MS多采用病例对照和自身对照,也使二者针对同一事件的统计结果存在一定差异[14]。
3 欧盟资助的跨国主动监测系统建设
由欧盟资助的跨国ADR主动监测系统有EUADR(Exploring and Understanding Adverse Drug Reactions)和PROTECT(Pharmacoepidemiological Research on Outcomes of Therapeutics by a European ConsorTium)两家,其数据来源是各国的医疗数据库,工作重点在于方法学研究,很少进行具体的危险信号验证。EU-ADR更是将所属的数据库、研究成果以网络平台(https://bioinformatics.ua.pt/euadr/)的形式向各国相关学科的研究人员开放,进行ADR及风险信号的研究,但两个系统间存在很大不同。
3.1EU-ADR
2008年启动该系统,一直致力于ADR的早期发现,即基于ADR事件对怀疑药物进行大范围筛选:由专家组选定监测方向后,通过文献研究分析ADR的药理学、生理学信息,探索ADR发生的合理性,如果合理即纳入怀疑信号,反之则舍弃[15]。相关研究包括制定文献筛选流程并将其自动化、建立机器学习数据库、数据提取标准等[16]。通过与自发报告系统在急性肝损伤、上消化道出血、急性肾损伤等ADR风险信号发现能力对比,EU-ADR在急性肝损伤、上消化道出血等背景干扰信号较多的ADR风险信号发现能力强于自发报告系统[17-18],是后者的有效补充。
3.2PROTECT
该系统研究重点在于主动监测方法学,包括监控和统计分析手段的开发和选择,特别是在监控网络危险信号评估程序测试、混杂因素及偏倚的控制等方面做了许多卓有成效的工作[19-21]。PROTECT的另一项工作为结合欧洲现有的数据库,测试自发报告系统中的危险信号评估方法[22]。结果表明不同方法的效能并无显著差别,但算法在不同类型数据库中的表现存在差异,应结合数据库的情况选择,这与OMOP研究成果相一致。
4 其他主动监测技术的开发
在上述主要大型ADR主动监测网络之外,国外还有许多小型ADR主动监测系统以及医院借助通用触发器工具系统开展的局部探索;研究思路受大型监测网络影响,缺乏创新特色。国内基于触发器技术的自动监测系统建设已有显著进步,但技术积累及相应的数据管理模式有限,多属于科研团队在监测方法、管理模式等的探索性研究,研发思路与国外以大型数据库为中心的网络化建设有较大差别,系统开发多基于医疗机构管理系统内的患者病历资料,以完善ADR上报机制和提供患者用药安全风险警示为主要目的,采用技术手段挖掘实验室检查指标或文本资料中的ADR信号。文献报道相对较少,也没有成型的自动监测网络。
4.1互联网搜索日志中ADR信号筛选
信息化时代互联网成为生活重要组成部分,通过分析网络中大众行为预测疾病、健康事件是流行病学领域新兴的热点,谷歌公司和微软公司都在进行此方面的研究[23-24]。在微软与斯坦福大学合作项目中,White团队[25]通过收集用户互联网搜索日志中关于药品及ADR的检索请求,梳理药品与ADR之间的时间关联性,使用自身对照模型甄别药品风险信号。该系统以OMOP制定的对照组金标准为测试案例进行测试,结果表明其在实验中准确性与传统方法相当。此尝试为ADR主动监测提供新的思路,然而真实世界中大众对不同ADR的认知存在偏倚,系统的监测能力难以预测。
4.2国内“医疗机构ADR主动监测与智能管理系统”
此系统在药品风险监测防控技术研究与药品安全性数据评价研究中完成度较高,系列性体现突出[26],是基于触发器原理、大数据挖掘技术开发而成。在该团队早前将体温作为触发条件筛选药物风险信号研究中[27],需人工完成的工作量过大,阳性率过低,适用性不佳。此后改变设计策略,强化了药品与ADR的针对性,并引进多重选择的相关指标,实施目标药物和住院病人肝肾功能、血小板、血红蛋白等多个ADR的自动监测,结果显示系统的ADR阳性报警率得到有效提升[28]。截止目前利用此系统开展的研究包括利奈唑胺与血小板减少、万古霉素与肾功能异常、阿托伐他汀与转氨酶异常、吉西他滨与贫血等,并实施有多中心后续研究,具有较好的实际意义[29-36]。但目前该系统监测项目仅限于相关的量化实验室检查指标,应用面有待进一步拓展。
4.3国内其他主动监测系统
潘雁等[37]基于院内HIS系统开发的化疗药物血液系统ADR监测软件,专科特色明显,但应用范围有限。陆晓彤等[38]、王明媚等[39]以丙氨酸氨基转移酶等检验数据为目标,设计研制的ADR自动监测系统,在发现新的肝功能损伤危险信号方面有一定作用,但目标单一且不能消除混杂因素,实用价值不乐观。耿魁魁等[40]探索医疗档案文本信息挖掘技术,利用“发热”、“骨髓抑制”等ADR常见术语作为关键词,搜索特定病区病例,过于依赖医生病案的书写规范化程度和关键词库的规模,且没有引入权重等关键词评价指标,其结果的阳性率难以提升。这些研究在尝试性文章发表后未再见后续报道,实际作用难以评价。
5 未来发展与思考
5.1信息化集中监测模式更为高效精准
涉及ADR监测的不同模式中,自发报告监测筛选风险信号,集中监测(主动监测)获取重点品种ADR发生率,并可据此开展流行病学研究得到相关风险数据,但其成本付出巨大。而借助专向研发软件实施的自动监测(信息化集中监测),虽然仍需人工审核系统给出的ADR信号,但因事先排除了大量无关病例而大大节省了人力和时间,使主动监测更趋高效精准。且评价员关注焦点更集中于系统筛选的病例,更易发现一些罕见ADR。而围绕电子医疗档案实施的自动监测不仅能得到真实世界准确的ADR发生率、进而获得相关风险评估数据,也能够转化临床提供用药风险的预警预测。详见表1。
5.2学习借鉴美欧先进技术
美欧将计算机及网络技术引进并形成ADR监测网络,在电子医疗档案中探测风险信号,大大降低其成本并提升监测效率。我们应吸收国外技术和开发经验,在基础建设、组织结构、方法学研究等方面缩小与国际水平的差距。但其也存在一些不足:(1)数据依赖合作伙伴,内容选择受限,例如MS的主要数据来源为保险索赔数据库,而索赔数据库中不包括实验室检查结果,无法从实验室结果做出全面的分析[41];(2)数据采集滞后,临床上发生的数据需经过数据伙伴的收集整理,电子化、标准化后才能被系统采用;(3)主要为大数量的风险信号的处理,无法进行病人个体医疗过程中的用药风险监控。
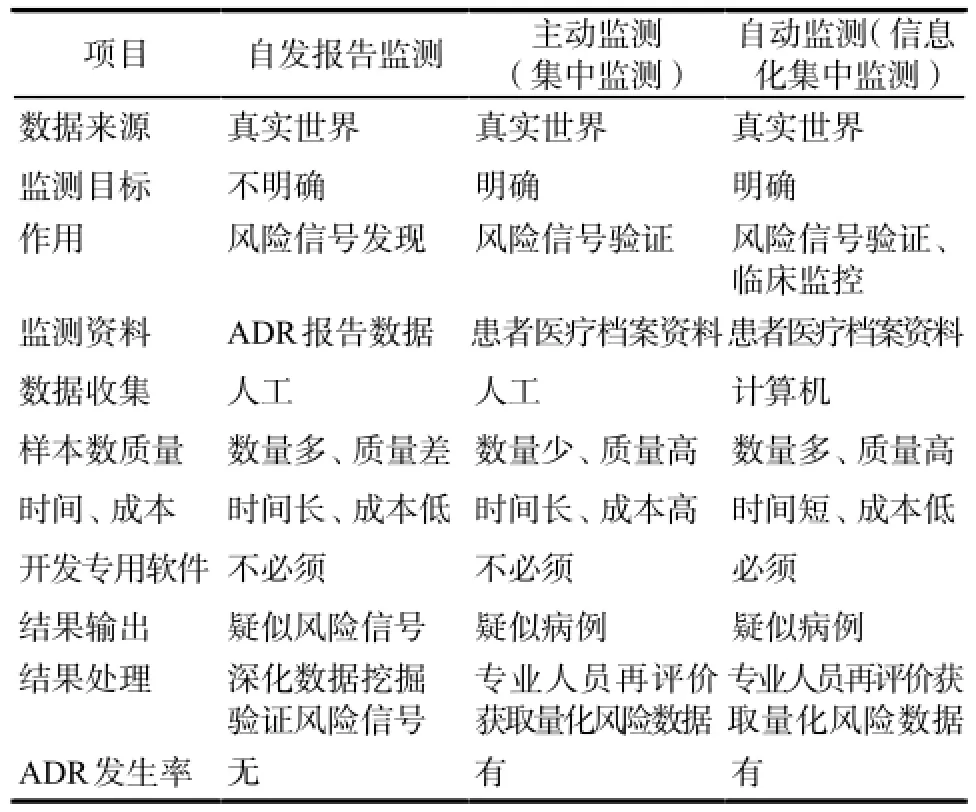
表1 不同ADR监测方法的特点Tab 1 Characteristics of different ADR monitoring methods
5.3结合国情逐步强化ADR监测
ADR主动监测是药品上市后安全性评价的重要环节,也是ADR风险信号评估的重要手段,实施自动监测应结合国情在以下方面进行系统完善:
5.3.1深化ADR识别技术,强化医疗文本资料的利用
宜在法基础上,探索自然语序处理手段,运用贝叶斯网络、决策树等文本分类方法,筛选ADR信号,拓展主动监控项目。期间宜考虑服务器负荷、监测效率等,结合实践经验权衡系统的多选择适用性;特别是在复杂的药品不良反应事件中,应联合采用实验室检验结果与医疗文本资料进行分析。
5.3.2推进方法学研究,建立质控标准提取自HIS的数据,同质化程度越高,越有利于得到更为可信的评价结果。成熟的主动监测系统是建立在充分的方法学研究的基础上,这其中包括统计学、流行病学、计算机等新方法探索,还应借助已有方法开展对比研究,如病例筛选纳入排除标准的对照、系统混杂因素控制方法的对照等。对性能测试、结果表达等环节还应建立普适性标准,减少研究间的差异性,提高研究结果的可重复性。
5.3.3构建医疗机构为哨点的主动监测网络医疗机构是国内ADR报告的主体,报告人临床实践经验丰富;在哨点医院建设自动监测软件端口,完成数据标准化并结合现有ADR报告网络上传数据,可在短时间内建立起覆盖全国的主动监测网络。既可开展大范围信息收集以完成风险信号的发现与评估,还可利用统计学手段进行广泛筛查,发挥大数据优势,分析已完成标准化数据中ADR的影响因素。
[1] Harpaz R,DuMouchel W,Shah NH,et al. Novel data-mining methodologies for adverse drug event discovery and analysis[J]. Clin Pharmacol Ther,2012,91(6): 1010-1021.
[2] Overhage JM,Ryan PB,Reich CG,et al. Validation of a common data model for active safety surveillance research[J]. J Am Med Inform Assoc,2012,19(1): 54-60.
[3] Madigan D,Ryan PB,Schuemie M,et al. Evaluating the impact of database heterogeneity on observational study results[J]. Am J Epidemiol,2013,178(4): 645-651.
[4] Hansen RA,Gray MD,Fox BI,et al. How well do various health outcome definitions identify appropriate cases in observational studies?[J]. Drug Saf,2013,36(Suppl 1): S27-S32.
[5] Overhage JM,Ryan PB,Schuemie MJ,et al. Desideratum for evidence based epidemiology[J]. Drug Saf,2013,36(Suppl 1): S5-S14.
[6] Madigan D,Stang PE,Berlin JA,et al. A systematic statistical approach to evaluating evidence from observational studies[J]. Annu Rev Stat Its Appli,2014,1(1): 11-39.
[7] Harpaz R,DuMouchel W,LePendu P,et al. Performance of pharmacovigilance signal-detection algorithms for the FDA adverse event reporting system[J]. Clin Pharmacol Ther,2013,93(6): 539-546.
[8] McClure DL,Raebel MA,Yih WK,et al. Mini-Sentinel methods: framework for assessment of positive results from signal refinement[J].Pharmacoepidemiol Drug Saf,2014,23(1): 3-8.
[9] Toh S,Avorn J,D'Agostino RB Sr,et al. Re-using Mini-Sentinel data following rapid assessments of potential safety signals via modular analytic programs[J]. Pharmacoepidemiol Drug Saf,2013,22(10): 1036-1045.
[10] McPheeters ML,Sathe NA,Jerome RN,et al. Methods for systematic reviews of administrative database studies capturing health outcomes of interest[J]. Vaccine,2013,31(Suppl 10): K2-K6.
[11] Toh S,Reichman ME,Houstoun M,et al. Multivariable confounding adjustment in distributed data networks without sharing of patient-level data[J]. Pharmacoepidemiol Drug Saf,2013,22(11): 1171-1177.
[12] Silva IR,Kulldorff M. Continuous versus group sequential analysis for post-market drug and vaccine safety surveillance[J]. Biometrics,2015,71(3): 851-858.
[13] Raebel MA,Penfold R,McMahon AW,et al. Adherence to guidelines for glucose assessment in starting second-generation antipsychotics[J]. Pediatrics,2014,134(5): e1308-e1314.
[14] Bell C,Chakravarty A,Gruber S,et al. Characteristics of study design and elements that may contribute to the success of electronic safety monitoring systems[J]. Pharmacoepidemiol Drug Saf,2014,23(11): 1223-1225.
[15] Coloma PM,Schuemie MJ,Trifirò G,et al. Drug-induced acute myocardial infarction: identifying 'prime suspects' from electronic healthcare records-based surveillance system[J]. PLoS One,2013,8(8): e72148.
[16] Avillach P,Dufour JC,Diallo G,et al. Design and validation of an automated method to detect known adverse drug reactions in MEDLINE: a contribution from the EU-ADR project[J]. J Am Med Inform Assoc,2013,20(3): 446-452.
[17] Pacurariu AC,Straus SM,Trifiro G,et al. Useful interplay between spontaneous ADR reports and electronic healthcare records in signal detection[J]. Drug Saf,2015,38(12): 1201-1210.
[18] Patadia VK,Coloma P,Schuemie MJ,et al. Using real-world healthcare data for pharmacovigilance signal detection —the experience of the EU-ADR project[J]. Expert Rev Clin Pharmacol,2015,8(1): 95-102.
[19] Uddin MJ,Groenwold RH,Van Staa TP,et al. Performance of prior event rate ratio adjustment method in pharmacoepidemiology: a simulation study[J]. Pharmacoepidemiol Drug Saf,2015,24(5): 468-477.
[20] Hazelbag CM,Klungel OH,Van Staa TP,et al. Left truncation results in substantial bias of the relation between time-dependent exposures and adverse events[J]. Ann Epidemiol,2015,25(8): 590-596.
[21] Cederholm S,Hill G,Asiimwe A,et al. Structured assessment for prospective identification of safety signals in electronic medical records: evaluation in the health improvement network[J]. Drug Saf,2015,38(1): 87-100.
[22] Candore G,Juhlin K,Manlik K,et al. Comparison of statistical signal detection methods within and across spontaneous reporting databases[J]. Drug Saf,2015,38(6): 577-587.
[23] Ginsberg J,Mohebbi MH,Patel RS,et al. Detecting influenza epidemics using search engine query data[J]. Nature,2009,457(7232): 1012-1014.
[24] White RW,Tatonetti NP,Shah NH,et al. Web-scale pharmacovigilance: listening to signals from the crowd[J]. J Am Med Inform Assoc,2013,20(3): 404-408.
[25] White RW,Harpaz R,Shah NH,et al. Toward enhanced pharmacovigilance using patient-generated data on the internet[J]. Clin Pharmacol Ther,2014,96(2): 239-246.
[26] 陈超,郭代红,薛万国,等.住院患者药品不良事件主动监测与评估警示系统的研发[J].中国药物警戒,2013,10(7):411-414,418.
[27] 王远航,刘皈阳,张艳君,等.住院患者药品不良反应自动化监测技术探讨[J].中国药物应用与监测,2010,7(2):70-73.
[28] 陈超,徐元杰,郭代红,等.计算机技术在医疗机构药品安全性监测中的应用进展[J].中国药房,2014,25(5):461-464.
[29] 朱曼,陈超,郭代红.万古霉素相关肾毒性的主动监测研究[J].中国药物应用与监测,2014,11(1):26-29.
[30] 王伟兰,陈超,郭代红.吉西他滨相关性贫血的主动监测研究[J].中国药物应用与监测,2014,11(1):29-30,59.
[31] 裴斐,陈超,郭代红.阿托伐他汀致转氨酶异常升高的主动监测研究[J].中国药物应用与监测,2014,11(1):31-33.
[32] 郭代红,陈超,马亮,等.5所医院住院患者ADE警示系统主动监测数据分析与评价[J].中国药物应用与监测,2014,11(6):368-371.
[33] 陈超,郭代红,王东晓,等.利奈唑胺相关性血小板减少的主动监测研究[J].中国药物应用与监测,2014,11(1):22-25.
[34] 郭代红,陈超,李罄,等.6所医院414例利奈唑胺相关性血小板减少集中监测研究[J].药物流行病学杂志,2013,22(3):109-113.
[35] 陈超,郭代红,曹秀堂,等.住院患者使用利奈唑胺致相关性血小板减少症的危险因素分析[J].中国药物警戒,2012,9(2):71-76.
[36] 郭代红,王丽,陈超,等.410例住院患者的利奈唑胺用药评估及影响因素分析[J].中国药物应用与监测,2011,8(2):69-74.
[37] 潘雁,许海静,朱珺.化疗药物血液学不良反应监测软件的设计及应用[J].中国药房,2011,22(1):87-89.
[38] 陆晓彤,刘海涛,张健.基于医院信息系统的肝酶升高药品不良反应自动监测系统研究[J].中国药房,2012,23(22):2080-2082.
[39] 王明媚,王冬艳,周亮,等.利用医院信息系统监测分析药物性肝损伤[J].药物流行病学杂志,2014,23(2):88-91.
[40] 耿魁魁,刘圣,沈爱宗,等.医院信息系统中药品不良反应主动监测系统的构建[J].中国医院药学杂志,2012,32(14):1147-1149.
[41] Raebel MA,Haynes K,Woodworth TS,et al. Electronic clinical laboratory test results data tables: lessons from Mini-Sentinel[J]. Pharmacoepidemiol Drug Saf,2014,23(6): 609-618.
专家介绍
郭代红,全军药品不良反应监测中心主任、解放军总医院医学保障部药品保障中心名誉主任,主任药师、硕士生导师。1983年毕业于北京医学院药学系。主要研究方向是临床药学与药物警戒。近年来先后主持国家自然科学基金、军队十一五、十二五、科技专项、后勤科技重点等课题十多项,以第一和通讯作者发表论文近百篇,主编、参编书籍近20部,以第一负责人获军队教学成果一等奖1项、军队科技成果二、三等奖各1项、参与获奖多项。
现任中国药学会军事药学专委会副主委;中国医药教育协会临床合理用药专委会副主委;中国药理学会TDM委员会常委暨循证药学学组副主委;中国医院协会药事管理委员会常委;中华医学会临床药学分会委员;解放军药学专委会副主委暨军队药物评价分委会主委;北京中西医结合学会药学分委会主委;北京医学会临床药学分委会副主委;北京药学会医院药学分委会副主委等。担任《中国药物应用与监测》杂志主编,《药物流行病学杂志》副主编,《药学实践杂志》常务编委,《药物不良反应杂志》、《中国药物警戒》等杂志编委。
Construction and application of adverse drug reaction automatic monitoring system based on the electronic healthcare record
WANG Xiao-yu,GUO Dai-hong(Department of Pharmaceutical Care,PLA General Hospital,Beijing 100853,China)
Objective: To overview the development of adverse drug reaction automatic monitoring system based on the electronic healthcare record,and provide references for designing of ADR automatic monitoring system. Methods: The current situations of ADR automatic monitoring system were retrospectively studied. Then the prospects of domestic development was forecasted. Results: The automatic monitoring systems,such as OMOP,MS,EU-ADR,PROTECT,that came from Western Country were applied for many years. Techniques of data standardization,signal detection,the innovation of epidemiological methods and statistic models are relatively mature. The domestic automatic monitoring systems are in the initial stage. There is no complete automatic monitoring network in China. Some Chinese research teams had made some progress in trigger technology area,monitoring methods and management,while the text technology needs to be improved. Conclusion: In order to improve the performance of the ADR automatic monitoring and get the detailed data about drug safety evaluation,according to national conditions,we should enhance technical level of ADR detecting,methodology,quality control standards and network constructions.
Adverse drug reaction; Automatic monitoring; Electronic healthcare record; Statistics; Trigger
R95
A
1672 - 8157(2016)01 - 0001 - 06
2014年全军后勤科研重点项目(BWS14R039)
郭代红,女,主任药师,硕士生导师,主要从事临床药学及药事管理工作。E-mail:guodh301@163.com
王啸宇,男,药师,硕士研究生,主要从事自动监测系统研发工作。E-mail:metallica365@126.com
(2015-11-20
2015-12-23)

