香椿老叶中黄酮与皂苷的含量测定
赵艳霞,刘常金,宛红颖
(1.济宁医学院法医学与医学检验学院,山东济宁272067;2.天津科技大学食品工程与生物技术学院天津300457)
香椿老叶中黄酮与皂苷的含量测定
赵艳霞1,刘常金2,宛红颖2
(1.济宁医学院法医学与医学检验学院,山东济宁272067;2.天津科技大学食品工程与生物技术学院天津300457)
以香椿老叶为材料,以乙醇为提取溶剂,对提取物中的黄酮和皂苷含量进行测定,使用HPLC方法对黄酮的种类进行了初步鉴定。结果表明,以质量分数计,香椿老叶中黄酮和皂苷的百分含量分别为(6.615±0.02)%和(3.917±0.05)%。HPLC结果表明,香椿老叶中的黄酮主要有3种,并含有1种非黄酮类的酚类物质,以质量分数计,4种化合物的百分含量分别为:芦丁(1.55±0.01)%、槲皮素(2.27±0.05)%、山奈酚(1.31±0.01)%、没食子酸(0.87±0.02)%。
香椿;黄酮;皂苷;酚类物质
香椿(Toona sinensis)是我国著名的传统木本蔬菜,属于楝科香椿属多年生落叶乔木,其嫩芽具有独特的香气,富含多种营养素,深受广大消费者喜爱。香椿的种子、根皮、叶片等部位可以作为中草药进行配伍,具有多种医疗保健作用,含有多种生物活性成分。陈铁山等对香椿种子、叶片中主要的化学成分以及种子挥发油进行了研究,结果发现香椿叶中含有黄酮、萜类、蒽醌、内酯、皂苷、鞣质、生物碱等重要药用成分,种子含有醛、酮、萜类、皂苷、甾体、硫醇类化合物、多元醇类化合物、芳香族类化合物等[1]。刘忠良等运用GCMS分析了香椿籽油中的化学成分,分离并鉴定出39个组分,得到的主要化学成分为萜烯类(多为倍半萜类),其中含量较多的为反-石竹烯、白菖烯、γ-榄香烯、α-长蒎烯等[2]。程传格等采用正己烷回流萃取得到香椿籽油并进行皂化-甲酯化,通过GC-MS方法鉴定出39种成分,包括22种为脂肪酸,占94.4%,其中亚油酸的含量最高达83.4%,其次是棕榈酸和硬脂酸,17种为萜烯类化合物,占4.0%[3]。谷月玲等采用GCMS对同步蒸馏萃取得到的香椿叶精油进行了分析,共定性鉴定出55种化合物,其中含氧化合物38种,有酯14种、醇15种、醛和酮7种、含氮化合物2种,碳氢类化合物15种[4]。张仲平等发现香椿叶中含有丰富的小分子鞣质、原花色苷、黄酮醇苷、皂苷、有机酸等,利用薄层色谱分析(TLC)得到香椿叶经水解后的苷元主要是槲皮素、山萘酚;多酚中含黄酮类苷和苷元、没食子酸、没食子儿茶素缩合鞣质、没食子鞣质、单体原花青素等成分,其中香椿叶中黄酮含量经过高效液相色谱法(HPLC)定量分析得出高于相同生长期的银杏叶1倍多[5]。李秀信等对香椿果壳、果实部位黄酮类化合物进行了分析研究,结果表明,香椿果壳及果实中含有黄酮、黄酮醇、二氢黄酮、二氢黄酮醇等多种黄酮类化合物[6]。由于产地不同和品种不同,香椿中的黄酮、酚类及皂苷等物质含量不同,对于中草药的功效会产生一定的影响。王昌禄等对香椿的三萜皂苷含量进行了分析测定,发现香椿中皂苷的含量较高[7]。刘常金等对于不同季节和产地的香椿黄酮和皂苷进行了分析测定,发现不同产地和品种的香椿黄酮和皂苷存在明显差异[8]。
本研究以山东省曲阜市产的香椿老叶为材料,测定了其中的黄酮与皂苷含量,并对黄酮的主要单体物质进行了初步鉴定,目的是为香椿功效成分研究和产品开发提供依据。
1 仪器及材料
1.1材料
香椿老叶2014年秋季采自山东省曲阜市香椿基地,采收后自然晾晒,干燥后粉碎成60目粉末,冰箱中保存。
1.2试剂
人参皂苷、芦丁、没食子酸、山奈酚标准对照品:均购自中国药品生物制品研究所;氢氧化钠:天津北方天医试剂厂;高氯酸:天津北方天医试剂厂;香草醛:上海静融生物科技有限公司;乙醇:天津化学试剂一厂。
1.3试验仪器
TE214S电子天平:赛多科斯科学仪器有限公司;SHB-3型循环水式多用真空泵、R-1001N旋转蒸发仪:郑州长城科工贸有限公司;HL-1S恒流泵、BS-100A自动部分收集器:上海泸西分析仪器厂有限公司;Venusil MP-C18色谱柱(4.6 mm×250 mm):天津博纳艾杰尔科技有限公司;ZF-C型三用紫外分析仪:上海长明光学电子仪器厂;HPLC 2489型:WATERS公司。
2 试验方法
2.1提取方法
将香椿老叶置于烘箱内(55℃)充分烘干24 h,将干燥后的香椿叶用粉碎机进行粉碎,然后过60目筛,香椿老叶粉在冰箱存放备用。
称取1 kg香椿叶粉,采用事先优化的最佳提取工艺进行浸提,用15 L体积分数为60%的乙醇60℃水浴震荡提取2 h后抽滤,滤渣加入15 L体积分数为60%的乙醇60℃再次水浴振荡提取2 h,合并两次提取液。用旋转蒸发仪,减压浓缩,得到香椿黄酮和皂苷的粗提液。
2.2总黄酮的测定
2.2.1芦丁标准曲线的制作
采用NaNO2-Al(NO3)3比色法测定总黄酮的含量,准确称取芦丁标准品100 mg,用体积分数为60%乙醇溶解,最后用体积分数为60%的乙醇定容至100 mL,装入棕色瓶中置4℃冰箱保存备用。准确吸取1 mg/mL芦丁标准溶液5 mL用体积分数为60%乙醇溶液定容至50 mL,摇匀得到质量浓度为100 μg/mL的芦丁标准样液,分别吸取0、12、15、18、21、24、27、30 mL于50 mL容量瓶,然后加入1.5 mL 5%NaNO2溶液后摇匀,6 min后加入1.5 mL质量分数为10%的Al(NO3)3溶液,摇匀,放置6 min后加入10 mL质量分数为4% NaOH的溶液,混匀后用体积分数为60%乙醇定容到刻度,摇匀,15 min后,以第一支试管溶液为空白,在510 nm的条件下测定吸光值,以芦丁添加量(mg)为横坐标,以吸光值A作为纵坐标,绘制标准曲线。
2.2.2提取液中总黄酮的含量测定
取香椿提取液过滤,将滤液置于容量瓶并定容至100 mL作为待测液,取1 mL待测液,按照标准曲线的方法测其吸光度。根据以下公式计算提取液中总黄酮的含量,计算公式:
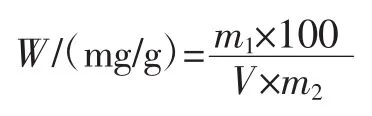
式中:W为香椿老叶子中总黄酮的含量,mg/g;m1为由标准曲线换算得的总黄酮质量,mg;m2为称取香椿老叶子的质量,g;V为添加待测提取液的体积,mL。
2.3总皂苷的测定
2.3.1人参皂苷标准曲线的制作
采用香草醛-冰乙酸比色法测定总皂苷含量。准确称取人参皂苷20 mg,加入到10 mL容量瓶中,用甲醇溶解并定容到刻度,得到质量浓度为2 mg/mL的标准溶液,准确吸取标准溶液25、50、75、100、125 μL于刻度试管,挥发干溶剂,冷却后加入质量分数为5%的香草醛-冰乙酸溶液0.2 mL,再加入高氯酸0.8 mL,充分混匀,盖塞后密封,60℃条件下水浴15 min,冷至室温加冰乙酸5 mL,摇匀后于560 nm的条件下比色测定吸光值,以人参皂苷添加量(mg)为横坐标,以吸光值A作为纵坐标,绘制标准曲线。
2.3.2提取液中总皂苷的含量测定
取香椿提取液过滤,将滤液置于容量瓶并定容至100 mL作为待测液,准确吸取待测液100 μL,按照标准曲线相同的测定方法测吸光度。根据以下公式计算提取液中总皂苷的含量,计算公式:

式中:W为香椿老叶子中总皂苷的含量,mg/g;m1为由标准曲线换算得的总皂苷质量,mg;m2为称取香椿老叶子的质量,g;V为添加待测液的体积,mL。
2.4香椿中黄酮各组分的HPLC分析
2.4.1高效液相色谱条件
泵:二元梯度泵,流速为1.0 mL/min;色谱柱:C18柱(250 mm×5 mm,5 μm),柱温40℃;流动相A:100%纯甲醇;流动相B:0.1%磷酸水溶液;检测波长:255nm。梯度洗脱的时间和洗脱液配比见表1。
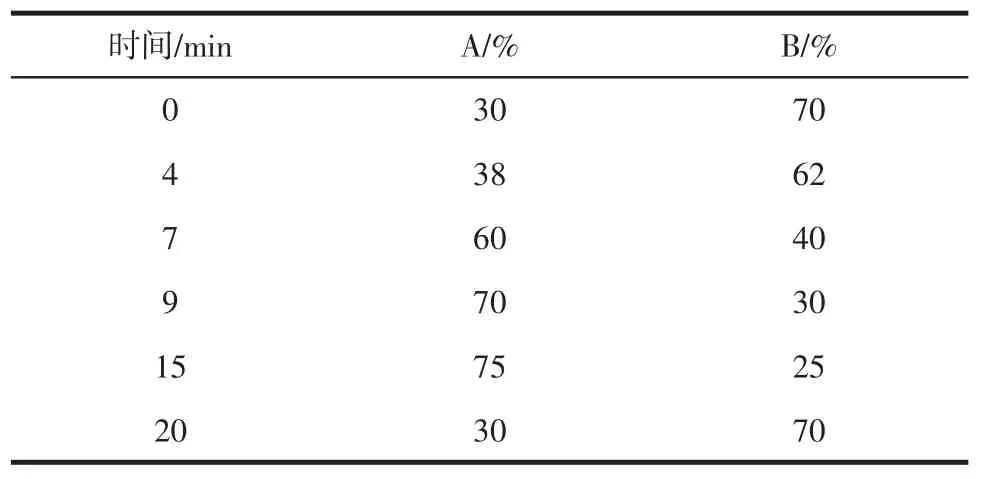
表1 梯度洗脱的时间和洗脱液配比Table 1 Gradient elution and solution A and solution B ratio
2.4.2线性条件
精确称取芦丁对照品10.00 mg置于10 mL容量瓶中,用体积分数为80%甲醇溶解并定容至刻度,得到质量浓度为1.000 mg/mL的芦丁对照品溶液。
精确称取没食子酸对照品0.9700mg置于10mL容量瓶中,用体积分数为80%甲醇溶解并定容到刻度,得到质量浓度为0.097 00 mg/mL的没食子酸对照品溶液。
精确称取槲皮素对照品10.00 mg置于10 mL容量瓶中,用80%甲醇溶解并定容到刻度,得到质量浓度为1.000 mg/mL的槲皮素对照品溶液。
精确称取山奈酚对照品1.020 mg置于10 mL容量瓶中,用80%甲醇溶解并定容到刻度,得到质量浓度为0.1020 mg/mL的山奈酚对照品溶液。
精确吸取上述配制好的芦丁对照品溶液0.48 mL、没食子酸对照品溶液2.8mL、槲皮素对照品溶液0.70mL、山奈酚对照品溶液2.1 mL于10 mL容量瓶中混匀,然后用体积分数为80%的甲醇溶液定容,得到混合标准品溶液。然后将混合标准品分别稀释为1/8、2/8、4/8和6/8的混合标准溶液。准确按2.4.1的色谱条件,对配制好的不同浓度梯度的混合标准溶液进行分析测定,进样量为10 μL,每个浓度测定5次取其平均值,以峰面积为纵坐标,各标准品的质量浓度为横坐标,绘制标准曲线,得到回归方程。
3 结果与分析
3.1香椿总黄酮与总皂苷的含量测定
3.1.1香椿总黄酮的含量测定
3.1.1.1芦丁标准曲线的制作
以芦丁为标准品,通过分光光度法制定黄酮标准曲线,以芦丁的含量为(mg)横坐标X,吸光度值(A)为纵坐标Y,绘制标准曲线。得到芦丁添加量X与吸光度Y关系曲线的回归方程为:y=0.254 7x+0.001 4,相关系数R2=0.999 4(如图1),线性范围为:0~3.0 mg。

图1 芦丁标准曲线Fig.1 The standard curve of rutin reference
3.1.1.2提取液中总黄酮的含量
按照方法中的提取方法,对3份香椿老叶进行提取,分别测定3份香椿中黄酮的含量,每份平均测定3次,最后取其平均值,经过换算得到香椿老叶中总黄酮的百分含量为(6.615±0.02)%。
3.1.2香椿总皂苷的含量测定
3.1.2.1人参皂苷标准曲线的制作
以人参皂苷为标准品,采用香草醛法制定总皂苷测定的标准曲线,以人参皂苷的量为(mg)横坐标x,吸光度值(A)为纵坐标y,绘制标准曲线。得到人参皂苷添加量X与吸光度值Y关系曲线的回归方程为:y= 3.798 7x-0.012 6,相关系数R2=0.999 2(如图2),线性范围0~0.22 mg。

图2 人参皂苷标准曲线Fig.2 The standard curve of ginsenoside reference
3.1.2.2提取液中总皂苷的含量
按照与黄酮提取相同的方法分别处理3份香椿老叶,分别测定3份香椿中总皂苷的含量,每份平均测定3次,最后取其平均值,经过换算得到香椿干叶中总皂苷的百分含量为(3.917±0.05)%。
3.2香椿黄酮中的各组分的高效液相色谱分析
3.2.1香椿黄酮中的各组分的液相色谱图
采用芦丁、槲皮素、山奈酚、没食子酸为标准品进行HPLC分析,同时分析香椿提取液及酸解后的主要黄酮苷元和酚类物质,结果如图3所示。

图3 芦丁、槲皮素、山奈酚、没食子酸标准品的HPLC图谱Fig.3 HPLC graph of standard including rutin,quercetin,kaempferol and gallic acid
3.2.2精密度试验

图4 香椿提取液酸解前的HPLC图谱Fig.4 HPLC graph of TS extract before acid hydrolysis

图5 香椿提取液酸解后的HPLC图谱Fig.5 HPLC graph of TS extract after acid hydrolysis
芦丁、没食子酸、槲皮素、山奈酚的质量浓度分别为48、27、70、21 μg/mL的混合标准品溶液重复进样5次,根据各标准品的峰面积,计算相应的RSD值分别为:0.313%、0.92%、0.316%、1.013%,结果表明仪器精密度良好。
3.2.3稳定性试验
芦丁、没食子酸、槲皮素、山奈酚质量浓度分别为48、27、70、21 μg/mL的混合标准品溶液在配制0、2、4、8、10、24 h后分别重复进样5次,根据各标准品的峰面积,计算相应的RSD值分别为:0.34%、1.125%、0.335%、1.176%,结果表明,供试样品溶液在24小时内稳定。
3.2.4香椿提取液中黄酮各组分的含量测定
提取液样品中芦丁、没食子酸、槲皮素、山奈酚的含量的测定结果见表2。

表2 香椿老叶中主要酚类物质含量Table 2 The main phenolics of TS old leaves
4 结论
1)利用酒精浸提法,料液比为1∶15(kg/L),60℃振荡提取2 h后得到香椿的粗提取液。以芦丁为标准品,采用NaNO2-Al(NO3)3比色法测定得到香椿老叶中总黄酮的百分含量为(6.615±0.02)%;以人参皂苷为标准品,采用香草醛-冰醋酸的方法测定得到香椿干叶中总皂苷的百分含量为(3.917±0.05)%。
2)通过对香椿提取液中各组分HPLC分析,得出香椿提取物中芦丁、槲皮素、山奈酚、没食子酸的百分含量分别为(1.55±0.01)%、(2.27±0.05)%、(1.31±0.01)%、(0.87±0.02)%。
本研究表明,曲阜生产的香椿老叶中含有丰富的抗氧化活性物质黄酮、酚类物质及皂苷等,适合作为生产抗氧化天然产物的提取原料,为开发保健品和天然抗氧化剂提供物质基础。
[1]陈铁山,罗忠萍,崔宏安,等.香椿化学成分的初步研究[J].陕西林业科技,2000(2):1-2
[2]刘忠良,马天波,孙立明.香椿籽挥发油的GC-MS[J].中国药学杂志,2002,37(2):94-96
[3]程传格,王晓,江婷,等.香椿籽油成分的GC-MS分析[J].分析测试学报,2001,20(4):74-76
[4]谷月玲,胡耿源,傅水玉.香椿叶精油成分的研究(2)香椿叶精油的GC/MS定性分析[J].质谱学报,1994,17(4):57-59
[5]张仲平,孙英,牛超,等.香椿多酚类化介物的提取、分离和薄层研究[J].中国野生植物资源,2002,21(4):52-53
[6]李秀信,张院民,刘青利,等.香椿叶中黄酮成分的分析鉴定[J].西北林学院学报,2001,16(增):86-88
[7]王昌禄,栾颖,陈志强,等.薄层分离-分光光度法测定楝科植物中三萜皂苷含量[J].安徽农业科学,2008,36(14):5708-5712
[8]刘常金,江慎华,王昌禄,等.不同季节与产地香椿黄酮与皂苷的含量变化[J].天津科技大学学报,2006,21(1):18-20
Determination of Flavonoids and Saponins in Old Leaves of Toona sinensis
ZHAO Yan-xia1,LIU Chang-jin2,WAN Hong-ying2
(1.Institute of Forensic Medicine and Laboratory Medicine,Jining Medical University,Jining 272067,Shandong,China;2.School of Food Science and Technology,Tianjin University of Science and Technology,Tianjin 300457,China)
The contents of flavonoids and saponins in Toona sinensis(TS)old leaves were determined with alcoholic solution as extracting solvents,and the detailed components of flavonoids of TS were analyzed with HPLC method.The results showed that the percentage contents of flavonoids and saponins in TS old leaves amounted to(6.615±0.02)%and(3.917±0.05)%,respectively.There were three kinds of flavonoids and one polyphenols in extracts with HPLC analysis,and the content was as following,rutin(1.55±0.01)%,quercetin(2.27±0.05)%and kaempferol(1.31±0.01)%,gallic acid(0.87±0.02)%,respectively.
Toona sinensis;flavonoids;saponins;phenolics
10.3969/j.issn.1005-6521.2016.21.031
赵艳霞(1969—),女(汉),高级实验师,硕士,研究方向:天然产物化学。
2015-12-14

