高效凝胶色谱法测定猴头菇多糖分子量及含量
周春晖,周丹丹,刘婷婷,马炳南
(广东太阳神集团有限公司,广东 广州510665)
高效凝胶色谱法测定猴头菇多糖分子量及含量
周春晖,周丹丹,刘婷婷,马炳南
(广东太阳神集团有限公司,广东 广州510665)
利用高效凝胶过滤色谱法(GFC),示差折光检测猴头菇子实体和猴头菇口服液中的猴头菇多糖的分子量和含量。通过建立不同分子量的葡聚糖标准品校正曲线,测定了猴头菇多糖的分子量和分子量分布;以保留时间与猴头菇多糖最接近的葡聚糖作为标准品,利用峰面积外标法定量测定猴头菇多糖的含量。结果表明,猴头菇子实体和猴头菇口服液多糖数均分子量Mn均为1.6×104Da,重均分子量Mw均为1.7×104Da,分布宽D值在1.05~1.07范围,重复良好。猴头菇子实体多糖含量为0.66%,猴头菇口服液多糖含量为37.1mg/100mL,方法学验证基本符合要求。
猴头菇多糖;凝胶过滤色谱法(GFC);分子量;含量
猴头菇(Hericium erinaceus)是一药膳两用菌,性平、味甘。研究证明,其提取物对多种消化系统疾病如慢性胃炎、消化不良和胃溃疡都具有较好的疗效,同时猴头菌还具有抗肿瘤、免疫调节、抗衰老、降血糖和保护神经等活性[1-7]。目前已广泛应用于药品、保健食品及食品等领域,随着现代科学技术的发展和临床试验的反复证明,猴头菇的功效价值不断地被挖掘出新的内涵,在产品剂型上,在传统的丸、片、汤剂基础上开发出了口服液、浸膏、酒、粉剂、乳品、蛋糕、蜜饯、饮料、饼干等多种产品。其中猴头菇口服液对胃黏膜损伤的保护功能尤为突出[8-9]。
一般认为,猴头菇的主要活性成分是多糖。除多糖外,猴头菌还含有低聚糖甾醇类猴头菌素和猴头菌酮等生物活性物质[10],其中研究最多的、最引起人们注意的是猴头菇多糖类物质。猴头菇中糖类物质主要以多糖、糖蛋白、糖苷的形式存在[11]。关于猴头菇多糖的组成,多数认为是由葡萄糖、半乳糖、甘露糖组成,以葡萄糖为主,是由β(1→3)键连接的主链和β(l→6)键连接的支链构成的葡聚糖[12-13]。多糖的活性,特别是抗肿瘤作用与其聚合度、分子量有关[14],故掌握其多糖分子量和含量对猴头菇运用具有较强的科学依据。
真菌多糖的应用价值已受到人们的关注,但其各方面的研究缺乏系统性,对活性起决定作用的结构和机理的研究不够深入,另外在哪种提取和分析方法是否灵敏适用方面缺乏相应的参考[15]。传统的多糖含量可用硫酸-酚法测定,蛋白含量用Lowry法测定,分子量的测定常采用超滤、沉降法等测定[16],其操作方法比较繁琐。高效凝胶过滤色谱法(GFC)因其快速、简便、准确,近年广泛应用于实验室中多糖的分子量和含量测定[17-18]。目前,香菇多糖、太子参多糖、白芨多糖、多花黄精多糖和甘草多糖等分子量及含量测定已有此类方法验证报道[19-23]。文献表明[24-25],猴头菇多糖分子量及含量也可采用凝胶过滤色谱法进行检测,但暂无方法验证的系统报道。故本研究参考魏远安[26]、陈轶兰[27]、Eliza Malinowska[25]等用高效凝胶渗透色谱法测定多糖纯度及分子量方法条件,对猴头菇多糖分子量及含量进行方法系统研究探讨。
1 材料与方法
1.1材料与试剂
猴头菇子实体:购于福建省古田县吉发食用菌有限公司;猴头菇口服液:广东太阳神集团有限公司。
葡聚糖标准品(1 g/支97%):Flukar公司;无水乙醇、硫酸铜(五水)、柠檬酸钠:广州番禺力强化工厂;三氯乙酸、苯酚、氢氧化钠、磷酸氢二钠、磷酸二氢钠:天津市大茂化学试剂厂;无水硫酸钠:广州化学试剂厂;浓硫酸:衡阳市凯信化工试剂有限公司;叠氮化钠(含量大于99%):成都化夏化学试剂有限公司。
铜贮存液:称取3.0 g硫酸铜(五水),30.0柠檬酸钠加水溶解至1 L,此溶液可贮存2周;铜应用溶液:取铜贮存液50 mL,加水50 mL混匀后加入无水硫酸钠12.5 g,临用现配;铜洗涤液:取水50 mL,加入10 mL铜应用溶液,10 mL 2.5 mol/L氢氧化钠溶液,混匀。除特殊要求外,所有试剂均为分析纯。
1.2仪器与设备
高效液相色谱仪1260(示差折光检测器):Agilent公司;凝胶色谱柱(GPC):TSK Gel 4000 SWXL;分析天平(感量0.1mg):梅特勒-托利多仪器(上海)有限公司;FW100型粉碎机:天津市泰斯特仪器有限公司;LXJIIB型高速离心机:上海安亭科学仪器厂;BMC110kz水浴锅:上海锦屏仪器仪表有限公司;KQ-300E型超声波清洗器:昆山市超声仪器有限公;20目筛(孔径0.9 mm):浙江乙达金属砂筛厂。
1.3方法
1.3.1供试品溶液制备
猴头菇子实体多糖样品:粉碎后,过20目筛,称取2.00 g,于50℃浸泡2 h,超声波振荡提取20 min,抽滤,收集滤液;残渣再加水30 mL,超声波振荡提取20 min,抽滤;合并两次滤液,于90℃水浴浓缩至10 mL,冷却至室温,加30 mL无水乙醇(即乙醇浓度为75%)沉淀多糖;静置过夜,于4 000 r/min离心5 min,弃去上清液,沉淀即为猴头菇粗多糖。取其粗多糖,加10 mL水溶解,再加5 mL 33%乙醇沉淀大分子化合物,弃去沉淀;溶液再加5 mL 50%乙醇沉淀多糖。用5 mL水溶解沉淀,加入2.5 mol/L NaOH 5 mL,铜应用溶液5 mL,混匀,在沸水浴中煮沸2 min,冷却后以4 000 r/min离心5 min,弃去上清液;沉淀用铜洗涤液洗涤2次,加5%HCl乙醇溶液5 mL混合,4 000 r/min离心5 min,得沉淀为猴头菇子实体中的多糖[28-30]。
猴头菇口服液多糖样品:直接采用75%醇沉方法得到,以上述乙醇分级沉淀和碱性铜试剂沉淀法纯化[31-32]。
1.3.2对照溶液制备
分子量测定对照品溶液:称取分子量分别为1.0× 103、5.0×103、1.20×104、2.50×104、5.00×104、8.00×104、1.50×105、2.70×105、4.100×105、6.70×105的一系列葡聚糖标准品,用流动相配制成每种标样的质量浓度约为1.0 mg/mL的系列标准溶液,将样品用流动相溶解,摇匀,经0.45 μm滤膜过滤后,即得。
含量测定对照品溶液:称取分子量为2.50×104葡聚糖标准品,精确到0.000 1 g,用流动相配制成浓度为0.10、0.25、0.50、1.00、2.50、5.00、10.00 mg/mL的系列对照品溶液,经0.45 μm滤膜过滤后,即得。
1.3.3猴头菇多糖分子量和含量测定色谱条件
色谱条件:TSKGel3000SWXL凝胶色谱柱,7.8mm× 300 mm;柱温35℃;流动相为0.025 mol/L NaH2PO4+ 0.025 mol/L Na2HPO4(pH=6.7)+0.05%NaN3;流速0.8mL/min;检测器为示差折光检测器(RID),恒温35℃[26]。
1.3.4猴头菇多糖分子量测定
1.3.4.1校正曲线的绘制
分别取一系列不同分子量的对照品溶液20 μL进入凝胶色谱测试,根据其凝胶色谱的保留时间和分子量数据,建立多糖分子量测定的标准校准曲线。
1.3.4.2分子量测定方法及重复性考察
取猴头菇子实体和猴头菇口服液样品各6份,按照1.3.1中方法对多糖进行提取和纯化处理,得到猴头菇子实体和猴头菇口服液多糖沉淀,用5 mL水溶解并定容,经0.45 μm水系滤膜过滤,作为待测液,再按1.3.3色谱条件测定多糖的分子量。根据其保留时间和多糖分子量标准校正曲线,计算猴头菇子实体、猴头菇口服液中多糖的分子量。
1.3.5猴头菇多糖含量测定
1.3.5.1标准曲线的绘制
进行凝胶色谱分析。通过色谱峰面积与标准溶液的质量浓度进行线性回归。
1.3.5.2含量测定方法
将1.3.4.2处理好的猴头菇子实体多糖和猴头菇口服液多糖的待测液,进行凝胶色谱测定,根据标准线性方程计算猴头菇子实体、猴头菇口服液中多糖的含量。
1.3.6猴头菇多糖含量测定方法学验证
1.3.6.1精密度考察
取猴头菇子实体、猴头菇口服液样品,各平行6份,按照1.3.1中方法对多糖进行提取和纯化处理,按1.3.3方法测定多糖含量,计算相对标准偏差(RSD)。
1.3.6.2回收率考察
取9份猴头菇子实体样品2.0 g,分别添加相当于其猴头菇多糖含量80%、100%、120%的分子量为2.50×104Da葡聚糖标准品,按照1.3.1方法对多糖进行提取和纯化处理,用5 mL纯化水溶解定容,上凝胶色谱测定其含量,平行测定3次;取猴头菇口服液样品10.0 mL,分别添加相当于其猴头菇多糖含量80%、100%、120%的分子量为2.50×104Da葡聚糖标准品,按照1.3.1方法对多糖进行提取和纯化处理,用5 mL纯化水溶解定容,上凝胶色谱测定其含量,平行测定3次。计算回收率和相对标准偏差(RSD)。
2 结果与分析
2.1猴头菇多糖分子量测定
2.1.1校准曲线的建立
根据试验结果中凝胶色谱的保留时间和分子量数据,建立多糖分子量测定的标准校准曲线,如图1、图2所示。

图1 葡聚糖标样的凝胶色谱(a)和多糖分子量测定的标准校正曲线(b)Fig.1 Gel chromatography of dextran standard(a)and standard calibration curve for molecular weight determination of polysaccharides(b)

图2 猴头菇子实体多糖的凝胶色谱(a)和猴头菇口服液多糖的凝胶色谱(b)Fig.2 Gel chromatograms of Hericium erinaceus polysaccharide(a)and oral liquid prepared from Hericium erinaceus(b)
2.1.2猴头菇多糖分子量及重复性
猴头菇多糖分子量测定结果表明,猴头菇子实体和猴头菇口服液多糖数均分子量Mn均为1.6×104Da,重均分子量Mw均为1.7×104Da,分布宽(D)在1.05~1.07范围,RSD值均小于1%,重复性良好。结果见表1,典型的猴头菇子实体和猴头菇口服液多糖见图2。

表1 猴头菇多糖的分子量及重复性Table 1 Molecular weight of hericium erinaceus polysaccharide and repeatability
2.2猴头菇多糖含量测定的方法研究
2.2.1校准曲线的绘制
选择分子量为2.50×104Da的葡聚糖标准系列,通过色谱峰面积与标准溶液的质量浓度进行线性回归。结果表明,多糖质量浓度在0.1 mg/100 mL~10 mg/mL范围内呈良好的线性,线性方程为y=354.9+1.926× 105x,相关系数为0.999 96,见图3、图4。

图3 系列多糖标准溶液的凝胶色谱图Fig.3 Gel chromatogram of a series of polysaccharide standard
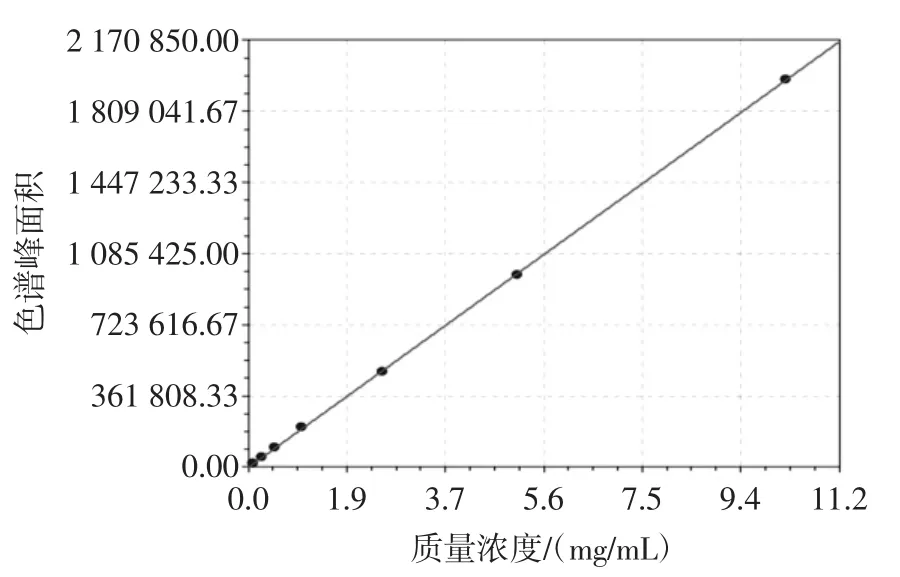
图4 多糖含量校准曲线Fig.4 Calibration curve of polysaccharide content
2.2.2猴头菇多糖含量及重复性
根据峰面积外标法进行单点定量测定,猴头菇子实体多糖含量为0.634%~0.679%,猴头菇口服液多糖含量为36.4 mg/100 mL~37.9 mg/100 mL。结果见表2。

表2 猴头菇多糖的含量及重复性Table 2 The content of polysaccharide of Hericium erinaceus and repeatability
2.3猴头菇多糖含量方法学验证
2.3.1精密度考察
由表2可知,猴头菇子实体和猴头菇口服液多糖含量的RSD分别为2.46%和1.71%,可见含量精密度良好,仪器连续进样误差小。
2.3.2回收率考察
根据猴头菇多糖分子量试验结果显示,校正曲线中分子量为2.50×104Da的葡聚糖标准品保留时间与猴头菇多糖最接近,故选择其作为回收率加标的标准样品。猴头菇多糖的回收率见表3。
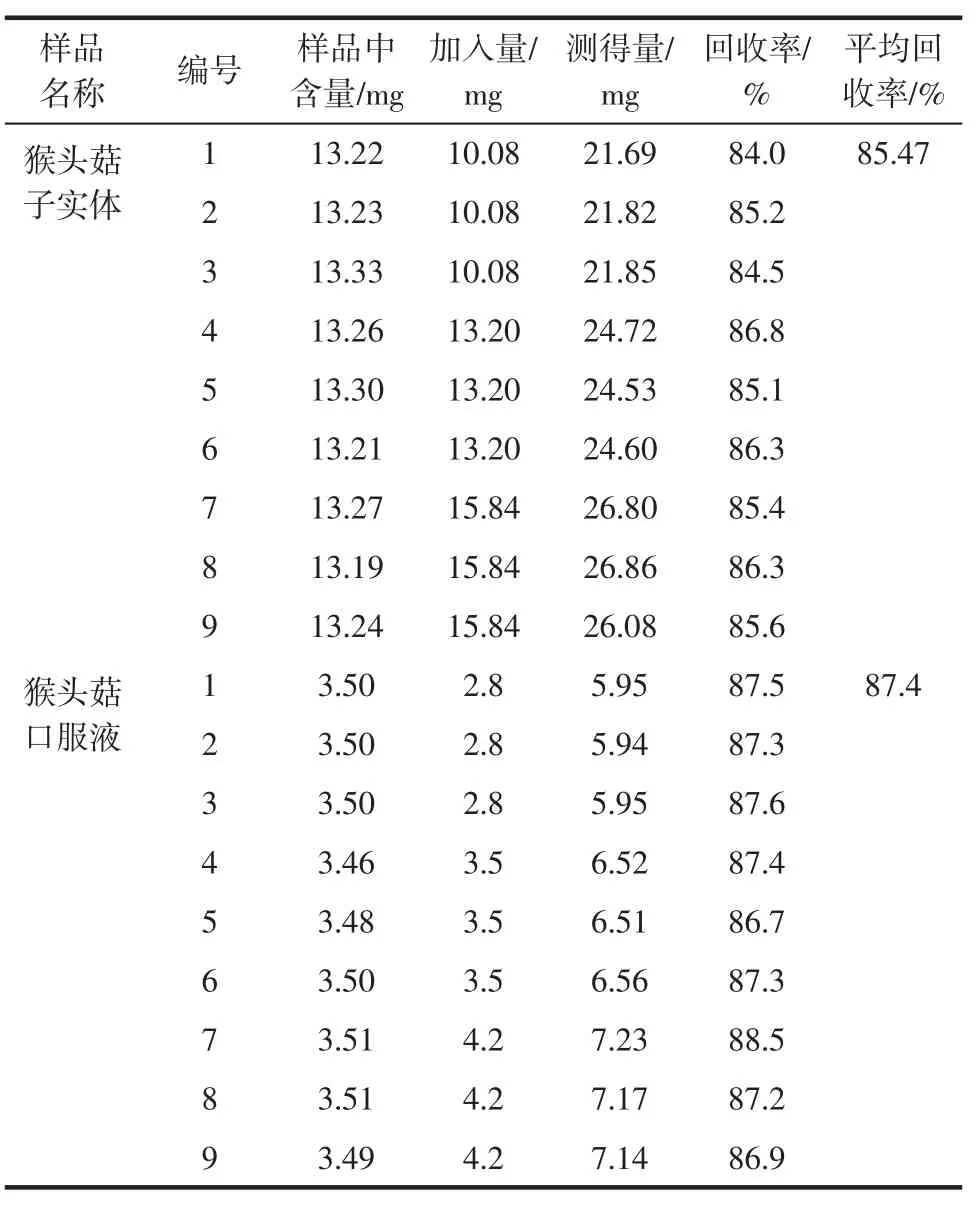
表3 猴头菇多糖的回收率(n=9)Table 3 Hericium erinaceus polysaccharide recovery rate(n=9)
由表3可知,猴头菇子实体多糖含量的回收率在84.0%~86.8%之间,猴头菇口服液多糖含量的回收率在86.7%~88.5%之间,鉴于重复性较好,为更准确反映多糖的实际含量,故实际含量可以经折算回收率后确定。
3 结论
本试验通过利用高效凝胶过滤色谱法(GFC)配合示差折光检测仪,以不同分子量的葡聚糖标准品系列绘制分子量曲线,通过猴头菇分子量的检测,得出其分子量的大致区间。试验结果表明,猴头菇子实体和猴头菇口服液多糖数均分子量Mn均为1.6×104Da,重均分子量Mw均为1.7×104Da,分布宽D在1.05~1.07范围,重复良好。用猴头菇多糖相对应分子量的葡聚糖标准品绘制含量校准曲线,测得猴头菇子实体多糖和猴头菇口服液多糖含量分别为0.66%和37.1 mg/ 100 mL。同时,猴头菇多糖的分子量和含量测定方法学验证均基本符合要求,获得一个系统性的检测方法。
本研究经系统验证获得的高效凝胶过滤色谱法和示差折光法测定猴头菇多糖的分子量及含量,方法新颖、选择性好、灵敏度高、重复性好。为一种灵敏适用的猴头菇多糖检测与分析方法提供理论基础与操作指导,同时为以猴头菇为原料的功能性保健食品或药品的的开发提供基础研究技术支持,使猴头菇的深加工产业具有更广泛的发展前景。
[1]Wong YangJing,ABDULLA M A,RAMAN J,et al,Gastroprotective Effects of Lion’s Mane Mushroom Hericium erinaceus(Bull.:Fr.)Pers.(Aphyllophoromycetideae)Extract against Ethanol-Induced Ulcer in Rats[J].Hindawi Publishing Corporation Evidence-Based Complementary and Alternative Medicine Volume,2013,2013(3):492976
[2]KIM S P,KANG M Y,KIM J H,et al.Composition and Mechanism of Antitumor Effects of Hericium erinaceus Mushroom Extracts in Tumor-Bearing Mice[J].Journal of Agricultural and Food Chemistry,2011,59(18):9861-9869
[3]杨焱,周昌艳,王晨光,等.猴头菌多糖调节机体免疫功能的研究[J].食用菌学报,2000,7(1):19-22
[4]HAN Zihua,YE Jianmin,WANG Guanfu.Evaluation of in vivo antioxidant activity of Hericium erinaceus polysaccharides[J].International Journal of Biological Macromolecules,2013,52(1):66-71
[5]LIANG Bin,GUO Zhengdong,XIE Fang,et al.Antihyperglycemic and antihyperlipidemic activities of aqueous extract of Hericium erinaceus in experimental diabetic rats[J].BMC Complementary and Alternative Medicine,2013,13(13):253
[6]貊润翌,朱平.猴头菌及其菌丝提取物的药理与临床研究进展[J].华西药学杂志,2009,24(5):555-557
[7]MORI K,KIKUCHI H,OBARA Y,et al.Inhibitory effect of hericenone B from Hericium erinaceus on collagen-induced platelet aggregation[J].Phytomedicine,2010,17(14):1082-1085
[8]秦美蓉,李俊鹏,钟敏.猴头菇胃肠保健口服液对胃黏膜损伤的保护功能研究[J].现代食品与药品杂志,2007,17(6):22-24
[9]范学工,吴安华,周平,等.猴头菇口服液对胃上皮细胞的保护作用[J].新消化病学杂志,1997,5(4):270
[10]王晓玉,蒋秋燕,凌沛学,等.猴头菌活性成分及药理作用研究进展[J].中国生化药物杂志,2010,31(1):70-72
[11]杨勇杰.猴头多糖化学成分研究[D].长春:吉林大学,2004
[12]陈明.抗癌菌类药常用种类及近代研究进展[J].食用菌,1994(2):40-41
[13]USUI T,YOSHIO I,KATDUYUKI H,et al.Antitumor activity of water solutble 0-D-Glucane laborated by Ganoderma apPlanatum[J]. Agrie Biol Chem,1981,45(1):323-332
[14]MIZUNO T,ITO H,SUZUKI C,et al.Antitumor-aetive Polysaeeharides isolated from the fruiting body of Herieium Erinaceus,an edible and mediclnal mushroom ealled yamabushitake or houtou[J]. Biosci Bioteehnol Bioehem,1992,56(2):347-348
[15]樊伟伟,黄惠华.猴头菇多糖研究进展[J].食品科学,2008,29(1):355-358
[16]邱龙新.真菌多糖化学研究[J].龙岩师专学报,1999,3(17):55-57
[17]李建,刘宁,陈平,等.香菇多糖分子质量的测定方法研究[J].哈尔滨商业大学学报(自然科学版),2005,21(5):644-648
[18]吴扬兰,王远亮,杨力.SEC-RI-MALLS技术在香菇多糖分子量与分子量分布分析方面的应用研究[J].药物分析杂志,2011,31(12):2256-2259
[19]王国佳,曹红,邢俊波,等.凝胶色谱法同时测定香菇多糖制剂中多糖分子量和含量[J].中国药事,2013,27(10):1090-1094
[20]史文涛,庞文生,胡娟.高效凝胶色谱法测定太子参均一多糖分子量[J].中国民族民间医药,2015(2):20,30
[21]李楠,李卓,张燕.高效分子排阻色谱法同时测定白及多糖分子量和含量[J].药物分析杂志,2012,32(10):1801-1803
[22]徐晓霞,李炎,刘华.高效凝胶色谱法测定多花黄精多糖分子量与分子量分布[J].四川生理科学杂志,2008,30(3):102-103
[23]赵颖,宋新波,张丽娟.高效凝胶色谱法测定甘草多糖分子量及其分子量分布[J].天津中医药,2015,32(1):46-48
[24]WU Dingtao,LI Wenzhi,CHEN Jun,et al.An evaluation system for characterization of polysaccharides from the fruiting body of Hericium erinaceus and identification of its commercial product[J].Carbohydrate Polymers,2015,124:201-207
[25]MALINOWSKA E,KRZYCZKOWSKI W,LPIENIS G,et al.Densitometric determination of carbohydrates:Application to purification and molecular weight determination of polysaccharide from Hericium erinaceum mushroom[J].Food Research International,2010,43:988-995
[26]魏远安,方积年.高效凝胶渗透色谱法测定多糖纯度及分子量[J].药学学报,1989,24(7):532-536
[27]陈轶兰,王友茹,马立人.用高效凝胶渗透色谱法测定多糖分子量[J].军事医学科学院院刊,1988,12(1):71-73
[28]张树海.猴头菇多糖提取及纯化的研究[J].食品研究与开发,2006,27(11):103-105
[29]胡斌杰.超声法提取猴头菇多糖最佳工艺优化研究[J].化学世界,2009(9):557-560
[30]肖丽霞,丁洪涛,胡晓松,等.猴头菇多糖的纯化工艺[J].食品科学,2011,32(24):186-190
[31]孟祥敏,王辉.猴头多糖口服液的制备工艺研究[J].食品工业,2013,34(3):65-68
[32]陈勇,朱炳辉,陆惠文.猴头菇口服液中多糖的分离和测定[J].中国药品标准,2002,4(3):21-23
Determination of Molecular Weight and Content of Hericium erinaceus Polysaccharide by High Performance Gel Chromatography
ZHOU Chun-hui,ZHOU Dan-dan,LIU Ting-ting,MA Bing-nan
(Guangdong Apollo Co.,Ltd.,Guangzhou 510665,Guangdong,China)
High performance gel filtration chromatography(GFC)and differential refraction detection were used to carry out the molecular weight and quantitive analysis on polysaccharide in the fruiting body of Hericium erinaceus and oral liquid prepared from Hericium erinaceus.A standard calibration curve was first established with different molecular weight dextran and determination of Hericium erinaceus polysaccharide molecular weight and its molecular weight distribution were performed.The retention time was used as the standard and the peak area external standard method was used to determine the content of polysaccharides of Hericium erinaceus. The results showed that polysaccharide of Hericium erinaceus fruiting body and Hericium erinaceus oral liquid had molecular weight 16 000 Da to 17 000 Da,and wide D distribution from 1.05 to 1.07.Polysaccharide content of the average was 0.66%in Hericium erinaceus fruiting body and 37.1 mg/100 mL in oral liquid.The validation of the method meets the basic requirements.
Hericium erinaceuspolysaccharide;gelfiltrationchromatography(GFC);molecularweight;content
10.3969/j.issn.1005-6521.2016.21.028
广东省省级科技计划项目(2013B090600008)
周春晖(1974—),女(汉),高级工程师,硕士,研究方向:保健食品的研究与开发。
2015-12-23

