非图案化法制备柔性连续葡萄糖监测传感器
陈玮 陈裕泉

摘 要 以聚多巴胺作为前驱体,在聚酰亚胺薄膜表面化学沉积一层牢固致密的金层,以该镀金薄膜两面的金层作为基体电极,在其中一面镀铂黑作为参比对电极,在另一面依次电沉积铂黑层、电泳形成Nafion/碳纳米管网络层、电吸引形成葡萄糖氧化酶层构成工作电极,并整体涂覆聚氨酯外膜,制备了一种柔性葡萄糖传感器。考察了此传感器对葡萄糖的检测性能,以及各层表面形态结构对传感器性能的影响。传感器在0.3 V的工作电位下对葡萄糖的线性响应范围是2.0~32.0 mmol/L,响应灵敏度为25 μA·(mmol/L)
Symbolm@@ 1·cm
Symbolm@@ 2,检出限为0.05 mmol/L (S/N=3),且传感器有良好的长期稳定性和抗干扰性,可用于皮下连续血糖监测。
关键词 表面金属化; 柔性传感器; 连续; 血糖
1 引 言
糖尿病是严重威胁人类健康的常见慢性病之一,目前仍无法治愈,但有效的血糖管理可以大幅降低并发症的发生率,提高患者生活质量。连续血糖监测系统(CGMS)的出现[1],为血糖监控提供了完整的趋势信息,并能提供高、低血糖的报警功能,能将患者每日指血测量的次数降低到1~2次,甚至于无需指血校准[2],是继指血血糖仪之后的又一重要发明。目前,这类传感器通常是以柔性聚合物薄膜为基底,在其上印刷碳电极或溅射金电极,通过电极的层层组装[3]或平面错位排布[4]形成电化学三电极体系;或者直接利用极细的金属丝制作[5,6],以金属丝表面的绝缘层隔离工作电极与参比电极,形成二电极体系。但这些方法制作的传感器材料成本高,工艺复杂、规模化程度低,使得这类产品生产成本高,价格昂贵,制约了CGMS系统的推广应用。
近年来,仿生学研究发现,在水溶液条件下,多巴胺能发生氧化聚合,在聚合物、金属、陶瓷、玻璃、木材等一系列固体材料表面形成一层超强附着的复合层。而多巴胺的邻苯二酚基团能够对金属产生一定强度的束缚力,且对金属离子具有较强的还原能力,当表面沉积聚多巴胺层的改性材料浸入金属盐溶液中时,复合层从溶液中还原金属阳离子并使之沉积在材料表面,从而实现无电镀的材料表面金属化[7]。这是一种有别于光刻、丝网印刷、喷印、磁控溅射等技术的有机薄膜表面金属化方法,非常适合用于构建薄膜型电化学电极。本研究利用该技术,在聚酰亚胺(PI)薄膜表面化学沉积一层致密的金层,然后以薄膜两面的金层分别作为工作电极与参比对电极,构成电化学两电极体系,形成一种单层双面柔性薄膜电极。以此为基础,在设定的工作电极表面电沉积花瓣状铂纳米颗粒作为催化层;在碳纳米管(CNT)的Nafion分散液中电泳吸附CNT形成CNT/Nafion网孔结构,作为抗干扰层;并在其上通过电吸附葡萄糖氧化酶,形成酶生化敏感层;最后,在戊二醛中交联固化后涂覆聚氨酯(PU)传质限制层,构成葡萄糖检测传感器。制备的传感器表现出良好的葡萄糖连续检测性能,兼具柔性、微细、长期稳定性好、抗干扰性强的特点,而此制备方法具有原材料成本低,可成板制备,切割成型,易于实现规模化生产等优点,有望应用于低成本皮下连续葡萄糖监测传感器的开发中。
2 实验部分
2.1 仪器与试剂
CHI660E型电化学工作站(上海辰华公司);Sirion100型场发射扫描电镜(荷兰FEI公司);激光切割机(深圳立华激光公司)。
聚酰亚胺(PI)薄膜(Kapton 500HN,3M公司);聚氨酯(PU)、Nafion(5%, w/V)、牛血清蛋白(BSA)、 多巴胺盐酸盐(Sigma公司);十八烷基三甲基氯化铵(STAC,上海阿拉丁生化科技股份有限公司);四氢呋喃(THF)、二甲基甲酰胺(DMF)、抗坏血酸(AA)、尿酸(UA)、醋氨酚(AP)、葡萄糖氧化酶(GOD,200U/mg)、葡萄糖、戊二醛(25% w/V)、氯铂酸、氯金酸、硼氢化钠、醋酸铅、H2O2(国药集团上海试剂公司);碳纳米管水性分散液(7%~8%,w/V,中国科学院成都有机化学有限公司);TrisHCl (pH 8.5)、0.01 mol/L PBS缓冲液(武汉博士德生物工程有限公司);实验用水为去离子水;所有试剂均为分析纯。实验在室温下进行。
2.2 聚酰亚胺薄膜表面金属化
将清洁后的PI薄膜(10 cm × 4 cm)浸入多巴胺盐酸盐溶液(2 mg/mL,pH 8.5)中,室温下缓慢振荡24 h,使PI薄膜表面形成一层聚多巴胺(记为PI/DOPA)。将PI/DOPA片浸入STAC溶液(0.1%,w/V)中静置5 s后,迅速转移到铂纳米溶胶[8]中,1 min后取出晾干,使PI/DOPA表面静电吸附一层随机分布的铂纳米颗粒;然后浸入镀金液(含10 mmol/L氯金酸与20 mmol/L过氧化氢)进行化学沉积,5 min后取出并在200℃烘箱中退火5 min,使聚酰亚胺薄膜表面形成一层光亮致密的金层(记为PI/Au)。
2.3 传感器制备
设定工作区域为5 mm,引线部分为1 cm,其余部分为绝缘区域(3.5 cm),在PI/Au两面设定的绝缘区域气相沉积Parylene(记为PI/Au/Parylene)。然后以Pt片为对电极,用恒电位法,设定工作电位
Symbolm@@ 2.5 V,沉积时间120 s,在设定的工作区域电沉积铂黑层(记为PtPt),其中,镀铂液为3%(w/V)氯铂酸和0.25%(w/V)醋酸铅的混合溶液;接着,在CNT/Nafion混合溶液(1∶4, V/V)中,以R面作为对电极,W面为工作电极,用恒电位法,设定工作电压为1.0 V,工作时间90 s,在W面上电泳吸附CNT,形成以CNT为骨架的Nafion网络层(记为Pt/CNTPt)。然后,同样用恒电位法,设定工作电压为0.7 V,工作时间20 min,在GOD溶液(含10wt%的BSA)中,将GOD电吸附于W面,接着在4℃冰箱中干燥8 h,使GOD充分嵌入到CNT网络层内.然后,在40℃烘箱中,将W面悬挂于底部含25%戊二醛的密封腔中进行交联,40 min后取出并置于4℃冰箱中保存8 h,使酶层充分交联固化(记为Pt/CNT/GOxPt)。然后用激光切割机将薄膜切割成0.5 mm×4 cm的细针状,其中工作区域为0.5 mm×5 mm。最后,让针型传感器的工作区域缓缓穿过沾有4%(w/V)PU溶液(THFDMF,98∶2, V/V)的钢丝圈(=2 mm),在其表面形成一层多孔保护膜。涂膜后的传感器在干燥箱中干燥8 h后,在PBS溶液中浸泡72 h,使传感器各层充分调控融合。制备的传感器放在4℃保存备用。传感器制备示意图如图1所示。
2.4 葡萄糖连续响应测试
测试在CHI660E电化学工作站上进行,采用计时电流 (it) 法进行葡萄糖连续响应测试。设定工作电位0.3 V,磁子转速200 r/min,检测池内PBS溶液(0.01 mol/L,pH 7.2)温度37℃。上电初始化40 min后,每隔5 min,向检测池中注射适量浓度葡萄糖溶液,使检测池中的葡萄糖浓度按4 mmol/L的梯度递增。
3 结果与讨论
3.1 传感器各层表面形态表征
利用扫描电镜观察各层表面形态。图2a是PI镀金薄膜横切面,金层厚约10 μm,与PI表面紧密结合。图2b是镀金层表面,可观察到整齐、紧致、均匀分布的金纳米颗粒。图2c是铂催化层,铂纳米颗粒呈花瓣状,单个花瓣平均长度400~500 nm,平均宽度150~250 nm。图2d是Nafion/CNT多孔网络层,可见Nafion以CNT为骨架,呈多孔网络结构状。图2e是葡萄糖氧化酶层,可看到GOx嵌入并覆盖Nafton/CNT网孔,形成一层多孔、厚实的酶层。图2f为PU外膜层,其中,PU呈多孔结构,孔径分布范围为2~4 μm。
3.2 传感器对葡萄糖的响应性能
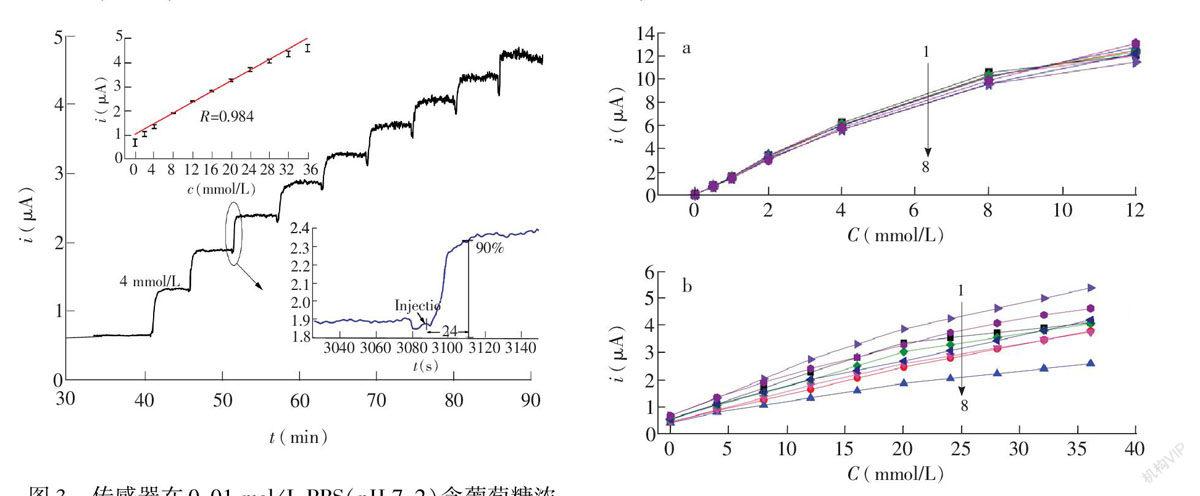
传感器对葡萄糖的连续响应测试如图3所示,在最优条件下,传感器对葡萄糖响应的线性范围为2.0~32.0 mmol/L,相关系数r=0.98(图3左上插图),响应灵敏度为25 μA·(mmol/L)
Symbolm@@ 1·cm
Symbolm@@ 2,检出限为0.05 mmol/L(S/N=3)。如此高的响应灵敏度一方面得益于催化层中花瓣状的铂纳米颗粒对H2O2有极强的电化学催化能力[10],使酶层催化葡萄糖反应生成的H2O2迅速分解,从而产生较强响应电流;另一方面,铂纳米花层大大增加了电极的比表面积,从而产生更大的响应电流。
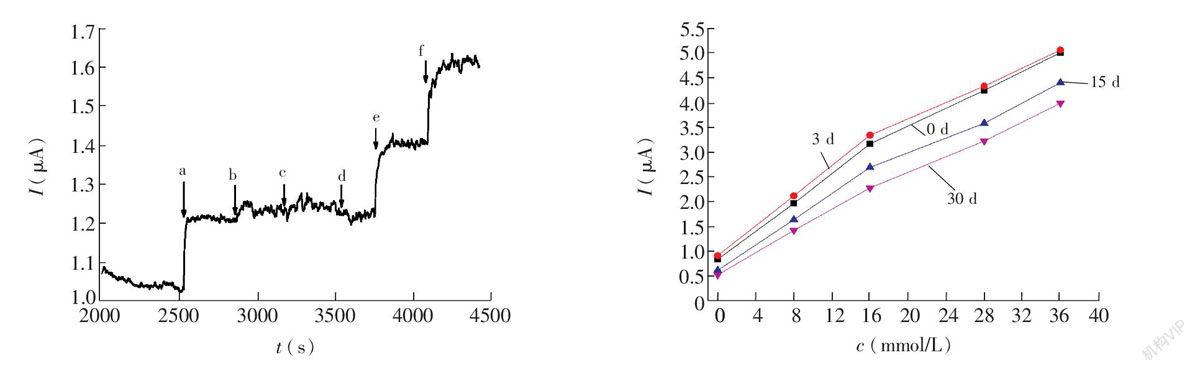
本传感器具有较快的响应速度,以葡萄糖浓度从8 mmol/L到12 mmol/L变化时为例,从注射高浓度葡萄糖至达到90%稳态响应值的用时24 s(图3右下插图),30 s内达到稳态响应值。考虑到每次从注射葡萄糖到检测池浓度达到均衡所花费时间的影响,单次浓度梯度变化的响应时间在25~35 s内。快速的响应速度既取决于Pt催化层对H2O2的快速响应能力,也取决于单层双面的传感器电极结构。工作电极与参比/对电极之间仅间隔一层PI膜,厚度仅127 μm,电极间如此近的距离,缩小了以O2扩散完成电子传递的距离,从而加快电子传递速度,获得较快的响应速度。然而,较小的电极间隙,也带来了电子在两极之间来回穿梭而形成的穿梭电流对响应的影响[3],尤其是在较高的浓度梯度下,穿梭电流带来了较大的背景噪声。
3.3 一致性测试
随机挑选同一片PI膜经激光切割后的8根传感器,对比其涂覆PU膜前后,传感器的线性响应范围,如图4所示。从图4a可见,经激光切割后,传感器的批量一致性好,但受酶反应动力学米氏常数的限制,其线性响应范围小。经手工涂覆PU膜后,在PU传质限制膜的作用下,传感器的线性范围明显扩大,但由于实验条件限制,用手工完成涂膜,涂膜操作的速度,周边环境温湿度的轻微变化都可能影响成膜的效果,因此,出现了涂膜后传感器一致性变差的情况,如图4b所示。
3.4 抗干扰实验
对电活性物质的抗干扰性是决定葡萄糖传感器准确性的重要指标,为能直接考察传感器的抗干扰特性,对未涂PU传质限制层的传感器进行连续梯度测试。如图5所示,本传感器对尿酸(UA)、抗坏血酸(AA)、醋氨酚(AP)都有良好的抗干扰性,这是由于Nafion/CNT网络多孔内层,对传感器的抗干扰性起到积极的作用[11],另一方面,本传感器工作电位低(0.3 V),大大降低了电极对抗坏血酸等电活性物质的响应,进一步提高了传感器的抗干扰性。
3.5 PU膜生物兼容性实验
植入皮下工作的葡萄糖传感器灵敏度会随着酶活性的下降, 传感器表面的蛋白吸附而下降。对涂有PU膜的传感器进行仿生理环境的体外测试结果如图6所示。在37℃水浴环境下,将传感器浸入胎牛血清中长期浸泡后,每隔一定时间取出进行葡萄糖连续响应测试,结果表明,浸泡3 d后,传感器的连续梯度响应性能比刚涂覆过PU膜的传感器性能略有提升,这是由于外层PU膜在连续浸泡后,传感器各层之间的调控更加连续一致。但浸泡15 d后,对36 mmol/L浓度时的最大响应电流约降为初始值的75%;浸泡30 d后,约降为初始值的65%。这可能是由于随着传感器长期在胎牛血清中的浸泡,PU表面多孔结构开始出现缓慢降解,促使蛋白吸附量逐渐增加,减少了传感器的有效面积所致。但此时的灵敏度仍达10 μA·(mmol/L)
Symbolm@@ 1·cm
Symbolm@@ 2,可以满足连续监测的要求。
4 结 论
以表面化学镀金的PI薄膜为基体电极,成功制备了一种柔性细针状葡萄糖传感器,本传感器在2.0~32.0 mmol/L的线性响应范围内,灵敏度为25 μA·cm
Symbolm@@ 2·(mmol/L)
Symbolm@@ 1,在胎牛血清中连续浸泡30 d,响应信号约为初始状态的65%,适用于皮下连续葡萄糖监测。本传感器制备采用激光切割成型,易于实现规模化生产,后期可改进PU涂膜方式为机涂,提高传感器批量生产的一致性。
References
1 Mastrototaro J. J. Pediatr. Endocr Met., 1999, 123: 751-758
2 Hoss U, Jeddi I, Schulz M, Budiman E, Bhogal C, McGarraugh G. Diabetes Technol., 2010, 12(8): 591-597
3 Heller A, Feldman B. Accounts Chem. Res., 2010, 43(7): 963-973
4 Koschwanez H E, Yap F Y, Klitzman B, Reichert W M. J. Biomed. Mater. Res. A, 2008, 87A(3): 792-807
5 Shults M C, Rhodes R K, Updike S J. Brauker J H. U.S. Patent, US07901354, 2011
6 Wilson G S, Zhang Y, Reach G, Moattisirat D, Poitout V, Thevenot D R, Lemonnier F, Klein J C. Clin. Chem., 1992, 38(9): 1613-1617
7 Lu Z, Xiao J, Wang Y, Meng M. J. Colloid Interf. Sci., 2015, 452: 8-14
8 Horiuchi S, Nakao Y. Surf. Coat. Tech., 2010, 204(23): 3811-3817
9 Ball V, Del Frari D, Toniazzo V, Ruch D. J. Colloid Interf. Sci., 2012, 386: 366-372
10 Heli H, Sattarahmady N, Vais R D, Mehdizadeh A R. Sens. Actuator B, 2014, 192: 310-316
11 JungChuan C, Jhang C, YiHung L, Lin J, Chen R, HsuehTao C. IEEE T. Semiconduct. M., 2014, 27(4): 523-529
12 Guo M Q, Hong H S, Tang X N, Fang H D, Xu X H. Electrochim. Acta, 2012, 63: 1-8
13 Park S, Boo H, Chung T D. Anal. Chim. Acta, 2006, 556(1): 46-57

