羟乙基淀粉130/0.4注射液中乳酸钠质量研究
王明明,孙 赞,权勤玲
(南京医科大学康达学院药学系,江苏 连云港 222000)
羟乙基淀粉130/0.4注射液中乳酸钠质量研究
王明明,孙 赞,权勤玲
(南京医科大学康达学院药学系,江苏 连云港 222000)
建立高效液相色谱法测定羟乙基淀粉130/0.4乳酸钠林格注射液中乳酸钠含量的方法并考察样品的稳定性。采用thermo BDS HYPERSIL C18(25 cm×4.6 mm,5 μm),流动相为0.39%磷酸二氢钾(pH=2.0):乙腈,梯度洗脱,检测波长210 nm。结果表明,乳酸钠在0.185~1.235 mg·mL-1范围内线性关系良好,r=0.9998,样品中乳酸钠平均含量为0.588 mg·mL-1,长期稳定性实验乳酸钠含量稳定。该方法能够准确的测定羟乙基淀粉130/0.4注射液中乳酸钠含量,复方注射液稳定性良好。
羟乙基淀粉130/0.4;乳酸钠;稳定性
羟乙基淀粉130/0.4乳酸钠林格注射液为羟乙基淀粉130/0.4、氯化钠、乳酸钠、氯化钾与氯化钙的灭菌水溶液,处方为羟乙基淀粉130/0.460.0 g、氯化钠6.0 g、乳酸钠3.1 g、氯化钾0.3 g和氯化钙0.3 g加注射用水制成1000 mL的溶液,各成分含量均为标示量的95.0%~105.0%。羟乙基淀粉130/0.4注射液具有扩容和稀释血液的作用,乳酸钠林格注射液为复方注射液,氯化钾、氯化钠、氯化钙其中是临床常用的电解质补充液,能及时补充体内流失的电解质成分,乳酸钠为营养性成分,具有L型和D型2种结构,药用L型,结构构型如图1所示。该复方具有调节体液、电解质和酸碱平衡的功效[1-3]。羟乙基淀粉130/0.4与乳酸钠林格注射液配伍使用,可以改善人体微循环,避免器官的功能性损害,起到补充药物治疗作用的效果[4]。最新有研究表明,羟乙基淀粉130/0.4(hydroxyethyl starch,HES)溶液会出现肾毒性反应、出血风险增加以及死亡率增高的趋势,有待于进一步的研究[5-7]。本实验以羟乙基淀粉130/0.4乳酸钠林格注射液作为研究对象,应用高效液相色谱方法检测复方注射液中乳酸钠的含量并对样品进行稳定性考察,为新型制剂的质量控制提供参考数据。
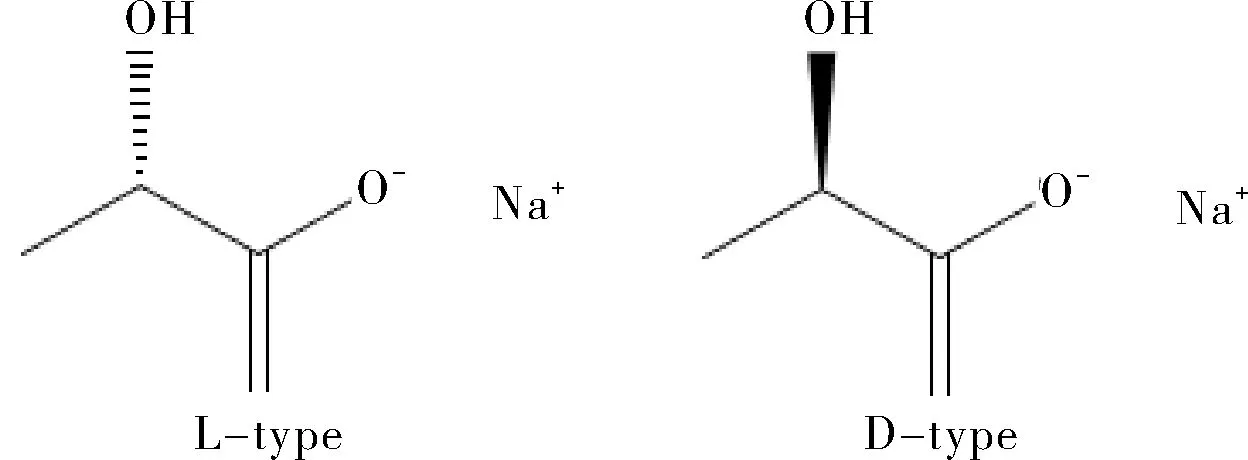
图1 乳酸钠构型结构
1 仪器与试药
戴安U3000高效液相色谱仪,赛默飞世尔科技;HD-E702-225恒温恒湿试验箱,海达仪器;DZF-6000减压真空干燥箱,上海善志仪器设备有限公司;XS千分之一分析天平,梅特勒科技有限公司。
羟乙基淀粉130/0.4乳酸钠林格注射液(批号:1212151,1212152,1212153),南京正大天晴制药有限公司;乳酸钠对照品(批号:100911-201501,规格100 mg),中国食品药品检定所;磷酸二氢钾(分析纯,500 g),天津科密欧化学试剂有限公司;乙腈(色谱纯,500 mL),国药集团化学试剂有限公司。
2 方法与结果
2.1 色谱条件
采用thermo BDS HYPERSIL C18(25 cm×4.6 m,5 μm)色谱柱,0.39%磷酸二氢钠(pH=0.2)为流动相A,乙腈为流动相B,梯度洗脱,流速为0.5 mL·min-1,检测波长210 nm,进样量10 μL。梯度洗脱条件见表1。

表1 梯度洗脱条件
2.2 溶液的配制
供试品溶液:取羟乙基淀粉130/0.4乳酸钠林格注射液10 mL,精密量取,置于50 mL量瓶中,加水稀释至刻度,摇匀滤过,取续滤液作为供试品溶液。
对照品溶液:取乳酸钠对照品适量,精密称定,制成每1 mL含乳酸钠0.62 mg的溶液,摇匀滤过,取续滤液作为对照品溶液。
乳酸钠对照品使用前需要前处理,处理方法为打开瓶盖,置于减压真空干燥箱中真空干燥4 h,加盖密封,置于专用干燥皿中备用,室温20 ℃下贮存,48 h内使用有效。
2.3 系统适用性考察
取羟乙基淀粉130/0.4约1.2 g,氯化钠约0.12 g,乳酸钠约0.062 g,氯化钾约0.006 g,无水氯化钙约0.004 g 置于100 mL量瓶中,加水稀释溶解至刻度摇匀,作为系统适用性溶液。精密量取10 μL,按照“2.1色谱条件”项,进样,记录色谱图。乳酸钠保留时间7.4 min,色谱峰面积7.327 mAU·s,理论塔板数5438,拖尾系数1.05,分离度大于1.5,无机盐和羟乙基淀粉130/0.4在该色谱条件下不出峰。系统适用性实验结果见图1。
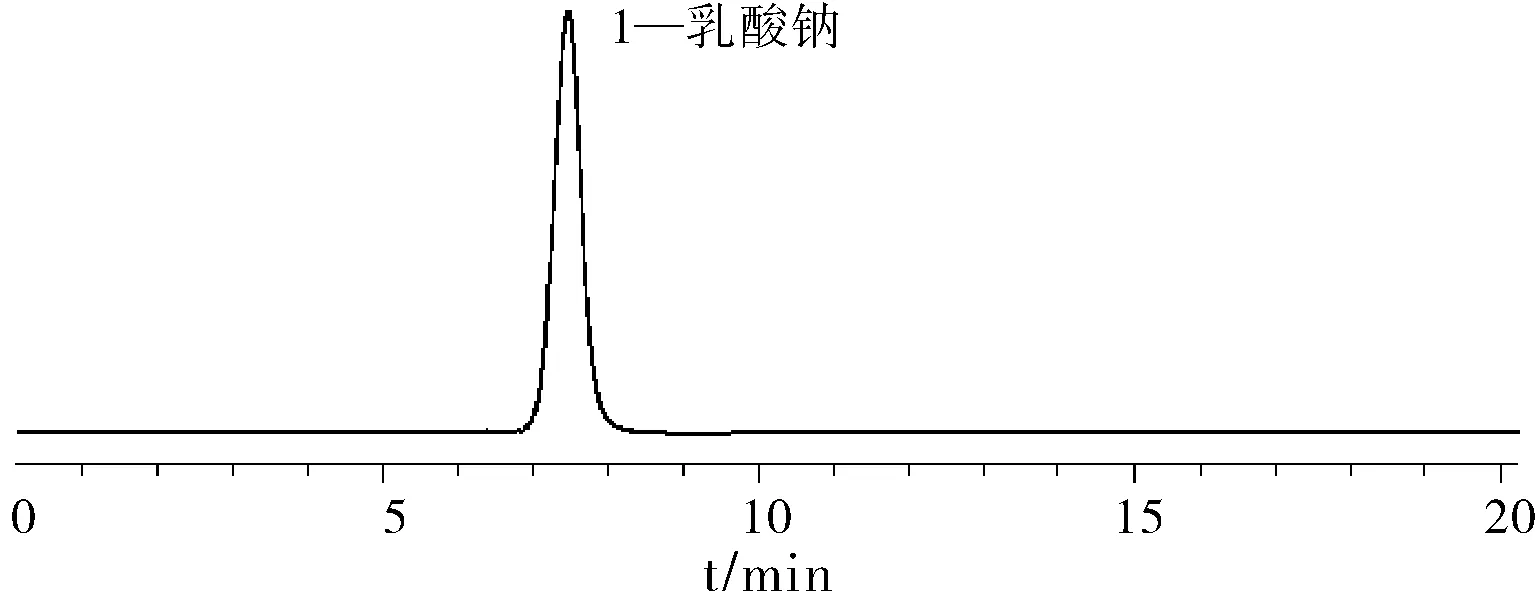
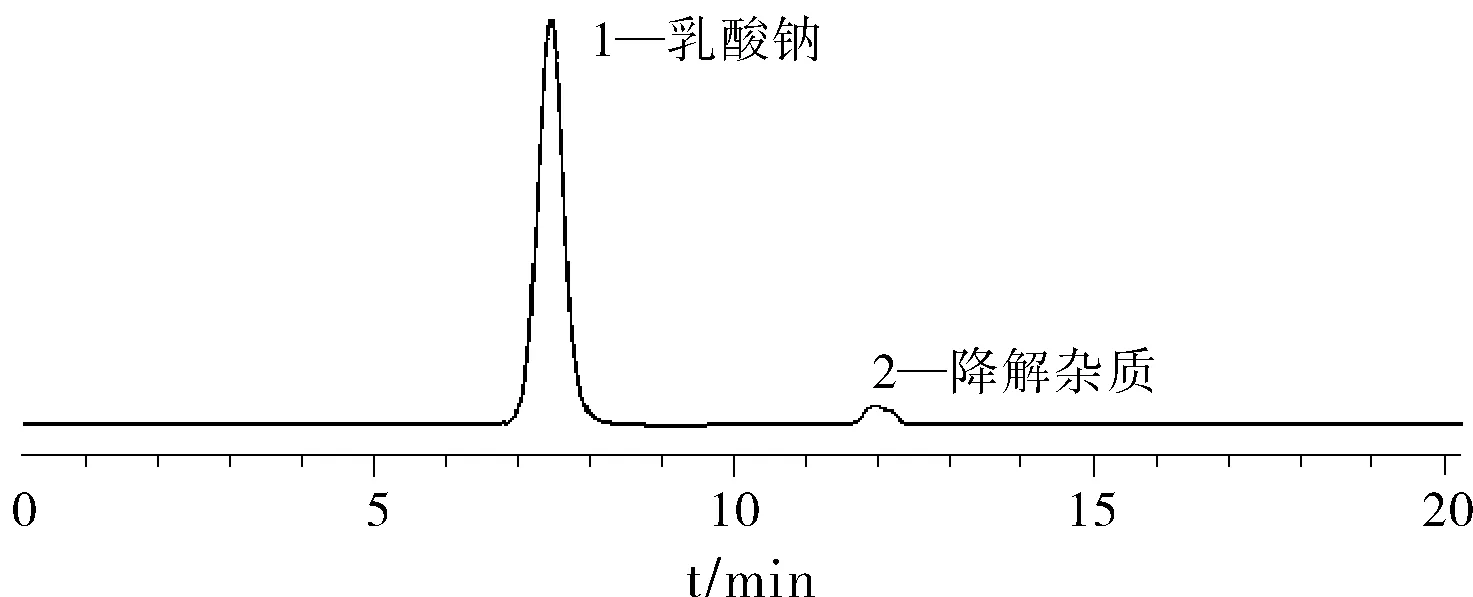
图1 系统适用性和稳定性实验
2.4 精密度考察
取浓度为0.62 mg·mL-1的乳酸钠对照品溶液,连续进样6次,进样量10 μL,结果表明,6次进样峰面积RSD为0.49%,表明精密度良好。
2.5 线性和线性范围考察
取乳酸钠对照品约31.0 mg,精密称定,置于10 mL量瓶中,加水溶解稀释至刻度,摇匀,分别精密量取上述溶液0.3、0.8、1.0、1.5、2 mL置5 mL量瓶中,加水稀释至刻度,摇匀滤过。按照“2.1色谱条件”项进样测定,以浓度(C)为横坐标,峰面积(A)为纵坐标绘制标准曲线。计算线性回归方程为:A=12.3190C+0.0921(r=0.9999)。结果表明,乳酸钠质量浓度在0.2039~0.6118 mg·mL-1范围内线性关系良好。
2.6 检测限和定量限考察
取“2.2”项下对照品溶液,加水逐步稀释,分别配制成浓度为6.175 μg·mL-1和2.031 μg·mL-1的溶液,进样,记录色谱图。结果表明,乳酸进样量为61.75 ng时,S/N=10,进样量为20.31 ng时,S/N=3。
2.7 稳定性考察
取“2.2”项下新配乳酸钠对照品溶液室温条件下放置0、5、7、9、12、14、16 h后分别进样,记录色谱图。结果表明12 h内,5次进样结果的RSD%为1.18%;14 h内6次进样结果的RSD%为1.31%;16 h后,乳酸钠对照品色谱峰分裂,出现杂质峰。因此,乳酸钠对照品溶液14 h内保持稳定,16 h后发生分解现象。稳定性实验色谱图见图1。
2.8 加样回收率考察
取不含乳酸钠处方条件下羟乙基淀粉130/0.4乳酸钠林格注射液9份,置100 mL量瓶中,分别加入乳酸钠对照品适量,流动相A溶解稀释定容,按“2.1”项下色谱条件进样测定,记录色谱图。计算结果,结果表明回收率为99.79%,RSD=1.14%。加样回收率见表2。

表2 样品回收率结果
3 样品检测
3.1 样品含量测定
取批号1212151 1212152 12121153三批样品,按照“2.2”项下溶液配制方法配制对照品溶液和供试品溶液,按照“2.1”项下色谱条件,精密取10 μL进样,记录色谱图。外标法以峰面积计算结果,乳酸钠含量分别为标示量的100.8%、99.7%和99.1%,符合质量标准。
3.2 样品稳定性实验考察
3.2.1 加速实验
取供试品三批,按照市售包装,置恒温恒湿干燥箱中,在温度(40±2) ℃,相对湿度75%±5%的条件下放置6个月,分别于1月、2月、3月、6月时间点取样一次,测定样品中乳酸钠含量,实验数据和结果见表。
3.2.2 长期实验
取供试品三批,按照市售包装,置恒温恒湿干燥箱中,在温度(25±2) ℃,相对湿度60%±5%的条件下放置12个月,分别于0月、3月、6月、9月、12月时间点取样一次,测定样品中乳酸钠含量。稳定性实验数据和结果见表3。

表3 样品稳定性实验结果
注:样品中乳酸钠含量在95.0%~105.0%范围内,均符合质量规定。
4 讨 论
本实验采用常用的十八烷基硅烷键合硅胶反向色谱柱,梯度洗脱对羟乙基淀粉130/0.4乳酸钠林格注射中的乳酸含量进行测定,建立方法学标准并考察了样品的放样稳定性。这种方法比早前应用旋光仪测定法测定乳酸钠含量的方法操作更加方便,结果更准确,样品的用量更少[8]。在实验中,我们发现乳酸钠溶液在室温条件下24 h内存在明显降解的现象,但是在放样稳定性实验中,我们没有发现样品中乳酸钠含量降低,这可能是由于复方溶液中的K+、Na+等离子对乳酸钠起到稳定的作用。检测波长和溶剂的选择方面,L型乳酸钠在210 nm处存在最大紫外吸收波长,属于末端吸收的范围,溶剂的选取会一定范围内影响乳酸钠含量的测定,选用乙腈作为有机相能有效的减少末端吸收,降低柱压,防止色谱基线漂移现象。
5 结 论
综上所述,本方法建立了高效液相色谱方法用于测定羟乙基淀粉130/0.4乳酸钠林格复方注射液中乳酸钠的含量,并对样品的长期和加速实验稳定性进行考察。结果表明,该方法测定乳酸钠含量,测定值不受注射剂处方中其余药物成分和辅料的干扰,样品在存放期内,性质保持稳定,该复方注射液具有广阔的市场应用前景。
[1] Li Y, He R, Ying X, et al. Ringer’s lactate, but not hydroxyethyl starch, prolongs the food intolerance time after major abdominal surgery, an open-labelled clinical trial[J]. Bmc Anesthesiology, 2015, 15(1):1-8.
[2] 何锐,李玉红,丁倩男,等.乳酸林格氏液体和羟乙基淀粉130/0.4氯化钠注射液对腹腔镜下胃肠癌根治术术后结局的影响[J].中国现代应用药学,2016(4):466-473.
[3] 彭元志,杜健儿.应用6%羟乙基淀粉130/0.4行急性扩容性血液稀释对脑肿瘤切除术患儿凝血功能和血流动力学的影响[J].上海医学,2016(2):72-75.
[4] Mahmood H M, Pooya D, Amir R S, et al. Comparing the Effects of 5% Albumin and 6% Hydroxyethyl Starch 130/0.4 (Voluven) on Renal Function as Priming Solutions for Cardiopulmonary Bypass:A Randomized Double Blind Clinical Trial[J]. Anesthesiology & Pain Medicine, 2016, 6(1).
[5] Kancir A S P. The nephrotoxicity of 6% Hydroxyethyl Starch 130/0.4 in surgery[J]. Acta Anaesthesiologica Scandinavica, 2016, 60(4):548-549.
[6] Su F, Xie K, He X, et al. The Harmful Effects of Hypertonic Sodium Lactate Administration in Hyperdynamic Septic Shock[J]. Shock, 2016.
[7] 李佳,程晟,沈素.药源性肾损害的临床新视点[J].中国医院用药评价与分析,2016,16(3): 431-432.
[8] 刘广桢,林林,孙晶,等.《中国药典》2010年版二部旋光度法测定含量方法的规范统一建议[J].中国药品标准,2013,14(4):249-250.
Study on Quality of Sodium Lactate Injection in Hydroxyethyl Starch 130/0.4
WANGMing-ming,SUNZan,QUANQin-ling
(Department of Pharmacy, Kangda College of Nanjing Medical University, Jiangsu Lianyungang 222000, China)
The HPLC method for determination the content of sodium lactate in hydroxyethyl starch 130/0.4 was established and the stability of the sample was investigated. Thermo BDS HYPERSIL C18(25 cm×4.6 mm, 5 μm), mobile phase 0.39% potassium dihydrogen phosphate (pH=2.0):acetonitrile and program of gradient elution were used, and detection wavelength was 210 nm. Results indicated that sodium lactate maintained fine linear relationship in the concentration range of 0.185~1.235 mg·mL-1, r=0.9998, the content of sodium lactate in the samples was 0.588 mg·mL-1, long-term stability of the experimental results were stable. The methods could accurately determine the content of sodium lactate in hydroxyethyl starch 130/0.4 injection and the stability of the compound injection was good.
hydroxyethyl starch130/0.4; sodium lactate; stability
王明明(1986-),男,助教,主要从事药物质量研究。
R917
A
1001-9677(2016)020-0111-03

