金乌贼胚胎发育阶段主要生化成分的变化*
刘长琳, 赵法箴, 陈四清**, 秦 搏, 阮飞腾, 葛建龙
(1.中国海洋大学水产学院,山东 青岛266003;2.中国水产科学研究院黄海水产研究所,农业部海洋渔业资源可持续利用重点开放实验室,山东 青岛 266071)
金乌贼胚胎发育阶段主要生化成分的变化*
刘长琳1,2, 赵法箴2, 陈四清2**, 秦 搏2, 阮飞腾2, 葛建龙2
(1.中国海洋大学水产学院,山东 青岛266003;2.中国水产科学研究院黄海水产研究所,农业部海洋渔业资源可持续利用重点开放实验室,山东 青岛 266071)
本研究采用生化方法对金乌贼胚胎发育过程中的粗蛋白、粗脂肪、灰分、氨基酸、脂肪酸、常量及微量元素等主要生化成分含量进行了测定和分析。结果显示,水分总体呈先下降后上升的变化趋势,而粗蛋白、粗脂肪、灰分和总糖含量呈先上升后下降的变化趋势;粗蛋白、粗脂肪和总糖的利用率分别为66.20%、66.67%和36.08%,总能消耗为0.91 kJ/g,其中粗蛋白供能为0.79 kJ/g,为能量的主要来源;总氨基酸、必需氨基酸、半必需氨基酸和非必需氨基酸含量总体均呈先上升后下降的变化趋势,利用率分别为18.48%、19.08%、16.77%和18.24%。饱和脂肪酸含量总体变化不大,利用率为7.86%,主要是由于C14:0和C16:0下降所致;单不饱和脂肪酸含量总体呈下降趋势,利用率为33.02%,主要是由于C20:1(n-7)下降所致;而多不饱和脂肪酸含量总体呈上升的变化趋势,含量上升9.35%,主要由于EPA和DHA含量上升所致。矿物质中P和Cu元素含量总体呈上升趋势,其余元素含量变化不大,其中Fe和Se利用率较高,分别为45.16%和33.33%,但Ca和Cu的含量在出膜期却明显上升,上升比例分别为68.3%和24.19%。
金乌贼;胚胎发育;生化成分;营养代谢
金乌贼(SepiaesculentaHoyle)是我国近些年开发的养殖新种类,但繁育过程中发现,金乌贼受精卵孵化率较高,但苗种培育早期成活率较低,造成大规格苗种数量不能满足市场需求,在一定程度上制约了产业化的发展,是亟待解决的关键技术之一,但目前还缺乏行之有效的技术措施。研究普遍认为,亲体培育的质量和人工孵化条件的优劣是影响水产苗种培育质量和成活率的最关键因素,深入研究胚胎发育阶段营养代谢的变化有助于认识亲本和幼体的营养需求、胚胎能量来源和利用模式,同时通过优化孵化条件提高卵黄营养的利用效率,以提高幼体的孵化率和质量,进而提高幼体的成活率[1-5]。因此开展水产动物胚胎发育阶段营养代谢研究,具有重要的生产意义。
有关水产经济动物胚胎发育阶段营养代谢的研究多集中在一些经济甲壳类动物[5-10]和一些经济鱼类[1,11-15]。目前,对于金乌贼胚胎发育阶段的研究大多集中在胚胎发育进程、形态特征描述[16-19],以及生化组成[20]等方面。本文对金乌贼胚胎发育阶段营养成分组成和变化进行了测定和分析,以期揭示营养物质代谢特征,进而为苗种繁育环节中的亲体营养强化、胚胎发育环境优化以及开口饵料供给提供理论指导。
1 材料与方法
1.1 材料
实验用样品于2014年6—7月取自青岛金沙滩水产开发有限公司。受精卵由野生金乌贼亲体自然产卵获得,采用自然海水孵化,孵化水温为18~25 ℃。取样时,先在同一批次受精卵中随机取3~5粒,剥离三级卵膜后在解剖镜下观察,参考陈四清等[18]的方法确定胚胎发育时期。对卵裂期(Ⅰ)、囊胚和原肠期(Ⅱ)、外部器官形成期(III)、红珠和黑珠期(Ⅳ)、心跳期(Ⅴ)、出膜期(Ⅵ)的受精卵,以及初孵幼体(Ⅶ)进行取样,取样后用滤纸吸干水分,称重后放入-80℃ 超低温冰箱中保存备用。每个时期取样200 g以上,实验共设3个平行组,胚胎发育阶段均是采用全卵进行测定。
1.2 方法
1.2.1 营养成分含量测定 水分、粗蛋白、粗脂肪和粗灰分含量分别按照GB5009.3-1985、GB/T5009.5-1985、GB/T5009. 6-1985和GB/T 5009. 4-1985测定。氨基酸和脂肪酸分别采用Agilent1100液相色谱仪和安捷仑6890N/ 5973气质联用仪测定。常量及微量元素的含量按照GB/T5009-2003,采用Thermo Fisher Scientific ICP 等离子发射光谱仪测定,其中硒(Se)采用全自动四通道氢化物原子荧光光度计测定。
1.2.2 能值的计算 参照Brett[21]提出的换算因子,蛋白质、脂肪、总糖的比能值分别为23.64、39.54和17.15 kJ /g,按Q(kJ/g) =ω1×23.64+ω2×39.54 +ω3×17.15公式计算肌肉的能值,式中Q为肌肉能值,ω1为粗蛋白百分含量,ω2为粗脂肪百分含量,ω3为总糖百分含量。
1.2.3 成分利用率的计算 利用率(%)=100%×(卵裂期含量-出膜期含量)/卵裂期含量。
1.2.4 数据处理 所得数据经 Excel2003 统计分析软件进行整理统计,用平均值±标准差表示;采SPSS11.5 统计软件进行单因素方差分析(one-way. ANOVA),达显著后(P<0.05),进行Duncan’s 多重比较检验组间差异。
2 结果
2.1 常规生化成分含量的变化
由表1知,金乌贼胚胎发育过程中水分含量变化差异显著,总体呈先下降后上升的变化趋势,到外部器官形成期最低(87.76%),在出膜期最高,含量达到96.49%,但初孵幼体的水分含量为83.67%,远低于胚胎发育各阶段含量。
金乌贼胚胎发育过程中主要生化成分含量的高低次序为粗蛋白>糖类>灰分>粗脂肪,且在胚胎发育阶段粗蛋白、粗脂肪、灰分和总糖等成分含量总体呈先上升后下降的变化趋势,其中除灰分含量在囊胚和原肠期最高,总糖含量在红珠和黑珠期最高外,其他成分均在外部器官形成期最高,在出膜期最低。除总糖和水分含量外,初孵幼体的各生化成分含量均高于胚胎发育各阶段,且差异显著。自卵裂期至出膜期,粗蛋白、粗脂肪和总糖的利用率分别为66.20%、66.67%和36.08%。在能值方面,总体变化幅度较大,各阶段差异显著,在胚胎发育阶段外部器官形成期能值最高为2.42 kJ/g,出膜期最低为0.59 kJ/g,而初孵幼体的能值高于胚胎发育各阶段。
2.2 能量消耗
由表2知,在金乌贼胚胎发育早期能量逐渐积累,自卵裂期至外部器官形成期积累的总能量为0.91 kJ/g,外部器官形成期以后总能量才逐渐消耗,其中在红珠和黑珠期至心跳期能量消耗最多,消耗量为0.77 kJ/g。自卵裂期至出膜期总能消耗为0.91 kJ/g,其中粗蛋白供能为0.79 kJ/g,占总能量消耗的86.81%;粗脂肪供能为0.02 kJ/g,占总能量消耗的2.20%;总糖供能为0.10 kJ/g,占总能量消耗的10.99%。
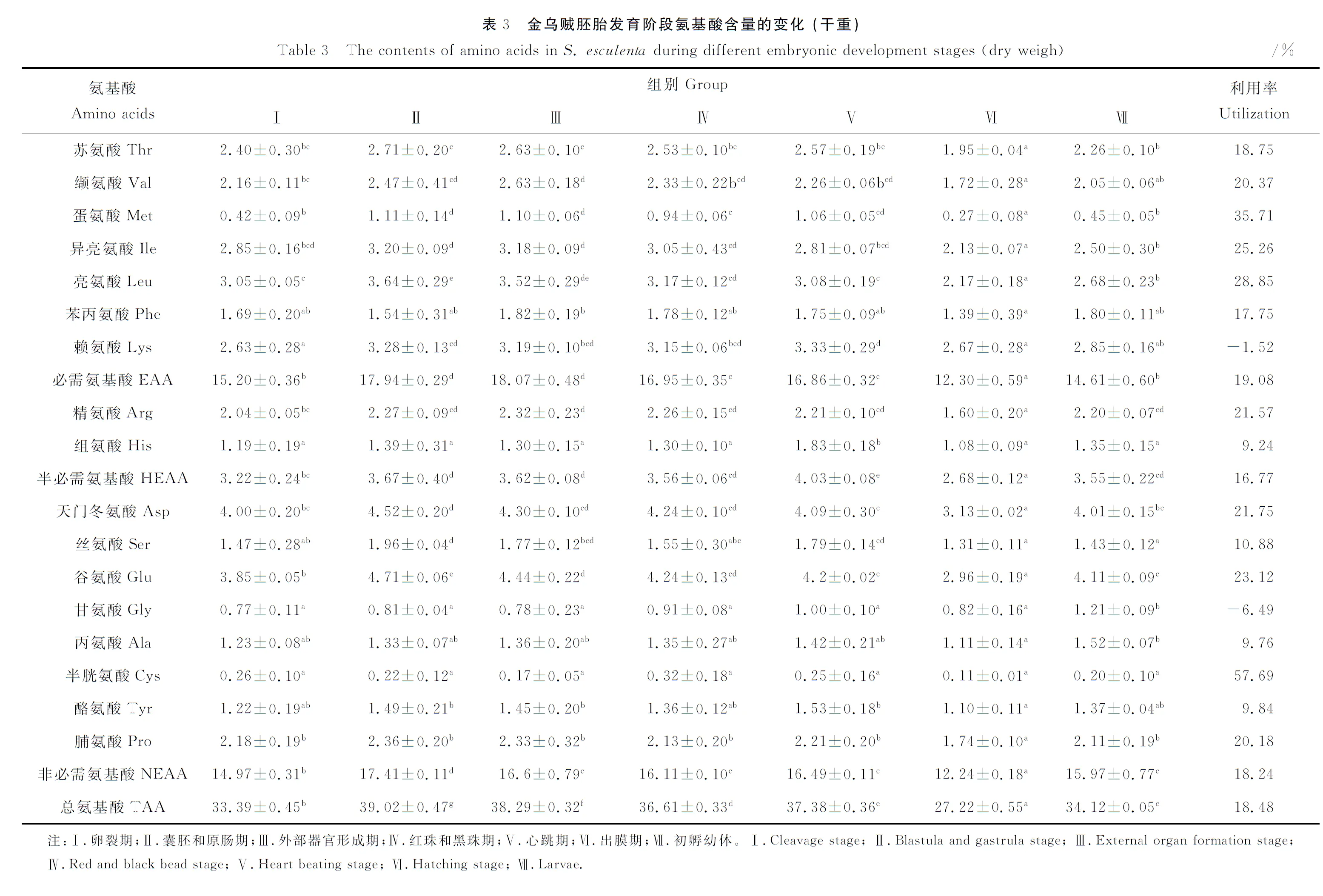
2.3 氨基酸组成及含量变化
在所有样品中,除色氨酸(Trp)在样品水解过程中被完全破坏外,共检测到17种氨基酸(见表3),其中必需氨基酸(EAA)7 种,半必需氨基酸(HEAA)2种,非必需氨基酸(NEAA)8 种,其中谷氨酸和天门冬氨酸在各阶段含量较高,亮氨酸和赖氨酸含量次之。
在胚胎发育阶段,总氨基酸、必需氨基酸、半必需氨基酸和非必需氨基酸含量总体均呈先上升后下降的变化趋势,且变化差异显著,其中总氨基酸和非必需氨基酸含量在囊胚和原肠期最高,分别为39.02%和17.41%,必需氨基酸含量在外部器官形成期最高(18.07%),半必需氨基酸含量在心跳期最高(4.03%),但这些氨基酸含量均在出膜期含量最低。在初孵幼体中,上述氨基酸含量略低于胚胎发育阶段,仅高于卵裂期和出膜期。
在单一氨基酸中,除组氨酸、甘氨酸、半胱氨酸和脯氨酸含量在各时期总体变化不大外,其余氨基酸均呈先上升后下降的变化趋势,且在出膜期含量最低,各阶段差异显著;在必需氨基酸中,亮氨酸含量在囊胚和原肠期含量最高,占干重的3.64%,赖氨酸在心跳期含量最高,占干重的3.33%;在半必需氨基酸中,精氨酸在外部器官形成期含量最高,占干重的2.32%;在非必需氨基酸中,谷氨酸和天门冬氨酸在囊胚和原肠期含量最高,分别占干重的4.71%和4.52%。
在胚胎发育阶段氨基酸利用方面,总氨基酸利用率为18.48%,其中必需氨基酸含量利用率为19.08%,主要由于蛋氨酸、亮氨酸和异亮氨酸分别下降35.71%、28.85%和25.26%所致;半必需氨基酸利用率为 16.77%,主要由精氨酸下降21.57%所致;非必需氨基酸含量利用率为18.24%,主要由于半胱氨酸、谷氨酸和天门冬氨酸含量分别下降57.69%、23.12%和21.75%所致。
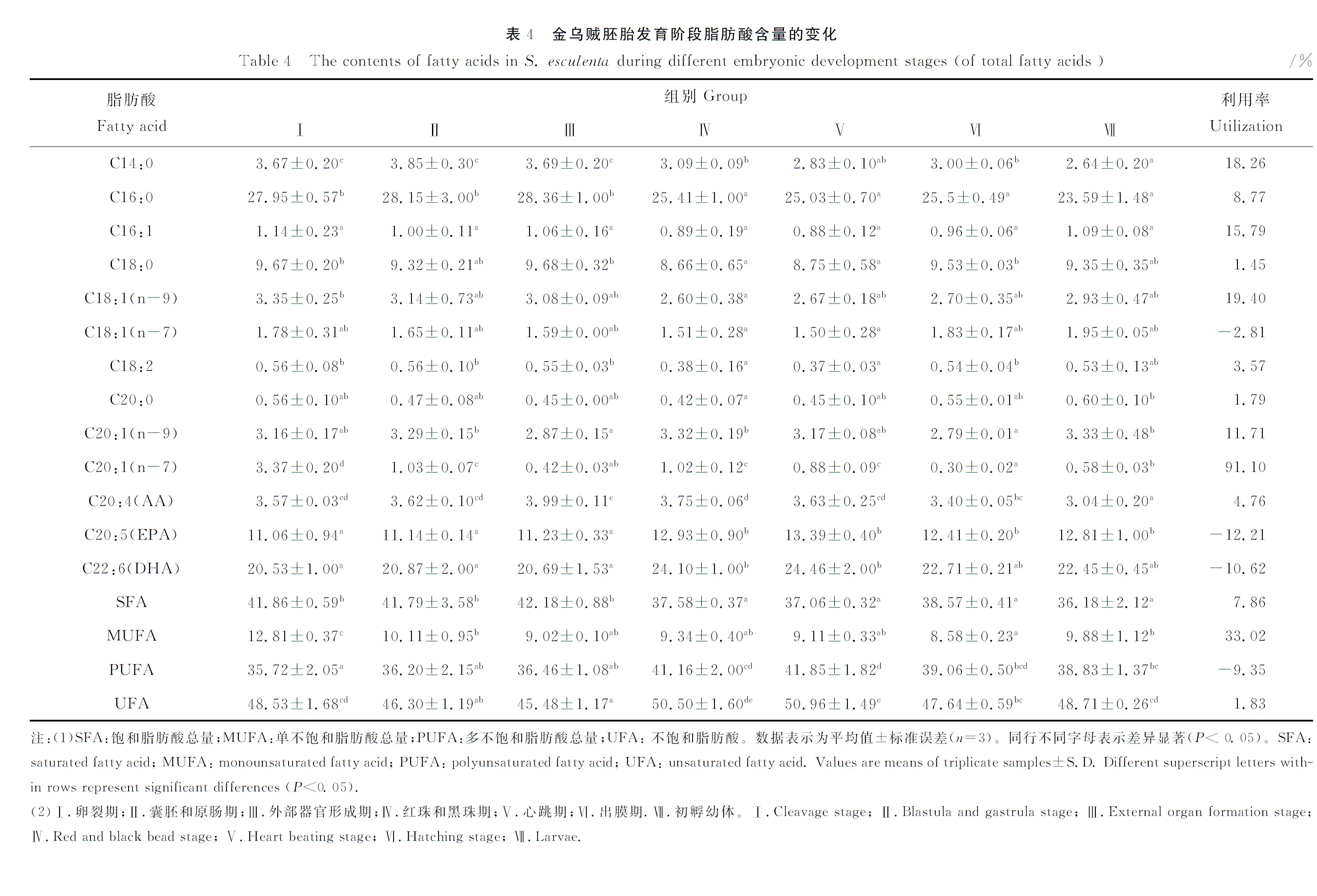
2.4 脂肪酸组成及含量变化
由表4可知,在金乌贼胚胎发育过程中主要检测出13种脂肪酸,其中C16:0含量最高,DHA和EPA含量次之。此外,总体上,不饱和脂肪酸的含量稍高于饱和脂肪酸,而多不饱和脂肪酸的含量远高于单不饱和脂肪酸含量。

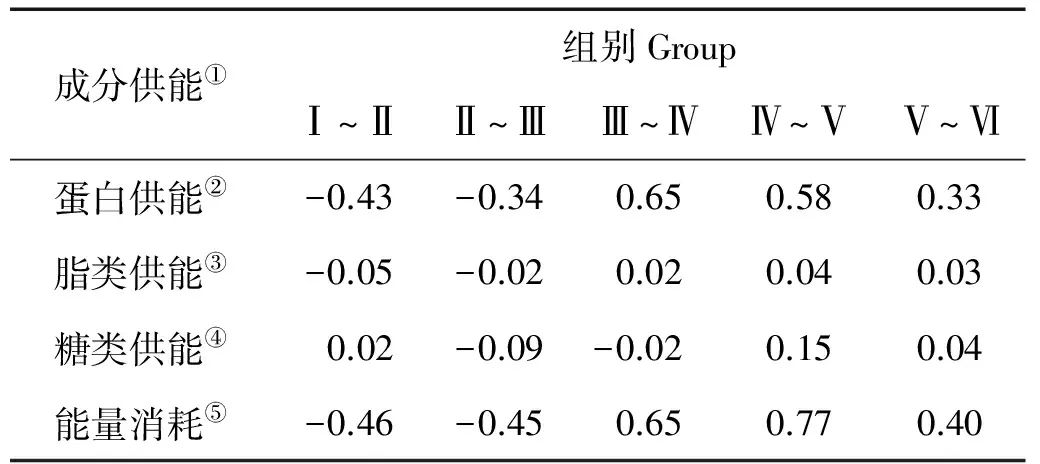
表2 金乌贼胚胎发育过程中的能量消耗
注:Ⅰ.卵裂期;Ⅱ.囊胚和原肠期;Ⅲ.外部器官形成期;Ⅳ.红珠和黑珠期;Ⅴ.心跳期;Ⅵ.出膜期;Ⅶ.初孵幼体。Ⅰ.Cleavage stage; Ⅱ.Blastula and gastrula stage; Ⅲ.External organ formation stage; Ⅳ.Red and black bead stage; Ⅴ.Heart beating stage; Ⅵ.Hatching stage; Ⅶ.Larvae.
①Composition expenditure;②Energy expenditure provided by protein;③Energy expenditure provided by lipid;④Energy expenditure provided by carbohydrate; ⑤Energy expenditure
在胚胎发育阶段,饱和脂肪酸在前期(Ⅰ~Ⅲ)含量变化不大,在42%左右,在后期(Ⅳ~Ⅵ)降至38%左右,且差异不显著。不饱和脂肪酸变化较大,呈“低-高-低”的变化趋势,且各阶段差异显著,其中心跳期含量最高(50.96%),外部器官形成期最低(45.48%)。单不饱和脂肪酸总体呈下降趋势,除卵裂期含量略高(12.81%)外,其他阶段为9%左右,且相对保持稳定。而多不饱和脂肪酸总体呈上升的变化趋势,其中前期(Ⅰ~Ⅲ)含量为36%左右,后期(Ⅳ~Ⅵ)含量上升至41%左右,且相对保持稳定。在初孵幼体中除饱和脂肪酸含量略低于胚胎发育各阶段外,不饱和脂肪酸、单不饱和脂肪酸和多不饱和脂肪酸含量均居中间水平。
在胚胎发育阶段脂肪酸利用方面,饱和脂肪酸利用率为7.86%,主要是由于C14:0和C16:0分别下降18.26%和8.77%所致;不和饱和脂肪酸利用率为1.83%,其中单不饱和脂肪酸利用率为33.02%,主要是由于C20:1(n-7)下降91.1%所致,但在出膜期中多不饱和脂肪酸含量却高于卵裂期,上升比例达9.35%,其主要由于EPA和DHA含量分别上升12.21%和10.62%所致。
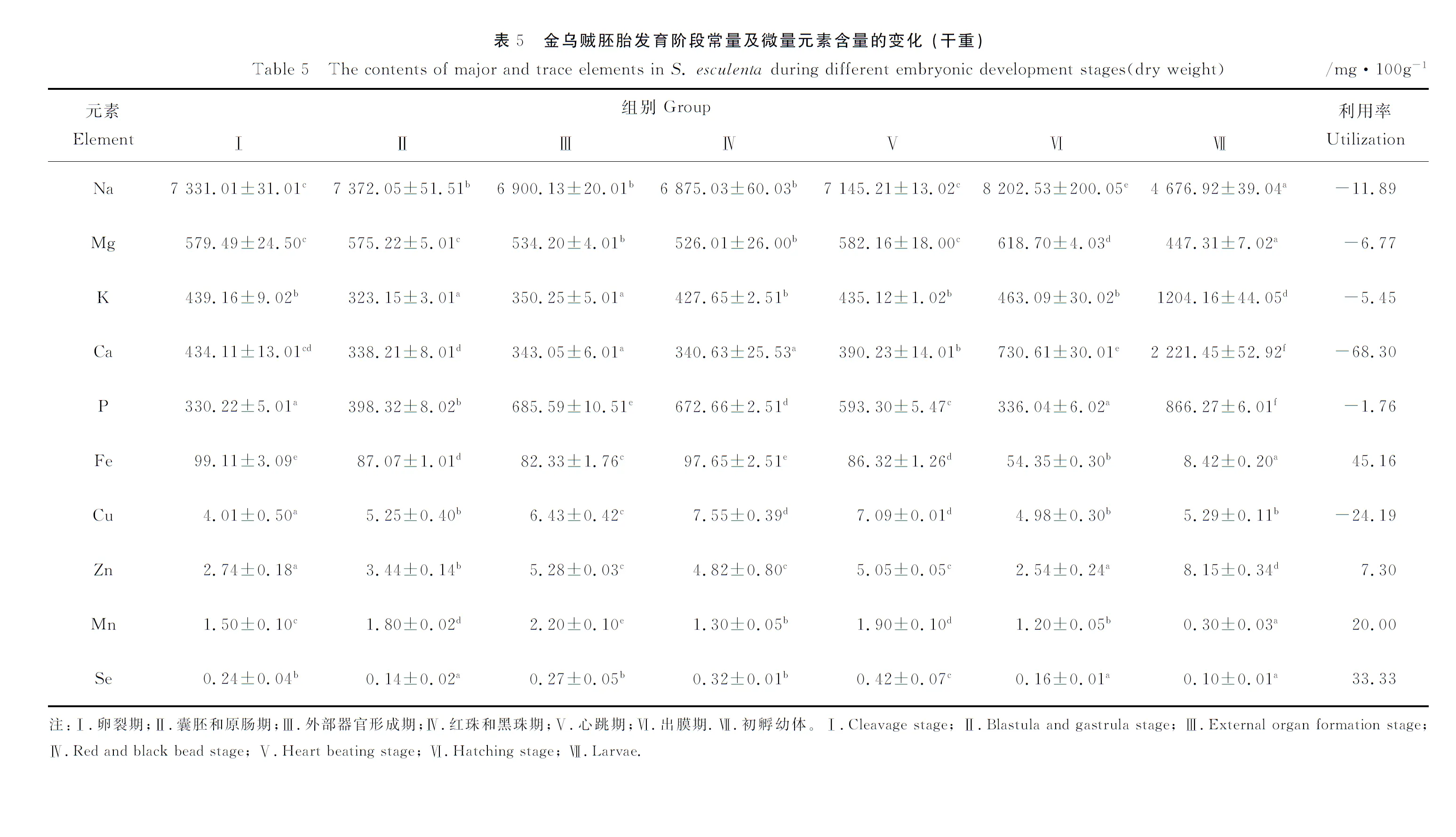
2.5 矿物质含量的变化
由表5可知,在所有样品的矿物质含量中Na含量最高,Mg含量次之,另外K、Ca和P的含量也较高。在胚胎发育阶段,总体呈上升趋势的元素是P和Cu,其余元素含量总体变化不大,在初孵幼体中K、Ca、P和Zn含量明显高于其他组,而Na、Mg、Fe和Se明显低于其他组。
在胚胎发育阶段矿物质利用方面,利用率较高的元素分别是Fe和Se,含量分别降低45.16%和33.33%,但Ca和Cu的含量却明显上升,上升比例分别为68.3%和24.19%。
3 讨论
3.1 常规生化成分含量的变化
金乌贼胚胎发育过程中粗蛋白和粗脂肪含量均呈先上升后下降的变化趋势,其原因可能是由于胚胎发育早期母源性酶类不断分解卵黄物质[7],但胚胎发育前期各种重要的器官系统尚未形成,物质分解合成速度大于消耗速度,使得蛋白质和脂肪处于少量的累积状态,而后期发育速度明显加快,肌肉、消化、神经等系统逐渐形成和完善,造成蛋白质和脂肪被大量消耗,使得含量逐渐降低。
研究表明,胚胎孵化前保留的营养物质的多少与初孵幼体的抗饥饿能力密切相关,孵化前内源营养较多的种类初孵幼体的抗饥饿能力较强,幼体成活率也较高[22],如三疣梭子蟹(Portunustrituberculatus)胚胎发育到心跳期每个卵中仍含约6.42 μg的蛋白质和2.05 μg的脂肪,分别占卵裂期的83.83%和60.83%[4],罗氏沼虾胚胎孵化前单卵中仍然含有20.18 μg的蛋白和7.77 μg的脂肪,分别占卵裂期的108.09%和57.47%[10]。而金乌贼胚胎发育至出膜期时粗蛋白和粗脂肪的含量分别占卵裂期含量的33.80%和33.33%,且能值为0.59kJ/g,仅为卵裂期的38.82%,说明金乌贼在胚胎发育阶段营养物质利用较多,使得胚胎孵化前保留的营养物质相对偏少,因此推测这是金乌贼苗种孵化率较高,但早期苗种培育成活率相对较低的原因之一。
同其他水产动物胚胎发育结果一致,在适宜的温度下,金乌贼孵化时间随温度的升高而缩短,而呼吸代谢速率则随温度的升高呈现上升的趋势[23],但温度对水产动物胚胎营养物质利用的影响迄今为止未见报道。在对鸭(AixsponsaLinnaeus)胚胎研究表明,在低温孵化时比在高温孵化时蛋白质含量偏低,而灰分含量偏高[24]。金乌贼受精卵在自然海水中孵化,孵化时间长达1个月,在此期间水温波动范围较大(18~25℃),因此温度的变动是否影响金乌贼胚胎营养物质的利用还有待进行深入研究。
3.2 能量来源及消耗规律
研究表明,在胚胎发育过程中大多数甲壳动物如三疣梭子蟹[4]、锯缘青蟹(Scyllaserrata)[22]、日本沼虾(Macrobrachiumnipponense)[5]和罗氏沼虾(Macrobrachiumrosenbergii)[10]等能量来源主要为脂类,其次为蛋白质;海洋鱼类由于具有富含脂类的油球,能量主要来源于脂类[25],而淡水鱼类以卵黄蛋白为能量来源,其次才是脂类[1,12,15]。金乌贼自卵裂期至出膜期总能消耗为0.91 kJ/g,其中粗蛋白供能为0.79 kJ/g,占总能量消耗的86.81%;粗脂肪供能为0.02 kJ/g,占总能量消耗的2.20%;总糖供能为0.10 kJ/g,占总能量消耗的10.99%,因此蛋白质是金乌贼胚胎发育过程中主要的供能物质,这与学者们普遍认为的头足类成体中占全身含量75%~85%的蛋白质是能量的主要来源的结论一致[26-27]。
3.3 氨基酸含量的变化
在金乌贼胚胎发育阶段,总氨基酸、必需氨基酸、半必需氨基酸和非必需氨基酸的含量与蛋白质含量变化趋势一致,总体均呈现“低-高-低”的变化趋势,由于氨基酸来源于卵黄蛋白的水解,因此推测在金乌贼胚胎发育早期卵黄蛋白被分解成氨基酸的速度大于消耗速度,后期随着胚胎组织分化和器官形成处于快速发展阶段,合成速度小于消耗速度。但不同品种在不同的环境中对营养物质利用情况不同,使得在胚胎发育阶段氨基酸变化存在一定差异,如罗氏沼虾[10]在胚胎发育过程中总氨基酸含量逐渐升高,而河川沙塘鳢(Odontobutispotamophila)[1]、大西洋鲑(Salmosalar)[11]、突吻麦鳕鲈(Maccullochellamacquariensis)[12]、墨累河鳕(Maccullochellapeeliipeelii)[13]和日本沼虾[28]等生物的总氨基酸含量逐渐降低。
在氨基酸含量方面,在金乌贼胚胎发育阶段,必需氨基酸中亮氨酸和赖氨酸最高,两者均是沟通糖类与脂类代谢的重要中间物质,可以生成酮基,并经过乙酰乙酰COA转化为乙酰COA和乙酰乙酸,然后进入三羧酸循环释放出能量[29],在保证胚胎组织、器官的形成以及旺盛的新陈代谢中具有重要作用。在非必需氨基酸中谷氨酸含量最高,天门冬氨酸含量次之,其中谷氨酸可以通过谷草转氨酶的作用形成草酰乙酸,然后通过糖逆生作用形成葡萄糖,储存能量促进胚胎发育,此外谷氨酸能与代谢生成的NH3的结合,形成易溶于水的谷氨酰氨,将代谢废物NH3排出体外,其含量最高可能与胚胎发育时期三羧酸循环反应比较活跃所致[8];天门冬氨酸可由转氨基作用从草酰乙酸产生,并参与鸟氨酸循环,因而也具有较高的含量[8]。
在氨基酸利用方面,半胱氨酸利用率最高(57.69%)、蛋氨酸次之(35.71%),半胱氨酸的硫基是一种不太稳定的基团,反应性能较高,在代谢活动中或氨基酸测定过程中易转化成其它物质;而蛋氨酸的甲硫基是一个很强的亲核基团,易与氧化剂结合形成蛋氨酸亚砜[30],因此造成在金乌贼胚胎发育过程中两者含量最低,且含量变化最大。
3.4 脂肪酸组成及含量的变化
在金乌贼胚胎发育过程中主要检测出13种脂肪酸,而曼氏无针乌贼(Sepiellamaindroni)共检测出19种[31]、欧洲乌贼共检测出26种脂肪酸[32],说明金乌贼胚胎的脂肪酸种类相对偏少。此外金乌贼胚胎中C16:0、DHA、EPA和C18:0等占主要比例,同曼氏无针乌贼[31]、欧洲乌贼(Sepiaofficinalis)[32-33]、欧洲枪乌贼(Loligovulgaris)[33]和真蛸(Octopusvulgaris)[33]等头足类一致,但金乌贼胚胎发育过程中单一脂肪酸中C16:0含量最高,这与大部分鱼类如河川沙塘鳢[34]、塞内加尔鳎(SoleasenegalensisKaup)[35]相同,但其余头足类中均为DHA的含量最高。
在金乌贼胚胎发育过程中,单不饱和脂肪酸利用率最高,为33.02%,饱和脂肪酸次之,利用率为7.86%,但多不饱和脂肪酸含量却有所升高,上升幅度为9.35%,表明金乌贼胚胎主要消耗单不饱和脂肪酸而对多不饱和脂肪酸有所保留,这与河川沙塘鳢[34]、突吻麦鳕鲈[12]和白斑狗鱼(EsoxluciusL)[36]等大多数淡水鱼的脂肪酸利用策略一致,其原因可能与金乌贼在胚胎发育过程中单不饱和脂肪酸和饱和脂肪酸主要参与能量消耗,而多不饱和脂肪酸主要参与组织和器官的构建有关,还可能与不同脂肪酸之间可能存在着相互转化,尤其向多不饱和脂肪酸转化有关。
由于海洋鱼类不能将短链的多不饱和脂肪酸转化为长链的高度不饱和脂肪酸,因此n-3和n-6系列的高度不饱和脂肪酸,特别是DHA、EPA和AA,是发育过程中的必需脂肪酸[34],其中DHA在中枢神经系统和视觉系统起重要作用[37],EPA是构成细胞膜和前列腺素前体细胞的重要组分[38]。 金乌贼胚胎发育阶段EPA和DHA含量分别升高12.21%和10.62%,亦说明两者对幼体孵化和存活具有重要作用[39-40],其增长原因可能是由于大量的饱和脂肪酸被消耗而使这两种脂肪酸的相对含量升高有关。
3.5 矿物质含量的变化
水产生物中的矿物质主要由无机元素构成,参与细胞和组织的代谢,并在形成骨骼、维持胶体系统、调节酸碱平衡等方面发挥着重要作用,且通过饵料和周围的水体获得[41]。目前对于水产动物矿物质营养研究,大多集中在矿物质的生理功能、吸收代谢机理、需求量以及元素间的交互作用等[42],但未见胚胎发育阶段矿物质含量的变化等方面的报道。
硬骨鱼类胚胎发育初期,由于鳃和渗透压调节器官尚未发育完全,为保证卵内适合发育的条件,使得胚胎对水和离子的渗透作用极低[43],但金乌贼与硬骨鱼类不同,受精卵卵膜具有高的通透性,渗透压调节能力较弱[19],因此金乌贼在胚胎发育过程中矿物质主要通过水体获得,其含量的变化主要是由于鳃丝、皮肤以及肠道、肝脏和肾脏等消化器官的吸收和排泄功能逐步发育完善所致。
在金乌贼胚胎发育阶段Fe和Se代谢利用率最高,含量分别降低45.16%和33.33%,但Ca和Gu的含量却明显上升,上升比例分别为68.3%和24.19%。Fe是动物机体必需的微量元素之一,主要功能是参与血红蛋白合成,与肌红蛋白结合用于肌肉储存氧,参与DNA、蛋白质的合成,作为氧化还原酶催化位置的组成部分[44]。对于鱼类,肠膜和鳃膜是Fe吸收的主要部位[45],而主要通过肠道和皮肤进行排泄,且有少量的Fe通过尿液排出,此外由于Fe与Cu在吸收水平上竞争结合位点,通常会发生拮抗作用,因此可推测金乌贼胚胎发育阶段Fe含量的下降的原因是由于肠道和皮肤排泄功能发育完善及Cu含量的上升有关。Se是谷胱甘肽过氧化酶的一部分,而谷胱甘肽过氧化酶起着保护细胞和生物膜不被氧化的作用[41],金乌贼在出膜期卵膜很薄,几乎透明[19],Se含量的下降可能与角质卵膜的逐步分解利用有关。金乌贼同其他乌贼科种类一样,具有发达的石灰质内壳(海螵蛸),内壳中主要成分为碳酸钙,其中Ca为内壳中含量最高的无机元素,含量达26.7%[46],金乌贼胚胎Ca含量明显上升,应该与内壳的逐渐形成有关。
[1] 胡先成, 赵云龙. 河川沙塘鳢胚胎、仔鱼发育过程中脂类含量及脂肪酸组成的变化[J]. 淡水渔业, 2008, 38(3): 46-50.
Hu X C, Zhao Y L. Variation in the lipid content and fatty acid composition during embryonic and larval development ofOdontobutispotamophila[J]. Freshwater Fisheries, 2008, 38(3): 46-50.
[2] Babu D E. Observations on the embryonic development and energy source in the crabXanthobidentatus[J]. Marine Biology, 1987, 95: 123-127.
[3] Clarke A. Egg size and egg composition in polar shrimps (Caridea;Decapoda) [J]. Journal of Experimental Marine Biologic Ecology, 1993, 168(2): 189-203.
[4] 陈石林, 吴旭干, 成永旭, 等. 三疣梭子蟹胚胎发育过程中主要生化组成的变化及其能量来源[J]. 中国水产科学, 2007, 14(2): 230- 234.
Chen S L, Wu X G, Cheng Y X, et al. Changes of proximate biochemical composition and energy source during embryonic development of swimming crab,Portunustrituberculatus[J]. Journal of Fishery Sciences of China, 2007, 14(2): 230- 234.
[5] 李红, 赵云龙, 王群, 等. 日本沼虾胚胎发育不同阶段主要生化成分的变化[J]. 水产学报, 2003, 27(6): 545-549.
Li H, Zhao Y L, Wang Q, et al. Variations in biochemical composition during embryonic development ofMacrobrachiumnipponense[J]. Journal of Fisheries of China, 2003, 27(6): 545-549.
[6] 田华梅, 赵云龙, 李晶晶, 等. 中华绒螯蟹胚胎发育过程中主要生化成分的变化[J]. 动物学杂志, 2002, 37(5): 18-21.
Tian H M, Zhao Y L, Li J J, et al. Biochemical changes during embryonic development in the crabEriocheirsinensis[J]. Chinese Journal of Zoology, 2002, 37(5): 18-21.
[7] 田华梅, 王群, 赵云龙, 等. 中华绒螯蟹胚胎发育过程中的消化酶活力及氨基酸组成[J]. 中国水产科学, 2003, 10(5): 404-408. Tian H M, Wang Q, Zhao Y L, et al. Digestive enzyme activities and amino acids composition during embryonic development ofEriocheirsinensis[J]. Journal of Fishery Sciences of China, 2003, 10(5): 404-408.
[8] 罗文. 红螯螯虾(Cheraxquadricarinatus)胚胎营养代谢的研究[D]. 上海: 华东师范大学, 2004.
Luo W. Study on Embryonic Nutrition Metabolism ofCheraxquadricarinatus[D]. Shanghai: East China Normal Universty. 2004.
[9] 姚俊杰, 赵云龙, 周忠良, 等. 两种沼虾胚胎发育中可溶蛋白的组成及含量变化[J]. 动物学杂志, 2006, 41(2): 9-14.
Yao J J, Zhao Y L, Zhou Z L, et al. Variation in soluble protein composition and content during embryonic development of two kinds of prawns[J]. Chinese Journal of Zoology, 2006, 41(2): 9-14.
[10] Yao J J, ZhaoY L, Wang Q, et al. Biochemical compositions and digestive enzyme activities during the embryonic development of prawn,Macrobrachiumrosenbergii[J]. Aquaculture, 2006, 253: 573-582.
[11] Srivastava K, Brown J A, Shahidi F. Changes in the amino acid pool during embryonic development of cultured and wild Atlantic salmon (Salmosalar) [J]. Aquaculture, 1995, 131: 115-124.
[12] Gunasekera R M, Silva S S D, Ingram B A. T'he amino acid profiles in developing eggs and larvae of the freshwater Percichthyid fishes, trout cod,Maccullochellamacquariensisand Murray cod,Maccullochellapeeliipeelii[J]. Aquatic Living Resources, 1999, 12(4): 255- 261.
[13] Gunasekera R M, De Silva S S D. The amino acid Profiles of estuary perch,Macquariacolonorum, during early development at different salinities[J]. Aquatic Living Resources, 2000, 13: 153-162.
[14] 马爱军, 雷霁霖, 孙飚, 等. 真鲷胚胎及胚后发育各阶段氨基酸组成的研究 [J]. 中国水产科学, 2000, 7(1): 113-115.
Ma A J, Lei J L, Sun B, et al. Studies on composition of amino acids in ambryos and larvae ofPagrosomusmajorat different stages[J]. Journal of Fishery Sciences of China, 2000, 7(1): 113-115.
[15] 朱邦科, 曹文宣. 鲢早期发育阶段鱼体脂肪酸组成变化[J]. 水生生物学报, 2002, 26(2): 130-135.
Zhu B K, Cao W X. Fatty acid composition and their changes during early life stage of silver carpHypophthalmichthysmolitrix[J]. Acta Hydrobiologica Sinica, 2002, 26(2): 130-135.
[16] 山本孝治. 金乌贼受精卵分裂[J]. 植物及动物, 1942, 10: 25-130.
Shan B X Z. The zygote divides of golden cuttlefish [J]. Plants and Animals, 1942, 10: 25-130.
[17] 李嘉泳. 金乌贼(SepiaesculentaHoyle)在我国黄渤海的生殖洄游和发育[C]//. 太平洋西部渔业研究委员会第六次全体会议论文集. 北京: 科学出版社, 1965. 61-92.
Li J Y. The reproductive migratory and development of golden cuttlefish (SepiaesculentaHoyle) in Chinese Huang and Bohai sea[C]. Proceedings of the Sixth Conference of the Western Pacific Fisheries Research Committee. Beijing: Science Publishing Company, 1965: 61-92.
[18] 陈四清, 刘长琳, 庄志猛, 等. 金乌贼(SepiaesculentaHoyle)胚胎发育的研究[J]. 渔业科学进展, 2010, 31(5): 1-7.
Chen S Q, Liu C L, Zhuang Z M, et al. Observation on the embryonic development ofSepiaesculentaHoyle[J]. Progress in Fishery Sciences, 2010, 31(5): 1-7.
[19] 雷舒涵, 吴常文, 高天翔, 等. 金乌贼和曼氏无针乌贼胚胎发育及其盐度耐受能力的比较研究[J]. 中国水产科学, 2011, 18(2): 350-359.
Lei S H, Wu C W, Gao T X, et al. A comparative study ofSepiaesculentaandSepiellamaindronion embryonic development and ability of salinity tolerance[J]. Journal of Fishery Sciences of China, 2011, 18(2): 350-359.
[20] Lei S H, Zhang X M, Zhang P D, et al. Biochemical composition of cuttlefish (Sepiaesculenta) eggs during embryonic development[J]. Molluscan Research, 2014, 34(1): 1-9.
[21] Brett J R. Physiological Energetics, Fish Physiology[M]. New York: Academic Press, 1979, 8: 279-352.
[22] 成永旭, 李少菁, 王桂忠, 等. 锯缘青蟹胚胎发育期脂类变化的研究[J]. 海洋学报, 2000, 22: 433-441.
Cheng Y X, Li S J, Wang G Z, et al. Studies on changes of lipid compositions of the crabScyllaserrataduring the embryonic development[J]. Acta Oceanologica Sinica, 2000, 22: 433-441.
[23] 雷舒涵. 金乌贼胚胎与幼体发育生物学研究[D]. 青岛:中国海洋大学, 2013.
Lei S H. Studies on Embryonic and Larval Development of Golden Cuttlefish (Sepiaesculenta) [D]. Qingdao: Ocean University of China, 2013.
[24] Hepp G R, Kennamer R A, Johnson M H. Maternal effects in wood ducks: Incubation temperature influences incubation period and neonate phenotype[J]. Functional Ecology, 2006, 20: 308-314.
[25] Love R M. Chemical Biology of Fishes[M]. London: Academie Press, 1980, 1968-1977.
[26] Lee P G. Nutrition of cephalopods: Fuelling the system[J]. Marine and Freshwater Behaviour and Physiology, 1994, 25: 35-51.
[27] García B G, Giménez F A. Influence of diet on ongrowing and nutrient utilization in the common octopus (Octopusvulgaris) [J]. Aquaculture, 2002, 211: 171-182.
[28] 赵艳民, 赵云龙, 王群, 等. 日本沼虾胚胎发育时期消化酶活力和氨基酸含量[J]. 华东师范大学学报, 2006(2): 75-81.
Zhao Y M, Zhao Y L, Wang Q, et al. Digestive enzyme activities and the contents of the amino acid during the embryonic development ofMacrobrachiumnipponense[J]. Journal of East China Normal University, 2006(2): 75-81.
[29] 沈同, 王镜岩. 生物化学(下册)第二版[M]. 北京: 高等教育出版社, 2000: 217-255.
Shen T, Wang J Y. Biochemistry (volume two) Second Edition[M]. Beijing: Higher Education Press, 2000: 217-255.
[30] Levine R L, Mosoni L, Berlett B S, et al. Methionine residues as endogenous antioxidants in proteins[J]. Proceedings of the National Academy of Sciences USA , 1996, 93: 15036-15040.
[31] 王津伟, 王春琳, 宋超霞, 等. 曼氏无针乌贼胚胎发育过程中生化成分的变化[J]. 中国科技论文在线, 2008.
Wang J W, Wang C L, Song C X, et al. Biochemical compositions of embryo ofSepiellamaindroni[J]. Sciencepaper Online, 2008.
[32] Sykes A V, Almansa E, Lorenzo A, et al. Lipid characterization of both wild and cultured eggs of cuttlefish (SepiaofficinalisL.) throughout the embryonic development[J]. Aquaculture Nutrition, 2009, 15(1): 38-53.
[33] Navarro J C, Villanueva R. Lipid and fatty acid composition of early stages of cephalopods: an approach to their lipid requirements[J]. Aquaculture, 2000, 183: 161-177.
[34] 胡先成. 河川沙塘鳢早期发育过程中的器官发生、营养代谢及其能量收支的研究[D]. 上海: 华东师范大学, 2007.
Hu X C. Organ Development, Nutrition Metabolism and Energy Budget During the Early Development ofOdontobutispotamophila(Günther) [D]. Shanghai: East China Normal University, 2007.
[35] Vázquez R, González S, Rodríguez A, et al. Biochemical composition and fatty acid content of fertilized eggs, yolk sac stage larvae and first-feeding larvae of the Senegal sole(SoleasenegalensisKaup) [J]. Aquaculture, 1994, 119(2-3): 273-286.
[36] Desvilettes C, Bourdier G, Breton J C. Changes in lipid class and fatty acid composition during development in pike (EsoxluciusL) eggs and larvae[J]. Fish Physiollogy and Biochemistry, 1997, 16: 381-393.
[37] Sargent J, McEvoy L, Estevez A, et al. Lipid nutrition of marine fish during early development: Current status and future directions[J]. Aquaculture, 1999, 179: 217-229.
[38] Bell J G, Sargent J R. Arachidonic acid in aquaculture feeds: Current status and future opportunities[J]. Aquaculture, 2003, 218: 491-499.
[39] Castro B G, Garrido J L, Sotelo C G. Changes in composition of digestive gland and mantle muscle of the cuttlefishSepiaofficinalisduring starvation[J]. Marine Biology, 1992, 114: 11-20.
[40] Sandra G, Ismael H C, Diego G, et al. Lipid composition of the mantle and digestive gland ofOctopusvulgarisjuveniles (Cuvier, 1797) exposed to prolonged starvation[J]. Aquaculture International, 2010, 18(6): 1223-1241.
[41] 刘镜恪, 陈晓琳. 鱼类的痕量矿物质研究进展[J]. 海洋科学集刊, 2003, 45: 153-162.
Liu J K, Chen X L. Reviewon the trace minerals in fish nutrition[J]. Studia Marina Sinica, 2003, 45: 153-162.
[42] 刘云, 王际英, 李宝山, 等. 海水鱼类微量元素需求研究进展[J]. 海洋渔业, 2015, 37(4): 378-385.
Liu Y, Wang J Y, Li B S, et al. Research progress on requirements of marine fishes for trace elements[J]. Marine Fisheries, 2015, 37(4): 378-385.
[43] Alderdice D F. Osmotic and ionic regulation in teleost eggs and larvae[J]. Fish Physiology, 1988, 11: 163-251.
[44] 吴志昊. Fe(II)、DO 含量对养殖大菱鲆幼鱼生理学性状影响的研究[D]. 北京: 中国科学院研究生院, 2011.
Wu Z H. Physiological effects of Fe(II) and DO on Juvinile TurbotScophthalmusmaximus[D]. Beijing: Institute of Oceanology, Chinese Academy of Sciences, 2011.
[45] Segner H, Storch V. Influence of water-borne iron on the liver ofPoeciliareticulate(Peters 1859) [J]. Journal of Applied Ichthyology, 1985, 1(1) : 39-47.
[46] 李兰, 吴启南. 海螵蛸的化学成分研究[J] . 现代中药研究与实践, 2009, 23(2): 52-54.
Li L, Wu Q N. Study the chemical compositions of Os sepiae[J]. Research and Practice of Chinese Medicines, 2009, 23(2): 52-54.
责任编辑 高 蓓
Changes of the Main Biochemical Composition During Embryonic Development Stage ofSepiaesculenta
LIU Chang-Lin1, 2, ZHAO Fa-Zhen2, CHEN Si-Qing2, QIN Bo2, RUAN Fei-Teng2, GE Jian-Long2
(1.College of Fisheries,Ocean University of China,Qingdao 266003, China;2.The Key Laboratory for Sustainable Utilization of Marine Fisheries Resource,Yellow Sea Fisheries Research Institute, Chinese Academy of Fisheries Science, Qingdao 266071, China)
Golden cuttlefish(SepiaesculentaHoyle)was one of the four traditional major fisheries in China, but in recent years, their natural resources have become increasingly exhausted. In this paper, the changes of the content of main biochemical composition such as crude protein,crude lipid,ash,amino acids,fatty acids,major and trace elements during embryonic development stage ofSepiaesculentawas determined and analyzed by chemical and biological methods. The results indicated that the content of water was declined firstly and elevated later, but the tendency of the contents of crude protein, crude fat, ash and total sugar was in the opposite, that was elevated firstly and declined later. The utilization rate of crude protein, crude fat and total sugar was 66.20%, 66.67% and 36.08%, respectively, the total energy expenditure was 0.91 kJ/g, including crude protein supplied energy of 0.79 kJ/g, as the main source of energy. Total amino acids (TAA), essential amino acids (EAA), half essential amino acids (HEAA) and non-essential amino acids (NEAA) showed a trend of increased firstly and then decreased, and the utilization rate was 18.48%, 19.08%, 16.77% and 18.24%,respectively. Saturated fatty acid (SFA) had little change, and the utilization rate of which was 7.86%, mainly due to the decline of C14:0 and C16:0, Monounsaturated fatty acids (MUFA) in general was downtrend, and the utilization rate of which was 33.02%, mainly dued to the decline of C20:1 (n-7), but the polyunsaturated fatty acids (PUFA) showed an increasing tendency, content increased by 9.35%, mainly due to the content increase of EPA and DHA. In mineral substance,the content of P and Cu in general showed an increasing tendency, the remaining elements content changed little, the rest of the element contents had little change, the utilization rate of Fe and Se was higher, which was 45.16% and 33.33%, respectively, but the content of Ca and Cu in the hatching stage was significantly increased, and the rising proportion was 68.3% and 24.19%, respectively. This study is not only an important application value to conquer the bottleneck of Golden cuttlefish in breeding technology, but also an important theory value to extend and enrich the content of cephalopod development biology research.
Sepiaesculenta; embryonic development; biochemical composition; nutrition metabolism
国家科技支撑计划项目(2011BAD13B08);中央级公益性科研院所基本科研业务费专项基金项目(20603022013021)资助
2016-04-09;
2016-06-03
刘长琳(1978-),男,副研究员,博士生。 E-mail: liuchl@ysfri.ac.cn
** 通讯作者:E-mail: chensq@ysfri.ac.cn
Q954.4
A
1672-5174(2016)11-062-11
10.16441/j.cnki.hdxb.20160120
刘长琳, 赵法箴, 陈四清, 等. 金乌贼胚胎发育阶段主要生化成分的变化[J]. 中国海洋大学学报(自然科学版), 2016, 46(11): 62-72.
LIU Chang-Lin, ZHAO Fa-Zhen, CHEN Si-Qing, et al. Changes of the main biochemical composition during embryonic development stage ofSepiaesculenta[J]. Periodical of Ocean University of China, 2016, 46(11): 62-72.
Supported by the National Key Technology Support Program (2011BAD13B08);Special Funds for the Basic R&D Program in the Central Non-Profit Research Institutes (20603022013021)

