外源植物生长素对鳗草植株促生长作用的研究*
张沛东, 吴晓晓, 徐 强, 方 超
(中国海洋大学海水养殖教育部重点实验室,山东 青岛 266003)
外源植物生长素对鳗草植株促生长作用的研究*
张沛东, 吴晓晓, 徐 强, 方 超
(中国海洋大学海水养殖教育部重点实验室,山东 青岛 266003)
实验室条件下,研究了5个不同吲哚乙酸(Indole-3-acetic acid, IAA)浓度处理(0(对照)、1、10、50、100 μmol·L-1)对鳗草(Zosteramarina)存活、生长、光合色素含量、过氧化物酶(POD)活力、超氧化物歧化酶(SOD)活力和丙二醛(MDA)含量的影响,分析了外源IAA对鳗草植株的促生长作用。研究显示,经25 d培育实验,鳗草地上组织环境海水添加IAA(1~100 μmol·L-1)显著提高了植株存活率(66%~69%),且植株的单株叶面积、地上组织绝对生长率、地上生产力和总生产力均在100 μmol·L-1处理组达到最大值,显著高于其他处理组(P<0.05);鳗草地下组织环境海水添加IAA对植株生长的促进作用不显著,仅50 μmol·L-1处理组植株的根长高于对照组植株根长2倍左右;鳗草地上组织环境海水的IAA浓度为100 μmol·L-1或地下组织环境海水的IAA浓度为50 μmol·L-1时,植株的各光合色素含量达到最大值;IAA对植株POD和SOD活力无显著影响(P>0.05),但高浓度IAA处理条件下植株的MDA含量显著降低。研究结果表明,IAA是一种有效促进鳗草植株生长的生长调节剂,叶片可能是鳗草吸收外源生长素的主要部位,在设定的4个IAA处理中,100 μmol·L-1IAA浓度对鳗草植株的促生长作用最显著。
吲哚乙酸;存活率;单株叶面积;生产力;光合色素;鳗草
海草床是地球生物圈最高产的生态系统之一,其生态服务价值达到19 004美元·hm-2·a-1,高于红树林和珊瑚礁[1]。受自然环境变化和人类活动影响,海草床在世界范围内呈现急剧退化趋势,2009年的一项评估显示,全球约1/3的海草床已消失,且消失速度还在加快[2]。我国的海草床也已严重退化,人为干扰是导致其衰退的主要原因[3]。与大型经济海藻不同,海草的商业化苗种繁育技术尚未建立,组织培养技术亦不成熟,因此海草床退化生境的修复仍依赖于天然供体[4-5]。随着生态修复理论研究的不断深入,人工控制条件下扩繁海草天然植株然后将其移植于修复海域的方法因具有天然供体使用少和植株存活率高等优点,逐渐成为研究热点[6]。然而与陆生植物有效且多样的促繁手段相比,人们对海草植株的人工促繁策略还知之甚少[7-8]。
生长素在植物早期发育和形态建成过程中发挥重要作用,其对植物的促生长作用主要体现在促进植物细胞的伸长和分裂、主侧根和下胚轴的生长、植株向地性和向光性的形成及维管组织的发育等[9]。施加外源植物生长素是陆生植物最有效的促繁手段之一,如在小麦分蘖[10]、苹果催熟[11]、姜根茎形成[12]、芝麻荚膜开裂[13]、龙胆草冠芽形成[14]、向日葵生长[15]等农作物生产多有报道。然而相比陆生植物,有关外源植物生长素对海草促生长作用的研究还非常滞后,仅见于Ruppiamaritima[16]、Cymodoceanodosa[17]、Posidoniaoceanica[18-19]等海草种类的报道。
植物生长素主要包括吲哚乙酸(Indole-3-acetic acid, IAA)、吲哚丁酸(Indole-3-butyric acid, IBA)、4-氯吲哚-3-乙酸(4-chloroindole-3-acetie acid, 4-Cl-IAA)、α-萘乙酸(α-naphthaleneacetic acid, NAA)、2,4-二氯苯氧乙酸(2, 4-dichlorophenoxyacetic acid, 2, 4-D)等。其中IAA虽然价格相对较高,但其是天然植物生长素的主要活性成分,也是生物合成途径认知最深入的促进植物生长的激素[9,17]。光合色素是光合作用中参与吸收、传递光能或引起原初光化学反应的色素,排列在类囊体膜上,是植物叶片光合作用的物质基础,其含量的高低反映植物的生长状况和叶片光合能力[20]。植物在移植过程中通常会受到植株采集、移植单元制作及种植等人为操作胁迫[21],IAA作为重要的痕量信号分子,对植物体膜脂过氧化过程具有调节作用,特别是丙二醛(MDA)、过氧化物酶(POD)和超氧化物歧化酶(SOD)等活性氧清除系统的3个主要组成部分[22]。
鳗草(ZosteramarinaL.)是北半球温带海域海草的优势种,属鳗草科(Zostreraceae)鳗草属(Zostera),在我国主要分布于山东、河北、辽宁等省沿海地区[23-24]。为探明鳗草植株对添加不同浓度外源植物生长素的生长响应及其生理适应过程,在实验室条件下营造植株地上组织和地下组织分隔模式,向地上组织和地下组织环境海水中添加不同浓度的IAA,监测植株的存活和生长状况,测定植株叶片的光合色素含量、MDA含量以及POD和SOD活性,查明鳗草植株对外源植物生长素的吸收规律,明确外源植物生长素对鳗草植株的促生长作用。研究结果不仅可以进一步丰富鳗草生理生态学理论,也可为实现鳗草植株规模化人工扩繁提供科学基础。
1 材料与方法
1.1 实验材料
实验于2015年4—5月在中国海洋大学增殖生态学实验室进行。实验用鳗草植株采自山东省荣成市天鹅湖鳗草草床。采集时,用手从鳗草植株底部连根挖取,以减少对植株的破坏,并确保植株地下组织完整。植株经海水充分浸洗,去除底泥、杂质及叶片附生生物,放入泡沫箱4 h内运回实验室,置于室内循环水槽暂养7 d。暂养条件:水温(18.0±0.5) ℃,光照强度(60±5) μmol·m-2·s-1(光周期12 h∶12 h),连续充氧。
1.2 鳗草植株不同组织分隔模式营造
取500 mL聚乙烯瓶,在其瓶盖表面均匀制造10个直径为3 cm小孔,并用黑色胶带将瓶身完全遮住,以营造瓶内的暗光环境。实验时,首先在瓶内注满设定浓度的IAA海水,其次将鳗草植株的地下组织穿过聚乙烯瓶盖上的小孔,至植株维管束顶端即分生组织处为止,然后用硅脂将小孔密封,最后将密封后的聚乙烯瓶放入盛有设定浓度IAA海水的玻璃水槽(50 cm×50 cm×40 cm),从而将植株的地上组织和地下组织分隔,实现植株地上组织和地下组织处于不同浓度IAA处理的海水环境。
1.3 实验设计与过程
实验分两部分:第一部分是将鳗草植株地上组织分别置于5个IAA浓度(0(对照)、1、10、50、100 μmol·L-1)的海水(Above-ground tissue-IAA, AGT-IAA),地下组织置于正常海水(IAA浓度为0 μmol·L-1);第二部分是将鳗草植株地下组织分别置于5个IAA浓度(0(对照)、1、10、50、100 μmol·L-1)的海水(Below-ground tissue-IAA, BGT-IAA),地上组织置于正常海水(IAA浓度为0 μmol·L-1)。实验用IAA产自江苏省金坛市姚西工业园,纯度>99%。不同IAA浓度配制时,首先用1 mol·L-1NaOH溶解IAA,添加海水配成1 mmol·L-1的IAA母液,避光保存,实验时用海水稀释至设定浓度。为保持海水IAA浓度保持在设定水平,实验海水每天更换2次。
每个处理组设置15个重复,每个重复使用10株植株,植于一个经过处理的聚乙烯瓶,全部实验共种植1 500株植株。相同处理的15个实验瓶置于同一个玻璃水槽中,每天随机变换位置以减少光照误差。实验时,选取长势良好的植株进行实验。为标准化实验,选取具有相似形态学特征的植株进行实验,即根状茎4 cm、株高10~15 cm、叶片数3~4片,并对其进行标记。标记时,在各植株维管束顶端即分生组织上方1 cm处,用细针扎孔。
实验期间,水温控制在(18.0±0.5) ℃,盐度33±1,光照强度(60±5) μmol·m-2·s-1,光周期12 L∶12 D,溶解氧含量维持在5.0 mg·L-1以上,pH为8.2±0.2。实验周期均为25 d。
1.4 样品采集与测定
实验结束后,观察并记录鳗草植株的存活情况,计算各处理组的存活率。每处理组随机选取5株植株进行叶片光合色素含量测定,另随机选取5株植株进行酶活力测定,余下植株进行生长指标测定。
1.4.1 植株生长指标 鳗草植株清水洗净后,用干纱布拭去水分,保证根、茎、叶的干净完整,然后测量植株新生组织(植株标记后新长出的部分)的叶长、叶宽、茎节长、根长(cm)。根据叶长和叶宽计算单株叶片面积,即实验期间单株全部新生叶片的叶长与叶宽乘积之和(cm2·shoot-1);根据单株新生叶片总长计算地上组织绝对生长率(aAGR),即单株新叶总长除以实验天数(mm·shoot-1·d-1);根据新生茎节总长计算茎节伸长率(REER),即单株新生茎长除以实验天数(mm·shoot-1·d-1)。植株生产力测定时,根据标记结果,分别将植株地上组织的新生叶片和地下组织的新生茎节用剪刀剪下,去离子水清洗后置于60 ℃烘干至恒重,测量各组织干重,计算公式参照Zhao等[8]。
1.4.2 叶片光合色素含量 鳗草植株叶片光合色素含量的测定采用萃取法[25],即取每株植株第二片新鲜叶片,用二甲基甲酰胺(DMFO)提取光合色素,然后用分光光度计法进行测定。以DMFO为空白,分别于665、652、649和470 nm测定吸光度值(OD),计算公式为:
叶绿素a含量=(13.95D665-6.88D649)×V/S;
叶绿素b含量=(24.96D649-7.32D665)×V/S;
叶绿素总含量=(D652×1000/34.5)×V/S;
类胡萝卜素含量=(4.08D470-11.56D649+3.29D665)×V/S。
式中,D为吸光度值(mg·mL-1);V为提取液体积(mL);S为叶片鲜重面积(cm2),各色素含量单位为mg·cm-2。
1.4.3 叶片POD活力、SOD活力和MDA含量 实验结束后,将植株叶片用海水清洗干净,干纱布拭去多余水分,迅速于-80 ℃保存,待测。
POD(U·mg-1)活力、SOD(U·g-1)活力和MDA(nmol·mg-1)含量的测定均采用比色法,分别使用南京建成生物工程研究所POD测试盒(A084-3)、SOD测试盒(A001-1)和MDA测试盒(A003-1)进行。于每个重复随机选取叶片0.5 g,加入生理盐水4.5 mL,冰浴研磨成10%的组织匀浆液,4 ℃、3 500 r·min-1离心10 min,取上清液分别于420、550和532 nm处比色,读取吸光度值,计算酶活力和MDA含量。
1.5 数据分析
各处理组数据以平均值±标准误表示,进行单因素方差分析(ANOVA),差异显著时使用Tukey多重比较分析组间差异。2个样本间的数据采用独立样本T检验分析。数据分析使用SPSS 17.0进行,以P<0.05作为差异显著水平,以P<0.01作为差异极显著水平。分析结果使用Orgin8.5软件绘图。
2 结果
2.1 成活率
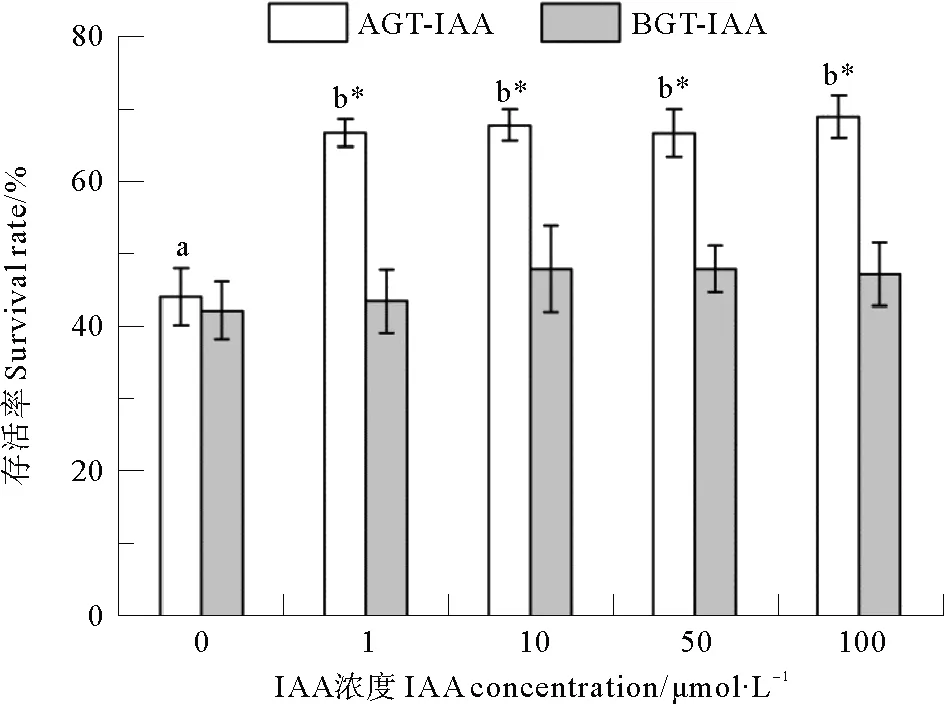
鳗草植株存活率的变化如图1所示。单因素方差分析显示,地上组织环境海水中添加IAA(1~100 μmol·L-1)明显提高植株存活,各处理组存活率在66%~69%之间,显著高于对照组(44%)(P<0.05);地下组织环境海水添加IAA各处理组之间存活率无显著差异(P>0.05),在42%~48%之间。独立样本T检验结果显示,地上组织环境海水添加IAA处理组(AGT-IAA)的存活率明显高于地下组织环境海水添加IAA处理组(BGT-IAA)。
2.2 生长指标
鳗草单株叶面积的变化如图2所示。随地上组织环境海水IAA浓度增加,叶面积逐渐增大,至100 μmol·L-1处理组时达到最大值(6.52 cm2·shoot-1),显著高于其他各处理组(P<0.05),是对照组(2.61 cm2·shoot-1)的2.5倍;随地下组织环境海水IAA浓度增加,叶面积呈现先增大后减小的变化趋势,在10 μmol·L-1处理组时达到最大值(3.64 cm2·shoot-1),但各处理组之间无显著差异(P>0.05)。独立样本T检验显示,50和100 μmol·L-1IAA浓度时,地上组织环境海水添加IAA植株的单株叶面积显著高于地下组织相同浓度IAA处理组(P<0.05),但其他IAA浓度处理组地上组织和地下组织间无明显不同(P>0.05)。
(数据为平均值±标准误,误差线上的不同字母表示同一列间差异显著(P<0.05);*表示同一簇间差异显著(P<0.05),**表示差异极显著(P<0.01)。下同。Data are means ±S.E. of the means. Different letters above error bars in the same column indicate significant differences (P<0.05). The data in the same cluster with * indicate significant difference (P<0.05) and ** indicate very significant difference (P<0.01). The same below.)
图1 地上组织(AGT-IAA)和地下组织(BGT-IAA)环境海水添加不同浓度IAA鳗草植株存活率的变化
Fig.1 Change in survival rate ofZ.marinaplants to different IAA concentrations added to seawater for above-ground tissues(AGT-IAA) and below-ground tissues (BGT-IAA)
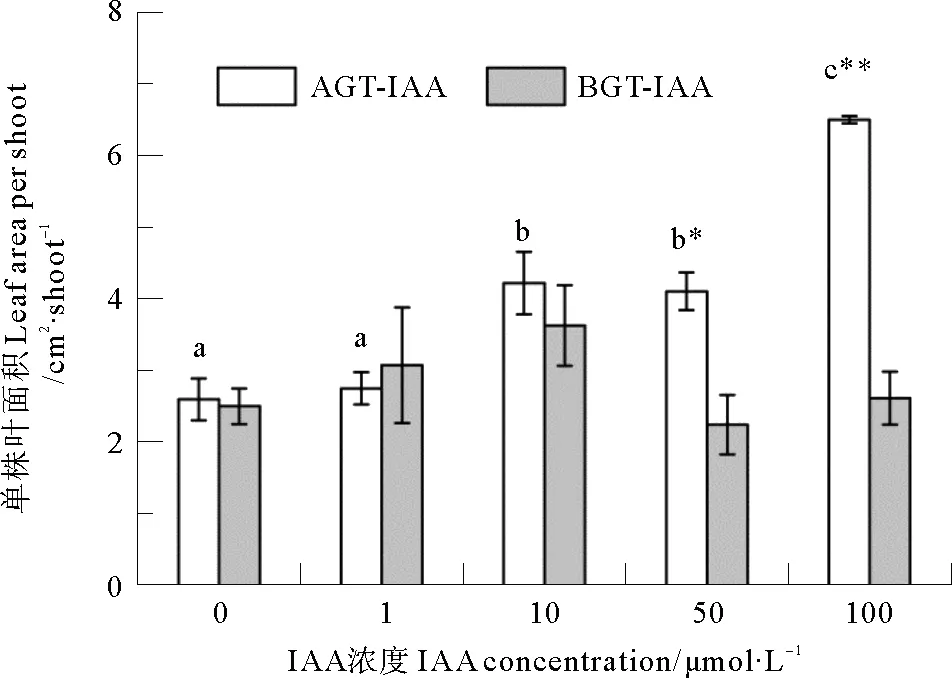
图2 地上组织(AGT-IAA)和地下组织(BGT-IAA)环境海水添加不同浓度IAA鳗草植株单株叶面积的变化
鳗草植株根长的变化如图3所示。随环境海水IAA浓度增加,植株的根长均呈现先增大后减小的变化趋势,并在50 μmol·L-1处理组时达到最大值,且显著高于对照组(P<0.05)。独立样本T检验显示,各IAA浓度条件下,地上组织环境海水添加IAA植株的根长与地下组织相同浓度IAA处理组之间均无显著差异(P>0.05)。
鳗草地上组织绝对生长率的变化如图4(a)所示。地上组织环境海水添加不同浓度IAA时,100 μmol·L-1处理组植株aAGR达到最大值(7.3 mm·shoot-1·d-1),是对照组的2.1倍;随地下组织环境海水IAA浓度增加,植株aAGR呈现先增大后减小的变化趋势,并于10 μmol·L-1时达到最大值,但各处理组间无显著差异(P>0.05)。独立样本T检验显示,100 μmol·L-1IAA浓度时,地上组织环境海水添加IAA植株的aAGR显著高于地下组织相同浓度IAA处理组(P<0.05),但其他IAA浓度处理组地上组织和地下组织间无明显不同(P>0.05)。各处理组间植株的茎节延伸率均无显著差异(P>0.05),其中地上组织环境海水添加不同浓度IAA时,植株的REER为1.1~1.5 mm·shoot-1·d-1,地下组织环境海水添加不同浓度IAA时,植株的REER为1.4~1.6 mm·shoot-1·d-1(见图4(b))。
鳗草植株生产力的变化如图5所示。地上组织环境海水IAA浓度为100 μmol·L-1时,植株地上生产力达到最大值(1.1 mg·shoot-1·d-1),显著高于其他处理组(P<0.05);而地下组织环境海水添加不同浓度IAA时,植株地上生产力无明显变化,各处理组的平均值为0.3 mg·shoot-1·d-1(见图5(a))。随地上组织环境海水IAA浓度增加,植株的地下生产力逐渐增大,至100 μmol·L-1时达到最大值(2.2 mg·shoot-1·d-1),是对照组的1.3倍(P<0.05);地下组织环境海水添加不同浓度IAA时,植株的地下生产力亦无显著差异,在1.7~2.6 mg·shoot-1·d-1之间(见图5(b))。植株总生产力表现出与地下生产力相同的变化趋势,地上组织环境海水IAA浓度为100 μmol·L-1时,植株总生产力达到最大值(3.3 mg·shoot-1·d-1),显著高于其他处理组(P<0.05),是对照组的1.7倍(见图5(c))。
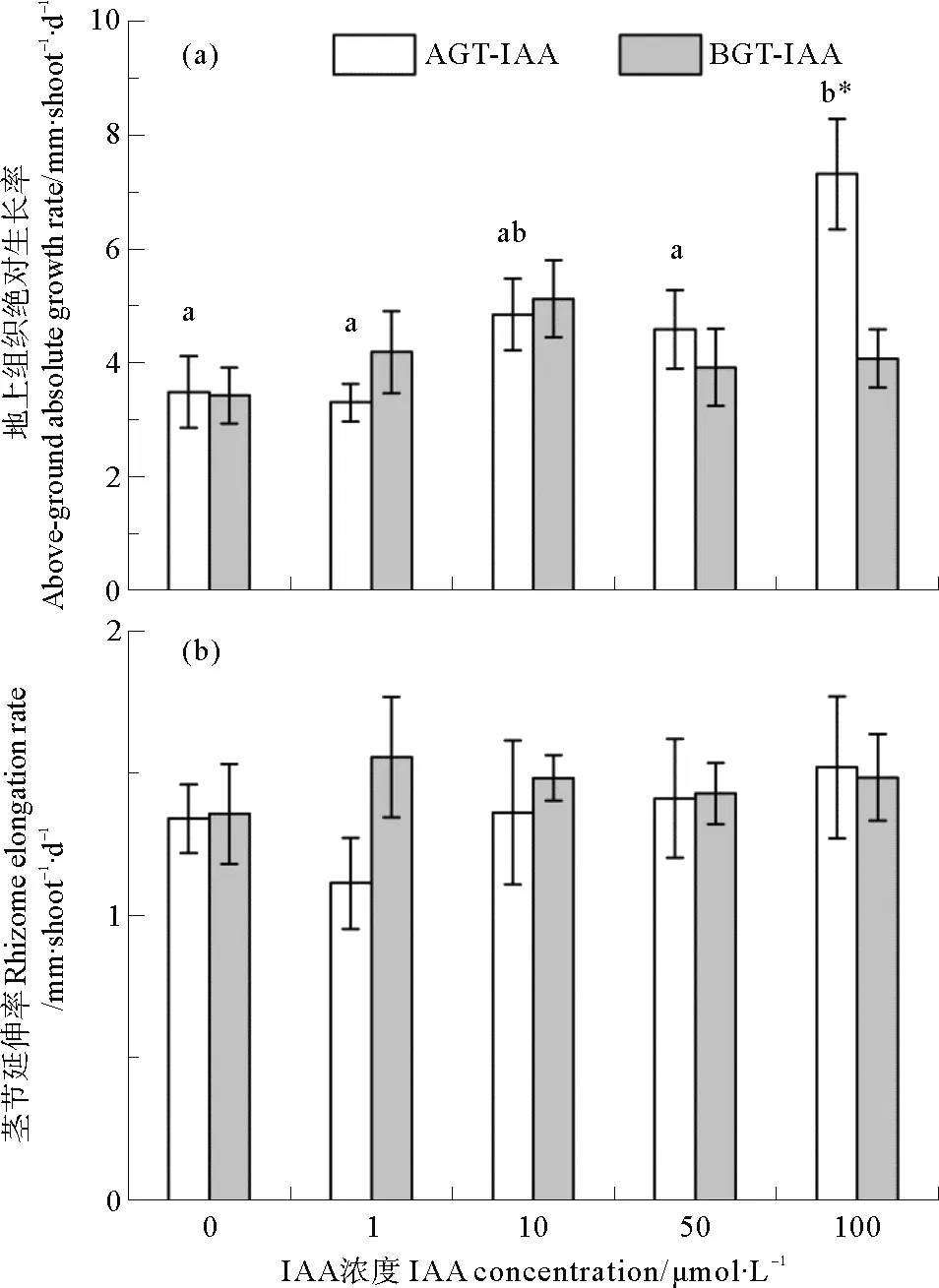
图4 地上组织(AGT-IAA)和地下组织(BGT-IAA)环境 海水添加不同浓度IAA鳗草植株地上组织绝对生长率(a)和茎节延伸率(b)的变化
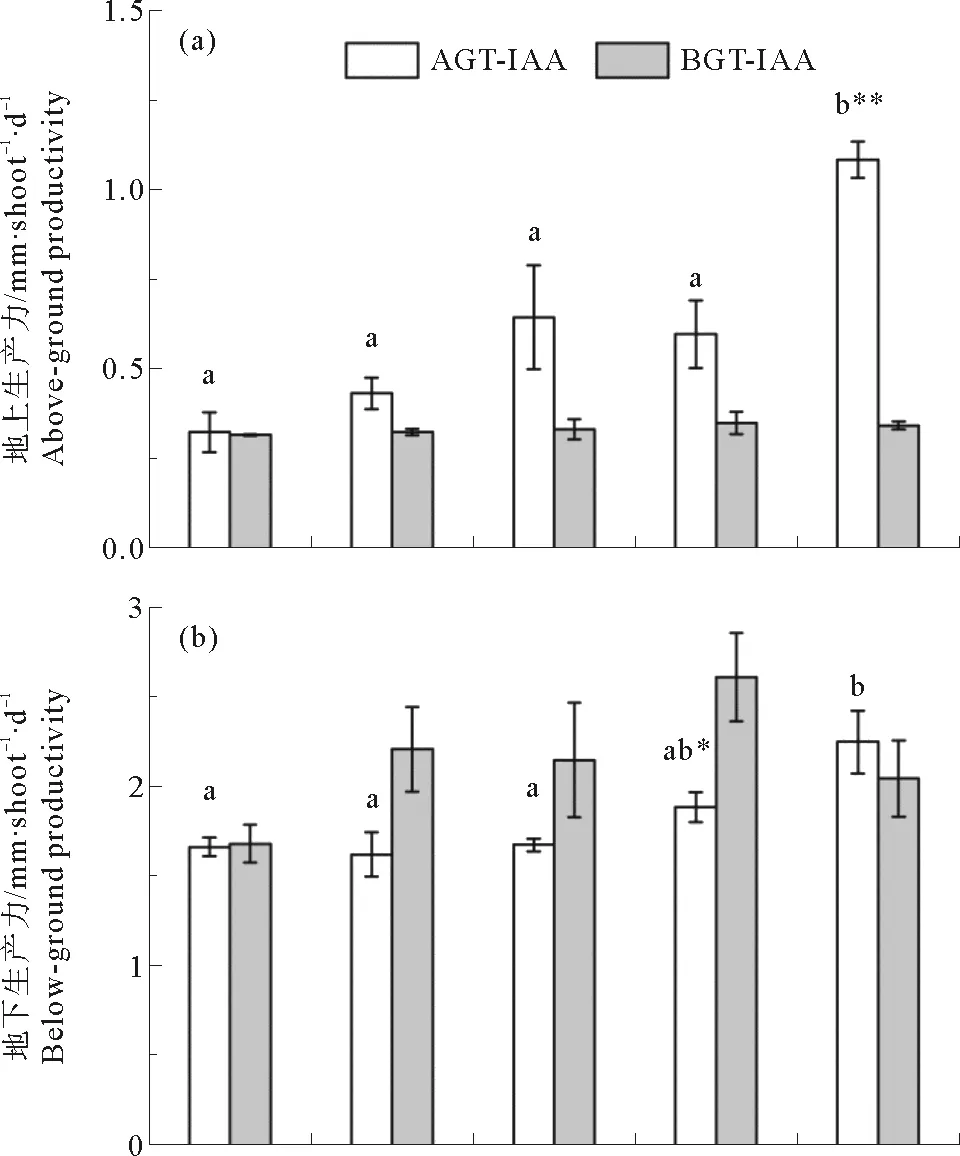
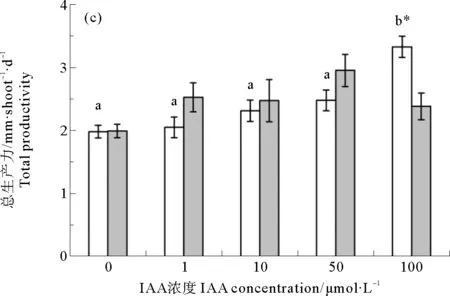
图5 地上组织(AGT-IAA)和地下组织(BGT-IAA)环境海水添加不同浓度IAA鳗草植株地上生产力(a)、地下生产力(b)和总生产力(c)的变化
2.3 光合色素含量
鳗草叶片光合色素含量的变化如图6所示。地上组织环境海水添加不同浓度IAA时,叶片的叶绿素a含量变化显著,于100 μmol·L-1处理组达到最大值(15.8 mg·cm-2),是对照组的1.6倍(P<0.05),然而叶片的叶绿素b、总叶绿素和类胡萝卜素含量均无明显不同(P>0.05)。地下组织环境海水添加不同浓度IAA时,叶片的类胡萝卜素含量变化明显,于50 μmol·L-1处理组达到最大值(3.0 mg·cm-2),显著高于其他处理组(P<0.05),然而叶片的叶绿素含量均无显著差异(P>0.05)。
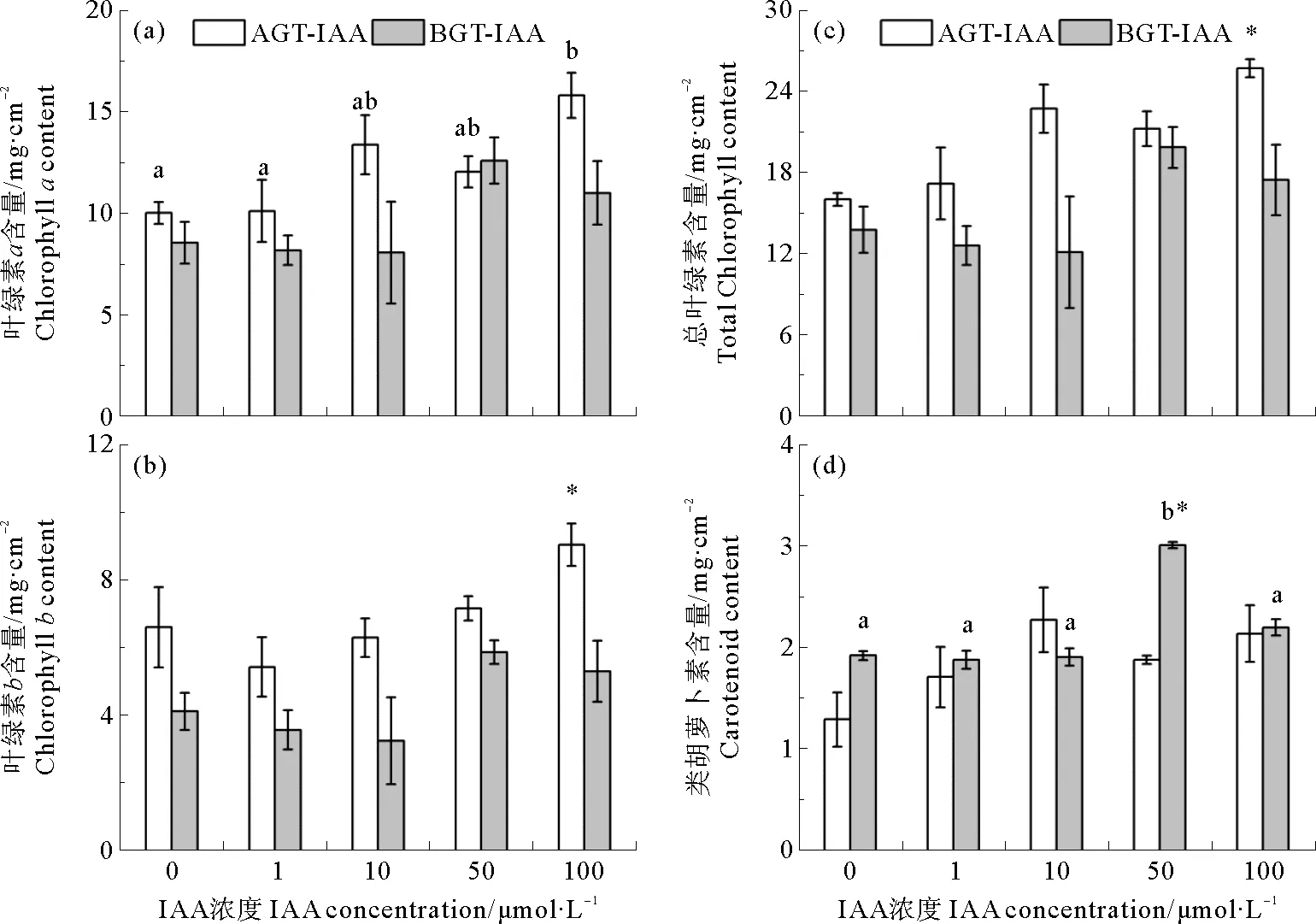
图6 地上组织(AGT-IAA)和地下组织(BGT-IAA)环境海水添加不同浓度IAA鳗草植株叶绿素a含量(a)、叶绿素b含量(b)、总叶绿素含量(c)和类胡萝卜素含量(d)的变化
2.4 POD活力、SOD活力和MDA含量
单因素方差分析显示,鳗草植株的POD活力和SOD活力在不同处理组间均无显著差异(P>0.05)(见图7(a)、(b));MDA含量变化明显,高浓度IAA条件下MDA含量显著低于对照组和低浓度IAA处理组(P<0.05)(见图7(c))。独立样本T检验显示,10 μmol·L-1IAA浓度时,地上组织环境海水添加IAA植株的MDA含量显著高于地下组织相同浓度IAA处理组(P<0.05),但其他IAA浓度处理组地上组织和地下组织间无明显不同(P>0.05)。
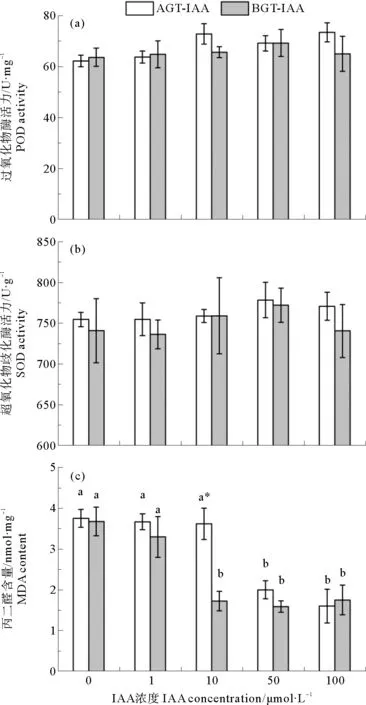
图7 地上组织(AGT-IAA)和地下组织(BGT-IAA)环境海水添加不同浓度IAA鳗草植株过氧化物酶活力(a)、超氧化物歧化酶活力(b)和丙二醛含量(c)的变化
3 讨论
3.1 外源植物生长素对海草的促生长作用
本研究结果显示,添加外源IAA可显著提高植株存活率,特别是地上组织环境海水添加IAA,植株存活率是对照组的1.5倍。对鳗草植株生长指标的综合分析表明,当鳗草地上组织环境海水添加IAA的浓度达到100 μmol·L-1(17.5 mg·L-1)时,IAA对鳗草植株的促生长作用明显,植株的单株叶面积和地上生产力分别是对照组的2.5和3.7倍,而地下组织环境海水添加IAA对鳗草植株的促生长作用不明显,仅对根长的生长表现出显著的促进作用,因此植株叶片可能是鳗草吸收外源生长素的主要部位。此外,无论何种IAA添加方式,植株的根长均在50 μmol·L-1条件下达到最大值,是对照组的1.6倍,地下组织环境海水添加该浓度的IAA亦可大幅提高植株的地下生产力,这对植株移植至修复海区后的扎根固着具有重要的生态学意义。
3.2 海草对外源植物生长素的生理响应
本研究结果显示,一定浓度的IAA可有效提高鳗草植株的光合色素含量,当地上组织环境海水的IAA浓度达到100 μmol·L-1时,植株的叶绿素a含量显著提升至对照组的1.6倍,且叶绿素b和总叶绿素含量亦有大幅提高,当地下组织环境海水的IAA浓度为50 μmol·L-1时,植株的各光合色素含量均达到最大值。有关陆生植物的研究亦有相似报道,如赵新宇等[26]研究了1 mg·L-1IAA对不同生育时期离体大豆植株叶片光合相关参数的影响,发现IAA对大豆叶片的净光合速率(Pn)、气孔导度(Gs)和蒸腾速率(Tr)均具有显著的促进作用,分别比对照组提高了24.1%、34.1%和17.3%;杨建昌等[27]研究了20 mg·L-1IAA对水稻光合强度的影响,发现IAA对水稻叶片的光合强度具有显著的促进作用,处理16 d后比对照组提高了16.5%。可见,在适宜IAA浓度下,植物对光的吸收能力明显提升,从而显著促进植物生长。
丙二醛(MDA)是膜脂过氧化最重要的产物之一,其含量高低在一定程度上反映植物体内清除自由基能力的大小和活性氧(AOS)代谢的水平[22]。本研究结果显示,当地上组织环境海水的IAA浓度≥50 μmol·L-1或地下组织环境海水IAA≥10 μmol·L-1时,鳗草植株的MDA含量显著下降,说明高浓度IAA条件下植株体内抗氧化机制发生显著作用,膜脂过氧化产物得到及时清理,从而保护细胞不受伤害,提高植株环境适应能力。
3.3 外源植物生长素对海草床修复与保护的生态学意义
植株的幼苗期是植物单株存活和种群扩展的决定性生活阶段,也是植物生活史中最关键和最敏感的时期,在这个时期植物个体对生态因子的变化最敏感,个体损失率最高[28-29]。本研究结果表明,适宜浓度的IAA可有效提高海草植株的生产力,促进叶片生长,因此可在海草幼苗人工培育过程中通过添加IAA实现海草幼苗的快速扩繁,从而为海草床修复实践提供大量供体。此外,植株移植法是迄今为止最成熟的海草床退化生境修复方法,即从生长茂盛的天然海草床采集植株,利用某种方法或装置将其移植于修复海域的一种方法[30]。研究表明,根状茎附带底质的植株移植方式可显著提高移植植株的存活率,从而在较短时间内形成新的海草斑块[31]。本研究结果发现,在鳗草地下组织添加适宜浓度的IAA可显著促进植株根的生长,因此可在植株移植过程中使用添加IAA的基质包裹植株根状茎促进根的快速生长,从而利于移植植株在自然海域的扎根固定,显著提高植株存活率。相关海区IAA添加实验及其效果评价仍需进一步研究。
4 结语
本研究发现,IAA是一种有效促进鳗草植株生长的生长调节剂,且叶片可能是鳗草吸收外源生长素的主要部位;鳗草地上组织环境海水添加IAA的浓度达到100 μmol·L-1时,IAA对鳗草植株的促生长作用最明显。本研究确定了外源植物生长素对鳗草植株的促生长作用,为建立鳗草植株规模化人工扩繁技术提供了理论依据和科学基础。
[1] Costanza R, d’Arge R, Groot R, et al. The value of the world’s ecosystem services and natural capital[J]. Nature, 1998, 387: 253-260.
[2] Waycott M, Duarte C M, Carruthers T J B, et al. Accelerating loss of seagrasses across the globe threatens coastal ecosystems[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(30): 12377-12381.
[3] 郑凤英, 邱广龙, 范航清, 等. 中国海草的多样性、分布及保护[J]. 生物多样性, 2013, 21(5): 517-526.
Zheng F Y, Qiu G L, Fan H Q, et al. Diversity, distribution and conservation of Chinese seagrass species[J]. Biodiversity Science, 2013, 21(5): 517-526.
[4] Shafer D, Bergstrom P. An introduction to a special issue on large-scale submerged aquatic vegetation restoration researchin the Chesapeake Bay: 2003-2008[J]. Restoration Ecology, 2008, 18(4): 481-489.
[5] Tanner C E, Parham T. GrowingZosteramarina(eelgrass) from seeds in land-based culture systems for use in restoration projects[J]. Restoration Ecology, 2010, 18(4): 527-537.
[6] Yang C J, Liu Y S, Liu J, et al. Assessment of the establishment success ofZosteramarina(eelgrass) from seeds in natural waters: Implications for large-scale restoration[J]. Ecological Engineering, 2016, 92: 1-9.
[7] Short F T. The seagrass,ZosteraMarinaL.: Plant morphology and bed structure in relation to sediment ammonium in izembek lagoon, Alaska[J]. Aquatic Botany, 1983, 16(2): 149-161.
[8] Zhao J S, Zhang Q, Liu J, et al. Effects of copper enrichment on survival, growth and photosynthetic pigment ofseedlings and young plants of the eelgrassZosteramarina[J]. Marine Biology Research, 2016, 12(7): 695-705.
[9] 王家利, 刘冬成, 郭小丽, 等. 生长素合成途径的研究进展[J]. 植物学报, 2012, 47(3): 292-301.
Wang J L, Liu D C, Guo X L, et al. Research advances in auxin biosynthesis[J]. Chinese Bulletin of Botany, 2012, 47(3): 292-301.
[10] 蔡铁, 徐海成, 尹燕枰, 等. 外源IAA、GA3和ABA影响不同穗型小麦分蘖发生的机制[J]. 作物学报, 2013, 39(10): 1835-1842.
Cai T, Xu H C, Yin Y P, et al. Mechanisms of tiller occurrence affected by exogenous IAA, GA3, and ABA in wheat with different spike-types[J]. Acta Agronomica Sinica, 2013, 39(10): 1835-1842.
[11] Masia A, Ventura M, Gemma H, et al. Effect of some plant growth regulator treatments on apple fruit ripening[J]. Plant Growth Regulation, 1998, 25(2): 127-134.
[12] Rout G R, Palai S K, Samantaray S, et al. Effect of growth regulator and culture conditions on shoot multiplication and rhizome formation in ginger (ZingiberofficinaleRosc.)invitro[J]. In Vitro Cellular & Developmental Biology - Plant, 2001, 37(6): 814-819.
[13] Day J. The effect of plant growth regulator treatments on plant productivity and capsule dehiscence in sesame[J]. Field Crops Research, 2000, 66(1): 15-24.
[14] Samarakoon U C, Funnell K A, Woolley D J, et al. Influence of photoperiod regime and exogenous plant growth regulators on crown bud formation in gentian[J]. Scientia Horticulturae, 2015, 182(182): 56-64.
[15] Fässler E, Evangelou M W, Robinson B H, et al. Effects of indole-3-acetic acid (IAA) on sunflower growth and heavy metal uptake in combination with ethylene diamine disuccinic acid (EDDS)[J]. Chemosphere, 2010, 80(8): 901-907.
[16] Koch E W, Durako M J. In vitro studies of the submerged angiospermRuppiamaritima: Auxin and cytokinin effects on plant growth and development[J]. Marine Biology, 1991, 110(110): 1-6.
[18] Balestri E, Bertini S. Growth and development ofPosidoniaoceanicaseedlings treated with plant growth regulators: Possible implications for meadow restoration[J]. Aquatic Botany, 2003, 76(4): 291-297.
[19] Balestri E, Lardicci C. Stimulation of root formation inPosidoniaoceanicacuttings by application of auxins (NAA and IBA)[J]. Marine Biology, 2006, 149(2): 393-400.
[20] 潘瑞炽, 王小菁, 李娘辉. 植物生理学[M]. 北京: 高等教育出版社, 2008.
Pan R C, Wang X J, Li N H. Plant Physiology[M]. Beijing: Higher Education Press, 2008.
[21] 田璐, 张沛东, 张凌宇, 等. 移植操作胁迫对天鹅湖大叶藻存活、生长及光合色素含量的影响[J]. 中国海洋大学学报(自然科学版), 2014, 44(8): 25-31.
Tian L, Zhang P D, Zhang L Y, et al. Influence of transplanting stress on the survival, growth and photosynthetic pigment content of eelgrass (ZosteramarinaL.) in swan lake, Rongcheng, Shandong [J]. Periodical of Ocean University of China, 2014, 44(8): 25-31.
[22] 吴建勋, 张姗姗. Cr、Co、Pb单一胁迫对浮萍SOD、POD、MDA的影响[J]. 中国农学通报, 2013, 29(15): 188-194.
Wu J X, Zhang S S. Effect of metal icon Cr, Co, Pb on SOD, POD, MDA inLemnaminorL. [J]. Chinese Agricultural Science Bulletin, 2013, 29(15): 188-194.
[23] Niu S N, Zhang P D, Liu J, et al. The effect of temperature on the survival, growth, photosynthesis, and respiration of young seedlings of eelgrassZosteramarinaL. [J]. Aquaculture, 2012, 350-353(2): 98-108.
[24] 黄小平, 江志坚, 范航清, 等. 中国海草的“藻”名更改[J]. 海洋与湖沼, 2016, 47(1): 290-294.
Huang X P, Jiang Z J, Fan H Q, et al. The nomenclature of the “algae” name of seagrasses in China[J]. Oceanologia et Limnologia Sinica, 2016, 47(1): 290-294.
[25] 王文杰, 贺海升, 关宇, 等. 丙酮和二甲基亚砜法测定植物叶绿素和类胡萝卜素的方法学比较[J]. 植物研究, 2009, 29(2): 224-229.
Wang W J, He H S, Guan Y, et al. Methodological comparison of chlorophyll and carotenoids contents of plant species measured by DMSO and acetone-extration methods[J]. Bulletin of Botanical Research, 2009, 29(2): 224-229.
[26] 赵新宇, 徐克章, 张玉姣, 等. 外源激素对大豆叶片光合相关参数的影响[J]. 大豆科学, 2014, 33(3): 358-364.
Zhao X Y, Xu K Z, Zhang Y J, et al. Effect of exogenous hormones on leaf photosynthetic parameters of soybean plants[J]. Soybean Science, 2014, 33(3): 358-364.
[27] 杨建昌, 王志琴, 朱庆森. 外源植物激素对水稻光合能力与产量的影响[J]. 江苏农学院学报, 1995, 16(1): 27-31.
Yang J C, Wang Z Q, Zhu Q S. Effects of exogenous plant hormones on the photosynthetic ability and grain yield of rice[J]. Journal of Jiangsu Agriculture College, 1995, 16(1): 27-31.
[28] 蒋高明. 植物生态生理学[M]. 北京: 高等教育出版社, 2004.
Jiang G M. Plant Ecophysiology[M]. Beijing: Higher Education Press, 2004.
[29] Peterson J E, Baldwin A H. Seedling emergence from seed banks of tidal freshwater wetlands: Response to inundation and sedimentation[J]. Aquatic Botany, 2004, 78(3): 243-254.
[30] 刘燕山, 郭栋, 张沛东, 等. 北方澙湖大叶藻植株枚订移植法的效果评估与适宜性分析[J]. 植物生态学报, 2015, 39(2): 176-183.
Liu Y S, Guo D, Zhang P D, et al. Assessing establishment success and suitability analysis ofZosteramarinatransplants using staple method in northern lagoons[J]. Chinese Journal of Plant Ecology, 2015, 39(2): 176-183.
[31] 张沛东, 曾星, 孙燕, 等. 海草植株移植方法的研究进展[J]. 海洋科学, 2013, 37(5): 100-107.
Zhang P D, Zeng X, Sun Y, et al. Research progress in seagress shoot trans planting method[J]. Marine Science, 2013, 37(5): 100-107.
责任编辑 朱宝象
Studies on Promotion of Exogenous Auxin to Zostera marina Growth
ZHANG Pei-Dong, WU Xiao-Xiao, XU Qiang, FANG Chao
(The Key Laboratory of Mariculture, Ministry of Education, Ocean University of China, Qingdao 266003, China)
To promote the growth of eelgrass (Zosteramarina), the effects of different concentrations of exogenous auxin(indole-3-acetic acid, IAA;0, the control, 1, 10, 50 and 100 μmol·L-1) on the survival, growth, photosynthetic pigment content, POD activity, SOD activity and MDA content of eelgrass were examined under laboratory conditions in a period of 25 days. The results showed that IAA (1~100 μmol·L-1) in seawater covering above-ground tissues significantly increased the survival rate (66%~69%), nearly two-folds higher than that of the control. The greatest leaf area per shoot, above-ground absolute growth rate, above-ground productivity and total productivity of eelgrass were obtained at 100 μmol·L-1, which were significantly higher (P<0.05) than those attained at other concentrations. No significant difference in survival and growth was observed among different IAA concentrations in seawater covering below-ground tissues; however 50 μmol·L-1caused nearly two-folds elongation of roots in comparison with the control. Results also revealed that the two greatest content of photosynthetic pigments was attained at 100 μmol·L-1and 50 μmol·L-1. MDA content significantly decreased at higher IAA concentrations, but no difference in POD and SOD activities was found. Our findings indicated that exposure to IAA (100 μmol·L-1) was effective for promoting the growth ofZ.marina.
Indole-3-acetic acid; survival rate; leaf area per shoot; productivity; photosynthetic pigment;Zosteramarina
国家自然科学基金项目(41576112);海洋公益性行业科研专项经费项目(201405010)资助
2016-07-28;
2016-09-07
张沛东(1975-),男,博士,副教授,主要从事海草床退化生境修复与保护研究。E-mail:zhangpdsg@ouc.edu.cn
Q948.8
A
1672-5174(2016)11-099-09
10.16441/j.cnki.hdxb.20160269
张沛东, 吴晓晓, 徐强, 等. 外源植物生长素对鳗草植株促生长作用的研究[J]. 中国海洋大学学报(自然科学版), 2016, 46(11): 99-107.
ZHANG Pei-Dong, WU Xiao-Xiao, XU Qiang, et al. Studies on promotion of exogenous auxin toZosteramarinagrowth[J]. Periodical of Ocean University of China, 2016, 46(11): 99-107.
Supported by the National Natural Science Foundation of China(41576112); National Marine Public Welfare Research Project(201405010)

