海洋药源微藻研究进展*
梁 英, 黄徐林, 田传远, 孟祥荣
(中国海洋大学海水养殖教育部重点实验室,山东 青岛 266003)
综 述
海洋药源微藻研究进展*
梁 英, 黄徐林, 田传远, 孟祥荣
(中国海洋大学海水养殖教育部重点实验室,山东 青岛 266003)
海洋微藻是海洋药物的一个重要来源,可从海洋微藻中筛选、分离和提取出多种具有抗菌、抗病毒、抗肿瘤和预防心血管疾病等功能的活性物质。本文概述了蓝藻门(Cyanophyta)、绿藻门(Chlorophyta)、硅藻门(Bacillariophyta)、金藻门(Chrysophyta)、红藻门(Rhodophyta)、甲藻门(Pyrrophyta)及其它门类海洋微藻的药用研究现状,介绍了各门类常见的药源微藻种类、主要活性物质和药理特性,概述了目前活性物质的应用情况,分析了海洋微藻开发过程中存在的问题和应用前景。通过本研究为进一步开发和利用海洋药源微藻提供参考。
海洋药源微藻; 活性物质; 药理特性
随着生活水平的不断提高人们对健康问题日益重视,高疗效、低毒副作用的海洋生物活性药物备受青睐。海洋是一个潜在的巨大药源宝库,其特殊的生态环境“炼就”了海洋生物独特的次生代谢产物合成途径和酶反应机制,从而保证了大多数海洋生物能够产生化学结构新颖、生物活性显著和药用价值高的化合物[1]。
海洋微藻在海洋生物资源中占有非常重要的地位,其种类繁多、生长迅速、富含活性物质、可大规模培养等,近年来已被作为开发海洋药物广泛筛选的焦点[2-4]。目前已成功从海洋微藻中筛选、分离和提取出多种具有抗病毒、抗肿瘤、预防心血管疾病、抗菌和提高机体免疫力等功能的活性物质,进一步为临床药物开发研究提供先导化合物[5-7]。但微藻药物的成功开发以及进入临床应用仍存在一些亟待解决的问题,其中一个关键的问题就是可利用的药源微藻十分有限,仍有许多种类尚待开发和研究。目前有关海洋药物的综述大多聚焦于活性物质种类及其多种或某种药理功能的论述,其中大篇幅介绍大型海藻、细菌、真菌和海洋动物活性物质的药用特性[8-11],而对于各个门类中具有药用价值的微藻,阐述不多。本文综述各门类中常见的海洋药源微藻种类,包括其含有的主要活性物质和药理特性,为最大限度地开发利用我国的海洋微藻种质资源以及推动海洋药源生物基础和应用研究提供参考。
1 蓝藻门药源微藻
蓝藻是一类结构简单,无典型细胞核的古老藻类,通常以丝状体或群体的形式存在。在自然界中分布广泛,海水、淡水、沙漠、土壤等环境中都可见到[12]。蓝藻在正常生长过程中或环境胁迫条件下会在胞内合成或向胞外分泌一些具有较高药用价值的活性物质,如多糖、藻胆蛋白、不饱和脂肪酸等[13]。目前蓝藻门(Cyanophyta)中研究较多的药源微藻有螺旋藻(Spirulinaspp.)、巨大鞘丝藻(Lyngbyamajuscule)、嗜盐隐杆藻(Aphanothecehalophytica)、席藻(Phormidiumspp.)、颤藻(Oscillatoriaspp.)、蓝杆藻(Cyanothecesp.)、聚球藻(Synechococcussp.)等。
1.1 螺旋藻
螺旋藻隶属于蓝藻门颤藻目(Oscillatoriales)螺旋藻属(Spirulina),是一种富含水溶性多糖、藻蓝蛋白、γ-亚麻酸和超氧化物歧化酶等活性成分的丝状蓝藻。其多糖主要以动物淀粉性多糖形式存在,含量可达干重的14%~16%[14]。螺旋藻蛋白基本上是水溶性的,含量高达干重的60%~70%,并含有17种氨基酸,包括人体不能合成的8种必需氨基酸,且必需氨基酸组成平衡[1]。其中,藻蓝蛋白是一类普遍存在于蓝藻细胞中的色素蛋白,含量高达蛋白总量的10%~20%[15]。螺旋藻蛋白中还含有多种重要酶类如超氧化物歧化酶(SOD),含量达1000~3750单位/g藻粉[14]。螺旋藻中脂肪酸含量占干重的6%~7%,其中不饱和脂肪酸占总脂含量的80%以上,尤其γ-亚麻酸含量最高,是迄今发现的唯一含有丰富γ-亚麻酸的自养生物[16]。螺旋藻多糖、藻蓝蛋白、超氧化物歧化酶和γ-亚麻酸等活性物质具有重要的药用用途,其具体药用价值见表1。
1.2 巨大鞘丝藻
巨大鞘丝藻隶属于颤藻目鞘丝藻属(Lyngbya),是一种单列细胞组成的不分支丝状体,具有毒性,但其生物活性物质如吲哚衍生物类生物碱毒素-鞘丝藻毒素A、免疫抑制多肽microcolinsA和B、藻胆蛋白和硫代-6-脱氧葡萄糖苷基二酰甘油(SQDG)等在医学方面具有重要的研究和临床应用价值,详见表1。
1.3 嗜盐隐杆藻
嗜盐隐杆藻隶属于色球藻目(Chroococcales)隐杆藻属(Aphanothece)。在其生长过程中会向胞外分泌由鼠李糖、岩藻糖、木糖、甘露糖、葡萄糖和葡萄糖醛酸组成的酸性多糖。该多糖成分单一,是一种高度硫酸化的多糖硫酸酯,其中硫酸根占整个分子的34.46%[17]。表1概述了其胞外多糖所具有的生物活性。
1.4 蓝藻门其它药源微藻
棕榈油酸是一种稀有的n-7系列的十六碳单不饱和脂肪酸,研究发现席藻属(Phormidiumsp. NKBG 041105)和颤藻属(Oscillatoriasp. NKBG 091600)含有相对较多的棕榈油酸,其含量分别占总脂肪酸的54.5%和54.4%,可作为提取棕榈油酸的原料[18]。此外,从纤细席藻(Phormidiumtenue)中提取的牛磺酸和糖脂,小头颤藻(Oscillatoriaaculissima)和弱细颤藻(Oscillatoriatenuis)中分离出的大环内酯类化合物Acutiphycin和藻蓝蛋白,聚球藻的β-谷甾醇,蓝杆藻的硫酸多糖均具有重要的生物活性,以上各类活性物质的具体生物活性见表1。
2 绿藻门药源微藻
绿藻门(Chlorophyta)是藻类中最庞大的一个门,种类繁多,用途广泛,既可作为养殖动物的优质饵料,又可供人直接食用,其中某些绿藻的活性物质还具有较高的药用价值[37]。目前绿藻门中研究较多的海洋药源微藻主要有小球藻(Chlorellaspp.)、盐生杜氏藻(Dunaliellasalina)、扁藻(Platymonasspp.)、塔胞藻(Pyramidomonassp.)等。
2.1 小球藻
小球藻属是绿藻门绿球藻目(Chlorococcales)小球藻科(Chlorellaceae)中的一个重要的属,其富含蛋白质、多糖、叶黄素等活性物质,其中叶黄素是一种含氧类胡萝卜素,素有“植物黄金”之称[38]。Shi等[39]研究发现原壳小球藻(Chlorellaprotothecoides)相对于普通小球藻(Chlorellavulgaris)和蛋白核小球藻(Chlorellapyrenoidosa)在异养条件下叶黄素含量最高,且在发酵罐中进行发酵培养,其细胞叶黄素含量可达到4.85 mg/g藻粉,生产效率为0.94 mg/(L·h)。小球藻生长因子(CGF)又称“类荷尔蒙”,一般包括氨基酸、核酸、多糖、多肽、蛋白质、酶、维生素等[40]。从1950年代开始人们就对小球藻生长因子进行了许多临床和药理试验,至今,小球藻生长因子的提取技术及其生理活性的研究已成为开发小球藻的新热点[41]。
2.2 盐生杜氏藻
盐生杜氏藻属于团藻目(Volvocales)衣藻科(Chlamydomonadaceae)盐藻属(Dunaliella),主要分布在近海水域,盐度适应范围广,具有繁殖快,生活力强,适于养殖等特点[42]。盐生杜氏藻含有大量β-胡萝卜素、玉米黄素、蛋白质、多糖等活性物质,其中多糖由岩藻糖、甘露糖、葡萄糖和半乳糖4种单糖组成,含量可高达干重的85.5%[43]。盐生杜氏藻是β-胡萝卜素最为天然的来源,在特定的培养条件下累积的β-胡萝卜素可达干重的10%~14%[44]。玉米黄素是一种萜烯类胡萝卜素,盐生杜氏藻可通过诱变积累玉米黄素,武昌俊等[45]利用UV照射和NTG(亚硝基胍)诱变处理得到一株高产玉米黄素突变株Zeal。关于盐藻多糖、β-胡萝卜素和玉米黄素的生物活性见表2。
此外,绿藻门中其它种类的活性物质也相继被研究,扁藻多糖、塔胞藻多糖、娇柔塔胞藻(Pyramidomonasdelicatula)粗脂等活性物质的具体生物活性见表2。
3 硅藻门药源微藻
硅藻因其细胞壁富含硅质而得名,海水种类多以单细胞形式存在,是海洋浮游植物的主要组分。许多硅藻在其生长过程中会向胞外分泌一类具有黏性、形态多样和结构复杂的多聚物,这些胞外多聚物主要由糖类组成,此外还包括少量的蛋白质及含硫化合物等[55]。其中某些硅藻如假微型海链藻(Thalassiosirapseudonana)、三角褐指藻(Phaeodactylumtricornutum)、中肋骨条藻(Skeletonemacostatum)、柔弱角毛藻(Chaetocerosdebilis)、新月菱形藻(Nitzschiaclosterium)、多枝舟形藻(Navicularamosissima)、尖针杆藻(Synedraacusvar)等胞外β-葡聚糖含量高,药用活性愈来愈受到关注。β-葡聚糖的具体生物活性见表3。
岩藻黄素是一种特殊的类胡萝卜素,在某些硅藻中含量丰富,臧正蓉等[56]研究发现三角褐指藻适合用于提取岩藻黄素,且25 ℃、7200 lx和红光是促进其岩藻黄素积累的最适宜条件。金色奥杜藻(Odontellaaurita)是一种带状的海洋单胞硅藻,富含岩藻黄素,同时EPA和金藻昆布多糖含量也很高。马雷讷素是一种多酚类水溶性天蓝色色素,牡蛎海氏藻(Hasleaostrearia)和卡拉达海氏藻(Hasleakaradagensis)可产生马雷讷素。岩藻黄素和马雷讷素的生物活性见表3。
二十碳五烯酸(EPA)是n-3系列多不饱和脂肪酸,与人体的多项生理机能密切相关[57]。三角褐指藻、筒柱藻(Cylindrothecasp.)、小新月菱形藻(N.closteriumf.minutissima)、牟氏角毛藻(Chaetocerosmuelleri)、纤细角毛藻(Chaetocerosgracilis)等EPA含量较高,并且通过改变培养条件如营养盐、盐度、光照、紫外辐射等可促进其EPA的积累[58-61]。旋链角毛藻(Chaetoceroscurvisetus)中分离出的弱极性多不饱和脂肪酸对细菌的生长抑制作用强于真菌,对革兰氏阴性菌的生长抑制效果尤为明显[62]。
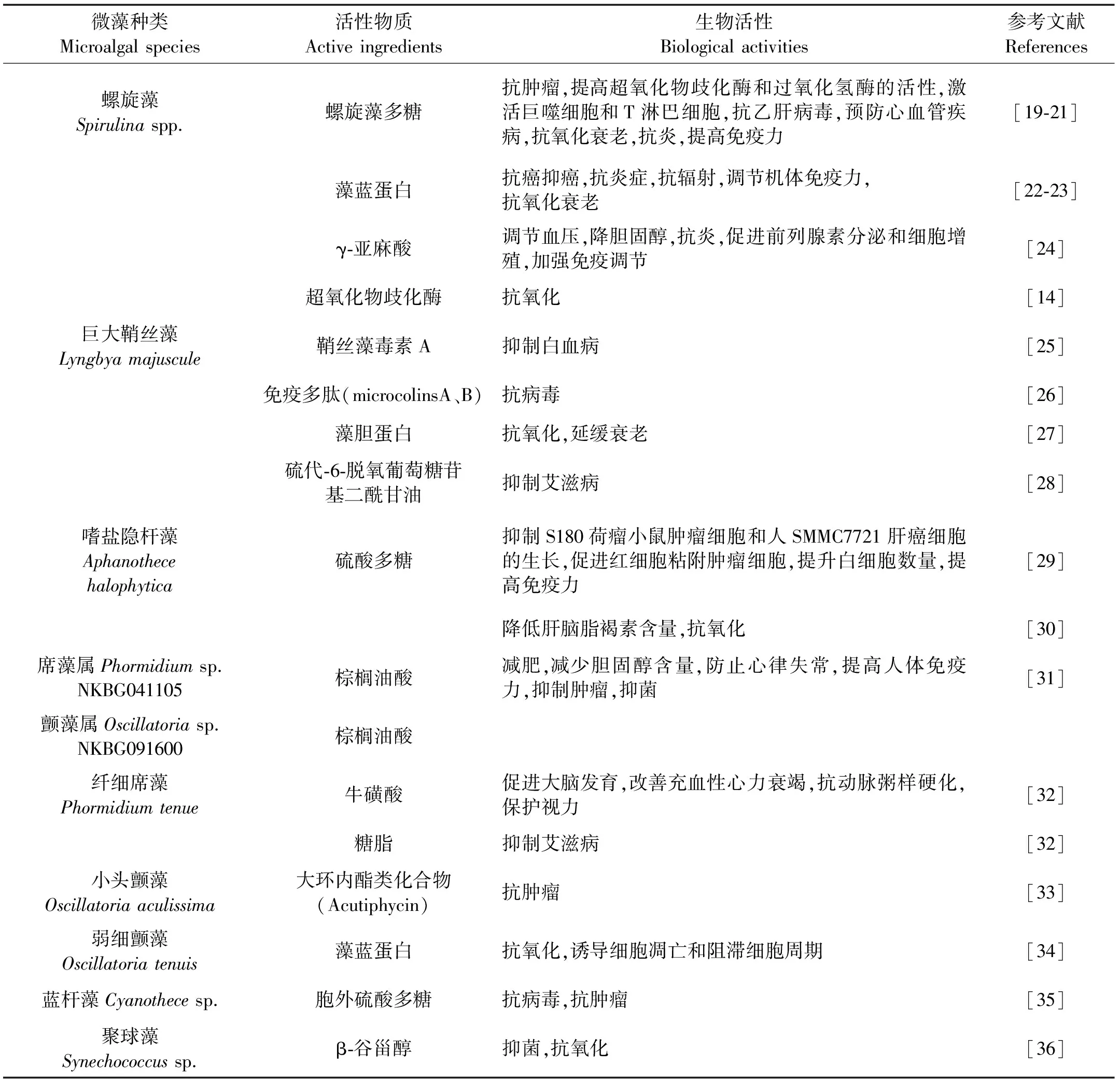
表1 蓝藻门主要的药源微藻种类
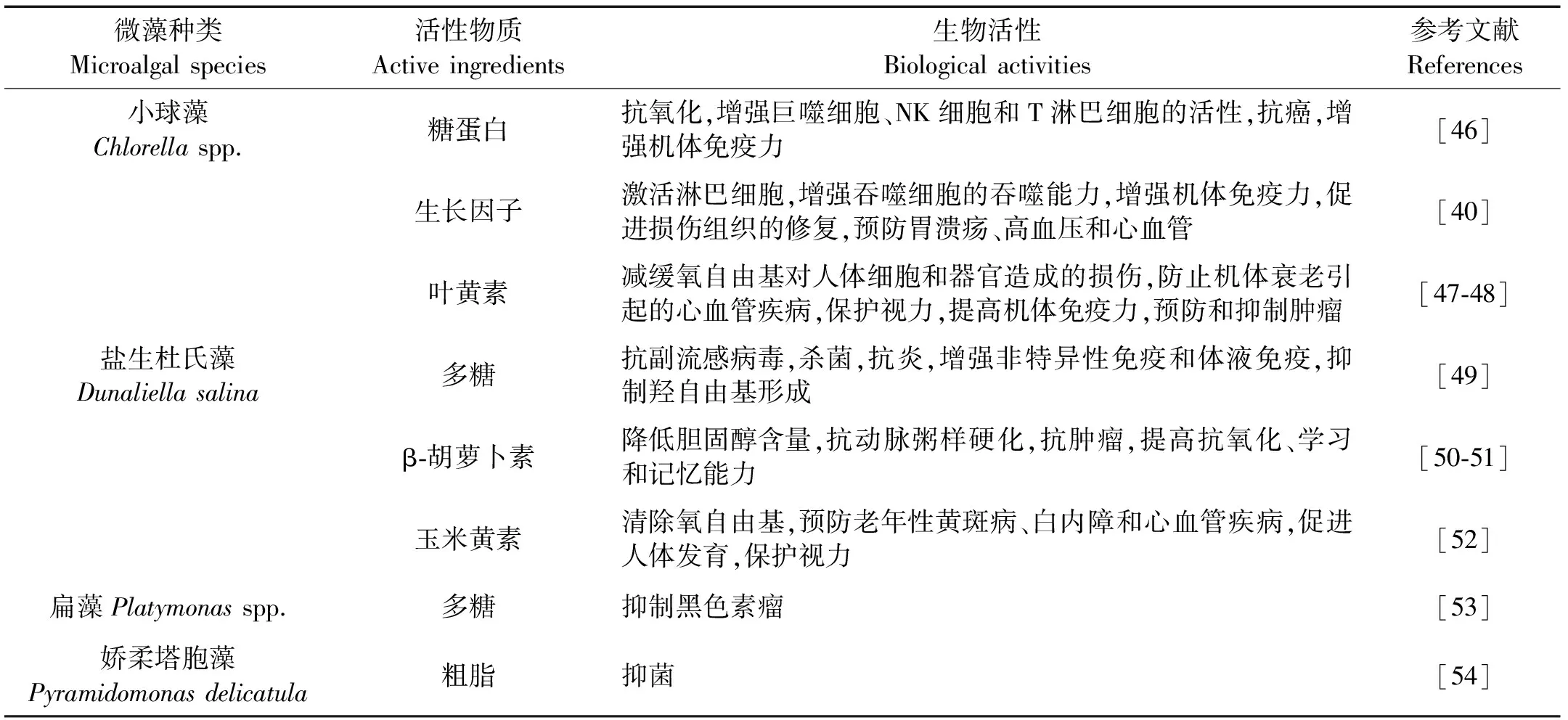
表2 绿藻门主要的药源微藻种类

表3 硅藻门主要的药源微藻种类
4 金藻门药源微藻
浮游金藻没有细胞壁,个体微小,营养丰富,是水生动物优质的天然饵料,同时金藻胞内和胞外多糖、DHA等活性物质具有重要的开发价值[73]。球等鞭金藻(Isochrysisgalbana)胞内和胞外多糖含量都比较高,其胞外多糖是一种富含硫酸基和糖醛酸的酸性多糖,胞内产生的是β-葡聚糖。绿色巴夫藻(Pavlovaviridis)体内还可分离得到一种硒多糖。金藻多糖的生物活性见表4。
金藻中某些种类如绿色巴夫藻、等鞭金藻(Isochrysisspp.)等含有丰富的DHA,DHA是人体自身不能合成的一种重要的二十二碳六烯酸,具有多种生理功能[74]。人们还首次从棕囊藻(Phaeocystissp.)中分离出具有抗菌活性的丙烯酸,对革兰氏阳性菌、酵母菌、曲霉菌等具有有效的抑制作用[75]。
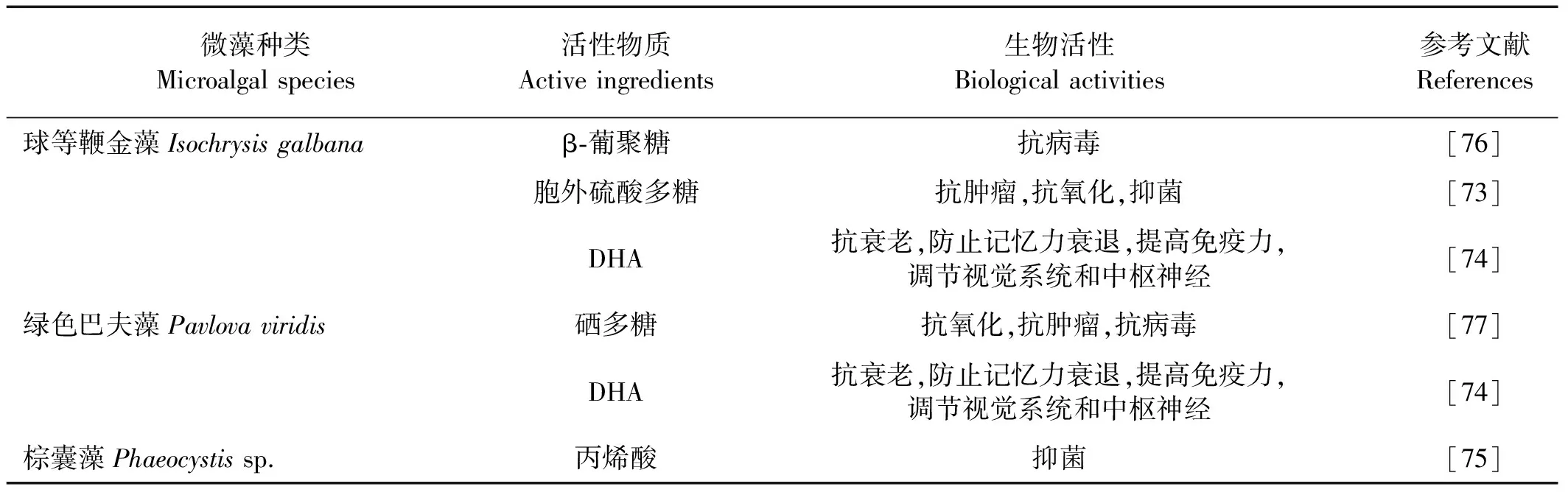
表4 金藻门主要的药源微藻种类
5 红藻门药源微藻
紫球藻(Porphyridiumcruentum)隶属于红毛菜目(Bangiales)紫球藻科(Porphyridiaceae)紫球藻属(Porphyridium),是红藻门中唯一的一种比较原始的单胞藻。在其生长过程中会合成藻红蛋白、硫酸酯多糖和花生四烯酸等生物活性物质,具有很高的经济和药用价值[78]。其β-藻红蛋白含量高,可作为治疗肿瘤的光敏剂,在杀伤肿瘤细胞的过程中不对正常组织造成损伤[79]。紫球藻中花生四烯酸含量丰富,高达不饱和脂肪酸总量的40%[80]。花生四烯酸是一种极其重要的n-6系列长链多不饱和脂肪酸,是母乳中含量最高的多不饱和脂肪酸[81]。

表5 红藻门主要的药源微藻种类
6 甲藻门药源微藻
甲藻在生物学上的分类地位比较特殊,既介于动物与植物之间,又介于真核生物和原核生物之间,特殊的进化地位决定其次生代谢产物的特殊性。从前沟藻属(Amphidiniumspp.)甲藻中分离得到的次生代谢产物Polyketids(聚酮类化合物)、米氏凯伦藻(Kareniamikimotoi)的70%乙醇提取物、环沟藻(Gyrodiniumimpudicum)产生的硫酸多糖均具有特殊的生物活性,详见表6。
寇氏隐甲藻(Crythecodiniumcohnii)隶属于多甲藻目(Peridiniales)隐甲藻科(Crythecodiniaceae)隐甲藻属(Crythecodinium),其胞内DHA含量可达总脂含量的25%~60%,而其它多不饱和脂肪酸的总和还不到总脂含量的1%,这使得其DHA的纯化工艺十分简单[87]。Swaaf等[88]研究发现以葡萄糖、醋酸和乙醇作为碳源,寇氏隐甲藻的DHA生产效率可达到19、48和53 mg/(L·h),是迄今报道过的最高的DHA产量。
甲藻毒素是一类高活性的特殊代谢成分,近年来其药用价值也成为开发的热点。塔玛亚历山大藻(Alexandriumtamarense)和链状膝沟藻(Gonyaulaxcatenella)产生的膝沟藻毒素,岗比毒甲藻(Gambierdiscustoxicus)产生的西加毒素,二者生物活性见表6。

表6 甲藻门主要的药源微藻种类
7 其它门类药源微藻
纤细裸藻(Euglenapisciformis)中含有丰富的β-胡萝卜素、维生素C和维生素E。这些活性物质在抗氧化和预防高血压及动脉粥样硬化方面具有重要的作用[95]。湖北省水生生物研究所从纤细裸藻Z品系中提取α-生育酚,含量可达到0.6~1 mg/g藻粉,为维生素E的生产提供原材料[96]。
隐藻(Cryptomonassp.)的藻蓝蛋白大约有6种,包括PC612,630和645,以及PE545,555和566。通过监测蓝隐藻(Chroomonassp.)天然和变性后的PC-645对氧自由基活性的抑制作用,发现天然PC-645二聚体具有抗氧化作用,可清除超氧阴离子,且对不同的氧自由基抑制效果不同[97]。
微拟球藻(Nannochloropsissp.)是一种异鞭藻门(Heterokontophyta)真眼点藻纲(Eustigmatophyceae)微拟球藻属(Nannochloropsis)的海洋单胞藻,富含EPA、C16:1(n-7)和C18:1(n-7)。王爱英等[98]通过比较微拟球藻和5种绿藻的类脂含量和脂肪酸组成,发现微拟球藻含有较高的C16:0、C16:1和C18:1,其含量占总脂的70.79%。
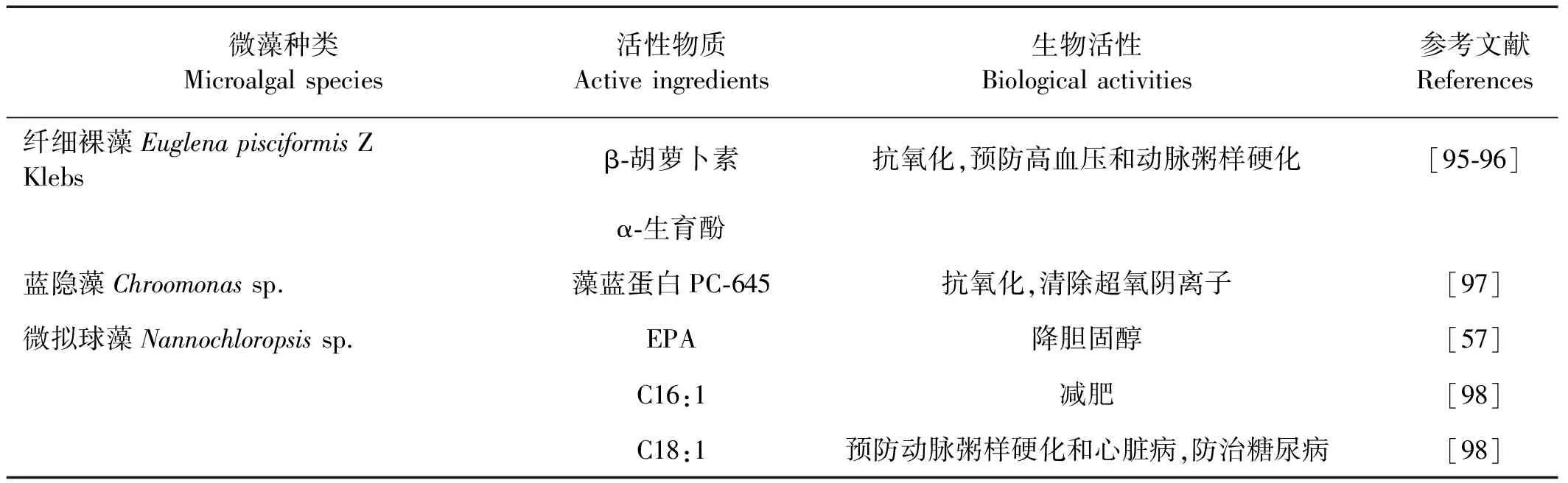
表7 其它门类主要的药源微藻
8 活性物质的应用
海洋微藻虽富含活性物质,但是绝大部分活性物质目前仍处于药理研究的初级阶段,只有少数微藻开发形成产业链,但大多以营养保健品的形式出现于市面上。如螺旋藻富含藻蓝蛋白、螺旋藻多糖、γ-亚麻酸和超氧化物歧化酶,被联合国粮农组织誉为“人类未来最优良的食物资源和未来食粮”[14]。现已开发出螺旋藻片、胶囊、丸剂和口服液等产品,其中山西同达药业有限公司生产的螺旋藻片和广州白云山明兴制药有限公司生产的螺旋藻胶囊已被国家食品药品监督管理总局批准作为上市药品。云南中医学院临床医学院利用螺旋藻片治疗大肠癌术后的脾胃气虚,取得不错效果[99];河北省张家口市中医院妇科例证螺旋藻胶囊联合化疗治疗乳腺癌术后患者,能减轻化疗的毒副作用,有效提高患者生活质量[100]。盐生杜氏藻富含β-胡萝卜素,目前,澳大利亚、美国、以色列和中国有许多工厂利用盐生杜氏藻生产天然β-胡萝卜素,其中我国已批量生产出一些以天然胡萝卜素为主要营养成分的保健品,如天然胡萝卜素口服液、天然胡萝卜素软胶囊等。小球藻类产品主要也是以保健品为主,如绿安奇牌小球藻咀嚼片、升康力牌小球藻片和益普利生牌小球藻片等。管华诗等主编的《中华海洋本草》中记载巨大鞘丝藻可整体入药,煎汤内服或捣烂外敷,可清热解毒,治疗脚气、感冒发热和腮腺炎[101]。
9 问题与展望
目前,海洋药源微藻在抗病毒、抗肿瘤、提高机体免疫力、预防心血管疾病、延缓衰老、抗辐射和抑菌等方面的研究已取得一定的成果,其中基因工程、细胞工程等现代生物技术的应用大大促进了海洋微藻活性物质的开发研究。我国已克隆出钝顶螺旋藻(S.platensis)的别藻蓝蛋白(Allophycocyanin,APC)基因,运用重组DNA技术,在大肠杆菌(Escherichiacoli)中高效表达,得到螺旋藻别藻蓝蛋白与细菌麦芽糖结合蛋白—基因重组APC(RAPC),研究发现RAPC对小鼠肉瘤S180具有显著的抑制效果[102];赫慧琛等[103]利用PCR技术扩增钝顶螺旋藻SOD基因,在大肠埃希菌中得到成功表达,为超氧化物歧化酶的产业化生产奠定了良好的基础。但是,基因工程在海洋药源微藻领域起步较晚,同时微藻遗传背景尚不清楚以及微藻胞内限制性核酸内切酶系的复杂性,共同制约着基因工程技术在海洋微藻活性物质开发研究上的应用[104]。
此外,海洋微藻活性物质开发过程中还存在一些问题如活性物质分离纯化步骤繁琐,制取效率低,获取物稳定性差,质量不佳;活性物质分子结构与功能关系尚不明确;产业化水平低,国内虽已开发出一些海洋药品,但真正应用于临床治疗的新药很少,并且其中绝大部分的长期疗效还有待进一步观察;药源微藻种质和培养模式还有待改良等。
虽然海洋微藻活性物质在开发过程中还存在诸多的困难,但是独特的海洋生态环境赋予了海洋微藻活性物质功能的多样性、复杂性和特殊性,随着海洋药物开发力度的不断加大以及恶劣环境对人类健康造成的诸多影响,新型、高效和低毒副作用的海洋药物必将成为研究开发的焦点。近年来,国家也开始重视海洋药物研究事业,设立专门的基金如国家自然科学基金、国家新药基金等,并相继成立了一批海洋生物研究中心。在大好趋势的推动下,新世纪海洋药物的研究与开发将成为我国天然药物研究的新热点。
[1] 谭仁祥. 功能海洋生物分子-发现与应用[M]. 北京: 科学出版社, 2006: 3-17.
Tan R X. Marine Functional Biological Molecules-Discovery and Applications[M]. Beijing: Science Press, 2006: 3-17.
[2] 席波, 宋东辉, 孙晶, 等. 十种微藻粗多糖的抑菌作用及海水小球藻粗多糖的抗氧化活性[J]. 天津科技大学学报, 2015, 30(5): 20-25.
Xi B, Song D H, Sun J, et al. Anti-microbial activities of crude polysaccharide extracts from ten species of microalgae and the antioxidant activities of crude polysaccharide extracts fromChlorellapacifica[J]. Journal of Tianjin University of Science and Technology, 2015, 30(5): 20-25.
[3] 刘龙军, 魏东, 梁晓芸, 等. 利用微藻生产特种天然类胡萝卜素的研究进展[J]. 海洋科学, 2006, 30(9): 63-68.
Liu L J, Wei D, Liang X Y, et al. Advances on the production of special natural carotenoids by microalgae[J]. Marine Science, 2006, 30(9): 63-68.
[4] 韩锦华, 王雪青, 苗惠. 三种海洋微藻抗肿瘤活性的研究[J]. 天津科技大学学报, 2006, 21(4): 25-28.
Han J H, Wang X Q, Miao H. Study on the antitumor activity of three microalgae[J]. Journal of Tianjin University of Science and Technology, 2006, 21(4): 25-28.
[5] Ngo D H, Kim S K. Sulfated polysaccharides as bioactive agents from marine algae[J]. International Journal of Biological Macromolecules, 2013, 62(11): 70-75.
[6] Nagaoka S, Shimizu K, Kaneko H, et al. A novel protein c-phycocyanin plays a crucial role in the hypocholesterolemic action ofSpirulinaplatensisconcentrate in rats[J]. Journal of Nutrition, 2005, 135(10): 2425-2430.
[7] Bigogno C, Khozin-Goldberg I, Boussiba S, et al. Lipid and fatty acid composition of the green oleaginous algaParietochlorisincisa, the richest plant source of arachidonic acid[J]. Phytochemistry, 2002, 60(5): 497-503.
[8] 韩玲, 张淑平, 刘晓慧. 海藻生物活性物质应用研究进展[J]. 化工进展, 2012, 31(8): 1794-1800.
Han L, Zhang S P, Liu X H. Research on bioactive substances in algae[J]. Chemical Industry and Engineering Progress, 2012, 31(8): 1794-1800.
[9] 刘全永, 胡江春, 薛德林, 等. 海洋微生物生物活性物质研究[J]. 应用生态学报, 2002, 13(7): 901-905.
Liu Q Y, Hu J C, Xue D L, et al. Bioactive substances derived from microorganisms[J]. Chinese Journal of Applied Ecology, 2002, 13(7): 901-905.
[10] 欧阳高亮, 李祺福, 田长海. 海洋生物抗肿瘤活性物质及其作用机理研究进展[J]. 海洋科学, 2003, 27(7): 21-24.
Ouyang G L, Li Q F, Tian C H. Progress in studies on marine antitumor bioactive substances and their antitumor mechanisms[J]. Marine Science, 2003, 27(7): 21-24.
[11] 张尔贤, 俞丽君. 海洋生物活性物质开发利用的现状与前景[J]. 台湾海峡, 2000, 19(3): 388-395.
Zhang E X, Yu L J. Research actualities and prospects of utilization of marine biological resources[J]. Journal of Oceanography in Taiwan Strait, 2000, 19(3): 388-395.
[12] 赵文, 王丽卿, 王高学, 等. 水生生物学[M]. 北京: 中国农业出版社, 2008: 16-31.
Zhao W, Wang L Q, Wang G X, et al. Aquatic Biology[M]. Beijing: Chinese Agricultural Press, 2008: 16-31.
[13] Fogg G E, Stewart W D P, Fay P, et al. The Blue-Green Algae[M]. New York: Academic Press, 1973: 819-829.
[14] 王文博, 高俊萍, 孙建光, 等. 螺旋藻的营养保健价值及其在预防医学中的应用[J]. 中国食物与营养, 2009(1): 48-51.
Wang W B, Gao J P, Sun J G, et al. Nutrition and health value ofSpirulinaand its application in preventive medicine[J]. Food and Nutrition in China, 2009(1): 48-51.
[15] 郝玮, 潘凌. 螺旋藻藻蓝蛋白生理活性的研究进展[J]. 医学综述, 2006, 12(2): 111-113.
Hao W, Pan L. Advances of studies on the physiology activities of phycocyanin inSpirulina[J]. Medical Recapitulate, 2006, 12(2): 111-113.
[16] Cohen Z, Vonshak A, Richmond A. Fatty acid composition ofSpirulinastrains grown under various environmental conditions[J]. Phytochemistry, 1987, 26(8): 2255-2258.
[17] Ou Y, Liu Z. Some physico-chemical analyses of the exopolysaccharide produced byAphanothecehalophytica[J]. Journal of Nanjing Agricultural University, 1999, 22(4): 89-91.
[18] Matsunaga T, Takeyama H, Miura Y, et al. Screening of marine cyanobacteria for high palmitoleic acid production[J]. Fems Microbiology Letters, 1995, 133(2): 137-141.
[19] Zhang H Q, Lin A P, Sun Y, et al. Chemo-and radio-protective effects of polysaccharide ofSpirulinaplatensison hemopoietic system of mice and dogs[J]. Acta Pharmacologica Sinica, 2001, 22(12): 1121-1124.
[20] Joventino I P, Alves H G R, Neves L C, et al. The microalgaSpirulinaplatensispresents anti-inflammatory action as well as hypoglycemic and hypolipidemic properties in diabetic rats[J]. Journal of Complementary and Integrative Medicine, 2012, 9(1): 17-45.
[21] Nagaoka M, Shibata H, Kimura-Takagi I, et al. Anti-ulcer effects and biological activities of polysaccharides from marine algae[J]. Biofactors, 2000, 12(4): 267-274.
[22] Kamble S P, Gaikar R B, Padalia R B, et al. Extraction and purification of c-phycocyanin from drySpirulinapowder and evaluating its antioxidant, anticoagulation and prevention of DNA damage activity[J]. Journal of Applied Pharmaceutical Science, 2013, 3(8): 149-153.
[23] 李冰, 张学成, 高美华, 等. 钝顶螺旋藻藻蓝蛋白和多糖的抗肿瘤免疫活性研究[J]. 中国海洋大学学报(自然科学版), 2004, 34(3): 396-402.
Li B, Zhang X C, Gao M H, et al. Study on the antitumor immune activities of phycocyanin and polysaccharide fromSpirulinaplatensis[J]. Periodical of Ocean University of China: Natural Science Edition, 2004, 34(3): 396-402.
[24] 王菲. 螺旋藻γ-亚麻酸的提取及其体外生物活性研究[D]. 北京: 北京林业大学, 2013.
Wang F. Extraction and in Vitro Bioactivities of γ-linolenic Acid fromSpirulinaplatensis[D]. Beijing: Beijing Forestry University, 2013.
[25] Fujiki H, Mori M, Nakayasu M, et al. Indole alkaloids: dihydroteleocidin B, teleocidin, and lyngbyatoxin A as members of a new class of tumor promoters[J]. Proceedings of the National Academy of Sciences, 1981, 78(6): 3872-3876.
[26] Koehn F E, Longley R E, Reed J K. Microcolins A and B, new immunosuppressive peptides from the blue-green algaLyngbyamajuscula[J]. Journal of Natural Products, 1992, 55(5): 613-619.
[27] Sonani R R, Singh N K, Kumar J, et al. Concurrent purification and antioxidant activity of phycobiliproteins fromLyngbyasp. A09DM: an antioxidant and anti-aging potential of phycoerythrin inCaenorhabditiselegans[J]. Process Biochemistry, 2014, 49(10): 1757-1766.
[28] Nagarajan S, Mathaiyan M. Emerging novel anti HIV biomolecules from marine algae: An overview[J]. Journal of Applied Pharmaceutical Science, 2015, 5(9): 153-158.
[29] 程启平, 周守标, 郑维发. 盐生隐杆藻胞外多糖 (EPAH) 抗肿瘤作用的实验研究[J]. 安徽技术师范学院学报, 2005, 19(1): 21-24.
Cheng Q P, Zhou S B, Zheng W F. Experimental study on effects of anti-tumour of exopolysaccharides ofAphanothecehalophytica(EPAH) in mice[J]. Journal of Anhui Technical Teachers College, 2005, 19(1): 21-24.
[30] 程启平, 周守标, 郑维发. 盐生隐杆藻胞外多糖 (EPAH) 抗衰老的实验研究[J]. 生物学杂志, 2005, 22(6): 38-40.
Cheng Q P, Zhou S B, Zheng W F. Experimental study of effects on anti-aging of exopolysaccharides ofAphanothecehalophytica(EPAH) in mice[J]. Journal of Biology, 2005, 22(6): 38-40.
[31] Kathrin M, José O, Pascal B, et al. Monounsaturated fatty acids prevent the deleterious effects of palmitate and high glucose on human pancreatic beta-cell turnover and function. [J]. Diabetes, 2003, 52(3): 726-733.
[32] 关美君, 丁源. 我国海洋药物主要成分研究概况(Ⅰ)[J]. 中国海洋药物, 2000, 19(3): 32-37.
Guan M J, Ding Y. Marine medicine ingredient research in China(Ⅰ)[J]. Chinese Journal of Marine Drugs, 2000, 19(3): 32-37.
[33] Moore R E, Banarjee S, Bornemann V, et al. Novel cytotoxins and fungicides from blue-green algae and marine animals possessing algal symbionts[J]. Pure and Applied Chemistry, 1989, 61(3): 521-524.
[34] Thangam R, Suresh V, Princy W A, et al. C-Phycocyanin fromOscillatoriatenuisexhibited an antioxidant and in vitro antiproliferative activity through induction of apoptosis and G 0/G 1 cell cycle arrest[J]. Food Chemistry, 2013, 140(1): 262-272.
[35] 苏传东. 盐度和营养限制对蓝杆藻 (Cyanothecesp.) 113 菌株生长和胞外多糖产量的影响[J]. 海洋湖沼通报, 2005(4): 69-74.
Su C D. Effects of salinity and nutritional limitation on the growth and exopolysaccharide production ofCyanothecesp. 113[J]. Transactions of Oceanology and Limnology, 2005(4): 69-74.
[36] 赵小惠. 聚球藻中活性化合物的分离及抗菌, 抗氧化活性研究[D]. 烟台: 烟台大学, 2013.
Zhao X H. Separation of Active Compounds fromSynechcoocussp. and Its Antibacterial and Antioxidative Properties[D]. Yantai: Yantai University, 2013.
[37] 华汝成. 单细胞藻类的培养与利用[M]. 北京: 农业出版社, 1986: 26-30.
Hua R C. The Culture and Applications of Single-Celled Algae[M]. Beijing: Agricultural Press, 1986: 26-30.
[38] Wang M, Tsao R S, Dong Z, et al. Antioxidant activity, mutagenicity/anti-mutagenicity, and clastogenicity/anti-clastogenicity of lutein from marigold flowers[J]. Food & Chemical Toxicology, 2006, 44(9): 1522-1529.
[39] Shi X M, Feng C, Yuan J P, et al. Heterotrophic production of lutein by selectedChlorellastrains[J]. Journal of Applied Phycology, 1997, 9(5): 445-450.
[40] Han S Q, Zhang Z H, Liu H Q. Effects ofChlorellagrowth factor on physiological function[J]. Chinese Journal of Biochemical Pharmaceutics, 2004, 25(1): 5-7.
[41] 刘海琴, 韩士群. 小球藻提取物的生物活性研究[J]. 海洋科学, 2005, 29(9): 23-26.
Liu H Q, Han S Q. Physiological function ofChlorellagrowth factor[J]. Marine Science, 2005, 29(9): 23-26.
[42] 贺超兴. 盐藻的生物学特性与开发利用[J]. 生物学通报, 1998(2): 12.
He C X. The biological characteristics and the development ofDunaliellasalina[J]. Bulletin of Biology, 1998(2): 12.
[43] 谢强胜, 尹鸿萍, 陈昕, 等. 盐藻多糖初级结构及性质测定[J]. 药物生物技术, 2005, 12(4): 242-247.
Xie Q S, Yin H P, Chen X, et al. The primary structure and characterization analysis of the polysaccharide fromDunaliellasalina[J]. Pharmaceutical Biotechnology, 2005, 12(4): 242-247.
[44] 王培磊. 胁迫因子对杜氏藻(Dunaliella)生长及其β-胡萝卜素积累的影响研究[D]. 青岛: 中国海洋大学, 2005.
Wang P L. Effects of Stress Factors on the Growth and the Accumulation of Beta-Carotene ofDunaliella[D]. Qingdao: Ocean University of China, 2005.
[45] 武昌俊. 杜氏盐藻高产玉米黄素突变株的诱变筛选及生物学特性的研究[D]. 合肥: 安徽农业大学, 2010.
Wu C J. The Mutagenesis Screening of a High Zeaxanthin Yield Mutant Strain ofDunaliellasalinaand Its Biological Characteristics[D]. Hefei: Anhui Agricultural University, 2010.
[46] 胡月薇, 史贤明. 异养蛋白核小球藻营养成分分析和免疫活性功能评价[D]. 武汉: 华中农业大学, 2003.
Hu Y W, Shi X M. Analysis of Nutritional Components and Evaluation of Immunostimulative Functions ofC.pyrenoidosaGrown Hetertrophically[D]. Wuhan: Huazhong Agricultural University, 2003.
[47] Satia J A, Alyson L, Slatore C G, et al. Long-term use of beta-carotene, retinol, lycopene, and lutein supplements and lung cancer risk: results from the vitamins and lifestyle study[J]. American Journal of Epidemiology, 2009, 169(7): 815-828.
[48] Izumi-Nagai K, Nagai N, Ohgami K, et al. Macular pigment lutein is anti-inflammatory in preventing choroidal neovascularization[J]. Arteriosclerosis Thrombosis & Vascular Biology, 2008, 27(12): 2555-2562.
[49] 朱红红, 尹鸿萍. 盐藻多糖抗病毒实验研究[J]. 南京中医药大学学报, 2007, 23(5): 310-312.
Zhu H H, Yin H P. Experimental study on anti-viral effect of polysaccharides ofHalophila[J]. Journal of Nanjing University of Traditional Chinese Medicine, 2007, 23(5): 310-312.
[50] 黄建乡, 崔瑞耀, 王春波. 盐藻 β-胡萝卜素对实验性动脉粥样硬化的作用[J]. 青岛大学医学院学报, 2003, 39(4): 441-443.
Huang J X, Cui R Y, Wang C B. The effects of beta-carotene fromDunaliellasalinaon experimental atherosclerosis in quails[J]. Acta Academiae Medicine Qingdao University, 2003, 39(4): 441-443.
[51] 陈雪红, 刘先荣, 张柱海, 等. 盐藻 β-胡萝卜素促进学习和记忆的作用[J]. 中国海洋药物, 2006, 25(2): 48-52.
Chen X H, Liu X R, Zhang Z H, et al. Promoting effects of beta-carotene fromDunaliellasalinaon learning and memory in rats and mice[J]. Chinese Journal of Marine Drugs, 2006, 25(2): 48-52.
[52] Abdel-Aal E S M, Akhtar H, Zaheer K, et al. Dietary sources of lutein and zeaxanthin carotenoids and their role in eye health[J]. Nutrients, 2013, 5(4): 1169-1185.
[53] 刘艳, 杨海波, 赵莲华, 等. 扁藻多糖的分离分析及其生物活性的初步研究[J]. 生物技术, 2007, 17(3): 53-56.
Liu Y, Yang H B, Zhao L H, et al. Separation and analysis of polysaccharide fromP.subcordigoramis(Will) Hanzen and primary studies on its anticancer activity[J]. Biotechnology, 2007, 17(3): 53-56.
[54] 江红霞. 娇柔塔胞藻脂溶性化合物的抑菌活性及成分分析[J]. 安徽农学通报, 2007, 13(17): 34-35.
Jiang H X. Antibacterial properties of fat-soluble compounds fromPyramidomonasdelicatulaand its composition analysis[J]. Anhui Agricultural Science Bulletin, 2007, 13(17): 34-35.
[55] 王大志, 黄世玉, 程兆第. 三种海洋硅藻胞外多聚物形态, 微细结构及组成的初步研究[J]. 海洋与湖沼, 2004, 3(35): 273-278.
Wang D Z, Huang S Y, Cheng Z D. Morphology, fine structure and chemical composition of extracellular polymeric substances in three marine diatom species[J]. Oceanologia et Limnologia Sinica, 2004, 3(35): 273-278.
[56] 臧正蓉, 解修俊, 赵佩佩, 等. 温度和光照对三角褐指藻的生长及岩藻黄素含量的影响[J]. 海洋科学, 2015, 39(7): 1-6.
Zang Z R, Xie X J, Zhao P P, et al. Effect of different temperatures and high conditions on the growth and fucoxanthin content ofPhaeodactylumtricornutum[J]. Marine Science, 2015, 39(7): 1-6.
[57] 梁英, 麦康森. 微藻EPA和DHA的研究现状及前景[J]. 水产学报, 2000, 24(3): 289-296.
Liang Y, Mai K S. Current status and prospect of studies on microalgal EPA and DHA[J]. Journal of Fisheries of China, 2000, 24(3): 289-296.
[58] 刁永芳, 梁英, 田传远. 磷浓度对筒柱藻叶绿素荧光参数, 生长及总脂含量的影响[J]. 海洋湖沼通报, 2012(4): 47-54.
Diao Y F, Liang Y, Tian C Y. Effects of phosphorus concentrations on the chlorophyll fluorescence parameters, growth and the total lipid content ofCylindrothecasp. [J]. Transactions of Oceanology and Limnology, 2012(4): 47-54.
[59] Liang Y, Mai K S, Sun S C, et al. Effect of light intensity on the total lipid and fatty acid composition of six strains of marine diatoms[J]. Chinese Journal of Oceanology and Limnology, 2001, 19(3): 249-254.
[60] Liang Y, Beardall J, Heraud P. Effects of nitrogen source and UV radiation on the growth, chlorophyll fluorescence and fatty acid composition ofPhaeodactylumtricornutumandChaetocerosmuelleri(Bacillariophyceae)[J]. Journal of Photochemistry and Photobiology B: Biology, 2006, 82(3): 161-172.
[61] Liang Y, Mai K S, Sun S C. Effects of salinity on the growth and fatty acid composition of six strains of marine diatoms[J]. Transactions of Oceanology and Limnology, 2000, 18(4): 53-62.
[62] 王芹, 刘超, 张少君, 等. 旋链角毛藻活性物质的提取及抑菌作用研究[J]. 食品科学, 2010, 31(5): 180-183.
Wang Q, Liu C, Zhang S J, et al. Extraction and antimicrobial effect of active components fromChaetoceroscurvisetus[J]. Food Science, 2010, 31(5): 180-183.
[63] 田甜, 周成旭, 刘宝宁, 等. 6种海洋微藻 β-葡聚糖的累积特征及其免疫活性分析[J]. 食品科学, 2013, 34(3): 188-192.
Tian T, Zhou C X, Liu B N, et al. Accumulation features and immune-stimulative effects of beta-glucans from six species of marine microalgae[J]. Food Science, 2013, 34(3): 188-192.
[64] 郑维发, 陈才法, 储成才, 等. 新月菱形藻胞外多糖抗病毒活性研究[J]. 解放军药学学报, 2005, 21(3): 181-185.
Zheng W F, Chen C F, Chu C C, et al.Invivoantiviral activity of exopolysaccharides fromNitzschiaclosterium[J]. Pharmaceutical Journal of Chinese People’s Liberation Army, 2005, 21(3): 181-185.
[65] Kusaikin M I, Ermakova S P, Shevchenko N M, et al. Structural characteristics and antitumor activity of a new chrysolaminaran from the diatom algaSynedraacus[J]. Chemistry of Natural Compounds, 2010, 46(1): 1-4.
[66] Iwasaki S, Widjaja-Adhi M A K, Koide A, et al.Invivoantioxidant activity of fucoxanthin on obese/diabetes KK-Ay Mice[J]. Food and Nutrition Sciences, 2012, 3(11): 1491-1499.
[67] Maeda H, Hosokawa M, Sashima T, et al. Anti-obesity and anti-diabetic effects of fucoxanthin on diet-induced obesity conditions in a murine model[J]. Molecular Medicine Reports, 2009, 2(6): 897-902.
[68] Moreau D, Tomasoni C, Jacquot C, et al. Cultivated microalgae and the carotenoid fucoxanthin fromOdontellaauritaas potent anti-proliferative agents in bronchopulmonary and epithelial cell lines[J]. Environmental Toxicology and Pharmacology, 2006, 22(1): 97-103.
[69] Xia S, Wang K, Wan L, et al. Production, characterization, and antioxidant activity of fucoxanthin from the marine diatomOdontellaaurita[J]. Marine Drugs, 2013, 11(7): 2667-2681.
[70] Carbonnelle D, Pondaven P, Morançais M, et al. Antitumor and antiproliferative effects of an aqueous extract from the marine diatomHasleaostrearia(Simonsen) against solid tumors: lung carcinoma (NSCLC-N6), kidney carcinoma (E39) and melanoma (M96) cell lines[J]. Anticancer Research, 1998, 19(1A): 621-624.
[71] Pouvreau J B, Taran F, Rosa P, et al. Antioxidant and free radical scavenging properties of marennine, a blue-green polyphenolic pigment from the diatomHasleaostrearia(Gaillon/Bory) Simonsen responsible for the natural greening of cultured oysters[J]. Journal of Agricultural and Food Chemistry, 2008, 56(15): 6278-6286.
[72] Gastineau R, Davidovich N A, Bardeau J F Ç, et al.Hasleakaradagensis(Bacillariophyta): a second blue diatom, recorded from the Black Sea and producing a novel blue pigment[J]. European Journal of Phycology, 2012, 47(4): 469-479.
[73] 吴电云. 金藻细胞培养条件优化及活性物质的分析[D]. 烟台: 鲁东大学, 2011.
Wu D Y. Optimization of the Culture Conditions ofIsochrysisgalbanaParke and Analysis of Active Substance in the Cells[D]. Yantai: Ludong University, 2011.
[74] 朱路英, 张学成, 宋晓金, 等. n-3 多不饱和脂肪酸 DHA, EPA 研究进展 [J]. 海洋科学, 2007, 31(11): 78-85.
Zhu L Y, Zhang X C, Song X J, et al. Advances in n-3 polyunsaturated fatty acids DHA and EPA[J]. Marine Science, 2007, 31(11): 78-85.
[75] Sieburth J M. Antibacterial substances produced by marine algae[J]. Develop Industrial Microbiol, 1964, 5: 124-134.
[76] 孙颖颖, 王辉. 球等鞭金藻胞外多糖的体外抗氧化活性和理化性质的初步分析[J]. 海洋科学, 2013, 37(5): 45-49.
Sun Y Y, Wang H. Study ofinvitroantioxidation and physical and chemical characteristics analysis of extracellular polysaccharides isolated fromIsochrysisgalbana[J]. Marine Science, 2013, 37(5): 45-49.
[77] 张新宇, 王雷, 李光友, 等. 绿色巴夫藻硒多糖的提取, 分离与纯化[J]. 海洋与湖沼, 2000, 31(6): 643-646.
Zhang X Y, Wang L, Li G Y, et al. Extraction, separation and purification of the selenium polysaccharide fromPavlovaviridis[J]. Oceanologia et Limnologia Sinica, 2000, 31(6): 643-646.
[78] 陈必链, 黄键, 梁世中. 紫球藻的研究进展[J]. 海洋通报, 2002, 21(5): 75-81.
Chen B L, Huang J, Liang S Z. Progress in the studies ofPorphyridiumsp. [J]. Marine Science Bulletin, 2002, 21(5): 75-81.
[79] 李冠武, 王广策. 藻红蛋白应用于肿瘤光动力治疗的研究[J]. 肿瘤防治杂志, 2001, 8(4): 353-356.
Li G W, Wang G C. Phycoerythrin as a novel photosensitizer applied in the photodynamic therapy of cancer[J]. China Journal of Cancer Prevention and Treatment, 2001, 8(4): 353-356.
[80] Cohen Z, Vonshak A, Richmond A. Effect of environmental conditions on fatty acid composition of the red algaPorphyridiumcruentum: correlation to growth rate[J]. Journal of Phycology, 1988, 24(3): 328-332.
[81] Birch E E, Garfield S, Hoffman D R, et al. A randomized controlled trial of early dietary supply of long-chain polyunsaturated fatty acids and mental development in term infants[J]. Developmental Medicine & Child Neurology, 2000, 42(3): 174-181.
[83] 黄键, 陈必链, 游文朗. 紫球藻胞外多糖的分离及体外抗乙肝病毒活性的初步研究[J]. 中国海洋药物, 2006, 24(5): 18-21.
Huang J, Chen B L, You W L. Studies on separation of extracellular polysaccharide fromPorphyridiumcruentumand its anti-HBV activityinvitro[J]. Chinese Journal of Marine Drugs, 2006, 24(5): 18-21.
[84] Wang J, Gong X G. Advances in the studies on the antitumor activity and immunomodulating action of polysaccharides[J]. Chinese Journal of Biochemical Pharmaceuticals, 2001, 22(1): 52-54.
[85] Gu N, Liu Y. Anti-irradiation activities of extracellular polysaccharide ofPorphyridiumspecies[J]. Marine Science, 2002, 26(12): 56-63.
[86] 姚昕, 秦文, 齐春梅, 等. 花生四烯酸的生理活性及其应用[J]. 粮油加工与食品机械, 2004(5): 57-59.
Yao X, Qin W, Qi C M, et al. Utilization and physiological activity of Arachidonic acid[J]. Machinery for Cereals Oil and Food Processing, 2004(5): 57-59.
[87] Silva T L D, Mendes A, Rui L M, et al. Effect of n-dodecane onCrypthecodiniumcohniifermentations and DHA production[J]. Journal of Industrial Microbiology & Biotechnology, 2006, 33(6): 408-416.
[88] Swaaf M E D, Rijk T C D, Pieter V D M, et al. Analysis of docosahexaenoic acid biosynthesis inCrypthecodiniumcohniiby 13C labelling and desaturase inhibitor experiments[J]. Journal of Biotechnology, 2003, 103(1): 21-29.
[89] Kubota T, Iwai T, Sakai K, et al. Amphidinins C-F, amphidinolide Q analogues from marine dinoflagellateAmphidiniumsp. [J]. Organic Letters, 2014, 16(21): 5624-5627.
[90] Minamida M, Kumagai K, Ulanova D, et al. Amphirionin-4 with potent proliferation-promoting activity on bone marrow stromal cells from a marine dinoflagellateAmphidiniumspecies[J]. Organic Letters, 2014, 16(18): 4858-4861.
[91] 谭成玉, 赵莹, 吴迪, 等. 海洋微藻体外抗肿瘤血管生成活性的研究[J]. 中国海洋药物, 2011, 30(6): 13-17.
Tan C Y, Zhao Y, Wu D, et al. Anti-angiogenic activity of the extracts from marine microalgaeinvitro[J]. Chinese Journal of Marine Drugs, 2011, 30(6): 13-17.
[92] Lee C K, Kim H S, Nam J R, et al. Antiviral effects of sulfated exopolysaccharide from the marine microalgaGyrodiniumimpudicumstrain KG03[J]. Antiviral Research, 2008, 78(2): A59.
[93] 王云峰. 麻痹性贝毒毒素的制备和活性研究[D]. 青岛: 中国科学院海洋研究所, 2001.
Wang Y F. The Research on Preparation and Activities of Paralytic Shellfish Poisons[D]. Qingdao: Institute of Oceanology of the Chinese Academy of Sciences, 2001.
[94] Ohshika H. Marine toxins from the Pacific—IX: Some effects of ciguatoxin on isolated mammalian atria[J]. Toxicon, 1971, 9(4): 337-343.
[95] 金之男. 两步培养纤细裸藻 Z 同时生产抗氧化维生素: β—胡萝卜素、维生素C和维生素E[J]. 国外医药: 合成药. 生化药. 制剂分册, 1998, 19(2): 75-77.
Jin Z N. Two steps to cultivateEuglenapisciformisZ Klebs to produce antioxidant vitamins: beta-carotene, vitamin C and vitamin E at the same time[J]. Foreign Medical: Synthetic Medicine. Biochemical Drugs. Preparation Pathology, 1998, 12(2): 75-77.
[96] 湖北省水生生物研究所, 藻类研究室藻类应用组. 裸藻中α-生育酚的提取和测定[J]. 水生生物学报, 1975, 5(3): 354-359.
Institute of Hydrobiology of Hebei, Application Group of Algae Research Laboratory. Extraction and determination of the alpha-tocopherol fromEuglena[J]. Acta Hydrobiologica Sinica, 1975, 5(3): 354-359.
[97] 李文军, 陈敏. 蓝隐藻藻蓝蛋白结构与功能稳定性研究[J]. 海洋科学, 2013, 37(7): 33-40.
Li W J, Chen M. Structural and functional stability of phycocyanin fromChroomonasplacoidea[J]. Marine Science, 2013, 37(7): 33-40.
[98] 王爱英, 崔喜艳, 张延华, 等. 微拟球藻与其他绿藻脂肪酸组成的比较分析[J]. 长江大学学报自然科学版: 石油/农学旬刊, 2014(2): 41-44.
Wang A Y, Cui X Y, Zhang Y H, et al. The comparative analysis of fatty acid composition betweenNannochloropsisoculataand other green algae[J]. Journal of Yangtze University(Natural Science Edition): Oil/Agronomy Ten-day Periodical, 2014(2): 41-44.
[99] 冯妮. 螺旋藻片治疗大肠癌术后脾胃气虚证25例临床观察[J]. 中医药导报, 2014, 20(2): 127-128.
Feng N.Spirulinatablets to treat colorectal cancer postoperative spleen deficiency of 25 cases of clinical observation[J]. Guiding Journal of Traditional Chinese Medicine and Pharmacy, 2014, 20(2): 127-128.
[100] 段秀红, 孙建宇. 螺旋藻胶囊联合化疗对乳腺癌术后患者的疗效[J]. 广东医学, 2014, 35(21): 3416-3417.
Duan X H, Sun J Y. The curative effect ofSpirulinacapsule combined chemotherapy for breast cancer postoperative patients[J]. Guangdong Medical Journal, 2014, 35(21): 3416-3417.
[101] 管华诗, 王曙光. 中华海洋本草[M]. 上海: 上海科学技术出版社, 2009.
Guan H S, Wang S G. The Chinese Marine Materia Medica[M]. Shanghai: Shanghai Science and Technology Press, 2009.
[102] 董志峰, 李新萍, 秦松, 等. 基因工程与海洋药物研究[J]. 海洋科学, 1998, 1(3): 16-20.
Dong Z F, Li X P, Qin S, et al. Genetic engineering and marine drug research[J]. Marine Science, 1998, 1(3): 16-20.
[103] 赫慧琛, 姜晓杰, 高金亮, 等. 钝顶螺旋藻超氧化物歧化酶的原核表达及纯化[J]. 中国生物制品学杂志, 2013, 26(12): 1764-1767.
He H C, Jiang X J, Gao J L, et al. Prokaryotic expression and purification of superoxide dismutase ofSpirulinaplatensis[J]. Chinese Journal of Biologicals, 2013, 26(12): 1764-1767.
[104] 苏忠亮, 王勇, 钱凯先. 螺旋藻基因克隆研究进展[J]. 浙江大学学报: 工学版, 2003, 37(1): 117-120.
Su Z L, Wang Y, Qian K X. Progress in genetic cloning ofSpirulina[J]. Journal of Zhejiang University: Engineering Science, 2003, 37(1): 117-120.
责任编辑 朱宝象
Advances in Studies on Marine Medicinal Microalgae
LIANG Ying, HUANG Xu-Lin, TIAN Chuan-Yuan, MENG Xiang-Rong
(The Key Laboratory of Mariculture, Ministry of Education, Ocean University of China, Qingdao 266003, China)
Marine microalgae are important sources of marine drugs. A variety of active ingredients of antimicrobial, antivirus, antitumor, cardiovascular disease preventing are screened, separated and extracted from marine microalgae. The medicinal marine microalgae in the Cyanophyta, Chlorophyta, Bacillariophyta, Chrysophyta, Rhodophyta, Pyrrophyta among others and all kinds of common microalgal species, and their active ingredients and pharmacological characteristics were summarized in this paper. The current application scenario of active ingredients, the problems around their developments and prospect were also summed up. We aimed to provide
for the further development and utilization of marine pharmaceutical microalgae.
marine medicinal microalgae; active ingredient; pharmacological property
“十二五”国家科技支撑计划项目(2011BAD14B01);国家高技术研究发展计划项目(2014AA022001)资助
2016-05-03;
2016-06-30
梁 英(1967-),女,博士,教授,主要从事微藻生理生化研究。E-mail: yliang@ouc.edu.cn
S963.21+3
A
1672-5174(2016)11-032-12
10.16441/j.cnki.hdxb.20160155
梁英, 黄徐林, 田传远, 等. 海洋药源微藻研究进展[J]. 中国海洋大学学报(自然科学版), 2016, 46(11): 32-43.
LIANG Ying, HUANG Xu-Lin, TIAN Chuan-Yuan, et al. Advances in studies on marine medicinal microalgae[J]. Periodical of Ocean University of China, 2016, 46(11): 32-43.
Supported by National Technologies Program of China during the 12thFive-Year Plan Period(2011BAD14B01); National High-Tech R&D Program of China (2014AA022001)

