两种磷虾油在家兔体内的药动学及生物利用度研究
孙艳宾,刘 云,姜国良,王 超
(山东药品食品职业学院,山东 威海 264210)
两种磷虾油在家兔体内的药动学及生物利用度研究
孙艳宾,刘云,姜国良,王超
(山东药品食品职业学院,山东 威海 264210)
为了研究两种磷虾油在家兔体内的药动学及生物利用度评价,将18只家兔随机分成3组,分别单剂量灌服南极磷虾油(受试制剂T1),太平洋磷虾油(受试制剂T2),鱼油(参比制剂R)。用GC-MS检测血浆中EPA,DHA的浓度,采用3p97程序计算药动学参数。结果对EPA而言,参比制剂R与受试制剂T1,T2的峰浓度(Cmax)分别为(190.03± 4.21 μg/mL),(192.79±3.64 μg/mL),(218.35±5.47 μg/mL);达峰时间(Tmax)分别为(8.02±0.65)、(12.04±0.31)、(12.10± 0.24)h;药时曲线下面积(AUC)分别为(23.32±6.72),(20.43±4.58),(19.23±6.24 mg)h/mL。对DHA而言,参比制剂R与受试制剂T1,T2的峰浓度(Cmax)分别为(243.50±3.47 μg/mL)、(219.52±2.04 μg/mL)、(233.27±2.87 μg/mL);达峰时间(Tmax)分别为(7.04±0.52)、(10.06±0.60)、(7.10±0.29)h;药时曲线下面积(AUC)分别为(16.08±4.98)、(23.49±4.84)、(9.70±0.67 mg)h/mL。以鱼油做为对照物,南极磷虾油中EPA和DHA的相对生物利用度(F)分别为(83.27±10.21)%、(134.56±20.51)%。太平洋磷虾油中EPA和DHA的相对生物利用度(F)分别为(84.73±12.03)%,(49.26±8.79)%。结论表明与鱼油相比,南极磷虾油显著提高了DHA的相对生物利用度。
磷虾油;GC-MS;药动学;相对生物利用度
EPA(二十碳五烯酸),DHA(二十二碳六烯酸)是ω-3类脂肪酸中两种主要高度不饱和脂肪酸,不仅是高等动物细胞细胞膜磷脂双分子层的重要组成成分,同时对防治心脑血管疾病的功效已被国内外医学界所公认,对多种自体免疫性疾病的疗效也已被证实[1]。但是这两种脂肪酸人体无法自身合成,必须从食物中摄取。目前国内外市场上EPA和DHA保健产品的原料主要来自深海鱼类的鱼油[2],磷虾油中EPA,DHA含量极高,与在鱼油中以甘油三酯或脂肪酸乙酯形式存在有所不同,EPA,DHA在磷虾油中主要以磷脂的形式存在,动物实验表明,磷脂形式与甘油三酯形式相比,前者大脑生物利用率更高[3-4]。现在有关文献对EPA,DHA体内药代动力学的研究比较少[5-6]。本试验以家兔为研究对象,考察了鱼油,南极磷虾油,太平洋磷虾油用药后其在家兔体内的血药浓度及药代动力学参数的变化,为进一步临床研究提供参考。
1 仪器与材料
1.1仪器气质联用仪:包括Agilent 7890A气相色谱仪、7683B自动进样器和5975C质谱检测器(安捷伦公司);氮吹仪(N.EVAP 112)。振荡器、涡旋混合器(德国IKA公司);电子天平(德国梅特勒公司);0.45 μm滤膜。
1.2试药药物:维妥立牌鱼油软胶囊(每粒1.0 g,含EPA 0.18 g,DHA 0.12 g,广东仙乐制药有限公司);南极磷虾油软胶囊(每粒1.0 g,含EPA 0.15 g,DHA 0.11 g,山东科芮尔生物制品有限公司);太平洋磷虾油(每1.0 g,含EPA 0.17 g,DHA 0.15 g);正己烷(色谱纯)美国Merck公司;甲醇(色谱纯)美国Merck公司;KOH(分析纯)国药集团化学试剂有限公司;EPA,DHA甲酯混合物标样(MIDI公司提供);用正己烷配置成浓度为1.0 mg/mL标准储备液,置冰箱冷冻保存。
1.3动物新西兰大白兔,雄性,体重2.5~3.0 kg,动物和饲料由青岛市药品检验所动物中心提供,许可证号SCXK(鲁)20140001,动物房温度(22±2)℃,湿度60%±15%。
2 方法
2.1GC/MS条件[7-8]HP毛细管柱(100 m×0.25 mm× 0.25 μm);程序升温:柱初温120℃保持1 min,以8℃/min的速度升至160℃,保持2 min,以5℃/min的速度升至200℃,保持5 min,以2℃/min的速度升至220℃,保持35 min。进样口温度240℃;载气为高纯氦气,流速0.5 mL/min,进样方式为不分流,进样量1 μL。GC/MS接口温度240℃;离子源温度250℃;电离方式EI源,电离能量70 eV;电子倍增电压1 400 V;溶剂延迟16 min;扫描质量范围30 amu~400 amu。
2.2给药与血样采集家兔18只,适应环境一周后随即分为3组。给药前均禁食12 h,灌胃鱼油、南极磷虾油、太平洋磷虾油,按照正常人服用EPA,DHA的剂量以及实验药理学中家兔与人用药量系数换算,保证最终EPA的量98.53 mg/ kg,DHA的量89.68 mg/kg的剂量灌胃,于给药后0.5、1、2、3、4、5、6、7、8、10、12、24 h耳缘静脉取血3.0 mL,4 200 r/min离心10 min,分离血浆于-20℃冰箱中待测。
2.3血浆中EPA,DHA的测定
2.3.1样品处理方法取血浆样品2 mL,加0.4 mol/L的KOH-CH3OH 2 mL,加入1 mL正己烷,涡旋混合30 s,收集正己烷层部分并用氮气吹干,残余相中加入一点无水硫酸钠去除水分,加5% H2SO4-CH3OH 2 mL,70℃水浴30 min,加1 mL正己烷,涡旋混合30 s,与前面用氮气吹干后的残余相混合再用氮气吹干,用1 mL正己烷复溶,微孔滤膜过滤,进样。
2.3.2标准曲线与线性范围配制EPA,DHA对照品系列溶液,精密量取EPA,DHA标准液适量于离心管中,挥干溶剂,加入1 mL家兔空白血浆,涡旋混匀,配置成每毫升血浆中含250、125、62.5、41.67、31.25、25、20.83 μg EPA的储备液,配成每毫升血浆中含375、187.5、93.75、62.5、46.87、37.5、31.25 μg DHA的储备液,按2.3项下操作。以EPA,的峰面积对应其浓度进行线性回归,求得直线回归方程为Y=0.0213X-0.00111,r=0.998。结果表明,EPA,DHA在20.83~250μg/ml的线性关系良好,以DHA的峰面积对应其浓度进行线性回归,求得直线回归方程为Y=0.0333X-0.0216,r=0.999。DHA在31.25~375 μg/mL线性关系良好。
2.3.3回收率和精密度EPA制备低、中、高20.83,41.67,250 μg/mL三个浓度的血浆样本。按2.3项下操作。计算回收率和日内、日间精密度。其回收率分别为96.03%,97.21%,98.05%,表明该方法回收率符合要求;其日内和日间精密度的相对标准偏差RSD分别为1.8%、1.0%,表明该方法精密度符合要求。DHA制备低、中、高31.25,62.5,375 μg/mL三个浓度的血浆样本。按2.3项下操作。计算回收率和日内、日间精密度。其回收率分别为98.21%,97.35%,99.12%,表明该方法回收率符合要求;其日内和日间精密度的RSD分别为2.5%,1.9%,表明该方法精密度符合要求。
3 结果
血药浓度曲线和药物动力学参数18只家兔一次性服用受试制剂和参比制剂后不同时间的血药浓度曲线见图1,2,将药-时数据输入药动学计算软件3P87,采用非房室模型对数据进行处理[9],确定药动学参数。其中Cmax和Tmax为实测值,药动学参数结果见表1,2。
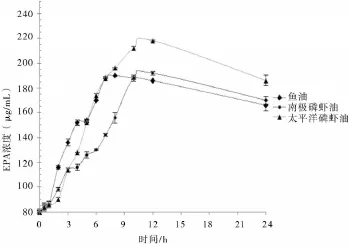
图1 新西兰大白兔灌胃2种磷虾油与鱼油后的血药(EPA)浓度曲线

图2 新西兰大白兔灌胃2种磷虾油与鱼油后的血药(DHA)浓度曲线
4 讨论与结论
4.1国内外关于EPA,DHA在体内吸收情况的实验,大部分都是长期服用建立模型后,检测血液中EPA,DHA的含量,以及对患者身体健康状况的改善[10-14]。EPA可以明显降低高甘油三酯患者血浆中甘油三酯的含量[10],甘油三酯与脂肪酸乙酯两种形式的DHA对高胆固醇的大鼠的代谢效应也存在明显差异[1],Kevin C.Makiai等发现,长期供给南极磷虾油可以明显比供给鱼油提高肥胖者血浆中EPA和DHA的含量,但是对二者的提高程度存在显著差异[3]。

表1 新西兰大白兔灌胃2种磷虾油与鱼油后的血药(EPA)主要药动学参数结构

表2 新西兰大白兔灌胃2种磷虾油与鱼油后的血药(DHA)主要药动学参数结构
4.2本文检测的是短期效应,从药代动力学方面检测服用制剂24 h内的血药浓度变化,药动学结果表明,对EPA的吸收而言,南极磷虾油与太平洋磷虾油药代参数AUC与鱼油之间无显著性差异,即生物利用度无显著差异,表明磷脂形式的EPA与普通的甘油三酯形式的EPA在短期内对体内的EPA含量影响并无差异。对DHA的吸收而言,南极磷虾油与太平洋磷虾油药代参数AUC与鱼油之间存在显著性差异,显示南极磷虾油吸收显著高于鱼油,太平洋磷虾油吸收显著低于鱼油,推测原因可能是南极磷虾极地适冷性甲壳类与普通海域的太平洋磷虾体内其他活性物质的差异对DHA吸收的影响。但磷脂形式的DHA与普通的甘油三酯形式的DHA相比较,短期内对体内的DHA含量究竟是提高还是降低,无法做出判断,还有待进一步研究和探索,这也有利于为进一步的人体药动学实验和保健品临床用药的长期与短期效应提供参考。
[1]Tabernero M,Bermejo L M,Elvira M,et al.Metabolic effect of docosahexaenoic acid supplementation in different doses and formulations(ethyl-and glyceryl-)in hypercholesterolemic rats[J]. Journal of Functional Foods,2013,5(2):755-762.
[2]徐世民,王芬,李明明.深海鱼油中EPA,DHA的气相色谱分析研究[J].粮油加工与食品机械,2006(10):54-57.
[3]Maki K C,Reeves M S,Farmer M,et al.Krill oil supplementation increases plasma concentrations of eicosapentaenoic and docosahexaenoic acids in overweight and obese men and women[J]. Nutrition research,2009,29(9):609-615.
[4]Schuchardt J P,Hahn A.Bioavailability of long-chain omega-3 fatty acids[J].Prostaglandins,Leukotrienes and Essential Fatty Acids(PLEFA),2013,89(1):1-8.
[5]谭丹.艾灸内关穴对家兔急性心肌缺血血清中游离脂肪酸(FFA)含量影响的实验研究[J].辽宁中医杂志,1991,6:037.
[6]沈晓京,胡鑫尧.亚麻籽油对家兔血浆脂肪酸影响的研究[J].第三军医大学学报,2001,23(A07):5-6.
[7]张雪琰,牟志春,高建国,等.4种海水鱼肉中脂肪酸组成分析及营养评价[J].食品研究与开发,2013,34(23):111-113.
[8]贾俊涛,赵丽青,张雪琰,等.气相色谱-质谱法测定福氏志贺氏菌的全细胞脂肪酸[J].山东出入境检验检疫局专刊,2012,31(12):140-142.
[9]梁文权,李高,刘建平.生物药剂学与药物动力学[M].3版.北京:人民卫生出版社,2007:1.
[10]Braeckman R A,Manku M S,Bays H E,et al.Icosapent ethyl,a pure EPA omega-3 fatty acid:Effects on plasma and red blood cell fatty acids in patients with very high triglyceride levels(results from the MARINE study)[J].Prostaglandins Leukotrienes and Essential Fatty Acids(PLEFA),2013,89(4):195-201.
[11]Nichols D J,Muirhead G J,Harness J A.Pharmacokinetics of sildenafil after single oral doses in healthy male subjects:absolute bioavailability,food effects and dose proportionality[J].British journal of clinical pharmacology,2002,53(s1):5S-12S.
[12]Eritsland J.Safety considerations of polyunsaturated fatty acids[J]. The American journal of clinical nutrition,2000,71(1):197S-201S.
[13]Cheruku S R,Montgomery-Downs H E,Farkas S L,et al.Higher maternal plasma docosahexaenoic acid during pregnancy is associated with more mature neonatal sleep-state patterning[J].The American journal of clinical nutrition,2002,76(3):608-613.
[14]Schuchardt J P,Hahn A.Bioavailability of long-chain omega-3 fatty acids[J].Prostaglandins,Leukotrienes and Essential Fatty Acids(PLEFA),2013,89(1):1-8.
S968.22
B
0529-6005(2016)04-0114-03
2014-10-09
孙艳宾(1990-),女,助教,硕士,从事生物化学与海洋生物活性物质研究,E-mail:sunyanbin1990@126.com

