剖宫产切口瘢痕妊娠患者采用宫腔镜及子宫动脉栓塞术联合治疗的效果及安全性分析
王素华
(山东省菏泽市第三人民医院 妇产科,山东 菏泽 274000)
剖宫产切口瘢痕妊娠患者采用宫腔镜及子宫动脉栓塞术联合治疗的效果及安全性分析
王素华
(山东省菏泽市第三人民医院 妇产科,山东 菏泽 274000)
目的 探讨剖宫产切口瘢痕妊娠患者(CSP)采用宫腔镜及子宫动脉栓塞术(UAE)联合治疗的效果及安全性分析。方法 选取该院收治的36例CSP患者,入院时均给予宫腔镜及子宫动脉注入甲氨蝶呤(MTX),在β-人绒毛膜促性腺激素(β-HCG)降至1 000 u/L时,超声显示病灶与浆膜层厚≥0.2 cm时,在宫腔镜下将妊娠病灶切除。结果 UAE联合MTX动脉内注射的手术平均时间(20.12±3.85)min,治疗前后β-HCG水平以及病灶直径均明显降低,分别为[(17 902.74±11 818.23)u/L vs (12 842.73±8 525.73)u/L和(3.65±1.02)cm vs(3.12±0.97)cm],差异有统计学意义(t =8.58,P <0.01和t =2.26,P <0.05);宫腔镜手术平均时间(19.13±2.67)min,平均出血量(17.43±7.28)ml,术后30~45天逐步恢复正常规律月经,疗效满意。结论 采用宫腔镜及UAE对CSP患者进行联合治疗,手术成功率高,术中出血量低,不良反应少,疗效满意。
瘢痕妊娠;剖宫产;宫腔镜;子宫动脉栓塞术;疗效
剖宫产切口瘢痕妊娠(caesarean scar pregnancy,CSP)是一种临床少见的异位妊娠,其发生率大约1∶1 800~1∶2 216,主要指滋养细胞、受精卵种植在患者前次剖宫产切口瘢痕部位的子宫肌层,并被瘢痕妊娠纤维及子宫肌纤维组织所包裹[1-2]。随着剖宫产手术的增加,CSP患病人数逐年增加,CSP可导致严重的并发症,对患者的生命安全构成严重威胁。因此,尽早发现并给予正确诊断与治疗对提高患者的治疗效果及预后均有积极的促进作用[3-5]。随着医疗改革的不断深入,宫腔镜微创手术在临床上广泛推广,本研究对我院治疗的36例剖宫产切口瘢痕妊娠患者行宫腔镜及子宫动脉栓塞术(uterine artery embolization,UAE)联合治疗。现报道如下:
1 资料与方法
1.1 一般资料
选取2014年6月-2015年6月我院收治的36例CSP患者,年龄21~43岁,平均(30.76±4.87)岁;既往妊娠史1~4次,平均(1.86±1.03)次,距离末次妊娠时间2~5年,平均(3.02±1.01)年;既往剖宫产史1或2次,平均(1.24±0.38)次,距离末次剖宫产时间2~7年,平均(3.29±1.37)年。36例患者主要症状为:停经33~57 d后出现阴道流血,通常流血量不超过月经量,伴发程度不同的间断性下腹痛18例,占50.0%,呕吐、恶心等早孕反应4例,占11.11%。21例患者于我院直接就诊,14例均为外院超声检查无法明确诊断但初步诊断为异位妊娠或滋养细胞疾病,转入我院进行就诊,1例存在药物流产失败而就诊于我院。
1.2 临床诊断
36患者入院时均进行急诊相关检查,其中血β-人绒毛膜促性腺激素(β-human choionic gonadotophin,β-HCG)值为4 624.81~53 104.38 u/L,平均(17 902.74±11 818.23)u/L;阴式超声检查提示,在对患者子宫前壁的下端剖宫产切口处向宫颈管内部检查,可探及存在不均质光团,直径大小为2.12~5.49 cm,平均(3.65±1.02)cm,另外,超声检查均可提示较为丰富的血流信号,距离浆膜层0.20~0.50 cm或连续,见或未见胎芽、卵黄囊以及心管搏动。所有患者入院后均明确确诊为CSP。
1.3 治疗方法
1.3.1 UAEUAE术及动脉内甲氨蝶呤注入治疗 36例患者入院后均给予完善的身体检查,诸如胸片、心电图、凝血功能、血常规和心肝肾功能等检查,并立刻采用UAE及动脉内注入甲氨蝶呤(methotrexate,MTX)MTX进行治疗,患者取平卧位,给予局部麻醉,并选择右侧股动脉进行穿刺,在数字减影血管显像技术(digital substraction angiography,DSA)协助下进行造影检查,双侧子宫动脉栓塞采用明胶海绵颗粒,并于动脉注入约50 mg MTX。在动脉栓塞术完成以后,对患者的病情变化需进行严密监测。于术后右腿制动12 h,为了防止血栓形成,需监测足背动脉波动情况,1次/30 min,持续2 h。对患者穿刺点实施加压包扎处理,24 h后方可取下。阴式超声及动态血β-HCG检查,分别1次/5 d和1次/48 h。患者超声检查见CSP病灶缩小,病灶活性抑制明显,血流信号明显降低,病灶与浆膜层厚度0.20~0.50 cm,可选择实施宫腔镜手术治疗。
1.3.2 宫腔镜手术治疗 实施手术前48 h,采用米非司酮口服治疗对宫颈进行软化,50 mg/1次,早晚各一次。手术当日行静脉复合麻醉,在宫腔镜下对宫腔深度进行探查,范围约8~10 cm,轻柔对宫颈进行扩张至10号扩棒,采用90电切环顺刀于腹部超声以及宫腔镜监护下对CSP切口进行切除,直至病灶于超声检查下完全切除,在患者子宫形态无异常发生后行球形电极进行电凝止血,并对宫腔积血块进行清除,直至宫腔镜下宫腔形态正常。手术完毕后,对患者行抗生素静脉滴注2 d,以有效预防感染,并对患者肌内注射止血药1次,同时每隔1天实施肌内注射10 u缩宫素。对于病灶较大患者,由于手术切除面积较大,应进行留置宫腔气囊处理,约6 d后拔出,然后再给予10 u缩宫素。36例患者均于术后48 h进行血β-HCG水平复查。
1.4 观察指标及随访
对患者实施手术期间的血β-HCG水平及并发症进行密切观察,并于实施手术3个月后对患者进行门诊或电话随访,对血β-HCG水平、妇科超声以及月经恢复等进行检查与评估,并对患者有无异常阴道流血、右下肢活动及感觉、间断腹痛及腹胀等并发症发生情况进行详细记录。
1.5 统计学方法
采用SPSS 18.0统计软件进行数据处理,计量资料用均数±标准差(±s)表示,数据差异采用两样本t检验,组间差异采用t检验,P <0.05时差异有统计学意义。
2 结果
2.1 UAE治疗及术后情况
通过DSA检查,可见患者子宫动脉主干增粗明显,螺旋动脉发生扭曲,并在子宫峡部形成较丰富血管网,即典型妊娠血管征,见附图A;36例患者均顺利完成UAE联合MTX动脉内注入治疗,且子宫动脉血流阻断效果理想,见附图B。36例患者手术时间平均(20.12±3.85)min,术中无副损伤以及特殊情况发生,患者生命体征均平稳正常。治疗前后,患者β-HCG水平和病灶最大直径见附表。

附图 子宫峡部于子宫动脉栓塞术时形成丰富血管网
附表 治疗前后患者β-HCG水平和病灶最大直径 (±s)
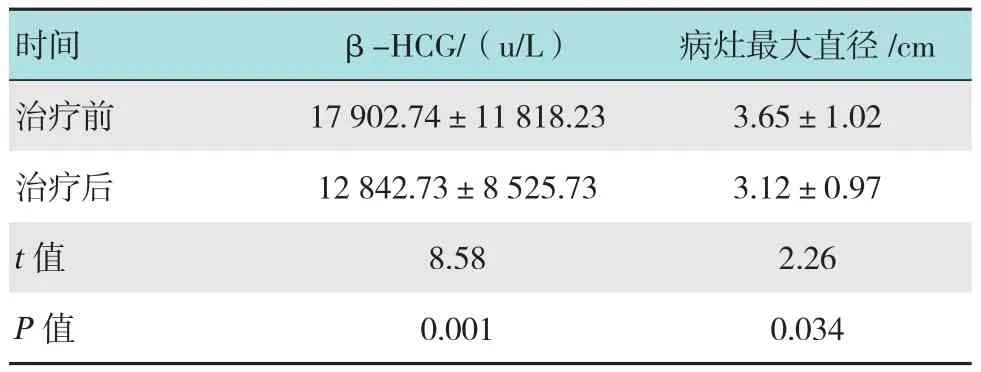
附表 治疗前后患者β-HCG水平和病灶最大直径 (±s)
时间 β-HCG/(u/L) 病灶最大直径/cm治疗前 17 902.74±11 818.23 3.65±1.02治疗后 12 842.73±8 525.73 3.12±0.97 t值 8.58 2.26 P值 0.001 0.034
2.2 宫腔镜手术治疗及术后情况
在UAE治疗后2~7 d内均进行宫腔镜手术,21例宫腔上段出现空虚,15例可见陈旧性坏死样积血块于宫腔内。缓慢将宫腔镜退出至前壁接近宫颈内口剖宫产切口部位,33例存在暗红色陈旧性病灶,3例存在“鱼泡样”病灶并凸向宫腔方向,病灶切除后宫腔形态均恢复正常。宫腔镜手术患者手术时间为(19.13±2.67)min,术中出血量(17.43±7.28)ml,术后48 h β-HCG为(194.23±116.73)u/L,术后2~4天β-HCG(113.45±36.14)u/L。
2.3 随访情况
术后3个月对患者进行随访,随访率100.00%。36例患者术后30天内超声复查显示,宫腔内无异常回声,且内膜回声均匀,术后约4~7周月经均恢复正常,其中10例患者第一次月经期持续约8~10 d,月经量较正常偏少,呈暗红色,且无异味,经口服优思明进行月经调节以及内膜修复后,并进行3个月随访,所有患者术后30~45天逐步恢复正常规律月经,疗效满意。
3 讨论
CSP因妊娠物种植于剖宫产瘢痕部位,存在特殊的病理生理基础,情况十分罕见且危险性较大,目前该病的发生机制尚未明确[6-7]。既往研究建议依靠引导超声诊断技术,将剖宫产切口瘢痕妊娠主要分为两个类型,内生型(Ⅰ型),妊娠物向宫腔内或宫颈管内生长;外生型(Ⅱ型),妊娠物种植于剖宫产瘢痕深部且向腹腔、膀胱等方向生长,此型更容易发生子宫劈裂[8-10],本研究所选CSP患者更倾向于内生型。
CSP一经确诊应马上给予妊娠终止,并采取有效的手段进行治疗,以免因治疗错过最佳时机而导致患者生命受到影响。CSP的诊疗主要依靠患者的临床体征、症状、血β-HCG水平、病灶大小、影像学表现以及实施手术的技术水平等。目前,治疗手段主要包括保守治疗、介入及手术治疗。其中保守治疗主要有MTX静脉、肌内以及妊娠囊注射,MTX局部注射配合天花粉、口服米非司酮以及UAE治疗,效果较佳;但也因病灶不能彻底完全清楚,存在子宫破裂以及大出血的发生风险,且遗留瘢痕会增加下次发生CSP的几率,同时患者阴道长时间流血,极易导致宫腔及盆腔感染,宫腔粘连及月经紊乱,严重者导致患者不孕不育而生活质量显著降低[11]。另外,CSP患者的妊娠组织存在非常丰富的血运,且周围组织菲薄,故在术前患者的血运情况仅能够通过间接评价,这样传统的开腹手术治疗下,便很容易造成术中大出血的发生,进而增加患者子宫切除的可能性,甚至危及患者生命安全。因此,近年来随着微创技术的广泛推广与应用,在临床上内镜操作技术有了较大的提升,并显示了巨大的优势[12-14]。
本研究中对36例患者实施UAE联合动脉腔MTX注射的“预处理”治疗,能够为临床医生提供一个较佳的手术“时机”,其中UAE能够有效地将宫动脉血流阻断,进而减少病灶血运,而MTX能够有效抑制并杀死滋养细胞,通过两者的协同作用一方面抑制病灶的生长,降低妊娠物破裂出血风险,同时还可以使手术过程中因诱发大出血而转为开腹手术切除子宫的几率降低,大大提高了手术的成功率。对于手术这一最佳“时间”的选择,主要参考血β-HCG水平,结合既往的临床治疗经验,以血β-HCG值降低至大约1 000 u/L范围作为手术的较理想“时机”,因为这个时间段,胚胎活性基本已经丧失,若再继续观察患者β-HCG水平降低,在一定程度上也会增加患者对疾病恐惧的心理,进而降低了患者战胜疾病的信心。另外,该“时机”应尽量在超声检查显示病灶与浆膜层厚≥0.2 cm时,以最大程度降低损伤的发生几率而确保手术的效果。本组36例患者均顺利完成手术,效果均较理想,术中出血量少,平均(17.43±7.28)ml。但针对具体的患者,其血β-HCG水平降低程度及时间变化存在差异,需要临床医师丰富的经验以及足够的耐心等待与观察,以尽可能获得手术最佳“时机”。本组36例患者均于UAE治疗后,2~7 d内进行宫腔镜手术。
宫腔镜手术具有明显的优势[15]:①宫腔镜手术能够镜下对病灶大小、位置、病灶与子宫肌层情况、有无活动性出血以及宫腔内具体情况等直接观察,克服了单纯清宫容易造成漏吸、漏刮以及过度损伤子宫内膜的危害等;②宫腔镜手术采用电凝止血,减少了手术缝合二次诱发瘢痕的风险发生;③宫腔镜手术的创伤性较小,术中出血量低,且术后患者预后较快等。本研究是在我院宫腔镜手术技术熟练,以及结合大量的临床实践经验基础上对患者进行联合治疗,36例患者均顺利完成手术治疗,术后随访效果满意,提示CSP患者采用宫腔镜及UAE联合治疗是安全、有效的,可作为CSP治疗的一种有效选择方案。
综上所述,剖宫产切口瘢痕妊娠的治疗目前仍缺乏统一的治疗标准,但结合我院UAE联合动脉腔MTX注射的“预处理”治疗,建议血β-HCG值降低至大约1 000 u/L范围作为手术的较理想“时机”。经宫腔镜联合UAE进行治疗能够提高手术的成功率,术中出血量低,不良反应小,减轻了患者的痛苦,具有重要的临床应用价值。
[1] SMITH A, NAJI O, DAEMEN A, et al. The relationship betweenprevious elective or emergency Caesarean section and time-to-next-pregnancy interval on Caesarean scar size and residualmyometrial thickness in subsequent pregnancy[J]. UltrasoundObstet Gynecol, 2011, 38(S1): 86-86.
[2] CHANG Y, TSAI E M, LONG C Y, et al. Resectoscopic treatment combined with sonohysterographic evaluation of women with postmenstrual bleeding as a result of previous cesarean delivery scar defects[J]. Am J Obstet Gynecol, 2009, 200(4): 370.
[3] LI C, LI C, FENG D, et al. Transcatheter arterial chemoembolization versus systemic methotrexate for the anagement of cesarean scar pregnancy[J]. Int J Gynaecol Obstet, 2011, 113(3): 178-182.
[4] VIKHAREVA OSSER O, VALENTIN L. Risk factors for incomplete healing of the uterine incision after caesarean section[J]. BJOG,2010, 117(9): 1119-1126.
[5] LIANG F, HE J. Methotrexate-based bilateral uterine arterial chemoembolization for treatment of cesarean scar pregnancy[J]. Acta Obstet Gynecol Scand, 2010, 89(12): 1592-1594.
[6] LITWICKA K, GRECO E. Caesarean scar pregnancy:a review of management options[J]. Curr Opin Ohstet Gynecol, 2011, 23(6):415-421.
[7] ZHANG B, JIANG Z B, HUANG M S, et al. Uterine artery embolizationcombined with methotrexate in the treatment of cesarean scarpregnancy:results of a case series and review of the literature[J]. J Vase Int Radiol, 2012, 23(12): 1582-1588.
[8] YIN X, SU S, DONG B, et al. Angiographic uterine arterychemoembolization followed by vacuum aspiration: an effi cientand safe treatment for managing complicated cesarean scarpregnancy[J]. Arch Gynecol Obstet, 2012, 285(5): 1313-1318.
[9] KANG S Y, PARK B J, KIM Y W, et al. Surgical management of cesarean scar ectopic pregnancy: hysterotomy by transvaginal approach[J]. Fertil Steril, 2011, 96 (1) : e25-e28.
[10] HIRAKAWA M, TAJIMA T, YOSHIMITSU K, et al. Uterine artery embolization along with the administration of methotrexate for cervical ectopic pregnancy: technical and clinical outcomes[J]. Am J Roentgenol, 2009, 192(6): 1601-1607.
[11] PETCRSEN K B, LANGHOFF-ROOS J, KREBS L, et al. Pregnancy within the uterine scar of a prior Caesarean section[J]. Ugeskr Lacger, 2010, 172 (33): 2226-2231.
[12] GANGULI S, STECKER M S, PYNE D, et al. Uterine artery embolization in the treatment of postpartum uterine hemorrhage[J]. Journal of Vascular and Interventional Radiology,2011, 22(2): 169-176.
[13] LAN W, HU D, LI Z, et al. Bilateral uterine artery chemoembolization combined with dilation and curettage for treatment of cesarean scar pregnancy: A method for preserving the uterus[J]. J Obstet Gynaecol Res, 2013, 39(6): 1153-1158.
[14] LITTLE E A, MOUSSAVIAN B, HORROW M M. Cesarean delivery scar ectopic pregnancy[J]. Ultrasound Quarterly, 2010,6(2): 107-109.
[15] YANG X Y, YU H, LI K M, et al. Uterine artery embolisation combined with local methotrexate for treatment of cesarean scar pregnancy [J]. BJOG, 2010, 117(8): 990-996.
(曾文军 编辑)
Analysis of the curative effect and safety of uterine artery embolization combined with hysteroscope in treating cesarean scar pregnancy
Su-hua Wang
(Department of Obstetrics and Gynecology, the Third People's Hospital, Heze, Shandong 274000, China)
Objective To explore the curative effect and safety of uterine artery embolization combined with hysteroscope in treating cesarean scar pregnancy. Methods 36 cesarean scar pregnancy patients (CSP diameter under six cm by ultrasound) from June 2014 to June 2015 were selected and studied. All patients received the UAE and arterial injection of Methotrexate (MTX), and while the blood beta-HCG fell to around 1 000 u/L and the lesions thickness to serous membrane were over 0.2 cm by ultrasound, pregnancy lesions were resected by hysteroscopy surgery. Results The UAE and arterial injection of Methotrexate about (20.12 ± 3.85) min. Blood beta-HCG level and lesion diameter both fell or decreased, each with [(17 902.74±11 818.23) u/L vs (12 842.73 ± 8 525.73) u/L and (3.65 ± 1.02) cm vs (3.12 ± 0.97) cm] (t = 8.58, P < 0.01, t = 2.26, P < 0.05). Hysteroscopy surgery cost about(19.13 ± 2.67) min, the amount of bleeding were (17.43 ± 7.28) ml. Postoperative blood beta-HCG decreased to (113.45 ± 36.14) u/L within 2~4 days, the patients were discharged. Conclusion Hysteroscopy surgery with pretreatment of UAE combined with MTX injection could gain satisfactory outcome for patients with CSP. It has high success rate, low blood loss, fewer adverse reactions satisfactory outcome.
scar pregnancy; cesarean; hysteroscope; uterine artery embolization; effects
R713.8
A
10.3969/j.issn.1007-1989.2016.09.019
1007-1989(2016)09-0084-04
2016-03-20