精准靶向缓释化疗粒子植入治疗进展期食管癌的临床研究
王利,李林艳,黄丹,邓冬梅,文黎明
(1.西南医科大学临床医学院,四川 泸州 646000;2.川北医学院附属第二医院 消化中心,四川 绵阳 621000)
精准靶向缓释化疗粒子植入治疗进展期食管癌的临床研究
王利1,李林艳2,黄丹2,邓冬梅2,文黎明1
(1.西南医科大学临床医学院,四川 泸州 646000;2.川北医学院附属第二医院 消化中心,四川 绵阳 621000)
目的 观察内镜下精准靶向植入缓释化疗粒子治疗进展期食管癌的临床疗效。方法 在内镜直视下,将病灶以1.0 cm的层间距分为若干层,每层内以每间隔1.0 cm种植一枚缓释化疗粒子;植入时每点植入10 mg,依病情需要,每4周植入1次,种植3次为1个疗程。此项研究中全部病患均顺利完成治疗。通过比对研究患者在治疗前、治疗后3个月及治疗后6个月的临床症状缓解情况、病灶面积变化情况、吞咽困难改善情况、不良反应和生活质量等。结果 治疗前分别与治疗3和6个月比较,患者病变面积、吞咽困难分级变化差异有统计学意义(P <0.05);但生活质量改善情况差异无统计学意义(P >0.05,原因可能是随访时间较短及样本量较少,未体现出个体之间差异);另外治疗前与治疗3个月白细胞(WBC)差异有统计学意义(P <0.05);治疗前、治疗3和6个月并发症情况发生率差异无统计学意义。结论 内镜下植入5-氟尿嘧啶(5-Fu)缓释粒子治疗晚期食管癌,是一种安全有效、毒副作用小和耐受性好的姑息治疗方法。
食管癌;5-Fu;精准靶向缓释化疗粒子植入
癌症患者早期常无明显症状,到医院就诊的患者大多己属中晚期,食管癌患者预后不良,即使采用合适的治疗方法,其5年生存率仅有5%~30%,有大于50%的患者不适合手术治疗,对于晚期食管癌,以缓解症状的支持治疗为主[1]。对于中晚期肿瘤患者,体质一般较弱,常无法采用强烈的放化疗。缓释化疗粒子植入病灶局部浓度高,且局部有轻微炎症反应,无细胞变性、坏死及其他不良反应,是一种微创、高效低毒副反应的方法,提高了进展期食管癌患者生存质量、延长生存期[2]。我科于2014年开始应用内镜下植入缓释化疗粒子治疗进展期食管癌患者21例,取得了一定的疗效。现报道如下:
1 资料与方法
1.1 一般资料
入选观察组患者21例(所有病例均经胃镜下病理活检确诊为癌)。其中,男15例,女6例,男女之比为2.5∶1;平均年龄为(73.8±6.6)岁;位于食管上段者3例,位于食管中段者14例,位于食管下段者4例;经病理证实为鳞癌者19例,腺癌者2例;临床分型:髓质型1例,蕈伞型7例,溃疡型13例,所有入选患者均种植缓释化疗粒子1个疗程。
1.1.1 入选标准
完善相关检查明确有远处转移,不
能进行根治手术,或患者及家属放弃手术治疗,要求内镜姑息治疗者为研究对象。
1.1.2 排除标准
对于病情危重、肿瘤广泛转移、顽固的癌性胸、腹水、严重的肝肾心肺功能衰竭、呼吸道消化道出血或生存期小于3个月,不进行缓释化疗粒子植入治疗。
1.2 材料与设备
电子胃镜(PENTAX公司,型号EG-2940);内镜专用粒子推注器(RC-GIE150型消化内镜专用,由山东创新医疗器械科技有限公司提供);植入用缓释5-氟尿嘧啶(5-Fu):由芜湖先声中人药业有限公司提供氟尿嘧啶植入剂(中人氟安),有效成分是氟尿嘧啶,该药植入人体内后通过渗透-扩散机制使5-Fu向组织间质扩散,有效药物扩散距离为3~7 cm,其所含5-Fu可在24 h内释放20%,5 d释放50%,15 d释放75%。
1.3 方法
1.3.1 术前准备
患者入院后做必要检查及对症支持治疗,一般情况改善后开始内镜下治疗。治疗前空腹8 h以上,在无痛胃镜下进行治疗。
1.3.2 方法
明确无禁忌证,于内镜直视下观察病变的形态、大小和范围,计算肿瘤面积,髓质型、溃疡型肿瘤计算病灶表面积;蕈伞型计算肿瘤表面体积,植入用缓释5-FU置入操作过程,在内镜直视下,患者取仰卧位,麻醉后经口腔送入,置于病变的下端,经内镜观察病灶长度及狭窄程度。将病灶以1.0 cm的层间距分为若干层,每层内以每间隔1.0 cm种植一枚缓释化疗粒子(图1);植入时每点植入10 mg,依病情需要,每4周植入1次,种植3次为1个疗程,治疗期间辅以全身支持治疗,以防并发症发生。
图1 内镜下缓释化疗粒子注药示意图
1.4 观察与评估方法
1.4.1 术后观察 术后观察并记录患者症状、临床症状缓解情况及不良反应等。治疗当天禁食,从第2天起依次进食流质、半流质乃至软食。1个月后复查胃镜,行第2次缓释化疗粒子植入治疗。
1.4.2 吞咽困难改善评估 按Stooler分级,将吞咽困难分为5级:0级能正常进食;1级能进固体软食;2级能进食半流食;3级能进流食;4级不能进食。治疗提高一个级别视为改善,无变化视为稳定,降低一个级别视为无效。
1.4.3 病灶面积变化情况 以内镜下所测面积(由熟练内镜医师操作,且治疗前后均为同一人)及抗肿瘤药对实体肿瘤客观疗效评定标准为指标。实体肿瘤病灶评价标准:完全缓解(complete response,CR),肿瘤完全消失,维持4周以上;部分缓解(partial response,PR),目标病灶最长径总和减少≥30%维持4周以上;疾病稳定(stable disease,SD),介于PR和疾病进展(progressive disease,PD)之间,肿瘤缩小50%以下或增大在20%以内,持续4周以上;PD,目标病灶最长径总和增加≥20%,并且其绝对值增加超过5 mm;出现新病灶也视为PD;完全缓解、部分缓解视为有效,有效率(response rate,RR)=CR+PR(%)。
1.4.4 生活质量评分
分别在治疗前、治疗3和6个月使用食管癌专用量表(quality of life questionnaireoesophagel 18,QLQ-OES18)[3]测量患者的生活质量评分,主要由患者复查时随访所得。
1.5 统计学方法
资料均采用SPSS 17.0统计软件进行统计处理,计量资料用均数±标准差(±s)表示,治疗前后变化情况比较采用配对t检验,吞咽困难缓解情况采用非参数检验,计数资料的比较采用χ2检验。P <0.05认为差异有统计学意义。
2 结果
2.1 治疗前与治疗3和6个月比较
治疗前与治疗3和6个月比较,病变面积变化差异有统计学(P <0.05);缓释化疗粒子治疗过程、内镜下病灶变化情况及病理分型详见图2;治疗前与治疗3和6个月粒子种植数量变化差异有统计学意义(P <0.05);治疗前与治疗3和6个月比较吞咽困难分级变化差异有统计学意义(P <0.05),见表1;缓释化疗粒子植入治疗能减小食管癌病变面积,减轻吞咽困难的症状;按实体肿瘤病灶评价标准:治疗3个月评估的有效率RR为85.7%,治疗6个月评估的有效率为76.2%。
2.2 生活质量评价
使用QLQ-OES18评价。治疗前、治疗3和6个月比较生活质量改善情况比较差异无统计学意义(P >0.05,因随访时间相对较短及样本量较少,未体现出个体之间差异),详见表2,症状量表及其单项条目得分越高,症状越明显;其生活质量趋势图改变详见图3。
2.3 不良反应
治疗前与治疗3个月比较,白细胞(white blood cell,WBC)的变化差异有统计学意义(P <0.05);治疗前与治疗6个月比较,WBC的变化差异无统计学意义(P >0.05);治疗前与治疗3和6个月比较,血红蛋白(hemoglobin,HGB)、谷丙转氨酶(alanine transaminase,ALT)、谷草转氨酶(aspartatetransaminase,AST)、甲胎蛋白(alpha-fetal protein,AFP)、癌胚抗原(carcinoembryonic antigen,CEA)和CA199的变化差异无统计学意义(P >0.05);经缓释化疗粒子植入治疗后近期内对WBC有不同程度的影响,但治疗前与治疗后6个月比较差异无统计学意义(P >0.05)。见表3。
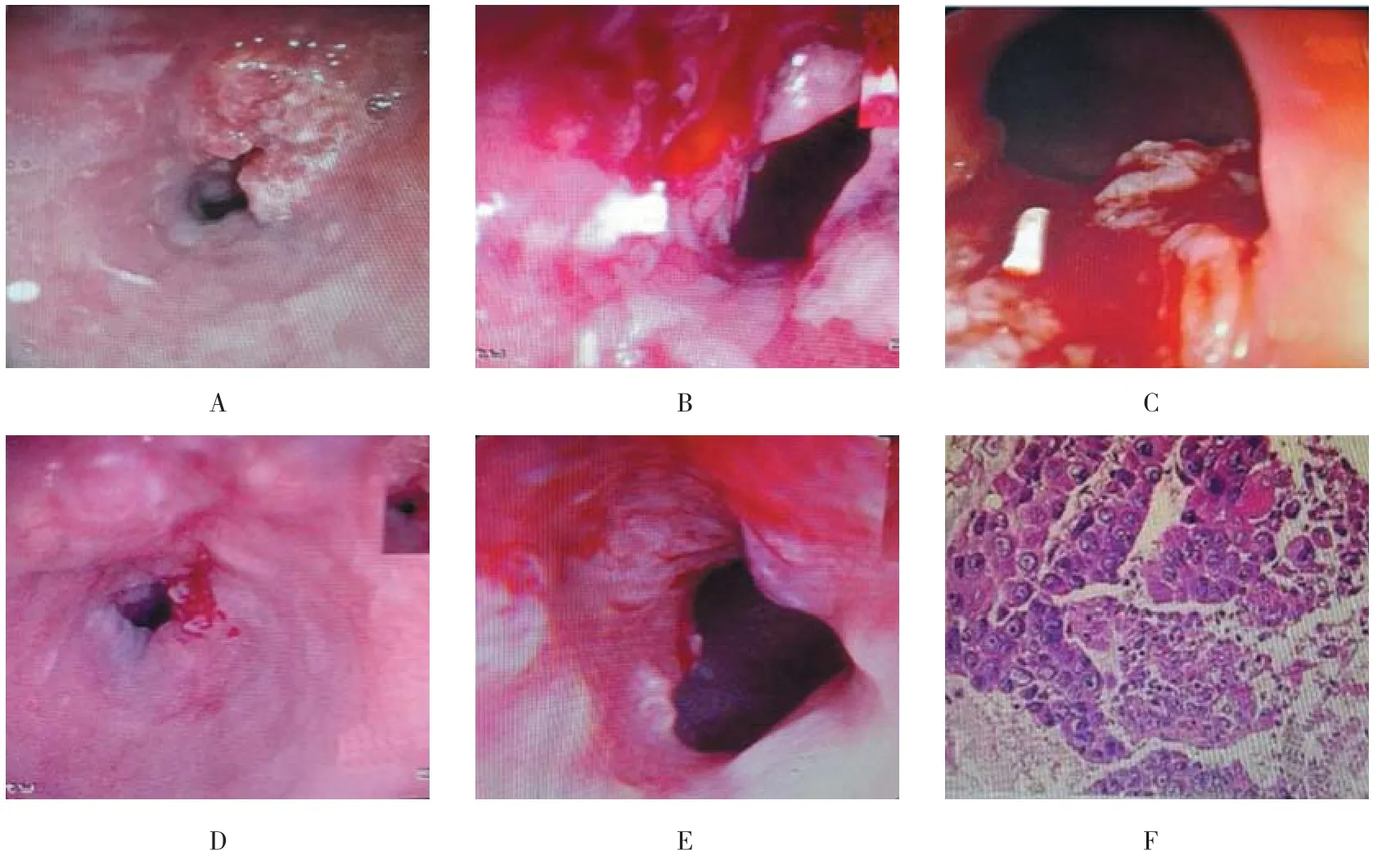
图2 缓释化疗粒子治疗过程、内镜下病灶变化情况及病理分型
2.4 并发症
经内镜下缓释化疗粒子植入治疗,所有患者植入部位均出现少量出血现象,经抑酸及局部止血治疗均能取得良好效果。治疗后随访发现,无1例患者出现大出血、感染、穿孔、纵膈气肿和食管气管瘘等并发症。将治疗前、治疗3及6个月并发症进行比较,差异无统计学意义(P >0.05);缓释化疗粒子治疗食管癌并不增加并发症的发生。见表4。
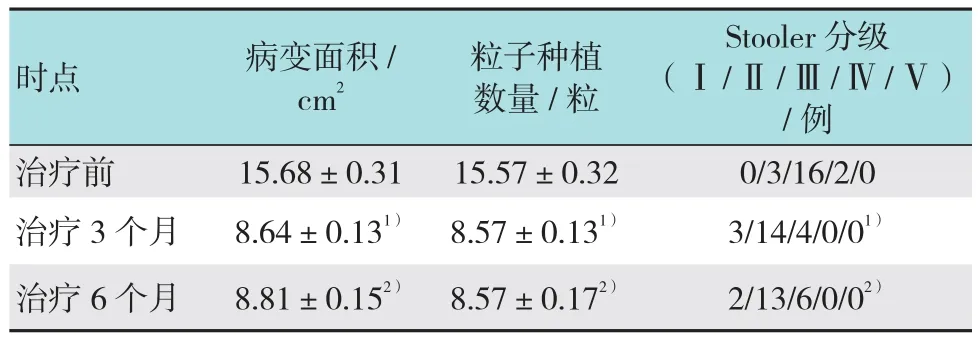
表1 各时点观察变量变化情况比较
表2 各个时点QLQ-OES18量表各领域得分情况 (分,±s)
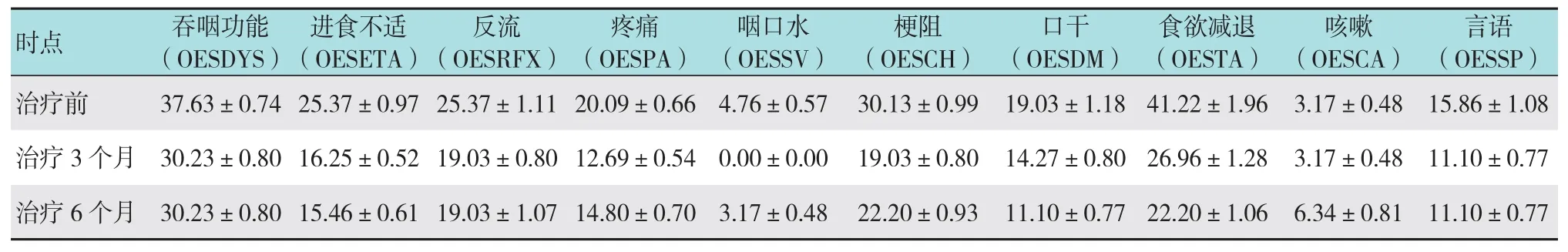
表2 各个时点QLQ-OES18量表各领域得分情况 (分,±s)
注:以上QLQ-OES18各单项条目中,分别将治疗3个月和治疗6个月与治疗前进行配对t检验,所有的检验结果均P >0.05
时点 吞咽功能(OESDYS)言语(OESSP)治疗前 37.63±0.74 25.37±0.97 25.37±1.11 20.09±0.66 4.76±0.57 30.13±0.99 19.03±1.18 41.22±1.96 3.17±0.48 15.86±1.08治疗3个月 30.23±0.80 16.25±0.52 19.03±0.80 12.69±0.54 0.00±0.00 19.03±0.80 14.27±0.80 26.96±1.28 3.17±0.48 11.10±0.77治疗6个月 30.23±0.80 15.46±0.61 19.03±1.07 14.80±0.70 3.17±0.48 22.20±0.93 11.10±0.77 22.20±1.06 6.34±0.81 11.10±0.77
表3 各时点的观察指标变化情况 (±s)
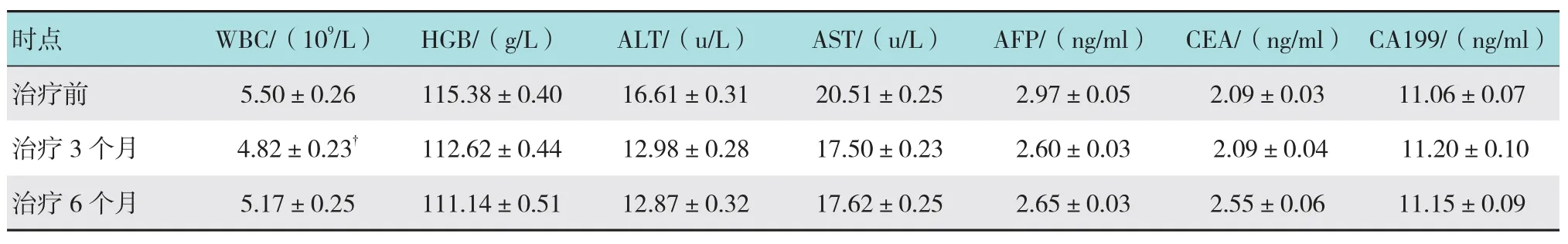
表3 各时点的观察指标变化情况 (±s)
注:†治疗3个月与治疗前比较,P <0.05
?
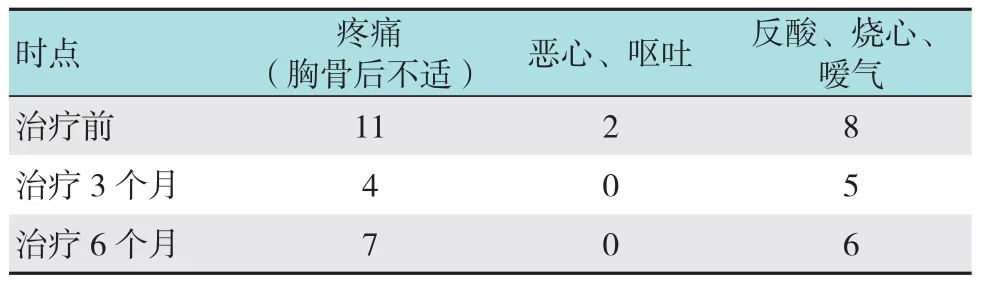
表4 患者并发症的结果比较 例
注:以上患者并发症的每个单项中,分别将治疗3个月和治疗6个月与治疗前进行比较,所有的检验结果均P >0.05
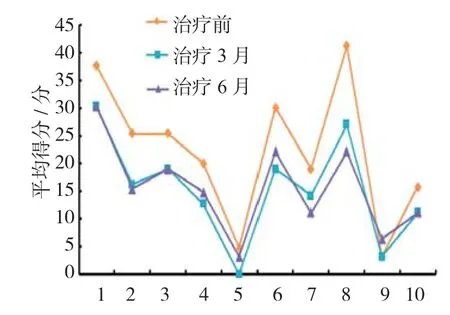
图3 治疗后生活质量趋势图
3 讨论
进展期食管癌的预后较差,肿瘤分化程度是影响预后的重要因素,临床上诊断的未转移的食管癌患者中,尸检证实有70%以上有淋巴结转移,50%以上有远处转移,不宜进行手术治疗[4];对于晚期或无法手术的进展期食管癌患者,食管狭窄是影响生活质量的关键因素,内镜下治疗是解决狭窄的主要手段,联合内镜下局部化疗,可明显改善患者的临床症状,且可明显降低晚期食管癌远处转移风险,延长生存期[5]。对于食管癌患者癌细胞的脱落种植和微小转移灶的残留是肿瘤局部区域复发的两大重要因素,有效化疗至关重要。5-Fu是胃肠道恶性肿瘤化疗的传统经典药物,半衰期短、代谢快;但常规化疗副反应重,晚期食管癌患者常常不能耐受,有食管癌患者使用含5-Fu的化疗方案进行全身化疗时可出现血液系统的毒性反应[6]。曾有文献报道[7],有胃肠道恶性肿瘤患者使用含氟尿嘧啶的化疗方案后出现心脏毒性反应,且既往合并心脏基础疾病的患者发病率更高。5-Fu局部注射化疗药物避免了全身较强的毒副作用,但5-Fu局部化疗半衰期短,无法杀灭处于G期及M期的肿瘤细胞,化疗效果受到很大影响;而缓释性化疗药物缓慢释放,可延长肿瘤组织与药物的接触时间.从而增强药效果;常用载体缓释型5-Fu的药代动力学优势及缓释作用是采用外周静脉化疗和口服化疗所完全不能达到的[8]。缓释剂局部植入后,将毒性控制在最小范围,有效减少全身毒副作用,效果更佳[9]。缓释化疗粒子作为一种新的有效治疗方法,能长期稳定控制靶向部位或血液浓度,并可改变肿瘤的间质、影响和改变肿瘤的微环境及调节肿瘤内的免疫,提高了生物利用度,降低了不良反应的发生。有实验通过对植入5-Fu缓释化疗粒子与腔内化疗对比研究发现,实验组缓解率明显高于对照组缓解率(差异有统计学意义)[10]。5-Fu缓释化疗药物主要分布于肿瘤局部,病灶组织中化疗药物的浓度远高于心脏,肝、脾、肺、肾和血液,血浆分布较少,不良反应较全身化疗小[11-12]。胡文江等[13]通过研究发现用5-Fu缓释化疗粒子内镜下植入治疗中晚期食管癌,每4周注射植入一次,能使癌细胞内药物持续高浓度,有效抑制浸润转移或缩小癌组织。国内有文献[14]报道通过“密集注入法”植入缓释化疗粒子治疗进展期食管癌,安全有效。
目前靶向治疗恶性肿瘤逐渐广泛应用于临床,内镜直视下将缓释化疗粒子植入局部治疗食管癌成为一种新的途径。内镜下缓释化疗粒子植入,为内镜下局部靶向治疗,能够使病灶减小、且副作用小,并发症少,是姑息治疗中晚期食管癌新的有效方法。我院自2014年起,开始应用精准靶向缓释化疗粒子植入治疗进展期食管癌,取得了一定的临床效果。本研究发现:治疗前与治疗3和6个月比较,患者病变面积、吞咽困难分级变化 差异有统计学意义(P <0.05),内镜下精准靶向植入缓释化疗粒子治疗进展期食管癌能够有效缩小病变面积,控制肿瘤生长,减轻吞咽困难程度,但生活质量改善情况差异无统计学意义(P >0.05),原因可能是随访时间较短及样本量较少,未体现出个体之间的差异;另外治疗前与治疗3个月WBC差异有统计学意义(P <0.05),可能与5-Fu毒副反应有关;治疗前、治疗3和6个月并发症情况发生率差异无统计学意义。缓释化疗粒子植入治疗能减小病灶,缓解吞咽困难,且不良反应少,精准靶向缓释化疗粒子植入治疗进展期食管癌对于提高晚期食管癌患者不失为有效手段之一,但本次研究中的病例数较少,随访时间短,关于缓释化疗粒子治疗的疗效还有待进一步观察研究。
综上所述,内镜下植入5-Fu缓释粒子治疗晚期食管癌,是一种安全有效、毒副作用小和耐受性好的姑息治疗方法,值得推广。
[1] SHARMA P, KOZAREK R. Role of esophageal stents in benign and malignant diseases[J]. American Journal of Gastroenterology,2010, 105(2): 258-273.
[2] WEI G, NIE M M, SHEN X J, et al. Experimental study on sustained-release 5-Fluorouracil implantation in canine peritoneum and para-aortic abdominalis[J]. Asian Pacific Journal of Cancer Prevention, 2014, 15(1): 407-411.
[3] DEROGAR M, LAGERGREN P. Health-related quality of life among 5-year survivors of esophageal cancer surgery: a prospective population-based study[J]. J Clin Oncol, 2012, 30(4):413-418.
[4] NAVARRETE A J, OÑATE OCAÑA L F, HERRERA G R, et al. Survival prognostic factors in a cohort of patients with esophageal carcinoma[J]. Rev Gastroenterol Mex, 2004, 69(4): 209-216.
[5] LINDENMANN J, MATZI V, NEUBOECK N, et al. Individualized,multimodal palliative treatment of inoperable esophageal cancer:clinical impact of photodynamic therapy resulting in prolonged survival[J]. Lasers in Surgery & Medicine, 2012, 44(3):189-198.
[6] SHIGEYUKI T, MOTOHIRO I, HIROYA T, et al. Phase II study of docetaxel, cisplatin and 5-fluorouracil (DCF) for metastatic esophageal cancer (OGSG 0403)[J]. Anticancer Research, 2012,32(4): 1403-1408.
[7] 廖峰, 王琳, 秦叔逵, 等. 氟尿嘧啶引起的心脏毒性9例报道附文献复习[J]. 实用肿瘤杂志, 2014, 29(2): 183-185.
[8] 陈环球, 龚建平, 何裕隆, 等. 进展期胃癌术中区域性缓释化疗专家共识[J]. 中华胃肠外科杂志, 2012, 15(9): 981-983.
[9] 高宏健, 董戬, 胡墨. 内镜直视下5-氟尿嘧啶缓释剂的安全性[J]. 中国组织工程研究与临床康复, 2009, 13(16): 3177-3180.
[10] JI Y L, LI R Z, XUE L F, et al. Therapeutic effects of 5-fl uorouracil sustained-release particles in 81 malignant pericardial effusion patients[J]. Kaohsiung Journal of Medical Sciences, 2015, 31(2):96-101.
[11] LIU J, WANG Z, WU K, et al. Paclitaxel or 5-fluorouracil/ esophageal stent combinations as a novel approach for the treatment of esophageal cancer[J]. Biomaterials, 2015, 53: 592-599.
[12] 李井泉, 赵平, 王世亮, 等. 5-氟尿嘧啶缓释化疗药代动力学研究[J]. 中国全科医学, 2007, 10(8): 630-631.
[13] 胡文江, 向良宏, 林立, 等. 内镜下植入缓释化疗粒子治疗中晚期食管癌的临床价值[J]. 临床消化病杂志, 2014, 26(1): 44-46.
[14] 陈鹏飞, 魏文斌, 谭远忠,等. 内镜下植入缓释化疗粒子治疗晚期食管癌的临床疗效观察[J]. 中国中西医结合消化杂志,2013, 21(9): 459-461.
(吴静 编辑)
Clinical effect of endoscopic implantation of accurate and slowrelease particles for advanced esophageal carcinoma
Li Wang1, Lin-yan Li2, Dan Huang2, Dong-mei Deng2, Li-ming Wen1
(1.Clinical Medicine College, Southwest Medical University, Luzhou, Sichuan 646000, China;2.Department of Digestive Diseases, the Second Affi liated Hospital of North Sichuan Medical College,Mianyang, Sichuan 621000, China)
Objective To observe the clinical effects by endoscopic implantation of accurate and slow-release particles for advanced esophageal carcinoma. Methods Under endoscopy, we dividing the whole focus into several layers by each 1.0 cm and implanting one slow-release particles (about 10 mg) in each point whose interval is 1.0 cm. One course of treatment includes three-time implantation and each treatment needs four weeks, by the way the details depend on the state of illness. In this research, all of patients complete the treatment smoothly. By comparing the patients' situation before treatment, three-month treatment and six-month treatment, which include the remission of clinical symptom, the changing of focus area, the improvement of swallow function, untoward effect and life quality,et al. Results The results show several test indexes changed a lot. When treated for 3 months and 6 months, the levels of focus area and swallow diffi culty classifi cation were decreased signifi cantly (P < 0.05) as compared with those before treatment; but the patients' life quality didn't have signifi cant statistical difference (P > 0.05), by the way there isn't individual difference appearing because of a little short of testing time and a few of samples. In addition, the WBC had a signifi cant statistical difference between before treatment and three-month treatment (P < 0.05), and theratio of complication didn't have a signifi cant change. Conclusions Endoscopic implantation of 5-Fu slow-release particles for the treatment of advanced esophageal carcinoma is a safety, high effi cacy, low toxic and good tolerant palliative treatment.
esophageal carcinoma; 5-Fu; implantation of accurate and slow-release particles
R735.1
A
10.3969/j.issn.1007-1989.2016.09.007
1007-1989(2016)09-0030-05
2016-03-28
文黎明,E-mail:wenlm404@sohu.com
文黎明现工作于川北医学院附属第二医院

