猪心肌高铁肌红蛋白高级结构动态信息的光谱指认
李亚东,吴名草,汤 宇,金邦荃,*,黄鹤勇,李 钢,冯玉英
(1.南京师范大学金陵女子学院,江苏 南京 210097;2.南京师范大学分析测试中心,江苏 南京 210097)
猪心肌高铁肌红蛋白高级结构动态信息的光谱指认
李亚东1,吴名草1,汤 宇1,金邦荃1,*,黄鹤勇2,李 钢2,冯玉英2
(1.南京师范大学金陵女子学院,江苏 南京 210097;2.南京师范大学分析测试中心,江苏 南京 210097)
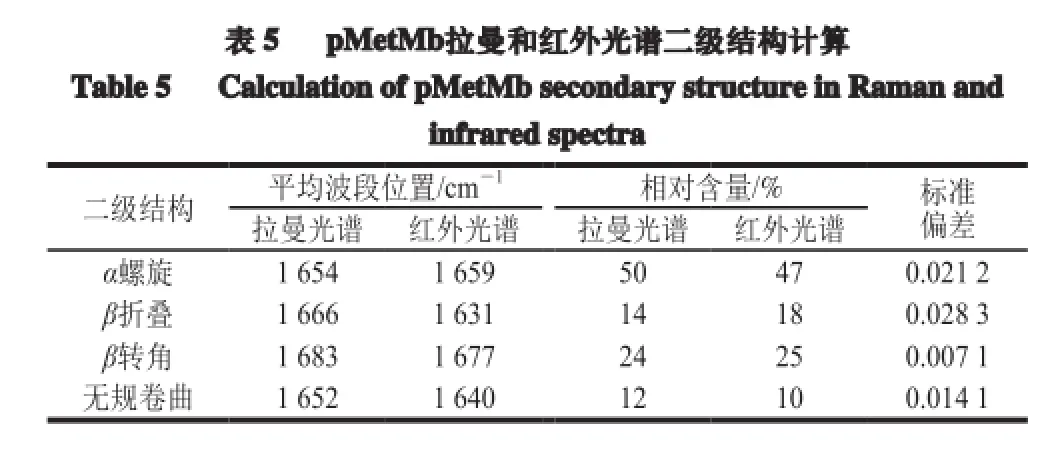
本实验采用扫描电子显微镜、X射线衍射、拉曼、红外等现代光谱技术和数据库、计算软件等,层层剖析猪心肌高铁肌红蛋白(pig metmyoglobin,pMetMb)冻干粉的结构特征和分子动态结构信息。结果表明,pMetMb冻干粉表观呈明显的棱状结晶体,结晶度为(95.60±1.37)%,三晶胞轴长不相等(a≠b≠c),可归属于高晶度含水单斜结晶体。根据晶体数据库同类化合物比对,得到pMetMb肽链和heme-Fe的关键基团来源;经拉曼和红外光谱解析和推算,pMetMb肽链均有α螺旋、β折叠、β转角和无规卷曲4 种蛋白质二级结构,分别占50%、14%、24%和12%;分别由3 个酰胺区中C=O、C=C、C—N、—COO-、C—H、N—H的不同振动形式所产生;六配位低自旋的Fe—C—N形成heme-Fe3+。因此,pMetMb为六配位低自旋构象,是结构紧密、性质稳定的球状蛋白质。
单斜晶体;结构域;动态结构信息;光谱特征;猪心肌高铁肌红蛋白
肌红蛋白(myoglobin,Mb)含有卟啉环铁(heme-Fe)化学结构,是心肌和骨骼肌细胞的胞浆呈色蛋白质,也是生鲜肉和肉制品的主要呈色物质[1-4]。它在活体内以3 种化学态(Mb-MbO2-MetMb)的动态平衡,维系畜肉及其肉食品的色泽稳定和理想肉色[5-8]。因此,肌细胞内Mb的主要生物学功能是在低氧分压条件下,传递电子,携带和储备氧气(O2),以红润的肉色展现良好的畜肉品质和心肌功能[1-8]。
Mb或高铁肌红蛋白(metmyoglobin,MetMb)是物种进化过程中一种高度稳定的球状蛋白质,种间同源性很高[3,9-11]。随着近年蛋白质组学的快速发展,人们对于马和人心肌肌红蛋白的分子结构和信息已有了较深入的了解[9-12]。马心肌肌红蛋白(hMb)作为生物标记物,用于临床诊断早期心肌损伤和肉质掺假鉴别等,并取得长足的进步[3,13-14];然而,hMb资源短缺,价格昂贵,难以进一步拓展到肉品品质的技术监控。
本实验是在前期猪心肌高铁肌红蛋白(pig metmyoglobin,pMetMb)分子信息解析基础上,采用光谱学手段,表征pMetMb高级动态结构、功能域和晶体特征,为其作为肉品品质监控等研究的生物标记物提供光谱学理论依据。
1 材料与方法
1.1 材料
猪高铁肌红蛋白(pMetMb),棕红色冻干粉,纯度≥93%,分子质量17 kD,南京师范大学金陵女子学院功能性食品实验室制备[15-16]。
1.2 仪器与设备
JSM-5610LV高分辨率扫描电子显微镜、JFC-1600溅射仪 日本电子公司;CH30RF200光学生物显微镜日本Olympus公司;D/max 2500VL/PC阳极转靶X射线衍射仪 日本理学公司;UVLABRAM HR800激光共焦显微拉曼光谱仪 法国Jobin Yvon公司;NEXUS670傅里叶红外光谱仪 美国Thermo Nicolet公司。
1.3 方法
1.3.1 pMetMb晶体结构解析
于500、1 000、2 000、5 000 倍扫描电子显微镜下,分别观察pMetMb冻干粉末晶体结构的超微特征[17]。pMetMb冻干粉压片后,直接阳极转靶X射线衍射(X-ray single crystal diffractometer,XRD)仪检测和数据库比对。X射线(X-ray)工作条件:管压40 kV、管流200 mA、狭缝宽度DS=SS=1°,布拉格衍射角(2θ)扫描范围3°~85°,设定扫描速率0.12°/min和步进间隔0.02°[18-19]。运用XRD-PDF-2004数据库和Jade5.0(MDI-R99100)计算软件,对pMetMb X射线衍射峰数据进行解析、计算和拟合,使拟合图谱误差R<9%(P≥0.05),解读其晶体高级结构的重要化学基团。
pMetMb晶粒直径按Debye-Scherrer公式(1)计算[20-21]。

式中:dhkl为晶粒直径/nm;λ为入射X射线衍射波长/nm;β为衍射峰半高峰宽;θ为布拉格衍射角/(°)。
pMetMb结晶度按Debye-Scherrer公式(2)计算[21]。

1.3.2 pMetMb结构信息的拉曼和红外光谱指认
用双蒸水(ddH2O)将pMetMb稀释至100 mg/mL,5 μL上样量。
拉曼光谱工作条件:163型氩离子激光光源、激发线波长(λ)514.15 nm、出射功率10 mW、分辨率2 cm-1,重复扫描3 次,由计算机作信号累加平均并绘图输出各样品的拉曼谱图,峰位误差小于±3 cm-1[22-25]。
红外光谱工作条件:KRS-5压片法透射光谱测定法,采用DTGS型KBr探头和4 cm-1分辨率,重复扫描32 次[26]。
运用Microcal Origin 6.0(序列号:MA 01060)软件,对pMetMb拉曼和红外光谱的高级结构解析;运用NGSLabSpec软件,以(1 005±1) cm-1处苯丙氨酸(Phe)特征峰强度为单位1,进行归一化处理。对于酰胺Ⅰ和Ⅲ特征区域采用两点基线校正,用5点Savitsk-Golay函数平滑图谱,做二阶导数和傅里叶去卷积,手动选定并估算各子峰的峰位和半峰宽,采用Gaussian函数进行图谱拟合,从而完全分辨开重叠在一起的不同谱带,进一步确定各子峰和不同二级结构的对应关系后,积分后根据峰面积计算各种二级结构的相对比例。
2 结果与分析
2.1 pMetMb三维晶体结构解析
2.1.1 结晶度和结晶态
由图1可知,将pMetMb冻干粉平铺于载玻片上,置于500~5 000 倍电子显微镜下扫描,可观察到连接成片的晶状体结构;2 000和5 000 倍电子显微镜下,pMetMb呈典型的棱状晶体,初步表明其为结晶态冻干粉。
对pMetMb冻干粉进行阳极转靶X射线衍射,得到其X射线衍射峰图谱。由图2可知,pMetMb产生6 个XRD,图形清晰陡直,X射线的信号强度高,无明显干扰噪音,且基线平稳,表明该冻干粉结晶度高、规整性好。

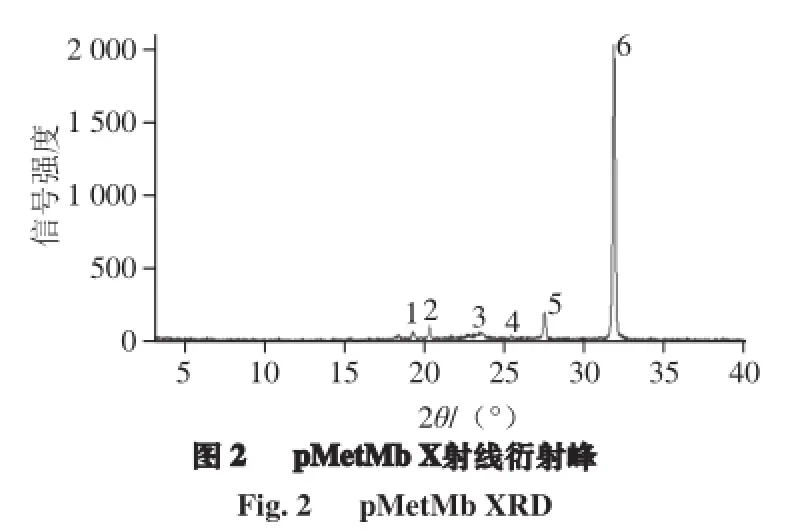
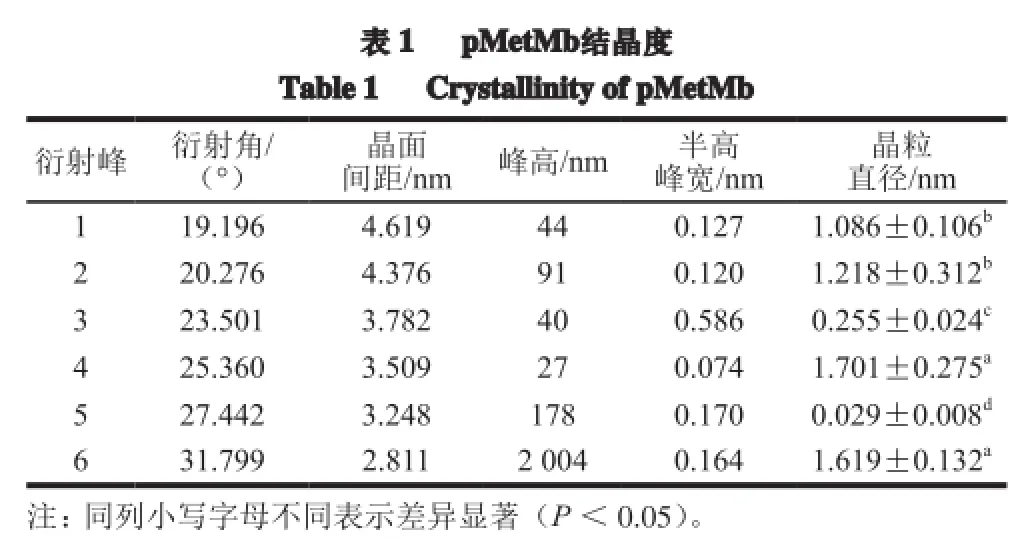
采用Debye-Scherrer公式(1)和公式(2)计算pMetMb晶粒直径和结晶度,其晶粒平均直径(dhkl)为(0.985±0.168)nm,平均结晶度达到(95.60±1.37)%(表1)。通过X射线衍射证明,pMetMb冻干粉具有极高的结晶度,可以进一步分析它的结晶态[18-21]。
在15°~35°布拉格衍射角(2θ)范围内,pMetMb出现6 个尖锐2θ XRD,分别对应19.196 °、20.276 °、23.501 °、25.360 °、27.442 °和31.799 °(简称1~6),它们峰面积比值分别为2.2、4.5、2.0、1.3、8.9和81.1,并以第6 XRD信号最强(图2)。将得到的6 个XRD 2θ等5 个参数输入XRD-PDF-2004数据库,计算pMetMb结晶态。由表2可知,3 个有机物XRD晶胞三轴长均不相等,即a≠b≠c;而且其中氧化钼铵苹果酸水合物(ammonium molybdenum oxide malate hydrate,C8H22Mo4N4O21·H2O)含有水分子(H2O)。由此推论,pMetMb结晶态可能归属于含水单斜晶体结构。

2.1.2 结构中化学信息比对
将pMetMb X射线衍射采集到的6 个XRD信号,计算匹配化合物的品质因子(figure of merit,FOM),并在数据库中与已有高信噪比的化合物进行比对,找到3 个有机化合物和3 个无机高匹配度化合物(表2,图3)。
3 个高匹配度有机化合物分别对应于对硝基苯胺(C6H6N2O2)、对氟苯氧乙酸(C8H7FO3)和氧化钼铵苹果酸水合物(C8H22Mo4N4O21·H2O),它们与pMetMb的FOM值为22.0、22.4和22.6,理论上它们化学结构与pMetMb的十分接近[19-21],因此本研究可用于解读pMetMb化学结构信息。
由表2、图3a可知,该3 个有机化合物具有pMetMb化学结构中所存在的苯环(C6H6)、甲胺基(CH3—NH—)、酰胺基(—CO—NH—)、羧甲基(—CH2COOH)和水分子(H2O)等基团,它们的XRD信号与pMetMb有高度重叠,尤其在pMetMb第6 XRD(31.799 °)处。推测pMetMb在烷基化缩合过程中,可通过这些基团形成肽骨架结构,以及由咪唑基团(C3H4N2)缩合而成卟啉环(heme)结构[27-29]。

3 个高匹配度无机化合物可能来自KFeO2、Fe2SiV和Fe3Si,它们的FOM值分别是14.3、19.9和32.8,三者均为含铁(Fe)化合物。它们在31.799 °处与pMetMb XRD高度重合(表2,图3b)。由此证实pMetMb分子结构中含有Fe配位基团,当与pMetMb中的heme螯合,就有可能形成了heme-Fe的电子传递核心结构域[27-31]。
2.2 pMetMb二级结构及官能团的拉曼光谱指认

由图4可知,300~3 900 cm-1范围内得到pMetMb拉曼光谱,出峰良好,未经平滑处理即可观察到清晰的结构域特征峰。
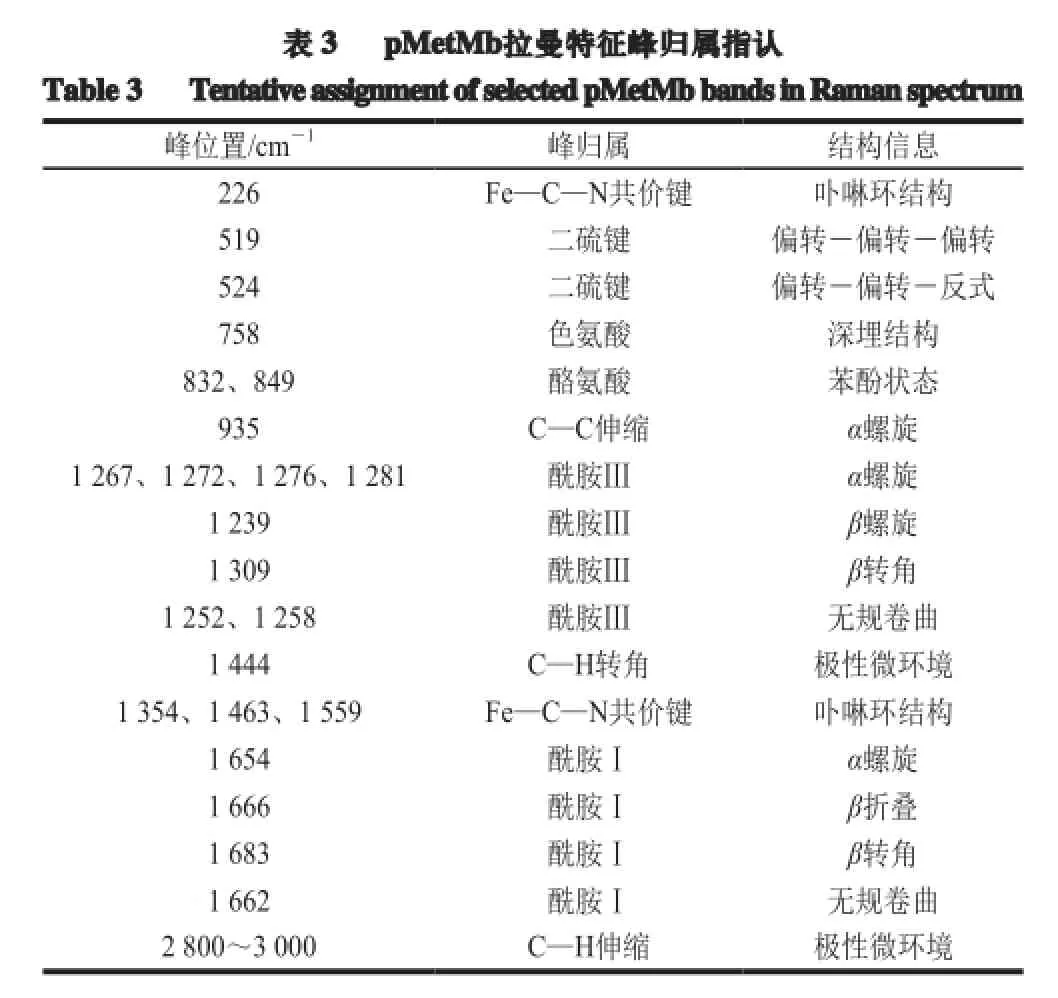
由图4、表3可知,酰胺Ⅰ和酰胺Ⅲ的结构域分别定位于1 640~1 690 cm-1和1 230~1 300 cm-1,前者1 654、1 666、1 682、1 662 cm-1特征峰分别归属α螺旋、β折叠、β转角和无规卷曲结构;后者4 种二级结构特征峰对应于1 267~1 281、1 238、1 304、1 247 cm-1[22-23]。二硫键(S—S)的结构域(官能团)位于507~540 cm-1,其中510 cm-1峰强度最大,为顺式构象,属于天然蛋白质的优势构象;525 cm-1处还呈现一弱峰,为S—S反式构象;推测pMetMb在纯化过程中,S—S部分发生反转,高级结构出现微小改变[22-25]。卟啉环铁(heme-Fe)的结构域(Fe—C—N)出现在高频区的1 354 cm-1(v4),1 463、1 559 cm-1(v3),226 cm-1(v2)。
根据拉曼光谱,pMetMb肽链含有酰胺Ⅰ和酰胺Ⅲ结构域,其中包含多个α螺旋的4 种蛋白质二级结构;除heme-Fe(Fe—C—N)核心基团外,其肽链中还包含色氨酸(Try)、酪氨酸(Trp)和苯丙氨酸(Phe)等芳香族氨基酸结构域,和顺式/反式S—S及C—H等键合结构。
2.3 pMetMb高级结构动态信息的红外光谱指认
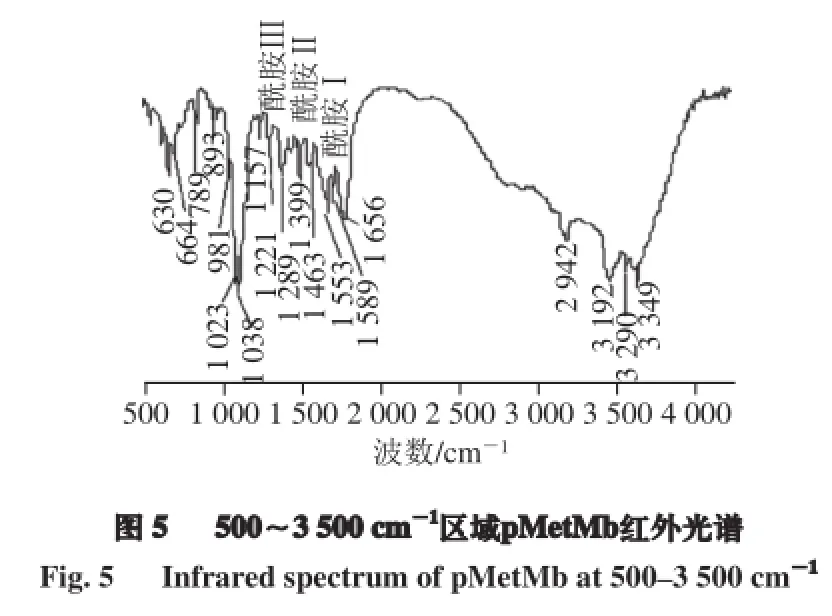
对pMetMb水溶液进行傅里叶红外光谱扫描,在500~4 000 cm-1范围内进一步解读它的动态结构信息,以补充对pMetMb高级结构信息的认识。研究观察到,600~1 700 cm-1和2 900~3 500 cm-1是pMetMb特征峰的主要区域,且与拉曼光谱相互映证。
由图5、表4可知,解析出3 个酰胺结构域,即1 564~1 703 cm-1的酰胺Ⅰ,形成了以C=O和C=C等伸缩振动为主的α螺旋肽骨架结构红外光谱吸收峰,这些主要来自肽链中谷氨酰胺(Gln)、谷氨酸(Glu)、组氨酸(His)、赖氨酸(Lys)、Trp和天冬氨酸(Asp)等氨基酸的键合行为;酰胺Ⅱ位于1 386~1 525 cm-1,跨度较大,呈现多种光谱振动形式,有C=C、C—N、—COO-反式弯曲振动和C—N、C—H、N—H伸缩振动等,它们来自肽链中Lys、Tyr、Trp、脯氨酸(Pro)和His等;1 198~1 274 cm-1区域的酰胺Ⅲ的红外光谱具有单酰胺模型特征,呈现β折叠二级结构的振动光谱,产生了源于Trp、Tyr和His等氨基酸的合并N—H弯曲和C—N伸缩振动,并伴随C=O平面内弯曲和C=C伸缩振动。从而表明pMetMb分子结构至少含有3 个酰胺结构域,通过C=O、C=C伸缩振动或C=C、C—N反式弯曲振动等,从动态红外光谱信息也证实其肽骨架具有了α螺旋和β折叠的二级结构和化学键的氨基酸来源[26]。
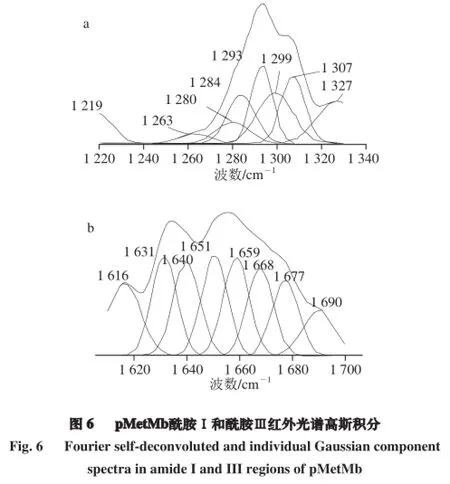
运用Microcal Origin 6.0软件,进一步对pMetMb的1 600~1 700 cm-1酰胺Ⅰ和1 200~1 300 cm-1酰胺Ⅲ特征区红外光谱进行高斯积分和精确定位,计算其峰面积和半峰宽。结果显示,酰胺Ⅰ的1 616、1 631 cm-1,1 640、1 651 cm-1,1 659、1 668~1 690 cm-1等依次对应为β折叠、无规卷曲、α螺旋和β转角结构,其中1 659 cm-1是α螺旋红外光谱振动区;酰胺Ⅲ中的1 219、1 263 cm-1,1 280、1 284 cm-1,1 293、1 299 cm-1,1 307、1 327 cm-1处积分,分别指认为β折叠、无规卷曲、β转角和α螺旋结构,α螺旋位于1 307、1 327 cm-1振动区(图6)。
经NGSLabSpec软件计算和解读(表5),pMetMb 4 种二级结构中,α螺旋、β折叠、β转角和无规卷曲的比例分别占二级结构的50%、14%、24%和12%,因此pMetMb具有α螺旋为主型的球蛋白结构;二级结构数据的标准偏差(standard deviation,SD)分析(SD<0.03)表明,拉曼和红外光谱对pMetMb二级结构的指认和比例分析的可信度高。

3 结 论
扫描电子显微镜下观察发现,pMetMb冻干粉呈现明显的棱状结晶体。经X射线衍射和胞晶计算,它的晶胞三轴长不相等(a≠b≠c)且含有结晶水,可归属于单斜晶体结构;由于dhkl为(0.985±0.168)nm,结晶度达到(95.60±1.37)%。根据它的布拉格衍射角(2θ)等参数计算,将它6 个XRD与晶体数据库同类化合物比对,pMetMb肽链和heme-Fe等关键基团来源均得到映证。
对pMetMb高级结构的拉曼和红外光谱解析,它肽链兼有α螺旋、β折叠、β转角和无规卷曲4 种蛋白质二级结构,分别占50%、14%、24%和12%,归属于α螺旋为主型球蛋白。它的结构动态信息还显示,其具有3 个酰胺区域,即酰胺Ⅰ、Ⅱ和Ⅲ;其C=O、C=C、C—N、—COO-、C—H、N—H的不同振动形式,产生了不同的二级结构;由于它核心区域heme-Fe以Fe—C—N六配位低自旋,从而呈现MetMb构象。
综上所述,本研究的pMetMb球状结构紧密,化学性质稳定,可以作为生物标记物用于肉品品质等研究。
[1] MANCINI R A, HUNT M C. Current research in meat color[J]. Meat Science, 2005, 71(1): 100-121. DOI:10.1016/j.meatsci.2005.03.003.
[2] BEKHIT A E, FAUSTMAN C. Metmyoglobin reducing activity[J]. Meat Science, 2005, 71(3): 407-439. DOI:10.1016/ j.meatsci.2005.04.032.
[3] HENGGEN-COTTA U B, KELM M, RASSAF T. Myoglobin functions in the heart[J]. Free Radical Biology and Medicine, 2014,73(2): 252-259. DOI:10.1016/j.freeradbiomed.2014.05.005.
[4] MIKKELSEN A, JUNCHER D, SKIBSTED L H. Metmyoglobin reductase activity in porcine m. longissimus dorsi muscle[J]. Meat Science, 1999, 51(2): 155-161. DOI:10.1016/S0309-1740(98)00114-4.
[5] 王玮, 汤祥明, 金邦荃. 高铁肌红蛋白含量和高铁肌红蛋白还原酶活性与冷鲜肉肉色稳定性关系的研究[J]. 食品科学, 2008, 29(7):94-97. DOI:10.3321/j.issn:1002-6630.2008.07.016.
[6] QUEVEDO R, VALENCIA E, CUEVAS G, et al. Color changes in the surface of fresh cut meat: a fractal kinetic application[J]. Food Research International, 2013, 54(2): 1430-1436. DOI:10.1016/ j.foodres.2013.10.006.
[7] KING D A, SHACKELFORD S D, WHEELER T L. Relative contributions of animal and muscle effects to variation in beef lean color stability[J]. Journal of Animal Science, 2011, 89(5): 1434-1451. DOI:10.2527/jas.2010-3595.
[8] FAUSTMAN C, SUN Q, MANCINI R, et al. Myoglobin and lipid oxidation interactions: mechanistic bases and control[J]. Meat Science,2010, 86(1): 86-94. DOI:10.1016/j.meatsci.2010.04.025.
[9] JOSEPH P, SUMAN S P, LI S T, et al. Primary structure of turkey myoglobin[J]. Food Chemistry, 2011, 129(1): 175-178. DOI:10.1016/ j.foodchem.2011.04.024.
[10] DOSI R, CARUSONE A, CHAMBERY A, et al. Rapid primary structure determination of myoglobins by a complementary approach based on mass spectrometry and Edman degradation[J]. Food Chemistry, 2012, 133(4): 1646-1652. DOI:10.1016/ j.foodchem.2012.02.042.
[11] JOSEPH P, SUMAN S P, LI S T, et al. Amino acid sequence of myoglobin from white-tailed deer (Odocoileus virginianus)[J]. Meat Science, 2012, 92(2): 160-163. DOI:10.1016/j.meatsci.2012.04.012.
[12] BHATTACHERJEE A, CHAKRABORTI A S. Fructose-induced modifications of myoglobin: change of structure from met (Fe3+) to oxy(Fe2+) form[J]. International Journal of Biological Macromolecules,2011, 48(1): 202-209. DOI:10.1016/j.ijbiomac.2010.11.003.
[13] di GIUSEPPE A M A, GIARRETTA N, LIPPERT M, et al. An improved UPLC method for the detection of undeclared horse meat addition by using myoglobin as molecular marker[J]. Food Chemistry,2015, 169: 241-245. DOI:10.1016/j.foodchem.2014.07.126.
[14] GIARETTA N, di GIUSEPPE A M A, LIPPERT M, et al. Myoglobin as marker in meat adulteration: a UPLC method for determining the presence of pork meat in raw beef burger[J]. Food Chemistry, 2013,141(3): 1814-1820. DOI:10.1016/j.foodchem.2013.04.124.
[15] 汤祥明, 金邦荃, 刘兴余. 猪心肌高铁肌红蛋白的提取和纯化[J]. 畜牧与兽医, 2006, 38(7): 34-36.
[16] 金邦荃, 汤祥明, 刘兴余. 从心肌中提取纯化高铁肌红蛋白的方法:200610037909.X[P]. 2008-01-25.
[17] 王大能, 陈勇, 隋森芳. 电子显微学在结构生物学研究中的新进展[J]. 电子显微学报, 2003, 22(5): 449-456. DOI:10.3969/ j.issn.1000-6281.2003.05.019.
[18] DIAZ-BUXO J A, GOTLOIB L. Agents that modulate peritoneal membrane structure and function[J]. Peritoneal Dialysis International:Journal of the International Society for Peritoneal Dialysis, 2007,27(1): 16-30.
[19] PANTAZATOS D, KIM J S, KOLCK H E, et al. Rapid refinement of crystallographic protein construct definition employing enhanced hydrogen/deuterium exchange MS[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(3):751-756. DOI:10.1073/pnas.030724101.
[20] MILATHIANAKI D, BOUTE S, WILLIAMS G J, et al. Femtosecond visualization of lattice dynamics in shock-compressed matter[J]. Science, 2013, 342: 220-223. DOI:10.1126/science.1239566.
[21] VEBERG A, SORHEIM O, MOAN J, et al. Measurement of lipid oxidation and porphyrins in high oxygen modified atmosphere and vacuum-packed minced turkey and pork meat by fluorescence spectra and images[J]. Meat Science, 2006, 73(3): 511-520. DOI:10.1016/ j.meatsci.2006.02.001.
[22] ELLEPOLA S W, CHOI S M, PHILLIPS D L, et al. Raman spectroscopic study of rice globulin[J]. Journal of Cereal Science,2006, 43(1): 85-93. DOI:10.1016/j.jcs.2005.06.006.
[23] WONG H W, PHILLIPS D L, MA C Y. Raman spectroscopic study of amidated food proteins[J]. Food Chemistry, 2007, 105(2): 784-792. DOI:10.1016/j.foodchem.2007.01.040.
[24] HERRERO A M. Raman spectroscopy a promising technique for quality assessment of meat and fish: a review[J]. Food Chemistry,2008, 107(4): 1642-1651. DOI:10.1016/j.foodchem.2007.10.014.
[25] WONG H W, CHOI S M, PHILLIPS D L, et al. Raman spectroscopic study of deamidated food proteins[J]. Food Chemistry, 2009, 113(2):363-370. DOI:10.1016/j.foodchem.2008.09.027.
[26] 戈志成, 张燕萍. 对改性小麦面筋蛋白二级结构的红外光谱研究[J]. 中国粮油学报, 2006, 21(3): 36-38. DOI:10.3321/ j.issn:1003-0174.2006.03.009.
[27] 舒占永, 毕汝昌. 蛋白质晶体的优化生长[J]. 生物化学与生物物理进展, 1997, 24(5): 396-401.
[28] WAGNER A, DIEZ J, SCHULZE-BRIESE C, et al. Crystal structure of ultralente-a microcrystalline insulin suspension[J]. Proteins:Structure, Function, and Bioinformatics, 2009, 74(4): 1018-1027. DOI:10.1002/prot.22213.
[29] MATYUSHOV D V. Nanosecond stokes shift dynamics, dynamical transition, and gigantic reorganization energy of hydrated heme proteins[J]. Journal of Physical Chemistry B, 2011, 115(36): 10715-10724. DOI:10.1021/jp200409z.
[30] LIU J, ZHOU Q G, CHENG Y X, et al. White electroluminescence from a single-polymer system with simultaneous two-color emission:polyfluorene as the blue host and a 2,1,3-benzothiadiazole derivative as the orange dopant an the main chain[J]. Advanced Functional Materials, 2006, 16(7): 957-965. DOI:10.1002/adfm.200500761.
[31] DOLMAN D E, FUKUMURA D, JAIN R K. Photodynamic therapy for cancer[J]. Nature Reviews Cancer, 2003, 3(5): 380-387. DOI:10.1038/nrc1071.
Spectral Assignment of Dynamic Structure Information of Porcine Myocardial Metmyoglobin (pMetMb)
LI Yadong1, WU Mingcao1, TANG Yu1, JIN Bangquan1,*, HUANG Heyong2, LI Gang2, FENG Yuying2
(1. Ginling College, Nanjing Normal University, Nanjing 210097, China;2. Center of Analysis and Testing, Nanjing Normal University, Nanjing 210097, China)
The dynamic molecular structures and domains of porcine myocardial metmyoglobin (pMetMb) were studied and analyzed by scanning electron microscopy, X-ray diffraction, Raman and Infrared spectroscopy with matched databases and softwares. Obviously prismatic crystalline structures were observed on the surface of lyophilized pMetMb powder. The crystallinity of pMetMb was (95.60 ± 1.37)%, and it was highly crystalline and monoclinic powder because the lengths of its three-dimensional unit cell were inequality (a ≠ b ≠ c). By comparison with crystal databases the source of heme-Fe domain in pMetMb was identified. The Raman and Infrared spectra proved that the peptide chain of pMetMb contained 50% α-helix,14% β-fold, 24% β-turn and 12% random coil, which came from the different shake forms C=O, C=C, C-N, -COO-,C-H and N-H in the amide I, II and III regions. The heme-Fe domain in pMetMb formed by imidazole group (C3H4N2)binding with Fe3+. So it belonged to globin with compact structure and stable properties.
monoclinic crystal; structural domain; dynamic structural information; spectral characteristics; porcine myocardial metmyoglobin (pMetMb)
10.7506/spkx1002-6630-201609021
TS251
A
1002-6630(2016)09-0111-06
李亚东, 吴名草, 汤宇, 等. 猪心肌高铁肌红蛋白高级结构动态信息的光谱指认[J]. 食品科学, 2016, 37(9): 111-116. DOI:10.7506/spkx1002-6630-201609021. http://www.spkx.net.cn
LI Yadong, WU Mingcao, TANG Yu, et al. Spectral assignment of dynamic structure information of porcine myocardial metmyoglobin (pMetMb)[J]. Food Science, 2016, 37(9): 111-116. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201609021. http://www.spkx.net.cn
2015-07-12
江苏省六大人才高峰项目(184080H10202);江苏省农业科技自主创新资金项目(CX(11)1301)
李亚东(1989—),男,硕士研究生,研究方向为肉品科学。E-mail:ns_liyadong@163.com
*通信作者:金邦荃(1956—),女,教授,博士,研究方向为食品科学。E-mail:jinbangquan@njnu.edu.cn

