牦牛肉宰后成熟过程中热休克蛋白27表达量与食用品质的相关性分析
李 婕,罗天林,师希雄,*,韩 玲,*,余群力,马君义
(1.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070;2.青海百德投资发展有限公司,青海 西宁 810007)
牦牛肉宰后成熟过程中热休克蛋白27表达量与食用品质的相关性分析
李 婕1,罗天林1,师希雄1,*,韩 玲1,*,余群力1,马君义2
(1.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070;2.青海百德投资发展有限公司,青海 西宁 810007)
为研究牦牛肉宰后成熟过程中热休克蛋白27(heat shock protein 27,Hsp27)的变化及其与食用品质的相关性,测定了5 头青海大通母牦牛背最长肌肉成熟过程中色度L*、a*、b*值、pH值、剪切力、蒸煮损失以及Hsp27的表达量,进一步研究了Hsp27与肉品质的相关性。结果表明:Hsp27表达量总体呈降低的趋势,宰后0~48 h Hsp27表达量显著降低(P<0.05),72~120 h Hsp27表达量显著升高,至168 h又显著降低(P<0.05);Hsp27表达量与a*值成显著正相关(P<0.05),与b*值成极显著负相关(P<0.01),与pH值成极显著正相关(P<0.01)。证明Hsp27与牦牛肉食用品质之间存在相关性。
牦牛肉;宰后成熟;热休克蛋白27;食用品质;相关性分析
青海大通牦牛是世界上第一个培育的牦牛品种,其肌肉大理石纹分布广,风味和肉色较好,但嫩度较差[1],牛肉嫩度的改善一直是肉品科学工作者的研究热点。热休克蛋白(heat shock proteins,HSPs)是指机体受到外界环境刺激时诱导发生应激反应而合成的几族蛋白质[2]。Hsp27是小分子热休克蛋白(sHSPs)中的一种,是机体中细胞维持和修复的重要成分,具有可充当分子伴侣、调节肌动蛋白的聚合,并能够调节中间体细丝间的相互作用,还可抑制应激诱导的细胞凋亡,维持肌原纤维结构的稳定[3-4]等生物学功能。动物宰后放血缺氧的状态能够刺激Hsp27的表达,但目前Hsp27与牦牛肉食用品质之间的相关性研究还未见报道。
Lomiwes等[5]用免疫沉淀法研究安格斯小母牛背最长肌中Hsp27等几种蛋白与μ-钙蛋白酶之间的关系时发现,Hsp27在肉中表达量的下降有利于肌动蛋白与肌球蛋白的水解,导致了肉嫩度增加;且Hsp27在较嫩的肉样中含量较低。Bernard等[6]研究表明,Hsp27在夏洛莱牛胸部肌肉中表达量的下调能够改善肉的嫩度、多汁性、风味。然而Morzel等[7]报道,Hsp27可维持肌原纤维的稳定性,其表达量与牛肉的韧性成负相关。张淼[8]研究发现运输应激可导致皮特兰与二花脸杂交二代猪肉的剪切力值和a*值随时间总体呈现下降的趋势,L*值和b*值显著升高,在此过程中Hsp27的表达量与对照组相比呈下降趋势,即Hsp27与猪肉韧性、a*值成正相关,而与L*值和b*值成负相关。总之,关于Hsp27对肉品质,尤其是对嫩度影响的报道不一致。
本实验以5 头2~4 岁青海大通母牦牛背最长肌肉为研究对象,对其宰后成熟过程中0、24、48、72、120、168、192 h的色度、pH值、剪切力、蒸煮损失以及Hsp27表达量进行测定,分析了大通牦牛肉的食用品质,同时,研究Hsp27表达量的变化及其与食用品质的关系,以期为Hsp27对牦牛肉食用品质影响的机理研究提供理论依据。
1 材料与方法
1.1 材料与试剂
参考国外对动物福利的要求,屠宰操作严格按照国内标准化方法,屠宰时无应激反应,保证宰前牦牛的健康状况良好,宰后热应激波动幅度较小。选取年龄2~4 岁、自然放养、发育正常、健康无病、体质量相近的5 头青海大通母牦牛背最长肌肉作为实验材料。
RIPA组织/细胞裂解液、苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF) 北京索莱宝科技有限公司;牛Hsp27酶联免疫吸附实验(enzyme linked immunosorbent assay,ELISA)试剂盒 美国Abnova公司;DC蛋白测定试剂盒 美国Bio-Rad公司。
1.2 仪器与设备
Testo 205便携式pH计 德图仪表有限公司;CR-10型色差仪 日本柯尼卡美能达公司;C-LM4型数显式肌肉嫩度仪 东北农业大学工程学院;TGL-16M高速台式冷冻离心机 长沙湘仪有限公司;FA2004B电子天平上海佑科仪器有限公司;HHS(数显式)型电热恒温水浴锅 上海博讯实业有限公司医疗设备厂;iMark全自动酶标仪 美国Bio-Rad公司。
1.3 实验设计
将选取的牦牛背最长肌肉切割成150 g左右的肉块,共7 份,用聚氯乙烯保鲜袋包装后在0~4 ℃条件下成熟0、24、48、72、120、168、192 h,在不同的时间点分别取样,一部分样品用于测定肉品质,另一部分保存于-80 ℃冰箱中用于Hsp27表达量的测定。
1.4 实验方法
1.4.1 pH值测定
采用Testo 205便携式pH计,用蒸馏水冲洗肉样上的血渍,并用干净滤纸吸干表面残留水分,随机选择3 个不同部位的肉样进行pH值测定,取其平均值。
1.4.2 色度测定
采用CR-10色差仪进行测定。用蒸馏水冲洗肉样上的血渍并用干净滤纸吸干表面残留水分进行亮度(L*)值、红度(a*)值、黄度(b*)值测定,每个肉样选取3 处测定求其平均值。
1.4.3 蒸煮损失测定
选取体积不小于6 cm×3 cm×3 cm的肉样,修整去除肉块表面的脂肪和结缔组织,称质量(m1)放入80 ℃恒温水浴锅中加热,用热电耦温度计检测到肉样中心温度至75 ℃时取出冷却至中心温度达室温,用滤纸吸去肉样表面多余水分称质量(m2)。蒸煮损失计算公式如下。
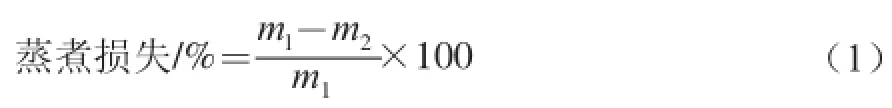
1.4.4 剪切力测定
参照田甲春等[9]的方法,将测定蒸煮损失后的肉样沿肌纤维方向用直径1.27 cm采样器平行取3个肉柱,然后用C-LM4型数显式肌肉嫩度仪V型活动剪切刀架测定其剪切力,3 次测定取其平均值。
1.4.5 Hsp27表达量的测定
1.4.5.1 蛋白样品的制备
参考Salokhe等[10]的方法并改进,将保存于-80 ℃冰箱中的肉样组织取出,于4 ℃恒温恒湿箱解冻至半冻状态,除去表皮脂肪和筋膜,切成小块。准确称取150 mg样品置于研钵中,加入1.5 mL RIPA组织裂解液,15 μL PMSF充分研磨,将研磨后的组织液转移到玻璃匀浆器中匀浆1 min,以充分裂解组织细胞,将匀浆液移至EP管中离心(12 000×g,4 ℃,20 min),离心完毕后将上清液移至另一EP管中,参考Lowry等[11]的方法,取适量上清液采用DC蛋白测定试剂盒测定蛋白质量浓度,剩余上清液于-80 ℃保存备用。
1.4.5.2 Hsp27的定量测定
标准曲线的绘制:在Excel工作表中,以Hsp27标准品质量浓度为横坐标,光密度(OD450nm)值为纵坐标绘制出标准曲线,得到回归方程为y=0.145 9x+0.071 3(R2=0.997 6)。
参考Yu Jimian等[12]的方法采用ELISA分析法检测Hsp27表达量。将提前保存于4 ℃冰箱中的试剂盒取出,室温下放置30 min后,对Hsp27进行ELISA检测。用酶标仪测定OD450nm值,代入回归方程计算样品质量浓度。
Hsp27的表达量用下面公式进行标准化。

1.5 数据分析
用Microsoft Office Excel 2013软件绘制折线图,并用IBM SPSS Statistics 19.0统计分析软件进行方差分析和相关性分析,用Duncan's法进行多重比较。
2 结果与分析
2.1 牦牛肉成熟过程中pH值的变化
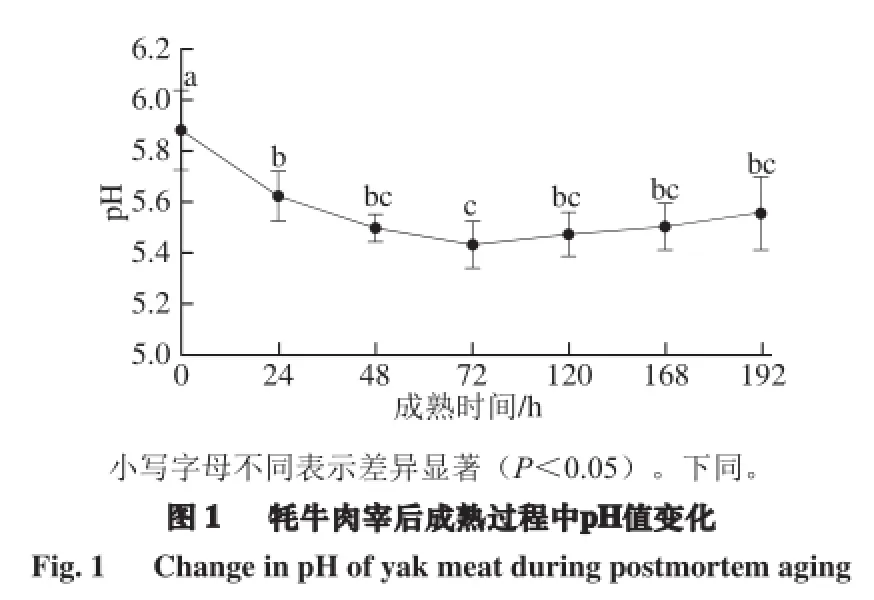
pH值反映机体生成的酸性物质(主要是乳酸)含量。如图1所示,随着成熟时间的延长,宰后初期0~24 h牦牛肉的pH值显著降低,可能会影响肉的其他品质,因此,宰后初期肉的pH值可用来判断应激并预测肉品质[13],72 h后有缓慢回升趋势。原因可能是刚屠宰后糖原被分解产生大量乳酸使得pH值下降较快,当pH值降低到一定程度后,H+浓度大幅度升高使得与糖酵解有关的酶被钝化,随着时间延长,糖原含量逐渐降低,酵解速率和程度逐渐减小,pH值逐渐回升[9]。
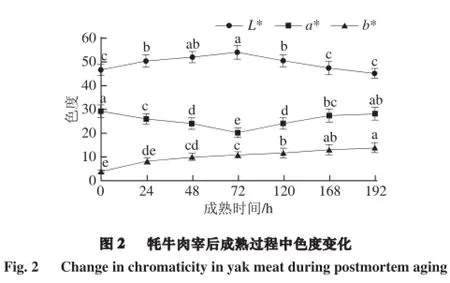
2.2 牦牛肉成熟过程中色度的变化
由图2可知,宰后成熟过程中牦牛肉L*、a*及b*值均有一定的变化。L*值呈先升高后降低趋势,72 h时达到最大值。宰后成熟过程中,肌肉内部水分向外渗出,堆积在肉块表面,从而增强了光的反射,导致L*值增加。a*值在整个成熟期间呈先降低后增加趋势,72 h时达到最小值。这与田甲春[9]对牦牛肉宰后成熟机理与肉用品质研究的结果相似。a*值的变化与肌红蛋白的含量和化学状态密切相关,宰后成熟过程肉长时间和空气接触,肌红蛋白逐渐被氧化成高铁肌红蛋白,a*值降低。b*值持续上升可能是肌肉与氧气充分接触后,肌肉中的脂肪被氧化所致[14]。
2.3 牦牛肉成熟过程中蒸煮损失的变化
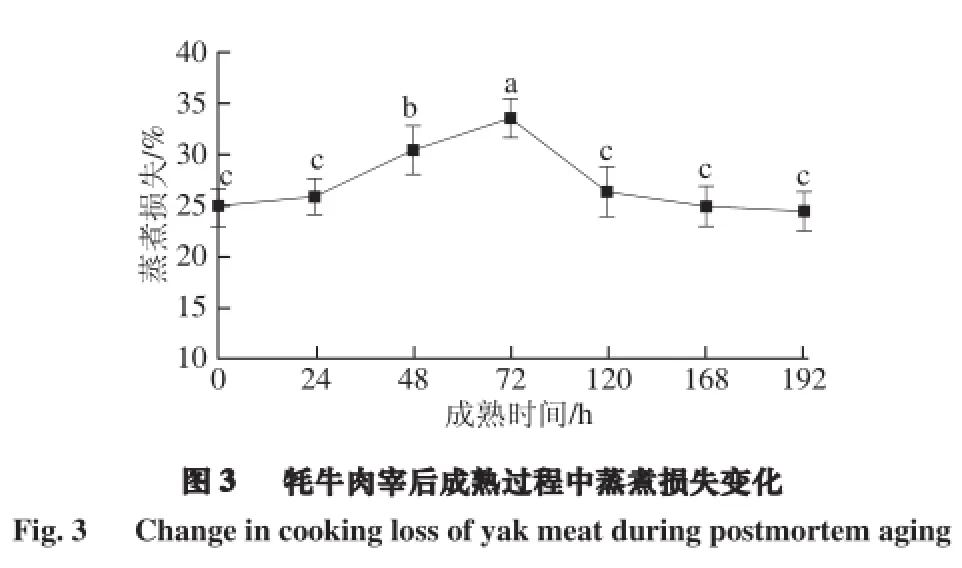
由图3可知,牦牛肉宰后成熟过程中蒸煮损失呈现先显著增加后降低的趋势,72 h达最大值。蒸煮损失可以反映肌肉的持水力,pH值是影响持水力的关键因素之一。肉的pH值决定蛋白质所带电荷数的多少,0~72 h,pH值显著下降接近蛋白质的等电点,蛋白质表面所带电荷减少,对水的吸附能力也就减弱,同时蛋白质分子间静电斥力越小,其网状结构皱缩,分子间隙变小,持水力愈差,蒸煮损失随之增大[15]。
2.4 牦牛肉成熟过程中剪切力的变化

肉的嫩度是消费者选择产品的重要品质指标之一,而剪切力值则是反映肉嫩度的指标。由图4可知,剪切力值呈先显著增大后减小的趋势。肉在成熟初期,肌肉中的重要蛋白质如肌球蛋白、肌动蛋白等达到等电点;同时,肌凝蛋白凝固、肌纤维硬化,肌肉进入僵直阶段,在极限pH值时肉嫩度最差。随着成熟过程的进行,ATP含量急剧下降和乳酸浓度的增大,使肌质网机能被破坏,Ca2+从网内释放出,引起肌浆中Ca2+浓度增高,高浓度Ca2+长时间作用于Z线,使Z线蛋白质变性而脆弱,会因冲击和牵引而发生断裂;同时,钙激活中性蛋白酶(Ca-activated sarcoplasmic factor,CASF)被激活,作用于Z线而促进了Z线的断裂。肌原纤维断裂使肉变得柔嫩多汁[15]。
2.5 Hsp27表达量的变化

由图5可知,随着牦牛肉成熟过程的进行,Hsp27表达量在48 h内显著下降(P<0.05),至120 h时有短暂的显著回升趋势,之后又显著降低(P<0.05),168 h后下降趋势缓慢。Lomiwes等[16]研究发现,牛背最长肌肉屠宰后置于-1.5 ℃成熟,Hsp27质量浓度呈总体下降趋势,在第7~14天显著增大,随后的第14~28天表达量显著降低。这与本实验中的变化趋势基本一致。原因可能是,一方面,宰后0~48 h,外界氧气和营养供应的终止导致细胞产生不可避免的凋亡现象[17]。Hsp27即刻对细胞凋亡产生应激反应,以维持细胞内平衡和细胞稳态。Hsp27作为分子伴侣,通过结合受损的以及错误折叠的蛋白质来保护细胞内蛋白防止不可逆损伤或聚集[18],最终导致组织中Hsp27质量浓度下降。另一方面,蛋白质组学研究认为,宰前应激和宰后因素导致Hsp27在应激牛肉宰后过程中呈正调节[19],宰后供能不足和糖原的大量消耗,引起牛肉pH值下降[9],导致Hsp27因接近其等电点而沉淀,变得不可溶[20]。随后,牛肉pH值逐渐回升,Hsp27的溶解抑制得以解除,在72~120 h过程中出现了短暂的显著回升趋势(P<0.05)。
2.6 HSP27表达量与肉品质的相关性分析
由表1可知,在成熟过程中,Hsp27表达量与牦牛肉L*值、剪切力值和蒸煮损失成负相关,与a*值成显著正相关(P<0.05),与b*值成极显著负相关(P<0.01),与pH值成极显著正相关(P<0.01)。Hsp27具有维持肌原纤维蛋白稳定,保护肌动蛋白细丝、肌间线蛋白的功能,Hsp27表达的下调增加了肌动蛋白的降解,肌肉中肌原纤维完整性的衰减和其内部Z线和I带连接处的破坏,进而导致肌原纤维超微结构发生变化,肉嫩度增大[5]。同时,细胞凋亡与细胞缩水和失水密切相关,HSPs因其对细胞凋亡和细胞膜的调控功能,对保水性产生一定影响[21]。
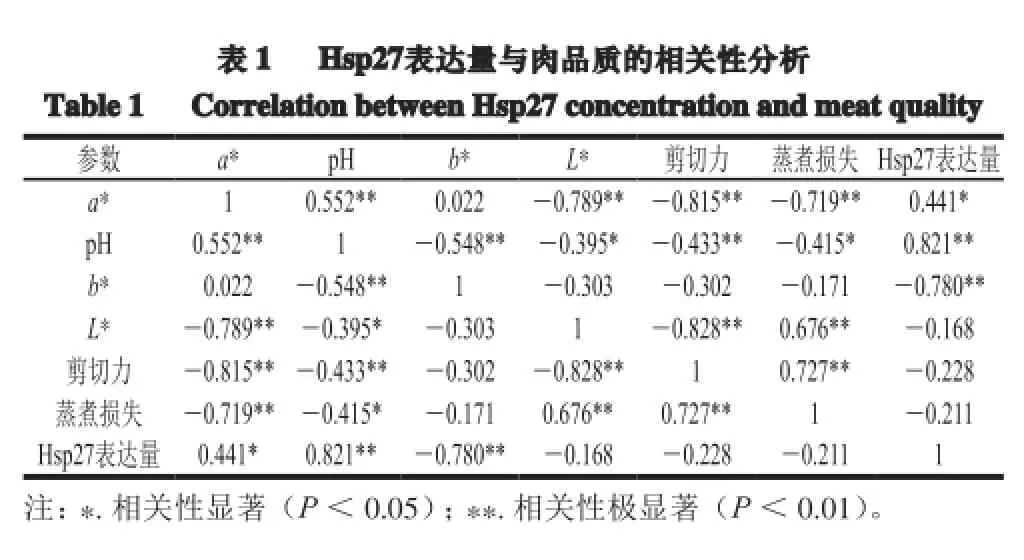
Minos等[22]用双向电泳和质谱来确定与剪切力值相关的几种蛋白质的表达时指出,印度牛属内诺尔牛Hsp27的表达量与肉的嫩度成正相关。然而,Balan等[23]研究表明,小公牛背最长肌中Hsp27表达量与肉嫩度成负相关,是因为Hsp27降解而失去保护肌原纤维蛋白、肌间线蛋白等免受不可逆降解的能力,结果是蛋白水解酶可以进一步降解肌原纤维蛋白,肉嫩度增大;并指出Hsp27降解程度可用来反映肌原纤维蛋白降解程度。本实验中Hsp27与剪切力成负相关,与Minos[22]研究结果一致,但数据分析表明,相关性差异并不显著(P>0.05),可能是由动物种类差异造成,也可能是饲养环境等差异所引起。Kim等[24]用二维电泳和光谱测定法研究韩国本地牛时发现,Hsp27质量浓度与品质较差的牛背最长肌肉L*、a*、b*值等均成负相关。本实验结果显示Hsp27与L*值成负相关,与a*值成显著正相关(P<0.05),与b*值成极显著负相关(P<0.01),这与张淼[8]研究结果基本一致,原因是宰前运输不仅加剧了ATP的消耗,肌肉中能量水平的降低激活了AMP蛋白激酶,使肉产生肌肉苍白、质地松软、表面肉汁渗出(pale, soft, exudative,PSE)特征。Hsp27与pH值成极显著正相关(P<0.01),与其他研究基本一致[16,23,25],主要是因为宰后外界环境变化引起的多种因素包括动物营养、气候和季节、运输和心理应激,均可能对肌肉中糖原含量产生一定影响。热应激、氧化应激、细菌感染和供能受限都会导致骨骼肌中pH值变得不正常,同时能刺激热休克蛋白的表达[25]。
3 结 论
青海大通牦牛背最长肌肉宰后成熟过程中,放血缺氧条件刺激了Hsp27的表达,ELISA方法检测到Hsp27表达量在最初的0~48 h显著下降(P<0.05),72~120 h显著回升之后,至168 h呈显著降低趋势(P<0.05),168 h后下降趋势缓慢。相关性分析表明:Hsp27的表达量与a*值成显著正相关(P<0.05),与b*值成极显著负相关(P<0.01),与pH值成极显著正相关(P<0.01)。
[1] 张永辉. 大通牦牛肉质特性研究[D]. 兰州: 甘肃农业大学, 2009.
[2] 蒲力群, 王逢会, 霍满鹏, 等. 热休克蛋白的研究进展[J]. 延安大学学报(自然科学版), 2008, 27(1): 72-75. DOI:10.3969/j.issn.1004-602X.2008.01.024.
[3] LOMIWES D, FAROUK M M, WIKLUND E, et al. Small heat shock proteins and their role in meat tenderness: a review[J]. Meat Science,2014, 96(1): 26-40. DOI:10.1016/j.meatsci.2013.06.008.
[4] 王万银, 钱令嘉. HSP27研究现状[J]. 国外医学(生理、病理科学与临床分册), 2001, 21(6): 467-469. DOI:10.3969/ j.issn.1673-2588.2001.06.018.
[5] LOMIWES D, HURST S M, DOBBIE P, et al. The protection of bovine skeletal myofibrils from proteolytic damage post mortem by small heat shock proteins[J]. Meat Science, 2014, 97(4): 548-557. DOI:10.1016/j.meatsci.2014.03.016.
[6] BERNARD C, CASSAR-MALEK I, LE C M, et al. New indicators of beef sensory quality revealed by expression of specific genes[J]. Journal of Agricultural and Food Chemistry, 2007, 55(13): 5229-5237. DOI:10.1021/jf063372l.
[7] MORZEL M, TERLOUW C, CHAMBON C, et al. Muscle proteome and meat eating qualities of longissimus thoracis of “Blonde d'Aquitaine” young bulls: a central role of HSP27 isoforms[J]. Meat Science, 2008, 78(3): 297-304. DOI:10.1016/j.meatsci.2007.06.016.
[8] 张淼. 应激过程中组织和细胞内HSPs表达与应激性损伤机理研究[D].南京: 南京农业大学, 2011.
[9] 田甲春, 韩玲, 刘昕, 等. 牦牛肉宰后成熟机理与肉用品质研究[J]. 农业机械学报, 2012, 43(12): 146-150. DOI:10.6041/ j.issn.1000-1298.2012.12.027.
[10] SALOKHE S, SARKAR A, KULKARNI A, et al. Flufenoxuron, an acylurea insect growth regulator, alters development of Tribolium castaneum (Herbst) (Coleoptera: Tenebrionidae) by modulating levels of chitin, soluble protein content, and HSP70 and p34cdc2in the larval tissues[J]. Pesticide Biochemistry and Physiology, 2006, 85(2): 84-90. DOI:10.1016/j.pestbp.2005.10.006.
[11] LOWRY O H, ROSEBROUGH N J, FARR A L, et al. Protein measurement with the Folin phenol reagent[J]. Journal of Biological Chemistry, 1951, 193(1): 265-275.
[12] YU Jimian, TANG Shu, BAO Endong, et al. The effect of transportation on the expression of heat shock proteins and meat quality of M. longissimus dorsi in pigs[J]. Meat Science, 2009, 83(3):474-478. DOI:10.1016/j.meatsci.2009.06.028.
[13] LINDAHL G, HENCKEL P, KARLSSON A H, et al. Significance of early post mortem temperature and pH decline on colour characteristics of pork loin from different crossbreeds[J]. Meat Science, 2006, 72(4):613-623. DOI:10.1016/j.meatsci.2005.09.014.
[14] 余小领, 李学斌, 陈会. 猪肉色泽和保水性的相关性研究[J]. 食品科学, 2009, 30(23): 44-46. DOI:10.3321/j.issn:1002-6630.2009.23.008.
[15] 周光宏. 畜产品加工学[M]. 北京: 中国农业出版社, 2007: 59-71.
[16] LOMIWES D, FAROUK M M, FROST D A, et al. Small heat shock proteins and toughness in intermediate pHubeef[J]. Meat Science,2013, 95(3): 472-479. DOI:10.1016/j.meatsci.2013.05.022.
[17] OUALI A, HERRERA-MENDEZ C H, COULIS G, et al. Revisiting the conversion of muscle into meat and the underlying mechanisms[J]. Meat Science, 2006, 74(1): 44-58. DOI:10.1016/j.meatsci.2006.05.010.
[18] SUN Yu, THOMAS H M. The small heat shock proteins and their role in human disease[J]. FEBS Journal, 2005, 272(11): 2613-2627. DOI:10.1111/j.1742-4658.2005.04708.x.
[19] BOULEY J, CHAMBON C, PICARD B. Mapping of bovine skeletal muscle proteins using two-dimensional gel electrophoresis and mass spectrometry[J]. Proteomics, 2004, 4(6): 1811-1824. DOI:10.1002/ pmic.200300688.
[20] PULFORD D J, FRAGA V S, FROST D F, et al. The intracellular distribution of small heat shock proteins in post-mortem beef is determined by ultimate pH[J]. Meat Science, 2008, 79(4): 623-630. DOI:10.1016/j.meatsci.2007.10.027.
[21] LUCA A D, MULLEN A M, GIULIANO E, et al. Centrifugal drip is an accessible source for protein indicators of pork ageing and water-holding capacity[J]. Meat Science, 2011, 88(2): 261-270. DOI:10.1016/j.meatsci.2010.12.033.
[22] MINOS E C, GUSTAVO G, MIRELE D P. Heat shock and structural proteins associated with meat tenderness in Nellore beef cattle,a Bosindicus breed[J]. Meat Science, 2014, 96(3): 1318-1324. DOI:10.1016/j.meatsci.2013.11.014.
[23] BALAN P, YUAN H, BRAD K, et al. Small heat shock protein degradation could be an indicator of the extent of myofibrillar protein degradation[J]. Meat Science, 2014, 97(2): 220-236. DOI:10.1016/ j.meatsci.2014.01.019.
[24] KIM N K, CHO S, LEE S H, et al. Proteins in longissimus muscle of Korean native cattle and their relationship to meat quality[J]. Meat Science, 2008, 80(4): 1068-1073. DOI:10.1016/j.meatsci.2008.04.027.
[25] CARA J B, ALURU N, MOYANO F J, et al. Food-deprivation induces HSP70 and HSP90 protein expression in larval gilthead sea bream and rainbow trout[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2005, 142(4): 426-431. DOI:10.1016/j.cbpb.2005.09.005.
Correlation Analysis between Heat Shock Protein 27 Expression and Eating Quality during Postmortem Aging of Yak Meat
LI Jie1, LUO Tianlin1, SHI Xixiong1,*, HAN Ling1,*, YU Qunli1, MA Junyi2
(1. College of Food Science and Engineering, Gansu Agricultural University, Lanzhou 730070, China;2. Qinghai Baide Investment Co. Ltd., Xining 810007, China)
The objective of this study was to evaluate the relationship between the expression of heat shock protein 27 (Hsp27)and eating quality of yak meat during postmortem aging. Loins (M. longissimus dorsi) from female Datong yak in Qinghai were analyzed for changes in chromaticity, pH, shear force, cooking loss and Hsp27 concentration during postmortem aging, and the relationship between Hsp27 and eating quality was determined. The results showed that Hsp27 concentration generally tended to decrease during postmortem aging with a significant reduction observed during the first 48 h postmortem(P < 0.05), followed by an increase from 72 to 120 h at first and then a significant decrease until 168 h at last (P < 0.05). Statistical analysis indicated that Hsp27 level had a significantly negative correlation with b* value (P < 0.01), while it was significantly positively correlated with a* value (P < 0.05) and pH (P < 0.01), respectively. In a word, these results suggested that Hsp27 and yak meat eating quality are highly correlated.
yak meat; postmortem aging; heat shock protein 27 (Hsp27); eating quality; correlation analysis
10.7506/spkx1002-6630-201609004
TS251.1
A
1002-6630(2016)09-0018-05
李婕, 罗天林, 师希雄, 等. 牦牛肉宰后成熟过程中热休克蛋白27表达量与食用品质的相关性分析[J]. 食品科学, 2016,37(9): 18-22. DOI:10.7506/spkx1002-6630-201609004. http://www.spkx.net.cn
LI Jie, LUO Tianlin, SHI Xixiong, et al. Correlation analysis between heat shock protein 27 expression and eating quality during postmortem aging of yak meat[J]. Food Science, 2016, 37(9): 18-22. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201609004. http://www.spkx.net.cn
2015-06-28
国家自然科学基金地区科学基金项目(31460433);甘肃省高等学校科研项目(2014B-047);国家现代农业(肉牛牦牛)产业技术体系建设专项(CARS-38);甘肃省自然科学基金项目(1308RJ2A268)
李婕(1991—),女,硕士研究生,研究方向为食品工程。E-mail:ljgsau@163.com
*通信作者:师希雄(1977—),男,讲师,博士,研究方向为畜产品加工。E-mail:sxix77@163.com韩玲(1963—),女,教授,博士,研究方向为畜产品加工及贮藏。E-mail:hanl@gsau.edu.cn

