双孢菇远红外干燥过程中内部水分的变化规律
刘宗博,张钟元,李大婧,*,李德海,江 宁,刘春泉
(1.东北林业大学林学院,黑龙江 哈尔滨 150040;2.江苏省农业科学院农产品加工研究所,国家农业科技华东(江苏)创新中心,农产品加工工程技术研究中心,江苏 南京 210014)
双孢菇远红外干燥过程中内部水分的变化规律
刘宗博1,张钟元2,李大婧2,*,李德海1,江 宁2,刘春泉2
(1.东北林业大学林学院,黑龙江 哈尔滨 150040;2.江苏省农业科学院农产品加工研究所,国家农业科技华东(江苏)创新中心,农产品加工工程技术研究中心,江苏 南京 210014)
利用低场核磁共振技术分析远红外干燥双孢菇内部水分分布及变化规律,研究在50、60、70 ℃条件下,切片厚度为3、5、7 mm双孢菇切片干燥过程中内部水分变化。结果表明:双孢菇中主要存在自由水、弱结合水和结合水3 种状态水,其中切片厚度为3、5、7 mm双孢菇片自由水含量(M23值)分别为9 048.26、12 038.71、17 532.27,在3 种状态水中所占比例最大。在相同干燥温度条件下,切片厚度为3 mm的双孢菇自由水和弱结合水去除所需的时间最短;随着干燥温度的升高,3、5、7 mm双孢菇片中自由水和弱结合水含量逐渐降低。3 种切片厚度的双孢菇在不同温度干燥过程中结合水含量无明显下降趋势,说明干燥过程中脱去的主要是自由水和部分弱结合水,结合水基本不会去除,因此结合水含量对双孢菇远红外干燥效果无明显影响。
核磁共振;干燥;双孢菇;水分变化
双孢菇肉质肥厚、营养丰富,素有“山珍”之称,并具有抗癌、降血压、减少胆固醇、滋补强身等药理作用[1],是一种理想的高蛋白低脂肪的保健营养食物。鲜蘑菇质地细嫩,采收后鲜度迅速下降,从而会引起开伞,菌褶褐变,菇体萎缩等,影响风味和商品价值。因此,通过干燥加工将其制成干制品有利于延长双孢菇的贮藏时间。
远红外辐射作为干燥方式具有热效率高、温度均匀等优点,可以使最终的干制品具有较好的品质。林喜娜等[2]采用远红外干燥双孢菇,确定了辐射强度、物料温度、物料厚度、干燥时间等因素对干燥速率的影响,并基于BP(back propagation)神经网络建立了含水率与各因素之间的网络模型结构。遇龙[3]对远红外干燥设备进行改进,探讨了环境温度、物料厚度、辐射距离对双孢菇干燥特性的影响,并对传统干燥模型进行非线性拟合,建立适用于双孢菇切片远红外干燥动力学模型。在果蔬干燥过程中,物料内部水分的变化直接影响物料的干燥速率和干制品的品质,对研究物料干燥特性具有重要意义[4-5]。分析物料干燥曲线并将实验数据与干燥数学模型相拟合是目前被广泛应用的用于阐述物料干燥过程水分变化规律的方法。该类方法被用于分析金针菇[6]、银耳[7]、龙眼果肉[8]等。但干燥曲线所描述的过程为物料中整体水分含量的变化,无法区分不同结合状态水即自由水、结合水、弱结合水的变化规律;而干燥动力学模型主要是对物料干燥曲线的数学模拟,虽可为实际生产提供理论依据,但对实际生产的指导具有一定的局限性。
低场核磁共振(low-field nuclear magnetic resonance,LF-NMR)是近年作为分析水分状态的新兴技术,通过低场质子核磁共振中的弛豫时间的测定,可以描述水分子的运动情况及其存在状态[9-12],因此广泛应用于食品领域[13-17]。Garnczarska等[18]用核磁共振成像和核磁共振光谱研究羽扇豆种子在成熟过程中水分分布和水分状态的变化,通过T2横向弛豫时间的分析得出羽扇豆种子在成熟期存在3 种水分,即自由水、结合水和毛细管水。Pitombo等[19]应用NMR光谱研究表明大西洋马鲛样品中存在3 种具有不同弛豫时间T2的水质子,其中冷冻干燥样品的水分含量增加时T2增加。因此,核磁共振技术可以有效地分析干燥过程中物料内部水分状态的变化。应用核磁共振技术对远红外干燥双孢菇过程的水分变化进行研究,可以更加详细、直观地分析双孢菇中不同状态水的分布和变化,所得的结果更加接近实际生产,有利于干燥设备及工艺参数的选择。
本实验旨在利用低场核磁共振技术分析双孢菇远红外干燥过程中内部水分变化规律,为双孢菇干燥工艺的研究以及实际生产控制提供参考。
1 材料与方法
1.1 材料
双孢菇,购于农贸市场,要求新鲜、完整。
1.2 仪器与设备
766B-3型远红外辐射干燥箱 上海浦东荣丰科学仪器有限公司;MP2002电子天平 上海舜宇恒平科学仪器有限公司;MesoMR23-060H-I型核磁共振分析仪 上海纽迈电子科技有限公司。
1.3 方法
1.3.1 样品处理
将新鲜双孢菇清洗并去除菇柄,纵向(沿着生长方向)切成厚度为3、5、7 mm的薄片,放入远红外干燥箱内,调节红外干燥功率为1 200 W,分别在50、60、70 ℃条件下进行干燥实验。
1.3.2 水分含量测定
采用GB 5009.3—2010《食品中水分的测定》方法。干基含水率按下式计算。
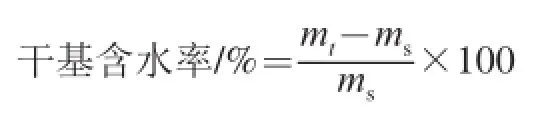
式中:mt为样品t时刻对应的质量/g;ms为样品干物质质量/g。
1.3.3 横向弛豫时间反演谱采集
将双孢菇切片放置在永久磁场的射频线圈的中心,应用CPMG脉冲序列测样品中的横向弛豫时间T2。设备参数设置为:主频SF=23 MHz,偏移频率Ol= 425 557.6 Hz,硬脉冲90°脉宽P90=14 μs,硬脉冲180°脉宽P180=30 μs,谱宽SW=200 kHz,采样点数TD=828 016,重复扫描次数NS=8,重复采样时间TW=5 000 ms,回波个数NECH=18 000。
1.4 统计分析
实验所得数据应用SPSS13.0软件处理,Origin 8.5软件进行图形绘制。
2 结果与分析
2.1 不同温度条件下双孢菇片干燥曲线
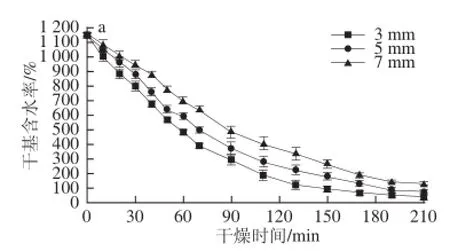

图1为3 种不同切片厚度的双孢菇片分别在50、60、70 ℃条件下的干燥特性曲线。随着干燥温度的增加,物料含水量下降所需的时间逐渐减少。在相同干燥温度条件下,7 mm双孢菇片含水率变化最为缓慢,说明其干燥速率最低,5 mm双孢菇片次之,3 mm双孢菇片干燥速率最快。就干燥时间而言,7 mm双孢菇所需时间最长,3 mm所需时间最短。说明干燥温度越高,物料厚度越薄,越有利于水分的脱除,所需干燥时间越短。
2.2 NMR分析双孢菇中水分状态
T2(横向弛豫时间)常被用来检测物料中水分与干物质结合的强度,T2的大小代表了水分流动性的强弱,可以表示物料中水分的自由度。T2值越小,代表水与干物质结合的越紧密;T2值越大,代表水分的自由度大,越容易排出。核磁共振信号幅值与样品中氢质子的数量成正比,因此在T2反演谱上的峰面积可间接表示出对应的状态水的含量。
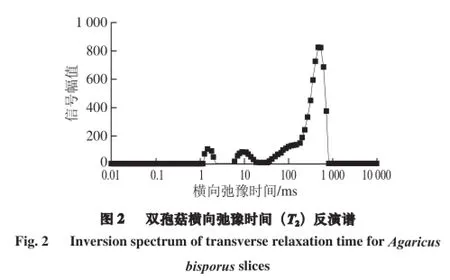
由图2可知,在T2反演谱上出现3 个较为明显的波峰,分别代表3 种不同相态的水,根据弛豫时间可划分为结合水T21(1~3 ms)、弱结合水T22(5~25 ms)和自由水T23(25~850 ms)。T21、T22、T23对应的核磁共振幅值分别为M21、M22、M23。
2.3 干燥温度对不同厚度双孢菇片水分状态的影响
2.3.1 不同干燥温度条件下自由水分状态变化
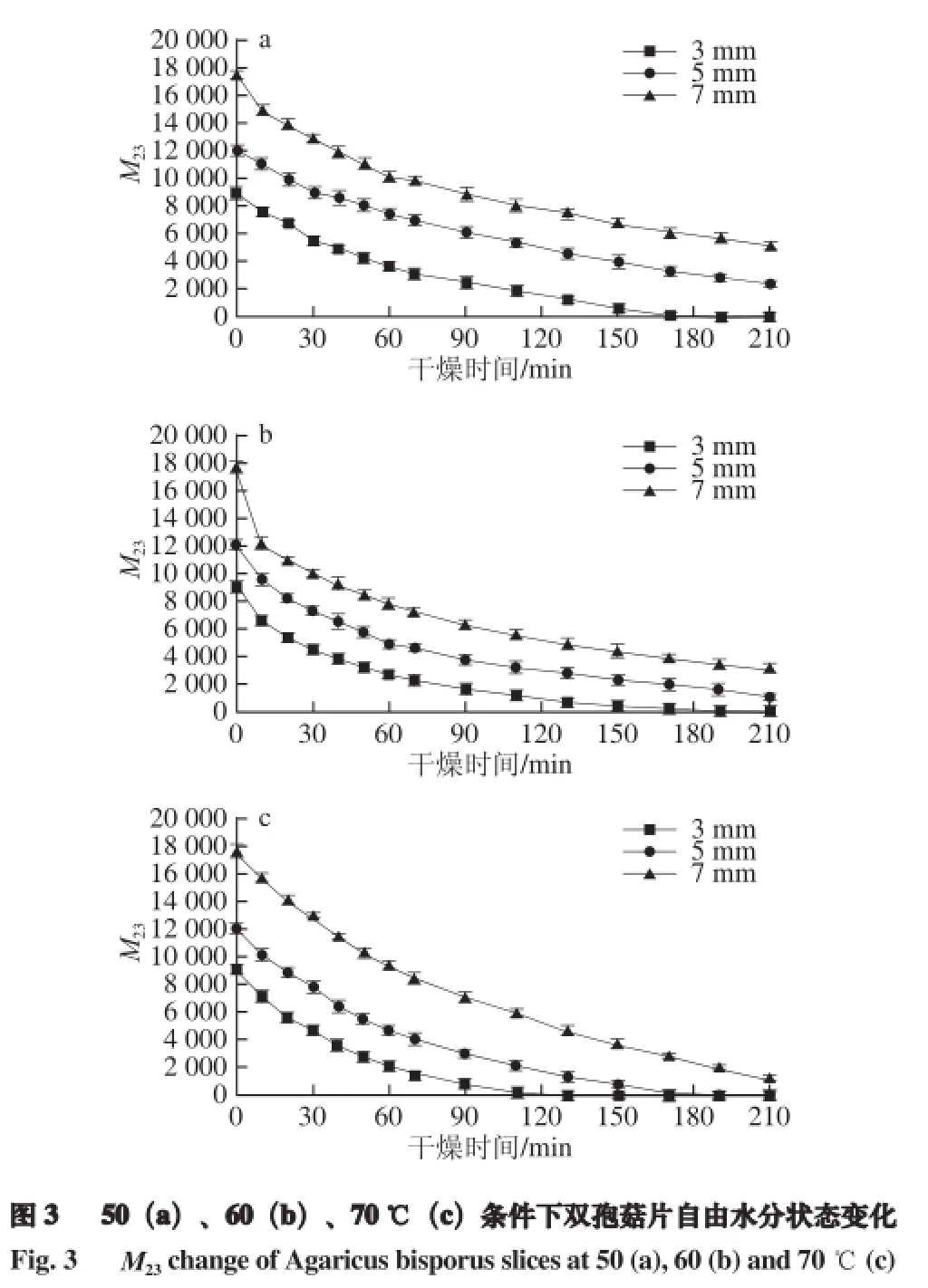
由图3可知,双孢菇切片中自由水含量(M23)随干燥时间的延长而逐渐减少。这是因为自由水主要存在于液泡、原生质和细胞间隙中,距离胶粒较远可以自由移动,因此在干燥过程中最容易被脱除[20]。相同干燥温度条件下,3 mm双孢菇片自由水损失最快、7 mm最慢。说明切片越薄,样品中自由水越容易去除,去除所需的时间越短。对比50、60、70 ℃干燥条件,温度为70 ℃时3 种厚度样品的自由水含量减少的最快,说明干燥温度越高自由水脱除越迅速。双孢菇中自由水在3 种状态水中含量最高,且变化趋势与图1干燥特性曲线相似,因此干燥过程中自由水含量的变化将直接影响干燥效果。
2.3.2 不同干燥温度条件下弱结合水分状态变化
弱结合水存在于细胞质和细胞外隙中,随着干燥过程中自由水含量的减少,弱结合水的含量也发生相应的变化,并且比自由水的变化更为复杂。图4a、b中,在干燥开始的前10 min,3 种切片厚度双孢菇中的弱结合水含量均减少,这可能是因为在干燥初期,温度升高,大部分弱结合水随着自由水的除去而向外迁移为自由水,继而被脱除。而图4c中3 mm双孢菇片在最初的10 min内弱结合水含量有所增加,这可能是因为其厚度相对较薄,在70 ℃条件下,自由水去除较快,双孢菇内部营养物质以及酶分解出的结合水迁移为弱结合水[21],因此短时间内弱结合水含量增加。
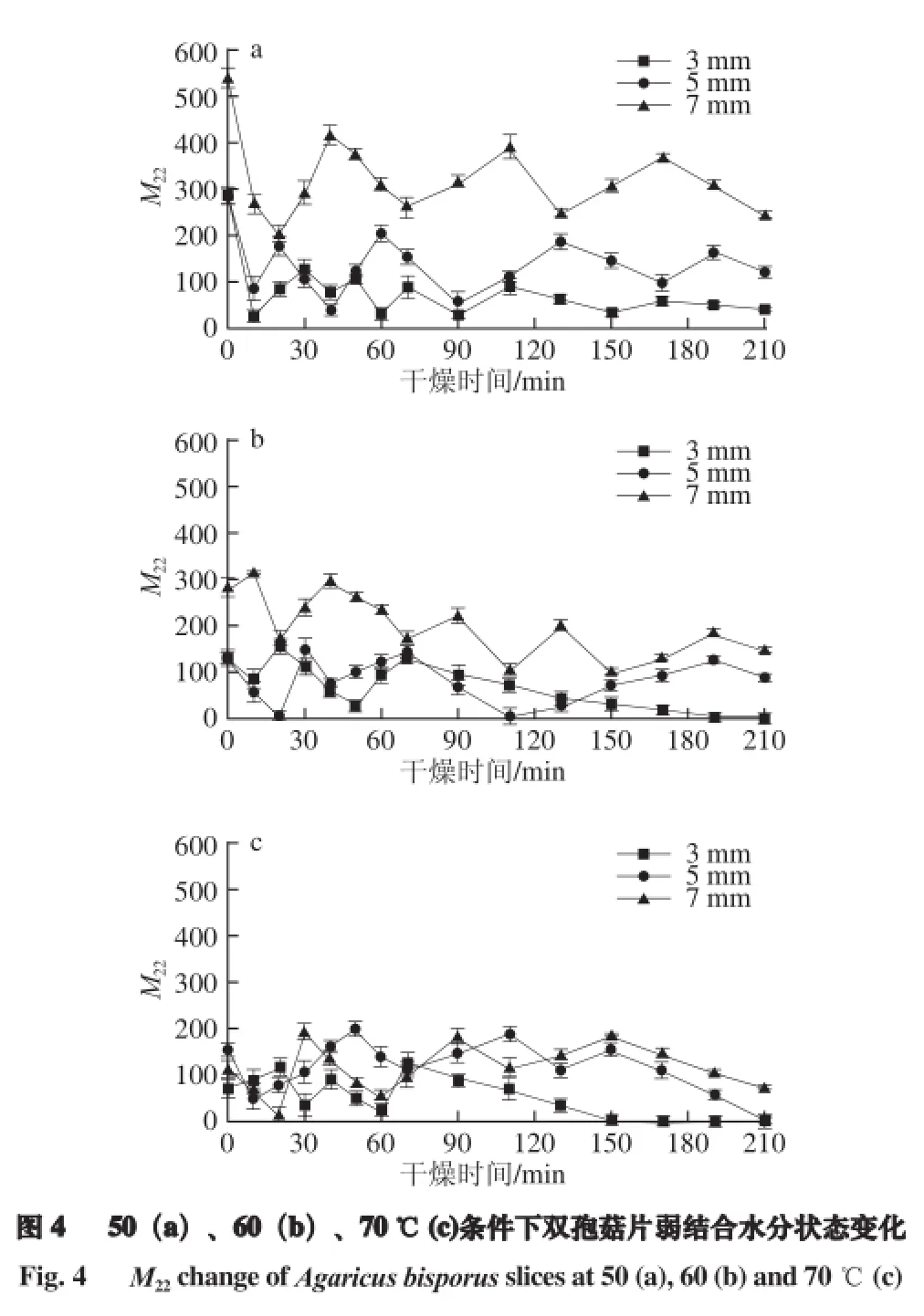
随着干燥过程继续进行,在不同温度条件下,3 种切片厚度双孢菇中的弱结合水曲线均呈现减少、增加交替出现的现象。分析原因,减少可能是因为在干燥过程中,一部分弱结合水与细胞壁接触,而细胞壁中多糖具有的亲水基团结构可以减少周围流动的动态水,因此弱结合水向结合水迁移[22];另一部分弱结合水在自由水被去除后,向自由水迁移,继而被脱除。增加可能是因为随着弱结合水的减少,双孢菇中碳水化合物浓度升高,而水分子进出细胞取决与细胞内外溶液的浓度差,浓度差的形成导致部分自由水向弱结合水迁移。另外,酶或者其他物质分解释放的结合水迁移为弱结合水。因此可认为在双孢菇干燥中,不同状态水之间存在相互迁移、转化的过程。
在图4中,弱结合水曲线最终呈下降趋势,说明在自由水基本被脱除后,弱结合水开始逐渐减少,这可能是干燥曲线后期趋于平缓的原因。
2.3.3 不同干燥温度条件下结合水分状态变化

结合水是水在生物体和细胞内的存在状态之一,是吸附和结合在有机固体物质上的水,主要是依靠氢键与蛋白质的极性基(羧基和氨基)相结合形成的水胶体[23],在干燥过程中一般不能被脱除。由图5可知,3 种厚度的双孢菇片在不同干燥温度条件下的结合水含量曲线上下起伏,明显区别于自由水,和弱结合水曲线相似,说明样品中的结合水在干燥过程中也是不断增减变化的。产生这种变化的原因与弱结合水的迁移有着密不可分的关系。可能是由于干燥过程中部分弱结合水与胶体结合的更紧密[24],致使结合水含量上升;随着干燥过程的进行,样品内酶和营养物质分解使部分结合水向弱结合水迁移,从而导致结合水含量下降。由于结合水分子主要与蛋白质、糖类、维生素等大分子结合[25],因此在双孢菇干燥过程中几乎不会对干燥效果产生影响。
3 结 论
应用低场核磁共振技术对干燥过程中双孢菇内部水分状态进行分析,探寻水分迁移规律。研究结果表明,在双孢菇中主要存在3 种状态的水,即自由水、弱结合水和结合水。其中自由水含量最高,在干燥过程中也最容易被脱除;弱结合水在干燥后期(即自由水被大量脱除后)逐渐减少;结合水因与胶体结合紧密而一般无法被去除,所以对最终干燥结果不会产生显著影响。相同的干燥温度,3 mm切片中自由水和弱结合水含量下降的时间最短;相同的切片厚度,70 ℃干燥温度下3 种切片厚度双孢菇中自由水和弱结合水含量下降的时间最短。在本实验中,干燥温度越高、厚度越薄,自由水和弱结合水减少所需的时间越短,其中自由水表现尤为明显。因此在双孢菇干制品实际生产中,一方面,可根据自由水和弱结合水脱除的时间来调整干燥工艺参数,缩短干燥时间,以达到节约能耗、提高经济效益的目的;另一方面,可通过调整切片方式和干燥温度来提高干燥效率。
[1] 周永斌, 张志军, 王文治, 等. 双孢菇保鲜与加工技术[J]. 科技情报开发与经济, 2008, 18(15): 151-152. DOI:10.3969/ j.issn.1005-6033.2008.15.086.
[2] 林喜娜, 王相友, 丁莹. 双孢蘑菇远红外干燥神经网络预测模型建立[J]. 农业机械学报, 2010, 41(5): 110-114. DOI:10.3969/ j.issn.1000-1298.2010.05.023.
[3] 遇龙. 双孢蘑菇远红外辐射干燥的试验研究[D]. 淄博: 山东理工大学, 2012.
[4] 朱开鼎, 陈海峰, 窦丹, 等. 果蔬压差膨化过程中水分迁移的机理分析[J]. 食品工业科技, 2012, 33(4): 83-85. DOI;10.13386/ j.issn1002-0306.2012.04.084.
[5] 孙丙虎, 王喜明. 利用低场核磁共振技术研究木材微波干燥过程中的水分状态与迁移[J]. 内蒙古农业大学学报, 2012, 33(3): 205-210.
[6] 胡庆国, 卜召辉, 陆宁. 金针菇真空微波干燥动力学模型的研究[J].食品与机械, 2010, 26(5): 48-50.
[7] 黄艳, 黄建立, 郑宝东. 银耳微波真空干燥特性及动力学模型[J]. 农业工程学报, 2010, 26(4): 362-367. DOI:10.3969/ j.issn.1002-6819.2010.04.062.
[8] 叶欣, 黄晓兵, 胡洋, 等. 龙眼果肉微波干燥特性及干燥模型研究[J]. 食品科技, 2012, 27(12): 67-71. DOI:10.13684/j.cnki. spkj.2012.12.042.
[9] FRIAS J M, FOUCAT L, BIMBENET J J, et al. Modeling of moisture profiles in paddy rice during drying mapped with magnetic resonance imaging[J]. Chemical Engineering Journal, 2002, 86(1/2): 173-178. DOI:10.1016/S1385-8947(01)00285-6.
[10] GHOSH P K, JAYAS D S, SMITH E A, et al. Mathematical modelling of wheat kernel drying with input from moisture movement studies using magnetic resonance imaging (MRI), part I: model development and comparison with MRI observations[J]. Biosystems Engineering,2008, 100(3): 389-400. DOI:10.1016/j.biosystemseng.2008.04.006.
[11] 李潮锐, 刘青, 杨培强. 鲜花生的低场核磁共振横向弛豫分析[J]. 中山大学学报(自然科学版), 2014, 53(2): 1-5. DOI:10.13471/j.cnki. acta.snus.2014.02.007.
[12] MARCONE M F, WANG S, ALBABISH W, et al. Diverse food-based applications of nuclear magnetic resonance (NMR) technology[J]. Food Research International, 2013, 51(2): 729-747. DOI:10.1016/ j.foodres.2012.12.046.
[13] 余瑞鑫, 顾振宇, 韩剑众. 粽子蒸煮过程水分状态变化的低场核磁共振研究[J]. 安徽农业科学, 2009, 37(31): 15407-15409. DOI:10.13989/j.cnki.0517-6611.2009.31.050.
[14] 邵小龙, 李云飞. 用低场核磁研究烫漂对甜玉米水分布和状态影响[J]. 农业工程学报, 2009, 25(10): 302-306. DOI:10.3969/ j.issn.1002-6819.2009.10.054.
[15] 余瑞鑫, 顾振宇, 韩剑众. 大米浸泡过程水分状态变化的低场核磁共振研究[J]. 食品工业, 2010, 31(1): 12-15.
[16] PANARESE V, LAGHI L, PISI A, et al. Effect of osmotic dehydration on Actinidia deliciosa kiwifruit: a combined NMR and ultrastructural study[J]. Food Chemistry, 2012, 132(4): 1706-1712. DOI:10.1016/ j.foodchem.2011.06.038.
[17] 朱丹实, 梁洁玉, 吕佳煜, 等. 秋红李子贮藏过程中水分迁移对其质构的影响[J]. 现代食品科技, 2014, 30(12): 100-105. DOI:10.13982/ j.mfst.1673-9078.2014.12.017.
[18] GARNCZARSKA M, ZALEWSKI T, KEMPKA M. Changes in water status and water distribution in maturing lupin seeds studied by MR imaging and NMR spectroscopy[J]. Journal of Experimental Botany, 2007, 58(14): 3961-3969. DOI:10.1093/jxb/erm250.
[19] PITOMBO R N M, LIMA G A M R. Nuclear magnetic resonance and water activity in measuring the water mobility in pintado(Pseudoplatystoma corruscans) fish[J]. Journal of Food Engineering,2003, 58(1): 59-66. DOI:10.1016/S0260-8774(02)00334-5.
[20] 张绪坤, 祝树森, 黄俭花, 等. 用低场核磁分析胡萝卜切片干燥过程的内部水分变化[J]. 农业工程学报, 2012, 28(22): 282-287. DOI:10.3969/j.issn.1002-6819.2012.22.039.
[21] XU C, LI Y, YU H. Effect of far-infrared drying on the water state and glass transition temperature in carrots[J]. Journal of Food Engineering,2014, 136: 42-47. DOI:10.1016/j.jfoodeng.2014.03.022.
[22] EINHORN-STOLL U, HATAKEYAMA H, HATAKEYAMA T. Influence of pectin modification on water binding properties[J]. Food Hydrocolloids, 2012, 27(2): 494-502. DOI:10.1016/ j.foodhyd.2011.08.019.
[23] CHENG X F, ZHANG M, ADHIKARI B, et al. Effect of power ultrasound and pulsed vacuum treatments on the dehydration kinetics,distribution, and status of water in osmotically dehydrated strawberry: a combined NMR and DSC study[J]. Food and Bioprocess Technology,2014, 7(10): 2782-2792. DOI:10.1007/s11947-014-1355-1.
[24] XU C, LI Y. Correlation of viscoelastic behavior with water state and ultrastructure in hot air-dried carrots[J]. Food Control, 2015, 50: 23-30. DOI:10.1016/j.foodcont.2014.08.020.
[25] 陈森, 孟兆磊, 陈闰堃, 等. 樱桃水分变化的低场核磁共振[J]. 实验室研究与探索, 2013, 32(8): 52-54. DOI:10.3969/j.issn.1006-7167.2013.08.014.
Analysis of Moisture Change during Far-Infrared Drying of Agaricus bisporus
LIU Zongbo1, ZHANG Zhongyuan2, LI Dajing2,*, LI Dehai1, JIANG Ning2, LIU Chunquan2
(1. College of Forestry, Northeast Forestry University, Harbin 150040, China; 2. Engineering Research Centre of Agricultural Products Processing, East China (Jiangsu) Innovation Center of National Agricultural Science and Technology,Institute of Farm Product Processing, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China)
The moisture distribution and change of Agaricus bisporus during far-infrared drying was analyzed by lowfield nuclear magnetic resonance (NMR) technology. Agaricus bisporus slices (3, 5 and 7 mm thickness) were dried at three different temperatures (50, 60 and 70 ℃). Results showed that the water states in Agaricus bisporus included free water, immobilized water and bound water. Free water (M23) was the most dominant among the three water states, which was 9048.26, 12038.71 and 17532.27, respectively, for 3, 5 and 7 mm thick Agaricus bisporus slices. The removal of free water and immobilized water from 3 mm thick Agaricus bisporus slices was the fastest at the same drying temperature. The contents of free water and immobilized water in Agaricus bisporus slices were decreased gradually with increasing temperature, independent of the thickness of slices, while the content of bound water had no obvious downtrend at different temperatures. These findings indicated that free water and partial immobilized water were mainly removed during the drying process, and bound water was hardly removed. Thus, the content of bound water had no significant effect on Agaricus bisporus during far infrared drying.
nuclear magnetic resonance; drying; Agaricus bisporus; moisture change
10.7506/spkx1002-6630-201609016
TS255.3
A
1002-6630(2016)09-0082-05
刘宗博, 张钟元, 李大婧, 等. 双孢菇远红外干燥过程中内部水分的变化规律[J]. 食品科学, 2016, 37(9): 82-86. DOI:10.7506/spkx1002-6630-201609016. http://www.spkx.net.cn
LIU Zongbo, ZHANG Zhongyuan, LI Dajing, et al. Analysis of moisture change during far-infrared drying of Agaricus bisporus[J]. Food Science, 2016, 37(9): 82-86. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201609016. http://www.spkx.net.cn
2015-05-20
公益性行业(农业)科研专项(201303080)
刘宗博(1990—),男,硕士研究生,研究方向为食品加工与贮藏。E-mail:laiyangdasuo@163.com
*通信作者:李大婧(1976—),女,研究员,博士,研究方向为食品营养化学。E-mail:lidajing@163.com

