多效唑人工抗原的合成与鉴定
王晓芬,鄢爱平,谭 婷,毛雪金,刘俊俊,郭 岚,万益群,,
(1.南昌大学化学学院,江西 南昌 330031;2.南昌大学分析测试中心,江西 南昌 330047;3.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
多效唑人工抗原的合成与鉴定
王晓芬1,鄢爱平2,谭 婷2,毛雪金3,刘俊俊1,郭 岚2,万益群1,2,*
(1.南昌大学化学学院,江西 南昌 330031;2.南昌大学分析测试中心,江西 南昌 330047;3.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
为合成新的、有效的多效唑人工抗原,采用琥珀酸酐法对多效唑小分子进行结构修饰,以获得含羧基的多效唑半抗原。将纯化后的半抗原分别与牛血清白蛋白和卵清蛋白经N-羟基琥珀酰亚胺活泼酯法偶联制备免疫原和包被原。采用质谱、红外光谱、核磁共振氢谱对多效唑半抗原的结构进行鉴定;采用紫外光谱及高性能基质辅助激光解吸电离-飞行时间质谱对偶联物的结构进行鉴定。结果显示成功合成出多效唑人工抗原,为其抗体的制备和免疫学方法的构建奠定了前期研究基础。
多效唑;半抗原;人工抗原;制备
多效唑(paclobutrazol,PAC)作为一种抑制类的植物生长调节剂,具有延缓植物生长、抑制茎杆伸长、缩短节间、促进花芽分化、增加植物抗逆性能、提高作物产量等功能,广泛应用于水稻、麦类、花生、果树、烟草、油菜、大豆等农作物生产。多效唑在土壤中易被吸附且降解慢,残留时间长[1-2],如使用不当,乱用或滥用,则有可能通过食物链传递,对人体健康造成潜在风险。为此,许多欧盟国家已经禁用[3],日本、新西兰、韩国和澳大利亚等国均规定多效唑的最高残留限量为0.5 mg/kg[4]。我国食品安全国家标准GB 2763ü2015《食品中农药最大残留限量》[5]对多效唑残留量的规定如下:谷物中稻谷、小麦≤0.5 mg/kg,油菜籽≤0.2 mg/kg,水果中苹果和荔枝≤0.5 mg/kg。因此,开展食品中多效唑残留快速检测新技术研究对食品安全生产、现场监督都有着十分重要的现实意义。
多效唑残留检测目前主要采用气相色谱(gas chromatography,GC)、液相色谱(liquid chromatography,LC)、气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)、液相色谱-质谱联用(liquid chromatography-mass spectrometry,LC-MS)等技术[6-9],这些方法的准确度和精密度较高,但存在检测成本高、周期长及操作繁琐等缺陷,不适于大规模现场筛查。与色谱等分析技术相比,免疫分析法具有样品前处理简单、样品用量少、检测成本低、选择性高及分析速度快等特点[10],其原理是基于抗原与抗体特异性结合。该法已广泛应用于食品中真菌毒素、药物用品、农药、兽药残留[11-15]等危害物的检测,但应用于食品中植物生长调节剂的分析研究报道相对较少。
制备小分子化合物的人工抗原,需要与载体进行交联,但小分子化合物必须具有或衍生出能与载体进行交联反应的功能基团(如氨基、羧基、重氮盐等),才能与载体交联[16]。多效唑是小分子物质,具有反应原性,但不具备免疫原性,因而必须与载体大分子蛋白偶联成为全抗原才可用于制备抗体。Cao Zhen等[17]以威廉姆森经典反应,合成多效唑半抗原,并取得了较好的成果。本实验采用微波无溶剂法将多效唑与琥珀酸酐反应衍生成为带羧基(—COOH)的半琥珀酸酐酯,拓宽了可选用的抗原合成方法。同时,该方法制备多效唑半抗原简单、有效和安全,且可较好地与载体蛋白交联制备多效唑的人工抗原,为多效唑抗体的进一步制备提供了前期研究基础。
1 材料与方法
1.1 试剂
多效唑(纯度≥99.5%)、琥珀酸酐、4-二甲氨基吡啶(4-dimethylaminopyridine,DMAP)、无水吡啶 上海百灵威公司;N-羟基琥珀酰亚胺(N-hydroxy succinimide,NHS)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(1-(3-dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride,EDAC)、N,N-二甲基甲酰胺(N,N-dimethylformamide,DMF) 生工生物工程(上海)股份有限公司;牛血清白蛋白(bovine albumin,BSA)、卵清蛋白(ovalbumin,OVA)美国Sigma公司;1hPBS透析液(0.01 mol/L,pH 7.4):NaCl 8 g、KCl 0.2 g、KH2PO40.2 g、Na2HPO4g12H2O 29 g,蒸馏水定容至1 000 mL。
1.2 仪器与设备
AV 600核磁共振波谱仪 瑞士布鲁克公司;6430三重串联四极杆液相色谱-质谱联用仪、1260高效液相色谱 美国Agilent公司;TGL-16G高速台式离心机上海安亭科学仪器公司;5800基质辅助激光解吸电离飞行时间质谱仪 美国AB SCIEX公司;5700 智能型傅里叶变换红外光谱仪 美国Nicolet公司;SM2涡旋混合器德国IKA公司;2501PC紫外-可见分光光度计 日本岛津公司;Milli-Q超纯水仪 美国Millipore公司。
1.3 方法
1.3.1 多效唑半抗原的制备
选用微波[18-21]无溶剂法合成多效唑半琥珀酸酯(paclobutrazol-hemisuccinate,PAC-HS)。用无水吡啶做溶剂,按照多效唑、琥珀酸酐、DMAP物质的量比1∶20∶1的比例混合均匀,氮气吹干溶剂。将混合物置于微波炉中(P=406 W)间歇反应2.5 h。反应结束后加入2 mL氯仿溶解,取出混合物离心去沉淀,取上清液再加入2 mL二次水,涡旋振荡2 min,以除去副产物丁二酸。取有机相,氮气吹干,得到多效唑半抗原。其合成路线见图1。
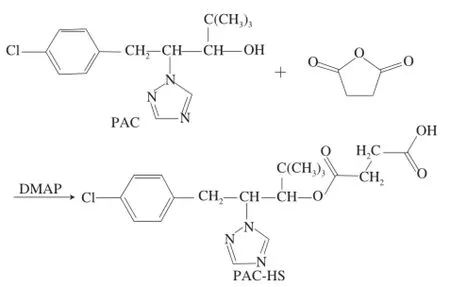
图1 琥珀酸酐法合成路线Fig.1 Synthetic route of PAC-HS by succinic anhydride method
1.3.2 多效唑半抗原的纯化及鉴定
采用Agilent 1260液相色谱仪对上述所合成的多效唑半抗原进行纯化,收集10~11 min流出液,氮气吹干,得到纯化后的多效唑半抗原。其色谱分离条件如下:色谱柱:ZORBAX RX-C18(250 mmh9.4 mm,5 μm);流动相:甲醇+0.1%甲酸水溶液(65∶35,V/V);柱温:30 ℃;流速:3.0 mL/min;检测波长:222 nm;进样量:100 μL。
1.3.3 多效唑半抗原的结构鉴定
采用液相色谱-质谱联用仪对纯化后的多效唑半抗原进行分析,正离子模式下做一级、二级质谱鉴定,并结合核磁共振氢谱和红外光谱鉴定,对多效唑半抗原进行结构分析。
1.3.4 NHS活泼酯法[22]制备人工抗原
1.3.4.1 NHS活泼酯法制备免疫抗原
准确称取2 mg PAC-HS溶于200 μL DMF中,加入NHS 4 mg(另溶于200 μL DMF),再加入7.5 mg称量好的EDC,室温下振荡反应16 h(溶液1);称取8.7 mg BSA(PAC-HS与BSA的物质的量比为39∶1)溶于1.6 mL 1hPBS中(溶液 2)。再将溶液 1 逐滴加入溶液2 中,边加边振荡,冰浴振荡反应6 h。反应混合物移入处理好的透析袋中,用1hPBS透析3 d,每天换两次透析液,即得到多效唑免疫抗原(PAC-HS-BSA),合成路线见图2。

图2 活泼酯法免疫抗原合成路线Fig.2 Synthetic route of immunogen active ester method
1.3.4.2 NHS活泼酯法制备检测抗原
称取1.2 mg PAC-HS溶于200 μL DMF中,加入NHS 2 mg(溶于200 μL DMF),再直接加入3.6 mg EDC,室温振荡反应16 h(溶液3);称取5 mg OVA(n(PAC-HS)∶n(OVA)=26∶1)溶于1.6 mL 1hPBS 中(溶液4)。溶液3与溶液4混匀后,冰浴振荡反应6 h。同上透析即得到多效唑检测抗原(PAC-HS-OVA),合成路线同图2。
采用紫外光谱及高性能基质辅助激光解吸电离-飞行时间质谱(matrix-assisted laser desorption/ ionization time of flight mass spectrometry,MALDI-TOF/MS)法对多效唑人工抗原进行结构鉴定,其中MALDI-TOF/MS检测方法如下:将蛋白及蛋白偶联物用 MALDI-TOF/MS 进行检测,通过分子质量数据的改变可说明半抗原与蛋白偶联成功与否,并可计算出蛋白与半抗原的偶联比[19-20]。
基质辅助溶液的配制:将34 μL 0.15% TFA与17 μL的乙腈混合,再加入适量的芥子酸使溶液达到过饱和状态,超声15 min,1 000 r/min离心3 min,备用[23]。
将载体蛋白BSA、OVA以及偶联物PAC-HS-BSA、PAC-HS-OVA脱盐后分别与基质辅助溶液混合,点到样品靶上,放入质谱仪内进行激光扫描。多效唑与载体蛋白的结合比按以下公式[24]计算。
式中:MA、MB和MC分别表示半抗原、蛋白、偶联物的相对分子质量。
2 结果与分析
2.1 多效唑半抗原的纯化
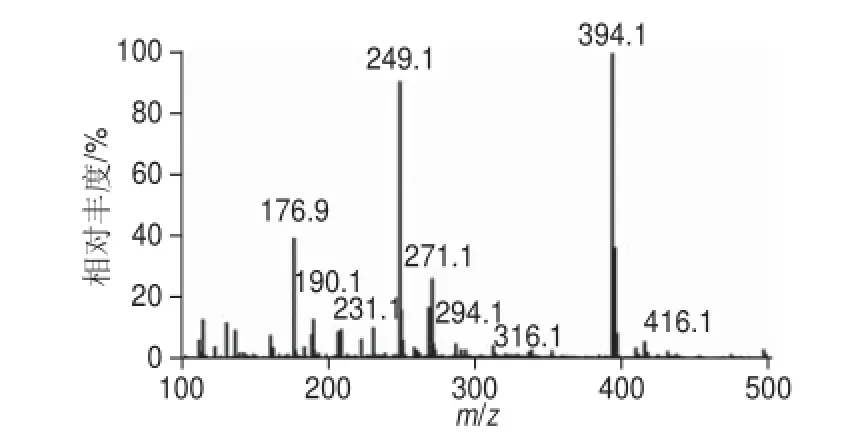
图3 未纯化的半抗原的质谱图Fig.3 Mass spectrum of non-purified hapten
采用微波无溶剂法合成得到的多效唑半抗原,正离子模式下一级质谱图如图3所示,m/z 394.1离子为目标物PAC-HS峰,但仍含有较多的杂质信号,如过剩的原料多效唑(m/z 294.1),多效唑中的杂质(m/z 316.1)和副产物产生等。为了避免杂质与载体蛋白偶联而干扰免疫效果,需进一步提纯。
治疗4周后,2组患者的FMA-UE、MBI和肩关节各方向主动关节活动度均有明显提高(均P<0.05),观察组的FMA-UE和肩关节前屈、水平内收、水平外展主动关节活动度提高程度更高于对照组(均P<0.05),2组患者的肩关节后伸、MBI改善程度差异无统计学意义。见表2~3。
2.2 多效唑半抗原的结构鉴定
2.2.1 PAC-HS的质谱鉴定
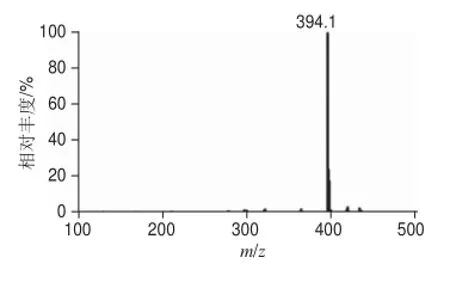
图4 PAC-HS的一级质谱图Fig.4 Full scan mass spectrum of PAC-HS
本实验采用半制备高效液相色谱法对合成的多效唑半抗原进行纯化,得到较纯的目标物质(图4),能够有效去除产物中的副产物和过剩的原料。
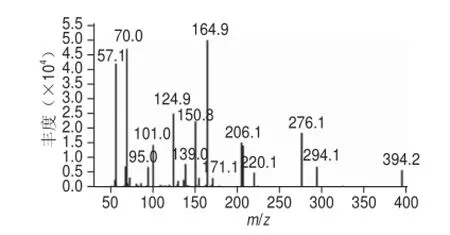
图5 PAC-HS的二级质谱扫描图Fig.5 Secondary mass spectrum of PAC-HS
图4 结果表明,一级质谱ESI+下出现的m/z 394.1,相应于加合质子准分子离子峰[M+H]+,与目标物的理论相对分子质量(393)相符。对分子离子进行ESI+-MS2鉴定(图5)出现若干碎片离子峰,各种碎片归属如下(图6):开裂方式1产生氯苄基峰(m/z 124.9),开裂方式2产生含苯环和杂环基峰(m/z 206.1),开裂方式3产生叔丁基峰(m/z 57.1),开裂方式4产生另一个含苯环和杂环基峰(m/z 276.1),开裂方式5产生丁酸残基峰(m/z 101.0),高质量端峰对应母体加合离子峰([M+H]+,m/z 394.2)。一级质谱和二级质谱峰表明经纯化后可得到多效唑半抗原目标化合物。

图6 PAC-HS的结构式图解Fig.6 Illustrative structural diagram of PAC-HS
2.2.2 PAC-HS红外光谱鉴定

图7 多效唑及其半抗原的红外光谱图Fig.7 Infrared spectra of paclobutrazol and PAC-HS
由图7可知,原料和产物红外光谱有相似之处,如:2 970.4 cm-1处为CüH伸缩振动吸收峰,3 130.1 cm-1处为ArüH伸缩振动吸收峰,1 690.7、1 500.5、1 410.2 cm-1处为苯环和杂环双键骨架伸缩振动吸收峰,760.7 cm-1处为ArüH面外弯曲振动吸收峰。同时也发现PAC和PAC-HS有明显的不同,例如:反应后多效唑中3 420.9 cm-1处OüH伸缩振动吸收峰减弱,而酯基特征显现,1 730.3 cm-1处为酯C=O伸缩振动吸收峰,1 100.3 cm-1处为CüOüC单键伸缩振动吸收峰。特别是半抗原中出现了1 730.3 cm-1为C=O的伸缩振动吸收峰。红外光谱分析表明多效唑中的羟基与琥珀酸酐形成了酯,即半抗原产物。
2.2.3 PAC-HS核磁共振分析
将PAC及纯化后的PAC-HS进行1H-NMR分析,结果见图8及图9。由图8可知:1H-NMR(600 MHz, DMSO)δ 0.616(9H,—(CH3)3),7.105~7.240(4H,苯环),7.752~8.516(2H,杂芳环),3.226(2H,üCH2),3.437(1H,—OH),4.750(1H,CHüN),5.506(1H,CHüO)。图9与图8相比,PAC-HS的1H-NMR(600 MHz,DMSO)谱图中保留了母体中苯环和氮杂环的氢谱信息,但δ 3.437(H,—OH)峰消失,增加了12.340(H,—COOH)峰和2.613~3.109(4H,—CH2CH2)峰。由此可推测琥珀酸酐开环与多效唑发生了酯化反应,同时其中一个酰基转变成了羧酸,为新化合物与蛋白质结合创造了条件。
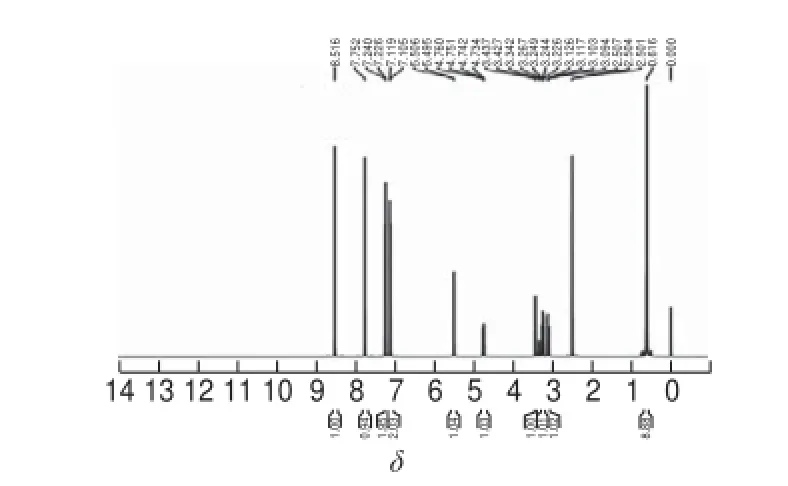
图8 PAC的核磁共振图谱Fig.8 1H-NMR spectrum of PAC

图9 PAC-HS的核磁共振图谱Fig.9 1H-NMR spectrum of PAC-HS
通过上述红外光谱、质谱和核磁共振氢谱分析,综合结果表明所合成的产物即为理论设想的多效唑半抗原目标物。
2.3 多效唑人工抗原的鉴定
2.3.1 紫外光谱扫描
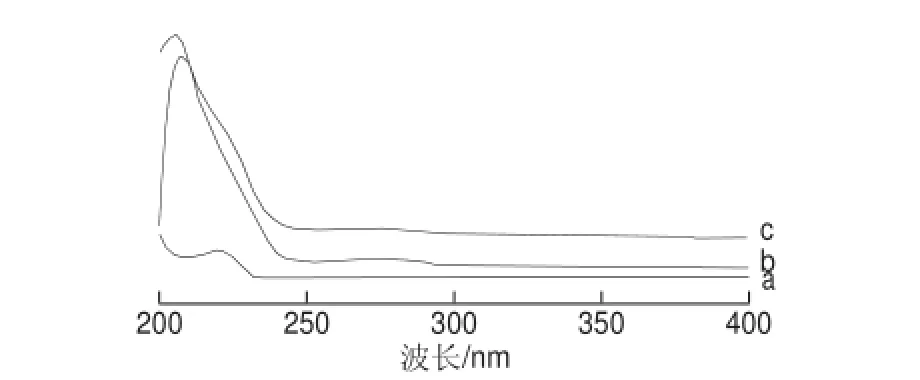
图10 PAC-HS(a)、BSA(b)和PAC-HS-BSA(c)的紫外扫描图谱Fig.10 UV scanning spectra of PAC-HS (a), BSA (b) and PAC-HS-BSA (c)
BSA在波长278 nm处有吸收峰,多效唑半抗原在222 nm波长处有最大吸收峰,BSA与半抗原偶联后,其产物的峰形发生变化且吸收产生了一定位移(图10c),表明PAC-HS与BSA可能产生了偶联。同样,由图11可知,OVA与PAC-HS也可能产生了偶联。
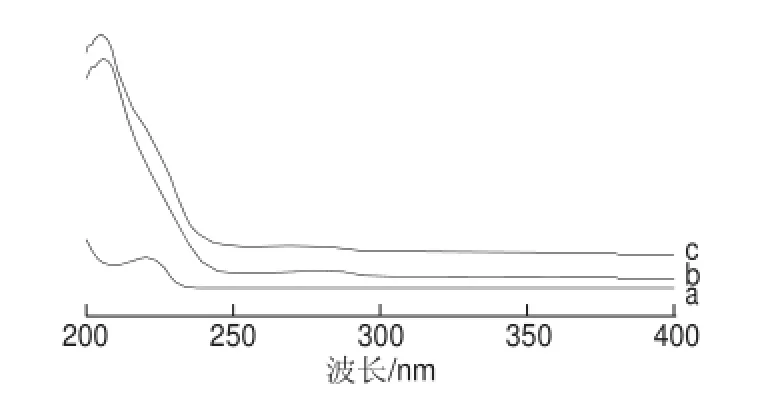
图11 PAC-HS(a)、OVA(b)和PAC-HS-OVA(c)的紫外扫描图谱Fig.11 UV scanning spectra of PAC-HS (a), OVA (b) and PAC-HS-OVA (c)
2.3.2 质谱鉴定及偶联物结合比分析
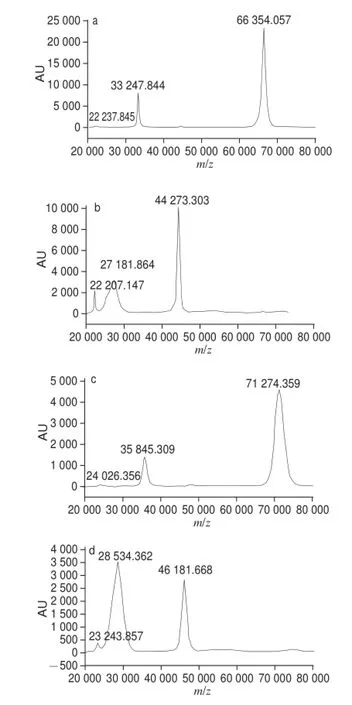
图12 BSA(a)、OVA(b)、PAC-HS-BSA(c)及PAC-HS-OVA(d)的质谱图Fig.12 Mass spectra of BSA (a), OVA (b), PAC-HS-BSA (c) and PAC-HS-OVA (d)
BSA和OVA在连上多效唑分子后,其质量数会发生改变,对照组蛋白质BSA 的质谱图(图12a)可见,单电荷离子峰为66 354.057,对照组OVA 的质谱图(图12b)中单电荷离子峰为44 273.303。由PAC-HS-BSA 的质谱图(图12c)可见,PAC-HS-BSA分子离子峰为71 274.359,PAC-HS-OVA分子离子峰(图12d)为46 181.668。已知PAC-HS的相对分子质量是393,可得出平均每个载体蛋白BSA分子上偶联的多效唑半抗原分子个数=(71 274.359-66 354.057)/ 393≈12.5 个。载体蛋白OVA 分子上偶联的多效唑半抗原分子个数=(46 181.668-44 273.303)/393≈4.9 个。制备相应的抗血清小分子化合物合成的全抗原,一般要求小分子与载体蛋白的最适偶联比在1∶10~1∶25之间,方可有效地刺激机体产生免疫应答[25],另有文献报道每一载体上含有8~25 个半抗原能得到效价较高的抗体[26-27]。从偶联比结果来看,本实验制备的多效唑免疫抗原(PAC-HS-BSA)免疫小鼠,有可能产生相应的应答。
3 结 论
本实验以琥珀酸酐为反应物,采用微波无溶剂法制备多效唑半抗原,将多效唑中的—OH衍生成为带有üCOOH的分子,以便利用更多—COOH偶联蛋白。同时采用半制备高效液相色谱法对合成的多效唑半抗原进行了纯化,以避免杂质与载体蛋白偶联而干扰免疫效果。在此基础上,采用碳二亚胺法制备了多效唑的免疫原及包被原。应用质谱、红外光谱及核磁共振等分析技术,对所制备的多效唑半抗原及其全抗原进行了结构鉴定。同时采用MALDI-TOF/MS分析技术,测得免疫原和包被原的偶联比分别为12.5∶1和4.9∶1,成功合成了多效唑人工抗原,为进一步研究构建食品中多效唑快速分析新方法奠定了基础。
[1] MAUK C S, UNRATH C R, BLANKENSHIP S M, et al. Influence of method of application of paclobutrazol on soil residues and growth retardation in a ‘Starkrimson-Delicious’ apple orchard[J]. Plant Growth Regulation, 1990, 9(1): 27-35. DOI:10.1007/BF00025276.
[2] SHALINI L, SHARMA D. Persistence and movement of paclobutrazol residues in a mango orchard soil[J]. Bulletin of Environmental Contamination & Toxicology, 2006, 76(6): 930-934. DOI:10.1007/ s00128-006-1007-x.
[3] 史晓梅, 金芬, 黄玉婷, 等. 水果中常用植物生长调节剂的研究进展[J]. 食品工业科技, 2012, 33(4): 417-422; 426. DOI:10.13386/ j.issn1002-0306.2012.04.009.
[4] 朱杰丽, 杨柳, 柴振林, 等. 国内外植物生长调节剂限量标准分析研究[J]. 生物灾害科学, 2013, 36(2): 232-236. DOI:10.3969/ j.issn.2095-3704.2013.02.025.
[5] 中华人民共和国卫生部. GB 2763ü2014 食品中农药最大残留限量[S].北京: 中国标准出版社, 2014.
[6] 徐国锋, 聂继云, 李静, 等. GC/ECD测定葡萄中多效唑和烯效唑的残留[J]. 农药, 2014, 53(10): 736-738.
[7] TIAN Qin, ZHOU Zhiqiang, LÜ Chunguang, et al. Simultaneous determination of paclobutrazol and myclobutanil enantiomers in water and soil using enantioselective reversed-phase liquid chromatography[J]. Analalytical Methods, 2010, 2(6): 617-622. DOI:10.1039/c0ay00187b.
[8] WANG Lu, ZHANG Xiaohuan, CHANG Qingyun, et al. Determination of triazole fungicides in vegetable samples by magnetic solid-phase extraction with graphene-coated magnetic nanocomposite as adsorbent followed by gas chromatography-mass spectrometry detection[J]. Food Analytical Methods, 2014, 7(2): 318-325. DOI:10.1007/s12161-013-9629-1.
[9] SHI Xiaomei, JIN Fen, HUANG Yuting, et al. Simultaneous determination of five plant growth regulators in fruits by modified quick, easy, cheap, effective, rugged, and safe (QuEChERS) extraction and liquid chromatography-tandem mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2011, 60(1): 60-65. DOI:10.1021/ jf204183d.
[10] 金茂俊, 王静, 杨丽华, 等. 化学发光免疫分析方法在食品安全检测中的研究进展[J]. 食品安全质量检测学报, 2014(3): 840-845.
[11] 张新, 王丹, 陆晶晶, 等. T-2毒素、脱氧雪腐镰刀菌烯醇全抗原的合成及鉴定[J]. 卫生研究, 2015, 44(1): 95-98; 105.
[12] 罗舜菁, 陈婷婷, 刘成梅, 等. 对甲基苯甲酸连接的氯霉毒全抗原合成与鉴定[J]. 食品工业科技, 2011, 32(3): 200-203. DOI:10.13386/ j.issn1002-0306.2011.03.045.
[13] 邓发亮, 刘晓云, 唐时幸, 等. 莱克多巴胺人工抗原的合成与鉴定[J].食品科学, 2013, 34(18): 146-149. DOI:10.7506/spkx1002-6630-201318029.
[14] NA Yu, SHENG Wei, YUAN Meng, et al. Enzyme-linked immunosorbent assay and immunochromatographic strip for rapid detection of atrazine in water samples[J]. Microchimica Acta, 2012, 177(1/2): 177-184. DOI:10.1007/s00604-012-0772-y.
[15] 王欢, 屈会化, 赵琰, 等. 桔梗皂苷人工抗原的合成及鉴定[J]. 辽宁中医杂志, 2014, 41(4): 760-763.
[16] 朱学加, 陈金兰, 何计国. 喹乙醇人工抗原的合成及鉴定[J]. 食品科学, 2008, 29(5): 129-133.
[17] CAO Zhen, ZHAO Hongwei, CUI Yongliang, et al. Development of a sensitive monoclonal antibody-based enzyme-linked immunosorbent assay for the analysis of paclobutrazol residue in wheat kernel[J]. Journal of Agricultural and Food Chemistry, 2014, 62(8): 1826-1831. DOI:10.1021/jf404905w.
[18] 雷红涛, 沈玉栋, 刘文字, 等. 甲硝唑半抗原及全抗原合成与鉴定[J].华南农业大学学报, 2007, 28(3): 101-104.
[19] 俞林良, 周伟澄. 微波促进的化学反应在药物合成中的应用[J]. 中国医药工业杂志, 2007, 38(2): 128-134.
[20] 刘善字, 李浩亮, 李书芳, 等. 微波辐射法合成单琥珀酸薄荷酯[J]. 烟草科技, 2012(6): 48-51. DOI:10.3969/ j.issn.1002-0861.2012.06.011.
[21] 陈晓彬, 张剑锋, 周慧. 单甲氧基聚乙二醇与丁二酸/酐的催化酯化反应研究[EB/OL]. 中国科技论文在线, http://www.paper.edu.cn.
[22] 王建华, 张冲. 小分子抗原人工合成进展[J]. 应用化学, 2011, 28(4): 367-375. DOI:10.3724/SP. J.1095.2011.00364.
[23] 蔡碧双, 邵幼岩, 林纪昀, 等. 甘草酸人工抗原的合成鉴定及免疫原性分析[J]. 中国生化药物杂志, 2008, 29(1): 19-22.
[24] 王莹, 王希春, 金福源, 等. 质谱法测定4种真菌毒素与载体蛋白偶联物的结合比[J]. 食品科学, 2012, 33(2): 219-223.
[25] 吴定, 张羽航, 姚汝华. 乳中磺胺甲基嘧啶残留酶联免疫测定[J]. 食品科学, 1998, 19(6): 42-45.
[26] LI Qingxiao, ZHAO Mengshu, GEE S J, et al. Development of enzyme-linked immunosorbent assays for 4-nitrophenol and substituted 4-nitrophenols[J]. Journal of Agricultural and Food Chemistry, 1991, 39(9): 1685-1692. DOI:10.1021/jf00009a028.
[27] ERLNGER B F. The preparation of antigenic hapten-carrier conjugates: a survey[J]. Methods in Enzymology, 1980, 70(A): 85-104.
Synthesis and Identification of Stable Artificial Paclobutrazol Antigen
WANG Xiaofen1, YAN Aiping2, TAN Ting2, MAO Xuejin3, LIU Junjun1, GUO Lan2, WAN Yiqun1,2,*
(1. College of Chemistry, Nanchang University, Nanchang 330031, China; 2. Center of Analysis and Testing, Nanchang University, Nanchang 330047, China; 3. State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China)
In order to synthesize a novel and effective artificial paclobutrazol antigen, succinic anhydride method was used to modify the structure of paclobutrazol. Paclobutrazol hapten (PAC-HS) with an active carboxyl group was obtained, and conjugated separately with BSA (bovine serum albumin) and OVA (ovalbumin) by carbodiimide method. Immunogen and coating antigen were obtained and designated as PAC-HS-BSA and PAC-HS-OVA, respectively. The hapten was characterized by mass spectrometry, infrared spectroscopy and1H nuclear magnetic resonance spectroscopy. Ultraviolet spectrophotometry was applied to determine the artificial paclobutrazol antigen. The coupling ratios of the conjugates were determined by matrix-assisted laser desorption/ionization time-of-flight mass spectrometry (MALDI-TOF/MS). The results suggested that paclobutrazol antigen was successfully synthesized, which will greatly facilitate antibody production and immunoassay development.
paclobutrazol; hapten; artificial antigen; preparation
10.7506/spkx1002-6630-201607025
TS201.2
A
1002-6630(2016)07-0134-06
王晓芬, 鄢爱平, 谭婷, 等. 多效唑人工抗原的合成与鉴定[J]. 食品科学, 2016, 37(7): 134-139. DOI:10.7506/spkx1002-6630-201607025. http://www.spkx.net.cn
WANG Xiaofen, YAN Aiping, TAN Ting, et al. Synthesis and identification of stable artificial paclobutrazol antigen[J]. Food Science,2016, 37(7): 134-139. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201607025. http://www.spkx.net.cn
2015-08-15
江西省科技支撑计划项目(20133ACG70002;20141BBG70093;20141BBF60047);江西省教育厅2014年度科学技术研究项目(GJJ14221)
王晓芬(1989—),女,硕士研究生,研究方向为食品质量与安全。E-mail:luckyfen123@163.com
*通信作者:万益群(1964—),男,教授,博士,研究方向为食品质量与安全。E-mail:wanyiqun@ncu.edu.cn

