亚基水平上花生蛋白组成、结构和功能性质研究进展
徐 飞,刘 丽,石爱民,刘红芝,胡 晖,王 强
(中国农业科学院农产品加工研究所,农业部农产品加工综合性重点实验室,北京 100193)
亚基水平上花生蛋白组成、结构和功能性质研究进展
徐 飞,刘 丽,石爱民,刘红芝,胡 晖,王 强*
(中国农业科学院农产品加工研究所,农业部农产品加工综合性重点实验室,北京 100193)
我国花生种质资源丰富,不同品种间蛋白亚基组成不同,分子结构各异,功能性质差异显著。本文在亚基水平上综述了花生蛋白主要组分(球蛋白、伴花生球蛋白和清蛋白)的组成;对花生球蛋白和伴花生球蛋白分子结构研究进展进行了归纳;总结花生各蛋白亚基的功能性质研究进展;并归纳了花生蛋白研究中目前存在的问题,对我国花生蛋白研究的发展方向和趋势进行了展望;旨在明确亚基水平上花生蛋白研究进展,为广大花生蛋白研究者提供一定的借鉴意义。
花生蛋白;亚基;结构;功能性质
花生(Arachis hypogaea L.)是一种重要的豆科植物,起源于南美洲热带亚热带地区,种植地域广泛。我国花生种质资源丰富,种质库共保存6 075 份花生种质材料,为科学研究和加工适宜性品种筛选提供了很好的材料来源。
花生中蛋白质含量高达24%~36%,在油料作物中仅次于大豆(36%~51%),供给了11%的世界蛋白消费[1]。花生蛋白营养价值高,含有人体必需的8 种氨基酸成分,且具有易消化、胀腹因子少等优点,同时花生蛋白还具有吸水性、黏着性、分散性、凝胶性、乳化性等功能性质[2],在食品加工业领域逐渐发挥重要作用。花生蛋白的各种功能性质主要靠蛋白质实现,而这些功能性质发挥归根结底是基于亚基组成和分子结构所决定的。因此无论从研究还是生产上来说,在亚基层次上研究花生蛋白将对花生蛋白产业的发展具有极其重要的意义。
国内花生蛋白研究起步较晚,且目前研究多以花生分离蛋白或浓缩蛋白为研究对象,极少有文献涉及亚基层次上的花生蛋白组分,如花生球蛋白和伴花生球蛋白的研究,尤其是对基础研究方面,如亚基组成、分子结构、亚基与功能性质间构效关系等。本文从亚基角度上对花生蛋白亚基组成、结构解析、功能性质三方面进行国内外文献综述,综合分析了当前问题,提出花生蛋白亚基未来发展方向,以期为花生蛋白亚基深入研究和实际应用提供一定帮助。
1 文献统计
图1列举了1990ü2015年间《科学引文索引》(Science Citation Index,SCI)收录的各国关于花生蛋白和花生蛋白亚基相关的研究论文数量,可见美国不论在花生蛋白或是花生蛋白亚基方面研究都遥遥领先,其次则为中国和印度。美国花生消费以食用为主,仅15%用于榨油。此外,对花生蛋白的加工特性、营养特性和致敏反应的研究需求也最为迫切,因此研究文献数量可观;而中、印两国作为主要的花生生产国和消费国,花生大部分用于榨油(≥50%),花生蛋白的研究起步较晚。

图 1 各国关于花生蛋白(A)和花生蛋白亚基(B)的论文比例Fig.1 Proportion of research articles regarding peanut protein (A) and subunits in various countries (B)
花生蛋白中的两大组分花生球蛋白和伴花生球蛋白均隶属于豆科植物贮藏蛋白大类。为了横向比较同类蛋白研究进展情况,因此以贮藏蛋白亚基大类别为关键词搜索1990ü2015年间SCI索引文献,其中日本京都大学以85 篇居首,其次为法国农业科学研究院和美国农业部农业科学研究院。详细分析京都大学文献发现其主要以大豆蛋白为研究对象,1980ü1995年间,主要亚基水平上的功能性质尤其是凝胶性为主;1995ü2005年间,主要运用晶体学方法解析蛋白/蛋白亚基结构,并从结构角度出发研究其功能性质差异为主;2005年至今,则多关注与功能性质蛋白(铁转运蛋白、二硫键异构酶等),且研究范围扩至细胞领域(液泡、高尔基体、内质网)。作为与大豆蛋白高同源性的花生蛋白,该研究思路和研究轨迹应为我国花生蛋白的研究提供一定的借鉴意义。
2 花生蛋白亚基组成
2.1 花生蛋白亚基组成
花生蛋白根据其溶解特性可分为水溶性蛋白和盐溶性蛋白两大类(图2),其中大约10%的蛋白质为水溶性蛋白,其余90%为盐溶性蛋白[3]。盐溶性蛋白主要包括花生球蛋白(73%)和伴花生球蛋白(21%)。
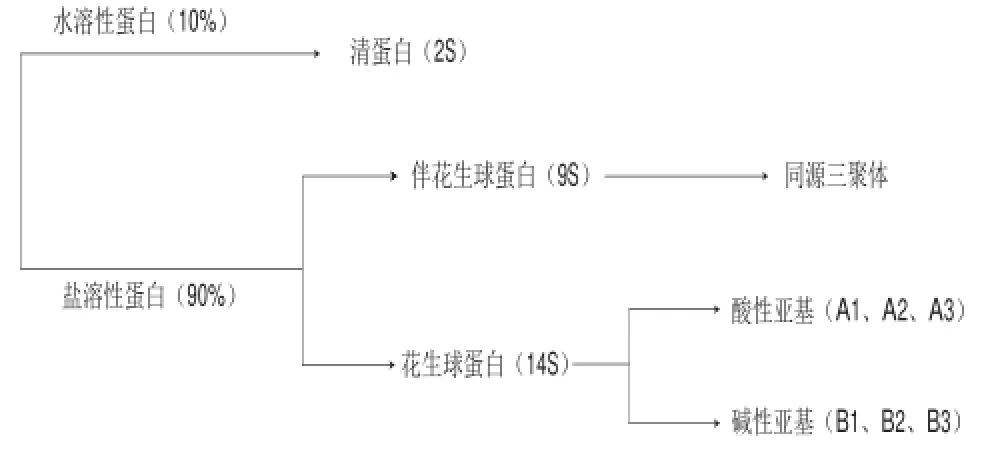
图 2 花生蛋白中几种主要蛋白和亚基组成Fig.2 Major peanut proteins and their subunit composition
2.1.1 花生球蛋白
花生球蛋白隶属于豆球蛋白家族(legumin),是花生中一类重要的贮藏性蛋白质[4-5]。在1950ü2015年间学术界对花生球蛋白的组成给予了广泛关注[6-17],关于花生球蛋白的亚基组成、聚合和解聚模式以及亚基间相互作用方式进行了报道。综合目前研究结果而言,花生球蛋白的研究已经达成一定共识,但仍在一些方面存在争议。
花生球蛋白可分为两种:花生球蛋白Ⅰ(arachinⅠ)和花生球蛋白Ⅱ(arachinⅡ),花生球蛋白Ⅰ为单体形式,沉降系数为9S,而花生球蛋白Ⅱ则以二聚体形式存在,沉降系数为14S,花生球蛋白亚基间以非共价方式结合,并无二硫键的存在[6,10-12]。但关于花生球蛋白的解聚-聚集行为模式仍存在些许争议。Johnson等[8]认为花生球蛋白的14S和9S组分在不同离子强度下存在比例不同,且两者间存在可逆转化;而Shetty等[18]研究表明所得的14S组分并不能解聚成9S组分;Yamada等[6]通过比较不同离子强度、不同pH值条件下花生球蛋白的超速离心组分,得出pH值和离子强度是影响其解聚和聚集可逆性的主要因素,并且由9S聚集而成的14S组分与本身存在的14S组分有不同的解聚模式。以上结论的分歧可能是由于提取蛋白的条件不同或是蛋白所处环境(pH值、离子强度等)不同,导致蛋白质有不同聚集-解聚行为,但具体原因仍需进一步实验确定。
2.1.2 伴花生球蛋白
伴花生球蛋白隶属于豌豆球蛋白家族b[4]。高度同源性的蛋白中研究最广泛的当属大豆β-伴球蛋白,已有研究发现该7S组分为异源三聚体,由3 个核心区高度同源的亚基α(67 kD)、α’(71 kD)、β(50 kD)组成[19]。不同于大豆β-伴球蛋白,研究发现伴花生球蛋白在蔗糖密度梯度实验中显示为一个7S球蛋白[20],是由60 kD亚基组成的同源三聚体,分子质量为180 kD[21]。但关于伴花生球蛋白的分子质量,目前说法并不统一,但基本处于60~66 kD范围间[16,20-21]。
2.1.3 2S清蛋白
2S清蛋白是双子叶植物,尤其是豆科植物的种子中主要的贮藏性蛋白,该家族蛋白具有特征性的四螺旋和4 个二硫键结构,该结构具有较高的紧凑性和耐蛋白水解性[22]。
杨晓泉等[16]通过激光质谱法测定了2S清蛋白的各组分的分子质量,发现其含有6 个主要多肽,并且多肽间是以解离形式存在,并通过单、双向电泳技术分离花生蛋白,结果表明2S清蛋白有6 个组分共用两个等电点(PI 5.0和PI 5.5)。林鹿等[23]研究表明2S蛋白主要由6 个亚基组成,分子质量分别为12.5、13、14、15.5、16.5、17 kD,该结果与杨晓泉等[16]研究结果相近。
2.2 花生蛋白亚基缺失
目前花生种质间蛋白亚基缺失多有报道。Shokraii等[24]利用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDSPAGE)和等电点聚焦分析了22 个花生品种,发现36 kD亚基的缺失品种,并证实36 kD条带与花生脱红衣容易度有关;杜寅[13]用SDS-PAGE分析了170 份花生品种的蛋白质含量,发现不同品种的蛋白质组分和亚基含量存在较大差异,其中双纪2号、粤油14号、闽花9号等25 个品种35.5 kD亚基缺失;Liang等[25]采用单/双向电泳技术,分析美国主要的兰娜型、西班牙型的12 个花生品种,发现兰娜型花生中的A-13缺失35 kD亚基,西班牙型中3 个品种缺失27 kD,并发现所有西班牙型均存在(22.5 kD,pI 3.9)和(23.5 kD,pI 5.7),而所有兰娜型花生中均不存在;而(23 kD,pI 6.6)和(22 kD,pI 6.8)则存在于所有兰娜型中,在所有西班牙型中缺失。
不同的蛋白亚基由于其氨基酸组成不同、排列顺序不同、肽链卷曲方式不同等造成功能性质有较大的差异。特定亚基的缺失品种将有利于某些功能性质的发挥,但目前花生蛋白亚基缺失品种多是自然突变获得。相比于大豆,除了自然突变之外,通过辐射和诱变得到不同亚基缺失材料,从而获得优良的加工适宜性品种(乳化型、凝胶型),在该方面日本较为领先,我国经引进也陆续培育得到了(α+β)缺失型,α、α’缺失品种[26]。因此,筛选、选育优良花生特定亚基缺失品种,研究其营养和功能特性,将有助于优质花生蛋白资源的开发,提升花生蛋白产业整体效益。
3 花生蛋白三维结构解析研究进展
3.1 三维结构解析概况
在美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库中,解析的花生蛋白的序列信息共有24 532 条,而关于蛋白质生物结构的信息则共有73 条,而其中解析结构中大部分为花生凝集素信息,其次为花生过敏原信息[27]。蛋白质数据库(protein data bank,PDB)中以花生为关键词,共检索结果36 条,其中凝集素(凝集素及其复合物)23 条,过敏原10 条,酶(二苯乙烯合成酶)3 条(图3)[28]。表1总结了花生蛋白和大豆蛋白亚基解析情况。综合可知花生蛋白结构的信息仍存在大部分空白,该领域应引起学者们的重视。

图3 花生蛋白三维结构解析研究现状Fig.3 Parsed molecular structures of peanut protein
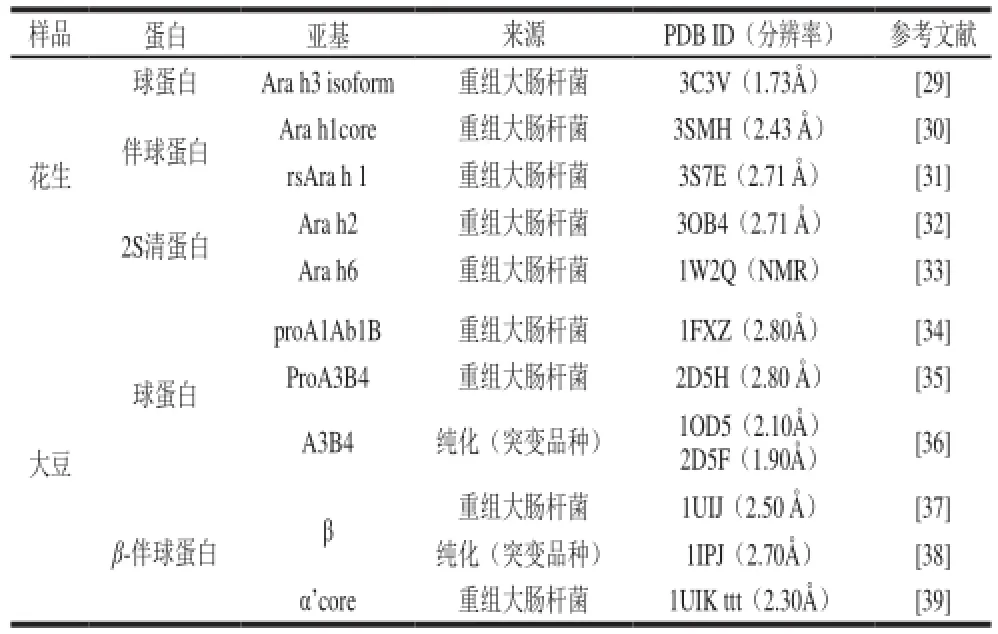
表1 花生蛋白和大豆蛋白三维结构解析情况对比Table 1 Comparison of parsed structures between peanut protein and soybean protein
3.2 花生蛋白三维结构
Jin等[40]于2007年采用体外重组的方法得到Ara h3的一个亚基,用悬滴法获得了结晶,并初步解析了其电子密度图(图4A),其团队于2009年得到该亚基的X射线衍射图谱[29](图4B),在1.73 Å分辨率下研究了Ara h3的晶体结构,确定了IgE线性结合表位,并通过线性表位的映射发现,与溶剂接触较多的线性表位即是前人文献中所综述的易于与病人血清反应的物质。
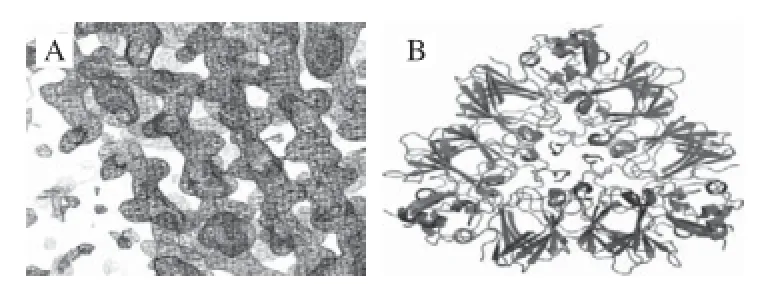
图4 花生蛋白Ara h3晶体结构[30,41]Fig.4 Crystal structure of peanut allergen Ara h3[30,41]
Cabanos等[30]对重组花生过敏原Ara h1进行X射线衍射,发现Ara h1的核心区结构同7S球蛋白十分相似,大多数的线性表位存在于N端和C端模块的环区和螺旋区域,其他的一些位于C端核心β-圆筒的β折叠上,这些表位能够影响三聚体的形成,也正是这些表位使得Ara h1可在肠道中完全或部分消化成碎片(图5)。


图5 花生蛋白Ara h1的晶体结构[31]Fig.5 Crystal structure of peanut allergen Ara h1[31]
目前花生中2S清蛋白高级结构得到解析的花生过敏原为Ara h2。Mueller等[32]对花生中致敏性最强过敏原Ara h2进行晶体结构解析,研究结果表明,Ara h2的5 个螺旋被4 个二硫键连结在一起,这种结构与淀粉酶和胰蛋白酶抑制剂很相似(图6);同时Lehmann等[33]研究证明Ara h2具有胰蛋白酶抑制活性,并且经过烘烤处理后其抑制活性被显著提高。夏立新等[41]比较Ara h 2和Ara h 6的生物信息,发现两者从一级结构到三级结构均极为相似,奠定了两者交叉反应的分子基础。

图6 花生过敏原Ara h2的晶体结构[33]Fig.6 Crystal structure of peanut allergen Ara h2[33]
4 蛋白亚基与功能性质关系
植物蛋白品质的好坏主要取决于它的营养特性和功能特性,其中功能特性主要包括溶解性、水合性、乳化性、起泡性、凝胶性和聚集性等。蛋白的功能性质与其蛋白质的分子质量分布、亚基的大小及其组成、亚基的解离/聚合性质、二硫键多寡及其热稳定性、亲水/疏水作用等有着密切的关系[42]。
4.1 溶解性
溶解性是发挥诸如凝胶、起泡、乳化等功能性质的先决条件。王丽[43]通过测试66 个花生品种的蛋白亚基的加工性质,分析得知花生分离蛋白的溶解性与18 kD亚基成显著相关性,但并未进行深入探讨该亚基造成溶解性差异的原因。目前有报道通过化学或酶改性,提高蛋白亚基水合性[44-46]。Gruener等[44]发现对蛋白质琥珀酰化能明显提高蛋白质溶解性和分子柔性,其原因在于琥珀酰化可有效展开蛋白亚基结构,促进分子的伸展和亲水基团的暴露。酶解方式可以导致蛋白亚基降解,从而提高溶解性[45],也可能通过专一性的水解,使亲水性基团暴露提高水解析。Larre等[46]研究发现加热后TGase酶更容易与蛋白亚基结合反应,提高水合性。
4.2 凝胶性
蛋白的凝胶性是重要功能特性,由于植物蛋白组成的高度不均一性以及复杂的空间构象,且应用中受诸如离子强度、温度、pH值、压力等多方面因素影响[47],因此研究其凝胶机理具有很大难度。
王丽[43]测试了66 个花生品种的蛋白亚基和花生分离蛋白的加工性质,数据相关性分析得知花生分离蛋白凝胶性与23.5 kD亚基成显著相关性。其他花生蛋白亚基的凝胶性还未见报道,而大豆蛋白方面,Utsumi等[48]研究了大豆蛋白凝胶形成过程,发现大豆11S球蛋白中酸性亚基对凝胶形成有重要作用,且A3比A4更重要,7S中3 个亚基均参与了凝胶形成;Poysa等[49]研究认为A3亚基对豆腐凝胶硬度起着重要作用,而A4亚基对豆腐品质起负作用,A1和A2亚基可以使豆腐质地显著好于缺少该亚基的豆腐,缺少α’亚基比含有该亚基时的凝胶硬度增加了;Salleh等[50]研究了7S蛋白缺失α及α’亚基对大豆蛋白凝胶性的影响,结果表明影响关系为:缺失α’亚基>7S全亚基>缺失α亚基。
4.3 热特性
热处理是食品行业中最常见的加工形式之一,因此研究花生蛋白在受热条件下的稳定性十分有必要。刘岩等[51]从单位时间内物料内热能随温度变化的角度分析,得知花生球蛋白的热稳定性要好于伴花生球蛋白,且其变性协同性也好于伴花生球蛋白。杨晓泉等[16]则从100 ℃下持续受热的稳定性角度出发,得知花生球蛋白的酸性亚基(40.5、37.5 kD)耐热性较差,而其碱性亚基(19.5 kD)则完全不耐热。而关于大豆蛋白亚基与热特性间的构效关系则研究比较深入。Maruyama等[39]研究发现大豆β-伴球蛋白的3 个亚基的热稳定性顺序为:β>α’>α,并且解析其三维结构发现该性质主要由核心区控制,从结构角度解释了α’和β亚基热稳定性差异的原因:1)α’亚基的空腔体积较大;2)α’亚基的内部单体界面的带电残基聚集较少,并且缺乏同β亚基一样的盐桥;3)α亚基的溶剂可及表面的疏水性更强;4)α’亚基含有较少的脯氨酸残基;5)α’亚基由于5 个额外的残基的插入,在螺旋3和J’链之间的一个环区更加灵活。
总体而言,花生蛋白亚基的功能性质研究总体处于初级阶段,单个亚基与功能性质的研究多停留于现象发现层面,且一般是通过突变品种观测得到;而亚基与亚基间的交互作用对功能性质的影响则尚未见文献报道,因此研究特定亚基的功能性质和亚基间的交互反应无疑应成为下一阶段研究的重点。
5 结 语
以上文献综述可知,花生蛋白研究主要存在以下三方面问题:花生亚基间的解聚和聚合模式还未明确,及聚合解聚对花生蛋白性质的影响还鲜有涉及;亚基的鉴定和结构解析方面还存在诸多空白,导致构效关系分析不明确;蛋白中特定亚基的功能性质,以及该亚基与其他亚基的交互作用对蛋白功能性质的影响还未见涉及。
针对以上存在的问题,今后花生蛋白的研究重点应主要集中于以下三个方面:1)明确花生蛋白亚基的解聚和聚合模式,及其对花生蛋白功能性质的影响。研究不同溶液体系、不同外界刺激条件下花生蛋白亚基的解聚和聚合模式,并在特定聚集模式下蛋白的功能性质。2)加深花生蛋白亚基三维结构解析,从结构角度解析花生蛋白构-效关系。单纯对某个蛋白功能性质的研究已经逐渐无法满足现在的研究需求,研究工作者应从结构解析角度入手,深入分析构效关系,为分子修饰、分子设计和功能改性等研究提供理论和可行性基础。3)亚基水平功能性质研究,解释亚基功能性质差异以及亚基间的交互作用。由研究综述可知,花生蛋白的功能性质研究仍停留于比较粗的组分方面,关于其超速离心组分,或单个亚基以及亚基间的功能性质对比研究仍有欠缺。亚基间交互作用方面(协同增效抑或相互消减),应作为广大研究工作者关注重点。
[1] KOTTAPALLI K R, PAYTON P, RAKWAL R, et al. Proteomics analysis of mature seed of four peanut cultivars using two-dimensional gel electrophoresis reveals distinct differential expression of storage, anti-nutritional, and allergenic proteins[J]. Plant Science, 2008, 175(3): 321-329. DOI:10.1016/ j.plantsci.2008.05.005.
[2] 赵晓燕, 孙秀平, 陈锋亮, 等. 花生蛋白的研究进展与开发利用现状[J]. 中国粮油学报, 2012, 26(12): 118-122.
[3] 杜寅, 王强, 刘红芝, 等. 花生蛋白组分及其功能性质研究进展[J].食品科学, 2012, 33(1): 285-289.
[4] FREITAS R L, TEIXEIRA A R, FERREIRA R B. Vicilin-type globulins follow distinct patterns of degradation in different species of germinating legume seeds[J]. Food Chemistry, 2007, 102(1): 323-329. DOI:10.1016/j.foodchem.2006.05.023.
[5] FERREIRA R B, FREITAS R L, TEIXEIRA A R. Self-aggregation of legume seed storage proteins inside the protein storage vacuoles is electrostatic in nature, rather than lectin-mediated[J]. FEBS Letters, 2003, 534(1): 106-110. DOI:10.1016/S0014-5793(02)03801-2.
[6] YAMADA T, AIBARA S, MORITA Y. Accumulation pattern of arachin and its subunits in maturation of groundnut seeds[J]. Plant and Cell Physiology, 1980, 21(7): 1217-1226.
[7] BASHA S M. Accumulation pattern of arachin in maturing peanut seed 1[J]. Peanut Science, 1989, 16(2): 70-73.
[8] JOHNSON P, SHOOTER E M, RIDEAL E K. The globulins of the ground nut (Arachis hypogaea): II. Electrophoretic examination of the arachin system[J]. Biochimica et Biophysica Acta, 1950, 5: 376-396. DOI:10.1016/0006-3002(50)90184-3.
[9] KRISHNA T G, MITRA R. Arachin polymorphism in groundnut (Arachis hypogaea)[J]. Phytochemistry, 1987, 26(4): 897-902.
[10] BHUSHAN R, ARYA U. Reversed-phase high-performance liquid chromatographic, size exclusion chromatographic and polyacrylamide gel electrophoretic studies of glycinin: evidence for molecular species and their association-dissociation[J]. Biomedical Chromatography, 2007, 21(12): 1245-1251. DOI:10.1002/bmc.876.
[11] BHUSHAN R, AGARWAL R. Investigation of arachin and its molecular species[J]. Proceedings of the National Academy of Sciences, India Section A: Physical Sciences, 2007, A(77): 71-77.
[12] BHUSHAN R, DIXIT S. Application of HPLC, Gel electrophoresis and size exclusion chromatography for separation and characterization of storage proteins of soybean and peanut[J]. Acta Chromatographica, 2012, 24(3): 323-349. DOI:10.1556/ AChrom.24.2012.3.1.
[13] 杜寅. 花生蛋白主要组分的制备及凝胶特性研究[D]. 北京: 中国农业科学院, 2012: 13-22.
[14] LIU Y, ZHAO G L, REN J Y, et al. Effect of denaturation during extraction on the conformational and functional properties of peanut protein isolate[J]. Innovative Food Science and Emerging Technologies, 2011, 12(3): 375-380. DOI:10.1016/ j.ifset.2011.01.012.
[15] LIU Y, ZHAO G, ZHAO M, et al. Improvement of functional properties of peanut protein isolate by conjugation with dextran through Maillard reaction[J]. Food Chemistry, 2012, 131(3): 901-906. DOI:10.1016/j.foodchem.2011.09.074.
[16] 杨晓泉, 陈中, 赵谋明. 花生蛋白的分离及部分性质研究[J]. 中国粮油学报, 2001, 16(5): 25-28. DOI:10.3321/j.issn:1003-0174.2001.05.007.
[17] FENG X L, LIU H Z, SHI A M, et al. Effects of transglutaminase catalyzed crosslinking on physicochemical characteristics of arachin and conarachin-rich peanut protein fractions[J]. Food Research International, 2014, 62: 84-90. DOI:10.1016/j.foodres.2014.02.022.
[18] SHETTY K J, RAO M S N. Groundnut proteins. IV. Effect of storage or proteolysis on the gel electrophoresis pattern of arachin[J]. Journal of Agricultural and Food Chemistry, 1975, 23(6): 1220-1221. DOI:10.1021/jf60202a036.
[19] 祝祥威, 黄行健, 赵琪, 等. 亚基水平上大豆蛋白改性修饰的研究进展[J]. 食品科学, 2012, 33(23): 388-392.
[20] WICHERS H J, de BEIJER T, SAVELKOUL H F J, et al. The major peanut allergen Ara h 1 and its cleaved-off N-terminal peptide; possible implications for peanut allergen detection[J]. Journal of Agricultural and Food Chemistry, 2004, 52(15): 4903-4907. DOI:10.1021/jf0496970.
[21] 赵谋明, 辛佩贤, 赵强忠, 等. 酸性条件下花生分离蛋白亚基结构的变化规律[J]. 现代食品科技, 2014, 30(12): 37-42. DOI:10.13982/j.mfst.1673-9078.2014.12.007.
[22] ROBOTHAM J M, WANG F, SEAMON V, et al. Ana o 3, an important cashew nut (Anacardium occidentale L.) allergen of the 2S albumin family[J]. Journal of Allergy and Clinical Immunology, 2005, 115(6): 1284-1290. DOI:10.1016/j.jaci.2005.02.028.
[23] 林鹿, 傅家瑞. 花生种子2S蛋白[J]. 花生科技, 1994(3): 1-4.
[24] SHOKRAII E H, ESEN A, MOZINGO R W. Relation of a 36,000-dalton arachin subunit to blanchability in peanuts (Arachis hypogaea L.)[J]. Journal of Agricultural and Food Chemistry, 1985, 33(6): 1114-1116. DOI:10.1021/jf00066a024.
[25] LIANG X Q, LUO M, HOLBROOK C C, et al. Storage protein profiles in Spanish and runner market type peanuts and potential markers[J]. BMC Plant Biology, 2006, 6(24): 1-9. DOI:10.1186/1471-2229-6-24.
[26] 张国敏, 张亚琴, 舒英杰, 等. 三种大豆种子贮藏蛋白亚基缺失种质的筛选与鉴定[J]. 大豆科学, 2015, 34(1): 1-8; 31. DOI:10.11861/j.issn.1000-9841.2015.01.0001.
[27] The National Center for Biotechnology Information[DB/OL]. [2015-07-26]. http://www.ncbi.nlm.nih.gov/.
[28] Protein Data Bank [DB/OL].[2015-07-26]. http://www.rcsb.org/ pdb/home/home.do.
[29] JIN T, GUO F, CHEN Y, et al. Crystal structure of Ara h 3, a major allergen in peanut[J]. Molecular Immunology, 2009, 46(8): 1796-1804. DOI:10.1016/j.molimm.2009.01.023.
[30] CABANOS C, URABE H, TANDANG-SILVAS M R, et al. Crystal structure of the major peanut allergen Ara h 1[J]. Molecular Immunology, 2011, 49(1): 115-123. DOI:10.1016/j.molimm.2011.08.004.
[31] CHRUSZCZ M, MALEKI S J, MAJOREK K A, et al. Structural and immunologic characterization of Ara h 1, a major peanut allergen[J]. Journal of Biological Chemistry, 2011, 286(45): 39318-39327. DOI:10.1074/jbc.M111.270132.
[32] MUELLER G A, GOSAVI R A, POMÉS A, et al. Ara h 2: crystal structure and IgE binding distinguish two subpopulations of peanut allergic patients by epitope diversity[J]. Allergy, 2011, 66(7): 878-885. DOI:10.1111/j.1398-9995.2010.02532.x.
[33] LEHMANN K, SCHWEIMER K, REESE G, et al. Structure and stability of 2S albumin-type peanut allergens: implications for the severity of peanut allergic reactions[J]. Biochemistry Journal, 2006, 395(3): 463-472. DOI:10.1042/BJ20051728.
[34] ADACHI M, TAKENAKA Y, GIDAMIS A B, et al. Crystal structure of soybean proglycinin A1aB1b homotrimer[J]. Journal of Molecular Biology, 2001, 305(2): 291-305. DOI:10.1006/ jmbi.2000.4310.
[35] TANDANG-SILVAS M R G, FUKUDA T, FUKUDA C, et al. Conservation and divergence on plant seed 11S globulins based on crystal structures[J]. Biochimica et Biophysica Acta (BBA)-Proteins and Proteomics, 2010(7): 1432-1442. DOI:10.1016/ j.bbapap.2010.02.016.
[36] ADACHI M, KANAMORI J, MASUDA T, et al. Crystal structure of soybean 11S globulin: glycinin A3B4 homohexamer[J]. Proceedings of the National Academy of Sciences, 2003, 100(12): 7395-7400. DOI:10.1073/pnas.0832158100.
[37] MARUYAMA N, MARUYAMA Y, TSURUKI T, et al. Creation of soybean β-conglycinin β with strong phagocytosisstimulating activity[J]. Biochimica et Biophysica Acta (BBA)-Proteins and Proteomics, 2003(1/2): 99-104. DOI:10.1016/S1570-9639(03)00113-4.
[38] MARUYAMA N, ADACHI M, TAKAHASHI K, et al. Crystal structures of recombinant and native soybean β-conglycinin β homotrimers[J]. European Journal of Biochemistry, 2001, 268(12): 3595-3604.
[39] MARUYAMA Y, MARUYAMA N, MIKAMI B, et al. Structure of the core region of the soybean β-conglycinin α’ subunit[J]. Acta Crystallographica Section D: Biological Crystallography, 2004, 60(2): 289-297.
[40] JIN T, HOWARD A, ZHANG Y Z. Purification, crystallization and initial crystallographic characterization of peanut major allergen Ara h 3[J]. Acta Crystallographica Section F: Structural Biology and Crystallization Communications, 2007, 63(10): 848-851. DOI:10.1107/S1744309107041176.
[41] 夏立新, 闫浩, 汤慕瑾, 等. 花生过敏原Ara h2与Ara h6的生物信息学比较研究[J]. 深圳大学学报(理工版), 2010, 27(2): 241-246. DOI:10.3969/j.issn.1000-2618.2010.02.021.
[42] 涂宗财, 汪菁琴, 刘成梅, 等. 动态超高压均质制备纳米级蛋白及其功能特性的研究[J]. 食品工业科技, 2007, 28(2): 89-91; 95. DOI:10.3969/j.issn.1002-0306.2007.02.020.
[43] 王丽. 蛋白用花生加工特性与品质评价技术研究[D]. 北京: 中国农业科学院, 2012: 44-64.
[44] GRUENER L, ISMOND M A H. Effects of acetylation and succinylation on the functional properties of the canola 12S globulin[J]. Food Chemistry, 1997, 60(4): 513-520. DOI:10.1016/ S0308-8146(97)00016-2.
[45] 王莹, 王瑛瑶, 刘建学, 等. 花生蛋白水合性质的研究进展[J].食品工业科技, 2014, 35(13): 374-377. DOI:10.13386/ j.issn1002-0306.2014.13.073.
[46] LARRE C, CHIARELLO M, BLANLOEIL Y, et al. Gliadin modifications catalyzed by guinea pig liver transglutaminase[J]. Journal of Food Biochemistry, 1993, 17(4): 267-282. DOI:10.1111/ j.1745-4514.1993.tb00472.x.
[47] 金郁葱. 大豆蛋白凝胶结构和质构的控制研究[D]. 广州: 华南理工大学, 2013: 3-4.
[48] UTSUMI S, KINSELLA J E. Structure-function relationships in food proteins: subunit interactions in heat-induced gelation of 7S, 11S, and soy isolate proteins[J]. Journal of Agricultural and Food chemistry, 1985, 33(2): 297-303. DOI:10.1021/jf00062a035.
[49] POYSA V, WOODROW L, YU K. Effect of soy protein subunit composition on tofu quality[J]. Food Research International, 2006, 39(3): 309-317. DOI:10.1016/j.foodres.2005.08.003.
[50] SALLEH M R B, MARUYAMA N, TAKAHASHI K, et al. Gelling properties of soybean β-conglycinin having different subunit compositions[J]. Bioscience, Biotechnology, and Biochemistry, 2004, 68(5): 1091-1096.
[51] 刘岩, 赵冠里, 苏新国. 花生球蛋白和伴球蛋白的功能特性及构象研究[J]. 现代食品科技, 2013, 29(9): 2095-2101.
Composition, Structures and Functional Properties of Peanut Seed Protein at Subunit Level: A Review
XU Fei, LIU Li, SHI Aimin, LIU Hongzhi, HU Hui, WANG Qiang*
(Key Laboratory of Agro-Products Processing, Ministry of Agriculture, Institute of Food Science and Technology, Chinese Academy of Agricultural Sciences, Beijing 100193, China)
Peanut germplasm resources are very rich and diverse in China, and subunit composition, molecular structures and functional properties are different in different peanut varieties. In this paper, the subunit composition of major peanut protein components such as arahin, conarachin and albumin is overviewed. Herein, we provide a systematic review of the recent progress made in the studies of the molecular structures of arahin and conarachin and the functional properties of each subunit at the subunit level. In addition, some problems encountered in the research on peanut proteins are summarized and the future research direction is proposed, aiming to provide a reference for researchers in this field.
peanut protein; subunit; structure; functional property
10.7506/spkx1002-6630-201607047
TS225.1
A
1002-6630(2016)07-0264-06
徐飞, 刘丽, 石爱民, 等. 亚基水平上花生蛋白组成、结构和功能性质研究进展[J]. 食品科学, 2016, 37(7): 264-269. DOI:10.7506/spkx1002-6630-201607047. http://www.spkx.net.cn
XU Fei, LIU Li, SHI Aimin, et al. Composition, structures and functional properties of peanut seed protein at subunit level: a review[J]. Food Science, 2016, 37(7): 264-269. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201607047. http://www.spkx.net.cn
2015-07-17
中国农业科学院科技创新工程项目(CAAS-ASTIP-201X-IAPPST)
徐飞(1989—),女,硕士研究生,研究方向为食品科学。E-mail:love_faith@163.com
*通信作者:王强(1965—),男,研究员,博士,研究方向为粮油加工与功能食品。E-mail:wangqiang06@caas.cn

