玉米大斑病菌漆酶基因Stlac2结构分析及原核表达
马双新,刘 宁,贾 慧,戴冬青,许苗苗,曹志艳,董金皋
玉米大斑病菌漆酶基因结构分析及原核表达
马双新,刘 宁,贾 慧,戴冬青,许苗苗,曹志艳,董金皋
(河北农业大学河北省植物生理与分子病理学重点实验室,河北保定 071001)
【目的】对玉米大斑病菌()漆酶基因进行生物信息学分析,推测其蛋白功能,探究木质素降解过程中产生的小分子物质对表达的影响,并对其进行克隆及原核表达,以便深入研究该基因在病菌生长、发育及致病过程中的作用。【方法】通过NCBI查询获得玉米大斑病菌EOA90070 ()基因的全序列,通过ClustalX与马尔尼菲青霉菌()(PMAA_082060)基因、烟曲霉()(AFUA_2G17530)基因、构巢曲菌()(AN6635) 基因等漆酶家族基因进行蛋白序列比对,查看中的铜离子结合位点,利用在线软件SOPMA和ProtParam对其二级结构及理化性质进行检测,通过SWISS-MODEL对Stlac2蛋白质的三维结构进行预测,采用SAVES对三维结构进行评价。通过对ABTS的氧化试验确定木质素降解过程中产生的小分子物质对玉米大斑病菌漆酶产量的影响;利用RT-qPCR方法分析小分子物质对表达规律的影响;采用原核表达系统,以pET-30a表达载体为框架,对其进行原核表达,并将表达蛋白纯化,以ABTS为底物,420 nm下检测漆酶活性。【结果】具有典型的Cu离子结合位点,与漆酶典型的Cu离子结构域相似。其蛋白二级结构中-螺旋、延伸链、-转角、无规则卷曲所占比例分别为18.59%、25.63%、11.91%和43.86%,分子量为61.64 kD,等电点为5.00,平均疏水性为-0.37,表明其为亲水蛋白。当在PDA中添加0.01 g·L-1香草醛、4-羟基苯甲醛、丁香醛、香草酸、4-羟基苯甲酸和香兰素时,玉米大斑病菌胞外漆酶的产量为香草酸>香兰素>4-羟基苯甲醛>4-羟基苯甲酸>丁香醛>对照。而在4-羟基苯甲醛和4-羟基苯甲酸存在时,玉米大斑病菌的相对表达量明显升高,约为对照的5—8倍。利用原核表达系统,在67 kD处成功诱导表达出一条特异性蛋白条带,大量表达纯化后,漆酶活性为(40.7±0.3)U·L-1。【结论】阐明了的生物信息学特性,初步断定其为漆酶基因;4-羟基苯甲醛和4-羟基苯甲酸可显著提高相对表达量,表明其在木质素降解过程中起到了一定的作用;该基因所编码的蛋白可通过pET-30a原核表达系统表达,体外漆酶活性可达(40.7±0.3)U·L-1,该研究结果为后期研究蛋白性质打下了基础。
玉米大斑病菌;;生物信息学分析;RT-qPCR;原核表达
0 引言
【研究意义】漆酶(EC1.10.3.2)是一类在催化中心含有多个铜离子的多酚氧化酶,也被称为多铜氧化酶[1]。在真菌中,漆酶主要参与病菌与寄主间的互作。以玉米大斑病菌()漆酶基因为出发点,探索其生物学特性,可为研究其在玉米大斑病菌致病过程中的作用打下基础,对病害防治具有重要意义。【前人研究进展】根据铜离子的配位清空和光谱特性,可将漆酶分为3种类型(类型I、类型II、类型III)[2]。漆酶的I型铜原子和氨基酸残基结合成为单核中心,II型和III型铜原子构成3核中心,I型铜原子作为初级电子的接受者,它参与分子内的电子传递,把电子从底物传递到其他铜原子上;之后电子结合于3核位点,该位点进一步把电子传递给活性中心的第二底物氧分子,使之还原为水[3]。漆酶广泛存在于高等植物和真菌中,在昆虫[4]和细菌中也有发现[5-8]。在高等植物中,漆酶在木质素形成过程中起到了主要作用[9-13]。而在真菌研究中发现,漆酶主要参与病菌的致病性、形态建成和木质素降解等过程[14];如漆酶基因的缺失导致其毒力和致病性较野生型菌株均有所下降;同样,中漆酶基因的缺失导致其抗逆性和致病性降低。漆酶能够氧化酚、多酚、芳香胺和一些非酚类化合物,将底物分子上的电子转移到氧分子上,从而使氧还原成水[15]。自然条件下伴随着木质素的降解过程会产生一些小分子物质,例如香草醛、4-羟基苯甲醛、丁香醛、香草酸、4-羟基苯甲酸和香兰素等[16-17],这些小分子物质严重影响了木质素的后续降解过程[18-19]。漆酶能够氧化这些小分子物质,同样在这些物质存在的条件下,也能诱导漆酶的活性及产量的增加,如香草酸可影响真菌漆酶的活性及产量[20],香兰素和丁香酸对sp. AH28-2漆酶活性有明显的诱导作用[21],阿魏酸和香草醛可使漆酶产量提高10倍[22],4-羟基苯甲酸对漆酶基因有显著的诱导作用[23],香草酸和壬基酚对漆酶基因有显著诱导作用,添加1 mmol·L-1香草酸的样品在第10天时漆酶基因的表达量是对照的7倍左右[24]。玉米大斑病是由玉米大斑病菌引起的一种真菌病害,在世界各个玉米产区危害严重[25-26]。曹志艳[27]通过RACE技术从玉米大斑病菌基因组中克隆到,曹可可[28]通过多铜氧化酶结合铜离子的保守结构域比对玉米大斑病菌基因组,预测到了9个具有典型铜离子结合结构域的类漆酶基因,其中EOA90070与曹志艳克隆到的基因序列一致,并将其命名为,根据表达的蛋白质序列与已报道的多个真菌漆酶进行比对分析,发现 EOA90070()与小麦黄斑病菌()等致病漆酶同源性较高,属于狭义的子囊菌漆酶,推测该基因在玉米大斑病菌侵染寄主过程中起重要作用。詹旭等[29]研究发现,玉米大斑病菌、玉米小斑病菌()、玉米弯孢叶斑病菌()等10个产漆酶的植物病原真菌均具有降解木质素的能力,其中玉米大斑病菌产漆酶活性最高,为18.984 U·mL-1。曹可可等[30]建立了以漆酶活性为响应值的多元二次回归模型,对玉米大斑病菌发酵条件进行优化,最佳条件下漆酶活性最高达(40.00±1.20)U·mL-1。【本研究切入点】在笔者实验室前人研究的基础上,进一步探究玉米大斑病菌漆酶基因的结构及其蛋白活性,筛选确定影响该基因表达的底物分子。【拟解决的关键问题】通过对进行生物信息学分析,检验基因所属类别,通过分析其在不同小分子物质存在条件下的表达情况,研究在降解木质素过程中起到的作用,并通过原核表达来探究其催化条件,为进一步研究基因及蛋白功能打下基础。
1 材料与方法
试验于2015年10月至2016年8月在河北农业大学真菌毒素与植物分子病理学实验室完成。
1.1 试验材料
玉米大斑病菌01-23由河北农业大学真菌毒素与植物分子病理学实验室保存。RNA提取试剂盒,TransStart Top Green qPCR SuperMix,BL21(DE3)购于北京全式金生物技术有限公司;限制性内切酶H I、d III、 LA Taq DNA酶、T4 Ligase、PrimeScriptTMRT Reagent Kit with gDNA Eraser(Perfect Real Time)反转录试剂盒等购于TaKaRa公司。
1.2 供试培养基及试剂
PDA培养基(g·L-1):马铃薯200,葡萄糖20,琼脂粉13,自然pH;PD培养基(g·L-1):马铃薯200,葡萄糖20。以上培养基均需经过1×105Pa,121℃灭菌20 min后使用。ABTS购于生工生物工程(上海)股份有限公司。柠檬酸缓冲液(pH 3.0):0.1 mol·L-1柠檬酸18.6 mL,0.1 mol·L-1柠檬酸三钠1.4 mL。
1.3 方法
1.3.1 Stlac2生物信息学分析 通过NCBI查找玉米大斑病菌Stlac2(EOA90070)与已知漆酶基因,如马尔尼菲青霉菌(Penicillium marneffei)PbrB(PMAA_082060)、烟曲霉(Aspergillus fumigatus)Abr2 (AFUA_2G17530)、构巢曲菌(Aspergillus nidulans)YA(AN6635)用ClustalX进行蛋白序列比对,查看Stlac2中的铜离子结合位点;利用在线软件SOPMA(http://nhjy.hzau.edu.cn/kech/swxxx/jakj/dianzi/ Bioinf7/Expasy/Expasy8.htm)和ProtParam(http://web. expasy.org/protparam/)对其二级结构及理化性质进行检测,最后用SWISS-MODEL(http://swissmodel. expasy.org/)对Stlac2蛋白的三维结构进行预测,并用SAVES(http://services.mbi.ucla.edu/SAVES/)对三维结构进行评价。
1.3.2 玉米大斑病菌总RNA的提取 将生长在PDA培养基上4 d的玉米大斑病菌分别接种至含有0.01 g·L-1的香草醛、4-羟基苯甲醛、紫丁香醛、香草酸、4-羟基苯甲酸和丁香酸的PD培养基中,于25℃,黑暗静置培养7 d后,搜集菌丝,用Up试剂盒提取总RNA用于的表达分析及cDNA克隆。
1.3.3在不同木质素降解产物中的表达分析 将1.3.2中提取的玉米大斑病菌总RNA根据PrimeScriptTMRT Reagent Kit with gDNA Eraser(Perfect Real Time)反转录试剂盒操作说明,将RNA反转录成cDNA。置于-80℃保存。根据基因序列设计RT-qPCR引物,并以作为内参。用Eppendorf Mastercyclyer ep实时荧光定量PCR仪,对在不同小分子物质存在下的表达情况进行检测,每组试验重复3次。引物序列见表1。

表1 玉米大斑病菌漆酶表达分析引物
1.3.4的原核表达及活性检测 以pET-30a为框架,用-F:5′-ATGTCTT ACAATG -3′,-R:5′-CAGGC CCGAGTCG -3′(下划线为加入酶切位点H I和d III)扩增cDNA全序列,构建原核表达载体pET-,之后将表达载体转入BL21(DE3)感受态细胞中,挑取阳性克隆接种至含有50 μg·mL-1卡那霉素的LB培养基中,于37℃,220 r/min条件下培养,待其OD600达0.7—0.8,用1 mmol·L-1的IPTG诱导,2、4 h后分别取样1.5 mL,6 000 r/min室温离心2 min。用30 μL 5×SDS上样缓冲液重悬沉淀,沸水浴15 min,5 000 r/min室温离心1 min,取10 μL上清液进行聚丙烯酰胺凝胶电泳(12%分离胶,5%浓缩胶),检测蛋白表达情况。Stlac2蛋白的纯化步骤如下:(1)15℃诱导 12 h,收集细胞,并用140 ml冰浴的Buffer A(20 mmol·L-1Tris-HCl,300 mmol·L-1NaCl,1% Triton-100,pH 8.0)重悬,超声裂解细胞,离心后上清过Ni-IDA柱;(2)200 ml Buffer E(20 mmol·L-1Tris-HCl pH 8.0,2 mol·L-1NaCl,0.1% TritonX-100)洗涤 Ni-IDA 柱;(3)50 ml Buffer F(20 mmol·L-1Tris-HCl pH 8.0,50 mmol·L-1NaCl,0.1% TritonX-100,20 mmol·L-1咪唑)洗涤Ni-IDA柱;(4)用Buffer G(20 mmol·L-1Tris-HCl pH 8.0,50 mmol·L-1NaCl,0.1% TritonX-100,250 mmol·L-1咪唑)洗脱 Ni-IDA柱。
Stlac2蛋白的活性检测:漆酶活性的检测采用ABTS法。5 mL反应体系中含有100 mmol·L-1的柠檬酸缓冲液(pH 3.0),2 mmol·L-1的ABTS,50 μL的Stlac2纯化蛋白,于30℃反应5 min,测定420 nm下吸光度的变化值。每分钟使1 μmol ABTS 氧化所需要的酶量定义为一个酶活力单位。公式如下:
U·L-1=n×△A×106/36 000/5
其中,n为稀释倍数,△A为反应液5 min中内在420 nm处吸光度变化值,消光系数ξ为36 000 mol·L-1·cm-1。
2 结果
2.1生物信息
通过ClustalX软件对玉米大斑病菌漆酶基因与已知漆酶基因进行序列比对,并对其不同类型的Cu离子结合位点进行分析(图1)。发现在中的所有铜离子结合位点均与已知漆酶一致,说明为典型的漆酶基因。
通过SOPMA在线软件对蛋白的二级结构进行预测分析(图2),得出-螺旋、延伸链、-转角和无规则卷曲在554个氨基酸中所占的比例分别为18.59%、25.63%、11.91%和43.86%(表2)。
通过在线软件ProtParam对其理化性质进行推测,发现分子量为61.64 kD,等电点为5.00,不稳定系数为30.23,280 nm处吸光值介于1.627—1.635,总体疏水性(GRAVY)为-0.37,表明其为亲水蛋白(表3)。
利用SWISS-MODEL对Stlac2蛋白质的三维结构进行预测(图3-A),并用SAVES在线软件对三维结构进行质量评估(图3-B)。核心区域的残基位点占83.2%,其他允许区域残基位点占16.1%,不合理残基位点占0.7%。3D-1D score≥0.2的残基位点占83.24%。表明Stlac2的三维构象比较合理。

表2 漆酶基因二级结构组成分析
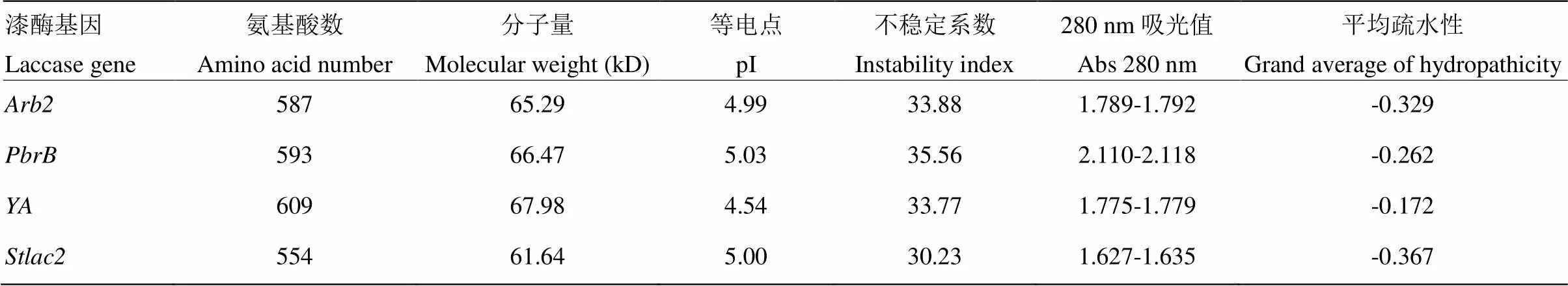
表3 漆酶基因理化性质分析
2.2 木质素降解产物存在下玉米大斑病菌胞外漆酶的产生情况将玉米大斑病菌培养在含有0.01 g·L-1的木质素降解产物(丁香醛、4-羟基苯甲醛、香草酸、香兰素、4-羟基苯甲酸)的PDA中,并添加终浓度为0.3 mmol·L-1的ABTS和终浓度为30 mmol·L-1的KNO3,培养5 d后发现,与CK对比,菌落周围的紫色深浅依次为香草酸>香兰素>4-羟基苯甲醛>4-羟基苯甲酸>丁香醛>CK,表明在这些小分子有机物存在的条件下,玉米大斑病菌漆酶基因的表达量有所增加,其中在添加香草酸、香兰素、4-羟基苯甲醛时,表现尤其明显(图4)。

1:CK;2:丁香醛Syringaldehyde;3:香草酸Vanillic acid;4:香兰素 Vanillin;5:4-羟基苯甲酸 4-Hydroxybenzoic acid;6:4-羟基苯甲醛 4-Hydroxybenzaidehyde
2.3 木质素降解产物存在下的相对表达分析
用Up提取试剂盒提取PD中培养7 d的玉米大斑病菌的总RNA,进行RT-qPCR试验,结果显示,在加入4-羟基苯甲酸和4-羟基苯甲醛后的表达量显著升高,约为CK的5—8倍,而在加入香兰素时,的相对表达量有所下降,在加入其他物质时表达量变化不显著(图5)。说明4-羟基苯甲酸和4-羟基苯甲醛能够诱导的表达,在木质素降解过程中,发挥了一定的作用。
2.4 Stlac2的原核表达及活性测定
以pET-30a载体为框架,用d III和H I双酶切片段连接到载体上,构建pET-Stlac2表达质粒(图6)。将成功构建的表达质粒转入大肠杆菌感受态细胞中,挑取阳性单克隆,然后提取质粒进行双酶切验证(图7)。
将双酶切验证正确的表达质粒转入BL21(DE3)感受态细胞中,加入终浓度为1 mmol·L-1的IPTG进行诱导表达,经SDS-PAGE检测后,结果显示,在未经IPTG诱导的菌液中,培养2 h和4 h后,重组质粒在67 kD(61.64 kD+ 5.6 kD空载)左右未产生的明显的蛋白条带,而经IPTG诱导的菌液中,在67 kD左右有清晰的蛋白条带,证明Stlac2被成功表达(图8)。纯化后检测漆酶活性为(40.7± 0.3)U·L-1。

1:CK;2:丁香醛Syringaldehyde;3:香草酸Vanillic acid;4:香兰素 Vanillin;5:4-羟基苯甲酸 4-Hydroxybenzoic acid;6:4-羟基苯甲醛 4-Hydroxybenzaidehyde。图中数值为平均值±标准误,柱状图上不同的字母代表基因相对表达差异显著(p<0.05)The values were mean±standard error, the different letters above the bar represented the significant differences (p<0.05)

图6 pET-Stlac2 重组质粒图谱
3 讨论
自1883年首次从漆树中发现漆酶以来,漆酶一直是从事化学和生物学等领域学者所关注的热点话题。第一个被扩增出来的真菌漆酶为粗糙脉孢菌()漆酶基因[31],之后更多的真菌漆酶被发现,特别是在以担子菌为主的白腐真菌中[32],随着研究深入及科学技术的发展,漆酶在真菌中的功能和作用越来越清楚,在病原性真菌中,漆酶在色素产生、子实体形成、菌体形态建成、病原菌致病性、植物与病原菌互作、脱毒和应激反应等方面具有重要作用[33-35]。

M:DL5000 DNA Maker;1—4:pET-Stlac2质粒 pET-Stlac2 plasmid

M:标准蛋白Marker Protein molecular weight marker;1:未诱导2 h Without IPTG induction for 2 h;2:未诱导4 h Without IPTG induction for 4 h;3:诱导2 h Cultivation with IPTG induction for 2 h;4:诱导4 h Cultivation with IPTG induction for 4 h。黑色箭头所指为目的条带 The black arrow indicated the obtained protein
在木质素降解过程中,漆酶是发现最早的能够降解木质素的酶类,而且不同于LiP(lignin peroxidase)、MnP(mangnase peroxidase),漆酶在氧化降解木质素的过程中不需要过氧化氢的参与[36-38]。在木质素的发酵降解过程中,会产生一类含量远低于碳水化合物,但却严重影响后续发酵的小分子芳香族化合物,例如香草醛、4-羟基苯甲醛、紫丁香醛、香草酸、4-羟基苯甲酸和紫丁香酸等[16-17]。由于漆酶氧化底物的广谱特性,使其在木质素降解过程中显得尤为重要。
研究表明,与木质素结构单元相似的芳香族小分子化合物或木质素降解过程中的中间产物,如香草酸等对真菌漆酶的活性及产量均有一定的影响。香兰素和丁香酸对spAH28-2漆酶的活性有明显的诱导作用[21],香草醛可使漆酶产量提高10倍[22]。
近些年来,对病原性真菌漆酶在木质素降解中的作用研究的比较少,主要原因是在病原性真菌中,漆酶的产量及活性低于白腐真菌。本试验基于前人研究结果,在保证高产漆酶的条件下,在玉米大斑病菌中,根据与已知漆酶保守结构进行ClustalX蛋白序列比对,并利用Neighbour joining方法聚类发现EOA90070()与小麦黄斑病菌等致病漆酶同源性较高,属于典型的子囊菌漆酶。再通过生物信息学对的生物学特性进行了预测与比对,判断其为漆酶基因。为研究其在木质素降解过程中是否起到了一定的作用,对其在小分子物质存在条件下的相对表达量进行了分析,发现其在4-羟基苯甲酸和4-羟基苯甲醛存在时表达量上升了5—8倍。已有研究表明,小分子物质诱导漆酶基因转录的机制可能与漆酶基因启动子上游的异生物质响应元件(xenobiotic response element,XRE)相关。XRE是真核生物中参与芳香族化合物激活某些特定基因转录的重要顺式作用元件[39-41],而在Stlac2中是否有此响应元件还有待研究。为了更深一步研究的功能,本研究对该基因进行了克隆及原核表达,并成功表达出了相应大小的蛋白条带。表达出的目的蛋白在体外成功地检测出漆酶活性,这种真核漆酶基因原核表达的方式报道的很少,为后期研究在真菌中的作用和功能打下了基础。
4 结论
生物信息学分析表明具有漆酶基因的典型结构,为玉米大斑病菌漆酶基因;该基因在4-羟基苯甲醛和4-羟基苯甲酸存在下表达量显著提高,表明在木质素降解过程中起到了一定作用;以pET-30a为表达载体框架,实现了玉米大斑病菌漆酶异源表达,胞外漆酶活性可达(40.7±0.3)U·L-1,该研究结果为后期研究蛋白性质打下了基础。
References:
[1] Baldrian P. Fungal laccases-occurrence and properties., 2006, 30(2): 215-242.
[2] Mot A C, Silaghi-Dumitrescu R. Laccases: complex architectures for one-electron oxidations., 2012, 77(12): 1395-1407.
[3] 钞亚鹏, 钱世钧. 真菌漆酶及其应用. 生物工程进展, 2001, 21(5): 23-27.
Chao Y P, Qian S J. Fungal laccase and its applications., 2001, 21(5): 23-27. (in Chinese)
[4] Brijwani K, Rigdon A, Vadlani P V. Fungal laccases: production, function, and applications in food processing., 2010(2010): Article ID 149748.
[5] Alexandre G, Zhulin I B. Laccases are widespread in bacteria., 2000, 18(2): 41-42.
[6] Martins L O, Soares C M, Pereira M M, Teixeira M, Costa T, Jones G H, Henriques A O. Molecular and biochemical characterization of a highly stable bacterial laccase that occurs as a structural component of theendospore coat., 2002, 277(21): 18849-18859.
[7] Claus H. Laccases and their occurrence in prokaryotes., 2003, 179(3): 145-150.
[8] Givaudan A, Effosse A, Faure D, Potier P, Bouillant M L, Bally R. Polyphenol oxidase inisolated from rice rhizosphere: evidence for a laccase in non-motile strains of., 1993, 108(2): 205-210.
[9] Sterjiades R, Dean J F D, Eriksson K E L. Laccase from sycamore maple () polymerizes monolignols., 1992, 99(3): 1162-1168.
[10] Liu L, Dean J F D, Friedman W E, Eriksson K E L. Laccase-like phenoloxidase is correlated with lignin biosynthesis instem tissue, 1994, 6(2): 213-224.
[11] Boudet A M. Lignins and lignification: selected issues., 2000, 38(1/2): 81-96.
[12] Ranocha P, Chabannes M, Chamayou S, Danoun S, Jauneau A, Boudet A M, Goffner D. Laccase down- regulation causes alterations in phenolic metabolism and cell wall structure in poplar., 2002, 129(1): 145-155.
[13] Hoopes J T, Dean J F D. Ferroxidase activity in a laccase-like multicopper oxidase from., 2004, 42(2): 27-33.
[14] Thurston C F. The structure and function of fungal laccases., 1994, 140(1): 19-26.
[15] Dwivedi U N, Singh P, Pandey V P, Kumar A. Structure-function relationship among becterial, fungal and plant laccases.:, 2011, 68(2): 117-128.
[16] Ando S, Arai I, Kiyoto K, HanaiS. Identification of aromatic monomers in steam-exploded poplar and their influences on ethanol fermentation by., 1986, 64(6): 567-570.
[17] Tran A V, Chambers R P. Lignin and extractives derived inhibitors in the 2, 3-butanediol fermentation of mannose-rich prehydrolysate., 1986, 23(3): 191-197.
[18] d’Acunzo F, Galli C, Gentili P, Sergi F. Mechanistic and steric issues in the oxidation of phenolic and non-phenolic compounds by laccase or laccase-mediator systems. The case of bifunctional substrates., 2006, 30(4): 583-591.
[19] Mayer A M, Staples R C. Laccase: new functions for an old enzyme., 2002, 60(6): 551-565.
[20] 赵敏, 杨谦, 宋小双, 刘桂丰. 真菌漆酶及其研究进展. 林产化学与工业, 2005, 25(1): 115-120.
Zhao M, Yang Q, Song X S, Liu G F. Advances of research on molecular biology of laccase from fungi., 2005, 25(1): 115-120. (in Chinese)
[21] 洪宇植. 新型真菌漆酶基因的克隆及其表达调控的分子机制[D]. 合肥: 安徽大学, 2005.
Hong Y Z. Molecular cloning and regulatory expression mechanism of novel fungal laccase genes[D]. Hefei: Anhui University, 2005. (in Chinese)
[22] Souza C G, Zilly A, Peralta R M. Production of laccase as the sole phenoloxidase by a Brazilian strain ofin solid state fermentation., 2002, 42(2): 83-90.
[23] Chen S C, Ge W, Buswell J A. Biochemical and molecular characterization of a laccase from the edible straw mushroom,, 2004, 271(2): 318-328.
[24] Solé M, Müller I, Pecyna M J, Fetzer I, Harms H, Schlosser D. Differential regulation byorganic compounds and heavy metals of multiple laccase genes in the aquatic hyphomycete., 2012, 78(13): 4732-4739.
[25] 孙淑琴, 温雷蕾, 董金皋. 玉米大斑病菌的生理小种及交配型测定. 玉米科学, 2005, 13(4): 112-113, 123.
Sun S Q, Wen L L, Dong J G. Identification of physiological races and mating type of., 2005, 13(4): 112-113, 123. (in Chinese)
[26] Degefu Y, Lohtander K, Paulin L. Expression patterns and phylogenetic analysis of two xylanase genes (and) from, the cause of northern leaf blight of maize., 2004, 86(2): 83-90.
[27] 曹志艳. 玉米大斑病菌黑色素合成途径相关基因的克隆及功能分析[D]. 保定: 河北农业大学, 2009.
Cao Z Y. Characterization and function analysis of the genes involved in melanin biosynthesis pathway in the phytopathogenic fungus[D]Baoding: Agricultural University of Hebei, 2009. (in Chinese)
[28] 曹可可. 大斑刚毛座腔菌漆酶基因功能验证及高产漆酶发酵条件优化[D]. 保定: 河北农业大学, 2015.
Cao K K.the function of laccase genes and optimization of fermentation condition for laccase production in[D]Baoding: Agricultural University of Hebei, 2015. (in Chinese)
[29] 詹旭, 曹志艳, 邢继红, 董金皋. 植物病原真菌产漆酶菌株的筛选. 中国农业科学, 2011, 44(4): 723-729.
Zhan X, Cao Z Y, Xing J H, Dong J G. Screening of laccase-producing isolates among plant pathogenic fungi., 2011, 44(4): 723-729. (in Chinese)
[30] 曹可可, 刘宁, 马双新, 曹志艳, 梁东旭, 柴江婷, 董金皋. 大斑刚毛座腔菌高产漆酶条件的响应面优化及酶学特性. 中国农业科学, 2015, 48(11): 2165-2175.
Cao K K, Liu N, Ma S X, Cao Z Y, Liang D X, Chai J T, Dong J G.Optimization of fermentation condition for laccase production byusing the response surface methodology and the enzymatic characters., 2015, 48(11): 2165-2175. (in Chinese)
[31] Germann U A, Müller G, Hunziker P E, Lerch K. Characterization of two allelic forms oflaccase. Amino- and carboxyl-terminal processing of a precursor., 1988, 263(2): 885-896.
[32] Thurston C F. The structure and function of fungal laccases., 1994, 140(1): 19-26.
[33] Pihet M, Vandeputte P, Tronchin G, Renier G, Saulnier P, Georgeault S, Mallet R, Chabasse D, Symoens F, Bouchara J P. Melanin is an essential component for the integrity of the cell wall ofconidia., 2009, 9(1): 177.
[34] Lin S Y, Okuda S, Ikeda K, Ikeda K, Okuno T, Takano Y.encoding a secreted laccase is involved in appressorial melanization and conidial pigmentation in., 2012, 25(12): 1552-1561.
[35] Morris-JonesR, Gomez B L, Diez S, Uran M, Morris- Jones S D, Casadevall A, Nosanchuk J D, Hamilton A J. Synthesis of melanin pigment byin vitro and during infection., 2005, 73(9): 6147-6150.
[36] 刘浩, 付时雨, 刘梦茹, 詹怀宇, 陈元彩. 白腐菌胞外酶降解木素的机制及其协同作用. 中国造纸学报, 2007, 22(4): 96-101.
Liu H, Fu S Y, Liu M R, Zhan H Y, Chen Y C. Mechanism of delignification of cetoenzym from white rot fungi., 2007, 22(4): 96-101. (in Chinese)
[37] 冯晓静, 谢益民, 洪卫. 白腐菌木素降解酶的作用机理及其在中段废水处理的应用. 湖南造纸, 2008(1): 21-23.
Feng X J, Xie Y M, Hong W. Lignin degradation mechanisms of ligninolytic enzyme system produced by wood white rot fungi and its application to bleaching effluents., 2008(1): 21-23. (in Chinese)
[38] Matera I, Gullotto A, Tilli S, Ferraroni M, Scozzafava A, Briganti F. Crystal structure of the blue multicopper oxidase from the whiterot funguscomplexed with-toluate., 2008, 361(14/15): 4129-4137.
[39] RushMore T H, MORTON M R, PICKETT C B. The antioxidant response element activation by oxidative stress and identification of the DNA consensus sequence required for functional activity., 1991, 266(18): 11632-11639.
[40] Collins P J, Dobson A D W. Regulation of laccase gene transcription in, 1997, 63(9): 3444-3450.
[41] Alvarez J M, Canessa P, Mancilla R A, Polanco R, Santibnez P A, VICUNA R. Expression of genes encoding laccase and manganese-dependent peroxidase in the fungusis mediated by an ACE1-like copper-fist transcription factor., 2009, 46(1): 104-111.
(责任编辑 岳梅)
Analysis and expression of laccase gene
MA Shuang-xin, LIU Ning, Jia Hui, DAI Dong-qing, XU Miao-miao, CAO Zhi-yan, DONG Jin-gao
(The Key Laboratory of Hebei Province for Molecular Plant-Microbe Interaction, Agricultural University of Hebei, Baoding 071001, Hebei)
【Objective】The objective of this study is to analyze the bioinformatics and infer the functions of, research on the effects of substrates generated in the process of lignin degradation on the relative expression ofFor further study on the function ofin the growth, development, and pathogenicity, thewas successfully expressed by prokaryotic expression system. 【Method】The protein sequences ofwere obtained through NCBI and aligned with the known laccases such as(PMAA_082060),(AFUA_2G17530),and(AN6635) by ClustalX for the Cu ion binding sites. The secondary structure and biochemicalproperties were predicted online by online softwares SOPMA and ProtParam, and the three-dimensional structure was modelled by SWISS-MODEL, and analyzed by SAVES. The effects of lignin degradation substrates on the expression of extracellular laccase were measured by oxidazing ABTS and the effect on the relative expression of specific genewas analyzed by using RT-qPCR.was fused into the pET-30a plasmid and expressed by prokaryotic expression system. The protein Stlac2 expressed by prokaryotic cell was extracted and the laccase activity was detected using ABTS as substrate at 420 nm.【Result】had typical sites bonding with Cu ion. The proportion of-helix, extended strand,-turn and random coil were 18.59%, 25.63%, 11.91% and 43.86%, respectively. The protein molecular weight is 61.64 kD, pI is 5.00, grand average of hydropathicity is -0.37, indicating Stlac2 is a hydrophilic protein. The effect of lignin degradation substrates on the production of extracellular laccase was vanillic acid>vanillin>4-hydroxybenzaidehyde>4-hydroxybenzoic acid>syringaldehyde>CK. The relative expression ofwas increased about 5-8 folds compared with CK under the substrates 4-hydroxybenzoic acid and 4-hydroxybenzaidehyde conditions. Stlac2 protein was successfully expressed by prokaryotic expression system and a specific protein band of 67 kD was induced. The laccase activity of this specific protein is (40.7±0.3) U·L-1.【Conclusion】The biochemical properties ofwere analyzed systematically and predicted thatis a laccase gene. 4-Hydroxybenzoic acid and 4-hydroxybenzaidehyde could increase the relative expression ofsignificantly, indicating it plays a role in the process of lignin degradation. Stlac2 protein can be expressed by the prokaryotic expression systems of pET-30a and the laccase activity is (40.7±0.3) U·L-1, thus laid a foundation for further study.
;; bioformatic analysis; RT-qPCR; prokaryotic expression
2016-07-11;接受日期:2016-08-30
国家自然科学基金(31101402)、国家玉米产业技术体系(CARS-02-12)、河北省高等学校科学技术研究项目(ZD2014053,QN2014091)
联系方式:马双新,E-mail:msx0214@126.com。刘宁,E-mail:lning121@126.com。马双新和刘宁为同等贡献作者。通信作者曹志艳,E-mail: caoyan208@126.com。通信作者董金皋,E-mail:dongjingao@126.com

