马铃薯块茎蒸煮品质、质构特性及加工型品系筛选
刘 娟,梁延超,隋景航,余 斌,王润润,张小微,程李香,王玉萍,张 峰
马铃薯块茎蒸煮品质、质构特性及加工型品系筛选
刘 娟1,2,梁延超1,隋景航1,余 斌1,王润润1,张小微1,程李香1,王玉萍1,张 峰1
(1甘肃农业大学农学院/甘肃省干旱生境作物学国家重点实验室培育基地/甘肃省遗传改良与种质创新重点实验室,兰州 730070;2甘肃农业大学食品科学与工程学院,兰州 730070)
【目的】蒸煮是马铃薯食用最主要的加工方式,马铃薯商业化加工过程中需要对蒸煮加工的品质性状进行定量化分析和分类。根据商业化加工的需求在品种选育中进行蒸煮品质性状的早期选择和筛选,确定蒸煮加工型品种的品质性状特征和相关参数,同时从现有品种和品系中根据商业化加工参数筛选适合不同用途需求的蒸煮品种,是提高蒸煮加工型品种选育效率和方法的有效手段,为制定蒸煮加工型品种选育目标提供基础。【方法】在对马铃薯品种和品系的块茎产量、块茎大小、薯型、薯肉颜色、芽眼深度、抗病性和商品率的初步选择基础上,筛选14个品种和品系进行蒸煮试验,在普通蒸锅中放入块茎蒸煮25 min,蒸熟后,在室温环境冷却20 min,7 d后,分别对蒸煮前后块茎色泽变化、蒸煮前后块茎硬度、蒸煮前后软化度进行测定。同时测定这些品种和品系的干物质含量、淀粉含量、蔗糖含量、葡萄糖含量、果糖含量、游离氨基酸含量、绿原酸含量、柠檬酸含量、抗坏血酸含量,分析以上成分在蒸煮加工过程中变化对品种和品系块茎的风味、色泽和质构特性的影响,确定蒸煮加工型品种的加工参数。【结果】选育蒸煮加工型马铃薯品种,首先考虑田间综合农艺性状要能够满足商业化生产与加工过程工艺流程和加工机械要求。块茎还原糖含量是影响蒸煮风味中甜度的主要因素,含量应控制在0.4%以下。游离氨基酸含量与蒸煮风味中鲜味有关,14个品种和品系的氨基酸含量差别还不能构成显著的风味差别,所有品种和品系的氨基酸含量介于30—70 µmol。块茎品种风味构成中的苦味来源主要是糖苷碱含量,蒸煮加工型品种的糖苷碱含量应控制在150 mg·kg-1以下。蒸煮后冷却20 min块茎色泽变化值和蒸煮后7 d的色泽变化值Δ差值是衡量蒸煮加工型品种色泽变化的重要参数。块茎蒸煮前后的软化度是衡量蒸煮加工型品种质地变化的重要参数。【结论】14个品种和品系块茎蒸煮后的风味、色泽变化、质构特性变化是判定蒸煮加工型品种的重要参数,通过对这些参数的全面分析表明,品种Burbank、Shepody和品系0724-58、0712-66是蒸煮后软化度比较高的品种和品系,而0744-8和0722-26是蒸煮后软化度比较低的品系。
马铃薯;蒸煮;风味;色泽;质地;软化度
0 引言
【研究意义】作为中国传统的食用方式,马铃薯在蒸煮品质标准上对品种并没有严格要求,从鲜食菜用型到薯片薯条加工型品种都可以蒸煮食用,消费者对蒸煮品质判定主要依据口感,并没有严格对蒸煮类型进行分类,但在商业化加工中,需要对不同用途类型品种的蒸熟品质进行评价和判断,以满足不同终端消费者的饮食习惯。按照商业化蒸煮加工的需求,对马铃薯的蒸煮加工品质进行分析,可以对现有品种和高代品系进行评价、筛选和分类,不仅是马铃薯蒸煮加工产业链延伸的基础,也是蒸煮加工型品种选育的前提。【前人研究进展】马铃薯加工品质是非常重要的商业化品质,在加工型品种选育过程中,高淀粉加工型品种最重要的品质是淀粉含量高(≥18%),而对块茎薯型、芽眼、还原糖含量等没有严格要求[1]。薯片、薯条加工型品种不仅对块茎薯型、芽眼、薯肉颜色、薯皮特性等农艺性状有严格要求,同时对块茎品质性状中干物质含量、淀粉含量、还原糖含量、贮藏回暖还原糖含量、龙葵素含量、多酚氧化酶活性、质地均一性等也有严格要求[2-3]。薯片薯条加工企业在原料收购过程中都会对品种农艺性状和品质性状按照标准进行强制控制,这种按照标准的强制控制是市场对加工型品种选育的目标要求。对全粉加工型品种而言,块茎品质性状中干物质含量、薯肉颜色、芽眼深浅、还原糖含量,都会影响全粉的加工产量和质量,但全粉加工品种块茎还应富含氨基酸、胡萝卜素等营养成分。国内对蒸煮加工型品种没有严格意义的划分标准,国外蒸煮品种的育种目标是按照商业化加工需要进行,通常蒸煮加工型品种除了要具备薯片、薯条和全粉加工型品种对薯型、芽眼等农艺性状的要求外,还对加工后薯肉风味、薯肉色泽和块茎质地变化进行分析。按照市场的细致划分,蒸煮加工品种品质也要满足不同的需要,加工速冻冷菜类的蒸煮加工型品种对风味、色泽和质地的要求都很高,而加工薯泥的品种对块茎质地均一性要求较低[4-5]。国外商业化生产中对蒸煮型马铃薯品种品质有规范和标准,这些标准建立的依据是在已有品种进行蒸煮加工实践基础上产生的,而后育成的品种蒸煮类型的划分是按照与以往蒸煮品种进行比较基础上进行的[6]。这种以蒸煮品质比较结果的选择体系在操作上具有一定的实践性,但在品种选育过程中对杂交后代和品系的筛选及商业化加工中需要总结出蒸煮品质特性和数据,并在蒸煮品种选育程序上实施。【本研究切入点】在马铃薯加工商业化程度较低的年代,任何类型的马铃薯都可以进行蒸煮加工满足食用的要求,对马铃薯块茎的蒸煮风味、色泽和质构特性没有明确的加工标准。但目前国内马铃薯加工的商业化不同需求要求马铃薯品种的育种目标也要围绕商业需求进行调整,同时需要按照市场划分进行育种目标设定和对现有品种进行品质分析来及时推出满足商业化加工生产需求的品种,这就需要育种目标的设定按照商业化生产对现有的品种和品系进行蒸煮型品质评价和分析,并逐渐建立起蒸煮加工型品种选育的标准。【拟解决的关键问题】本研究通过对引进国外蒸煮加工型品种和高代品系进行田间农艺性状选择以及对块茎蒸煮品质和质构特性的主要因素和成分进行分析,明确蒸煮加工品质的主要指标和特性,划分可能用于不同蒸煮加工的用途,并借此提出马铃薯蒸煮品种类型的选育标准和分类依据,为蒸煮马铃薯品种选择和育种过程提供理论和实践参考依据。
1 材料与方法
1.1 材料
材料来源分为具有良好炸片炸条加工型马铃薯品种、普通栽培种杂交高代品系和野生种渐渗系高代品系(表1),入选的材料进行3年田间综合农艺性状选择,主要以块茎产量、薯型、大小、薯肉颜色、芽眼深度、抗病性、淀粉含量、糖苷碱含量和商品率为标准,除此之外,将入选材料自2012—2015年种植在3个生态类型试验点,即,甘肃天水(海拔1 700 m,平均年降雨量450—600 mm,年平均气温10.7℃)、甘肃景泰(海拔1 950 m,平均年降雨量180—260 mm,年平均气温8.6℃)和甘肃渭源(海拔2 350 m,平均年降雨量450—700 mm,年平均气温6.8℃),进行田间综合农艺性状评价,收获后的品种/品系置于相对湿度为(80±5)%,10℃黑暗储藏15 d后取样,选择大小均匀、无病虫害和机械损伤的成熟块茎作为材料,测定相关生理生化指标,测试蒸煮品质和质构特性。
1.2 淀粉含量测定
采用比重法测定马铃薯块茎淀粉含量。称取5 kg的鲜薯放入水中称其重量,马铃薯比重计算公式为比重=A/(A-B)。其中,A为空气中块茎重量,B为水中块茎重量。通过比重与淀粉含量换算表得到淀粉含量。
1.3 糖含量的测定
参照Ohara-Takada等[7]方法测定糖含量。称取马铃薯块茎2 g,溶于20 mL 80%(v/v)乙醇中,80℃水浴提取1 h,10 319 r/min离心20 min。取上清液真空干燥并溶解于5 mL蒸馏水中,经0.2 µm滤膜过滤后,滤液中蔗糖、果糖和葡萄糖的含量用高效液相色谱仪(Agilent 1100 series,UV检测器,Amide-80色谱柱)测定。
1.4 游离氨基酸含量的测定
参照Lee等[8]方法测定游离氨基酸含量。取1 g马铃薯块茎,加入25 mL 2%乙酸研磨匀浆、过滤备用。取1 mL样品滤液、1 mL去离子水、3 mL水合茚三酮0.5%(w/v)和0.1 mL抗坏血酸0.1%(w/v)加入试管,沸水浴15 min。迅速流水冷却,当反应液呈蓝紫色,用60%乙醇定容至20 mL,测定570 nm波长吸光度。
1.5 糖苷碱含量的测定
参照Coxon等[9]方法测定糖苷碱含量。称取马铃薯块茎表皮10 g,研磨粉碎,加10 mL 0.08 mol·L-1硫酸浸提4 h,过滤2次留取滤液,氨水调pH至11,静置10 h,7 297 r/min离心15 min,用0.17 mol·L-1硫酸溶解沉淀,定容至10 mL。测定530 nm波长吸光度。
1.6 绿原酸含量的测定
参照Campos等[10]方法测定绿原酸含量。取阴干后马铃薯块茎2 g,液氮研磨粉碎,加入95%乙醇5 mL,4℃放置24 h。取0.5 mL提取液用7.5 mL水稀释,加入0.5 mL Folin-Ciocalteu(1﹕7)试剂,混匀反应3 min,再加入1 mL 0.5 mol·L-1Na2CO3,反应10 min,测定为725 nm波长吸光值。以绿原酸标准品作曲线计算最终含量。
1.7 蒸煮加工及色泽测定
取收获15 d后的新鲜马铃薯,削皮后用流水冲洗1 min,测定薯肉色泽。普通蒸锅中待水沸腾后放入块茎蒸25 min,冷却20 min后再测薯肉色泽,在室温环境下放置7 d后再次测薯肉色泽。色泽测定方法采用美国Hunter Lab D25LT标准色差仪D65光源下测定亨特指数(L、a、b是基于人类色感的三度色彩空间,其中,正、负L值分别代表亮和暗,正、负a值分别代表红和绿,正、负b值分别代表黄和蓝)。其总色差Δ可由公式得出:
式中,0、0和0代表处理前测得的值,、、代表处理后测得的值。
1.8 硬度测定
使用物性测试仪(TA.XT Express,STABLE MICRO SYSTEM,英国)分别对蒸前和蒸后的马铃薯块茎进行硬度测定,力量感应元10 kg,P2(2 mm)探头穿刺,测试速度2.0 mm·s-1,穿刺距离2 cm,块茎硬度为穿刺过程中受力峰值,每个块茎穿刺3次,每个品种测试5个块茎。
1.9 数据分析
每次试验重复3—5次,数据以平均值(±SD)表示。采用SPSS 17.0软件进行数据分析。所有平均数之间的比较采用方差分析(ANOVA),显著水平<0.05。
2 结果
2.1 马铃薯品种、品系田间农艺性状特征
不同品种、品系的薯肉颜色、产量、商品率、干物质含量、淀粉含量存在显著差异(表1)。供试材料的薯肉颜色多为白色和黄色,品系0782-43、0712-66薯肉以白色为主,其中,沿块茎维管束沉积有紫色薯肉。品种Shepody、Burbank和品系0739-211、0733-210和0728-11的产量显著高于其他品系。品种Burbank和品系0730-147、0711-67、0739-211、0733-210和0728-11的商品率显著高于其他品系,品种Shepody和品系0716-22、0782-43、0712-66商品率未达到80%。品种Burbank、Shepody和品系0730-147、0736-126、0739-211、0728-11、0722-26、0782-43和0712-66的干物质含量均超过22%。品系0711-67、0744-8和0733-210的淀粉含量低于16%,品种Burbank、Shepody和品系0724-58、0716-22和0739-211淀粉含量介于16%—18%。0730-147、0728-11、0782-43、0712-66和0722-26的干物质含量显著高于Burbank和Shepody,0730-147、0728-11、0722-26、0782-43和0712-66的淀粉含量显著高于Burbank和Shepody。0711-67、0744-8和0733-210的淀粉含量显著低于其他品系。0744-8、0739-211、0728-11和0722-26高抗晚疫病。
2.2 马铃薯品种和品系块茎成分
2.2.1 马铃薯品种和品系块茎糖含量 测定不同品种和品系块茎的蔗糖和还原糖(葡萄糖、果糖,图1)含量。品系0744-8、0724-58、0782-43和0712-66块茎的蔗糖含量显著高于其他品种/品系。而品系0730-147、0736-126和0733-210块茎的蔗糖含量显著低于其他品种/品系。品系0724-58、0744-8和0782-43的葡萄糖含量大于0.7%,并显著高于其他品种/品系。而品系 0739-211、0728-11和0712-66的葡萄糖含量介于0.5%—0.7%,显著高于其他品种/品系。品种Shepody、Burbank和品系0716-22、0730-147、0711-67、0736-126、0733-210的葡萄糖含量均低于0.5%。品种Shepody和品系0744-8果糖含量大于0.2%,显著高于其他品种/品系。品种Burbank和品系0739-211、0728-11、0782-43、0712-66果糖含量介于0.1%—1.75%,而品系0724-58、0716-22、0730-147、0711-67、0736-126、0733-210、0722-26果糖含量低于0.1%,并显著低于其他品种/品系。品系0744-8块茎的葡萄糖、果糖、蔗糖含量在所有品种/品系中均最高,并显著高于其他品系/品种。品系0736-126、0733-210块茎的蔗糖、葡萄糖、果糖含量均低于Shepody与Burbank。
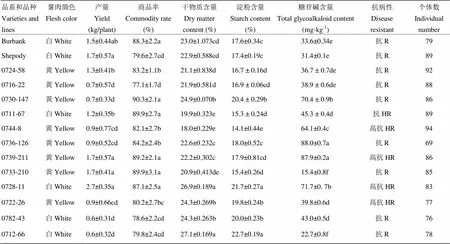
表1 马铃薯品种、品系田间农艺性状
同一列不同字母代表不同品系、品种间在≤0.05水平显著性差异;抗病性指抗晚疫病。R:抗病;HR:高抗。下同
Means within a column with the different lowercase letter are significantly different,≤0.05; Resistance mainly refers to the resistance to late blight; R: Resistant; HR: highly resistant. The same as below

不同字母代表不同品系、品种间在P≤0.05水平显著性差异。下同
2.2.2 马铃薯品种和品系块茎游离氨基酸含量 对品种/品系的游离氨基酸含量测定(图2),品系0733-210块茎游离氨基酸含量最高,超过60 µmol·g-1,品种Burbank、Shepody和0712-66之间无显著差别并显著高于其他品系,品系0724-58、0716-22、0744-8、0736-126、0728-11、0722-26和0782-43之间块茎游离氨基酸含量无显著差异,品系0711-67与0739-211块茎游离氨基酸含量均低于40 µmol·g-1。
2.2.3 马铃薯品种和品系块茎绿原酸、抗坏血酸和柠檬酸含量 品系0711-67的绿原酸含量达到106 mg·g-1,显著高于其他品种/品系,品系0724-58、0716-22和0733-210块茎绿原酸含量介于90—100 mg·g-1,但显著高于其他品系,品种Burbank绿原酸含量介于80—90 mg·g-1,品系0730-147和0744-8块茎绿原酸介于65—75 mg·g-1,品种Shepody和品系0736-126、0739-211、0728-11、0722-26、0712-66块茎绿原酸含量介于45—60 mg·g-1,品系0782-43块茎绿原酸含量为41 mg·g-1,显著低于所有品种和品系(图3-A);品系0722-26块茎抗坏血酸含量达到0.8 mmol·g-1,显著高于其他品种和品系,品种Burbank、Shepody和品系0736-126、0739-211、0782-43、0711-66块茎抗坏血酸含量介于0.12—0.25 mmol·g-1,品系0724-58、0716-22、0730-147、0711-67、0744-8、0733-210和0728-11均低于0.1 mmol·g-1(图3-B)。品种Shepody和品系0739-211、0782-43块茎的柠檬酸含量超过32 µmol·g-1,并显著高于其他品种/品系,品系0724-58、0711-67、0736-126、0733-210、0728-11、0722-26和0712-66块茎柠檬酸含量介于15—21 µmol·g-1,品种Burbank和品系0716-22、0730-147、0744-8均低于15 µmol·g-1(图3-C)。
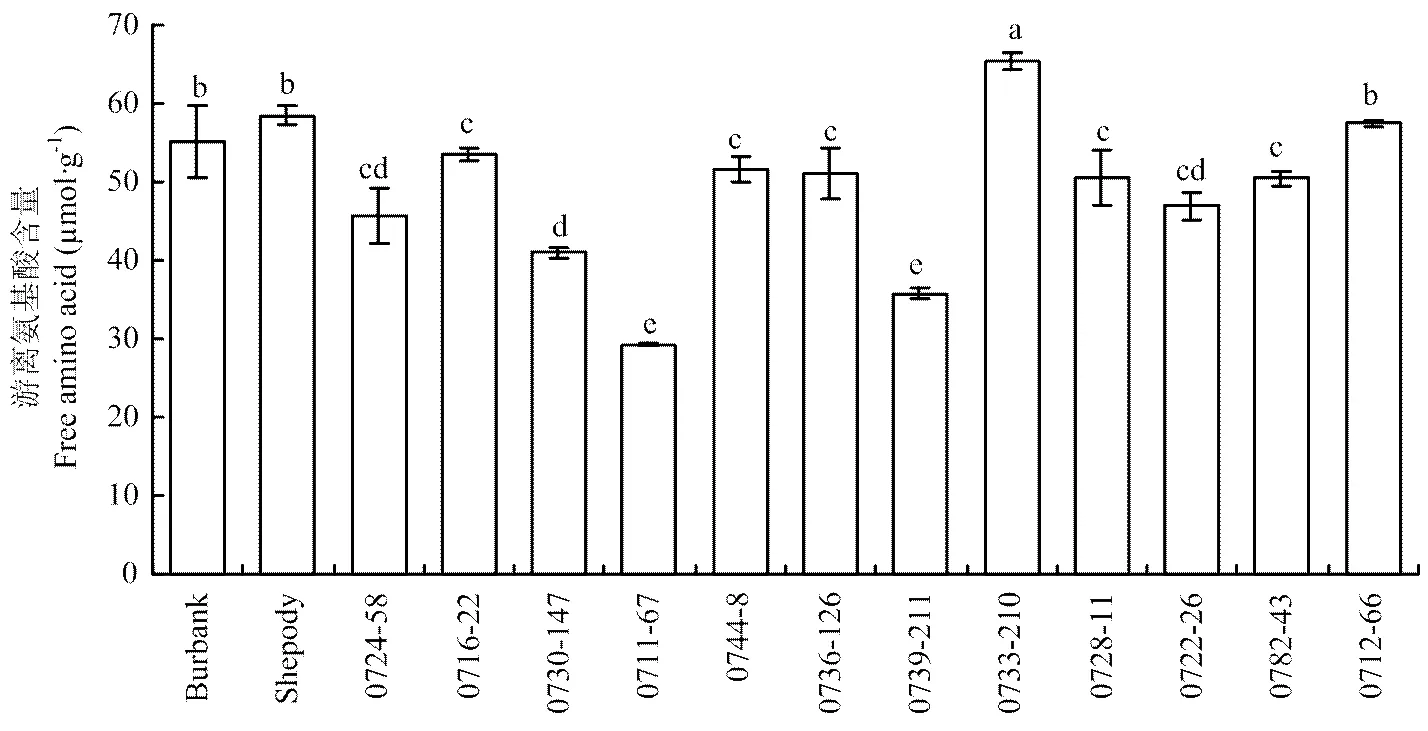
图2 马铃薯品种和品系块茎游离氨基酸含量
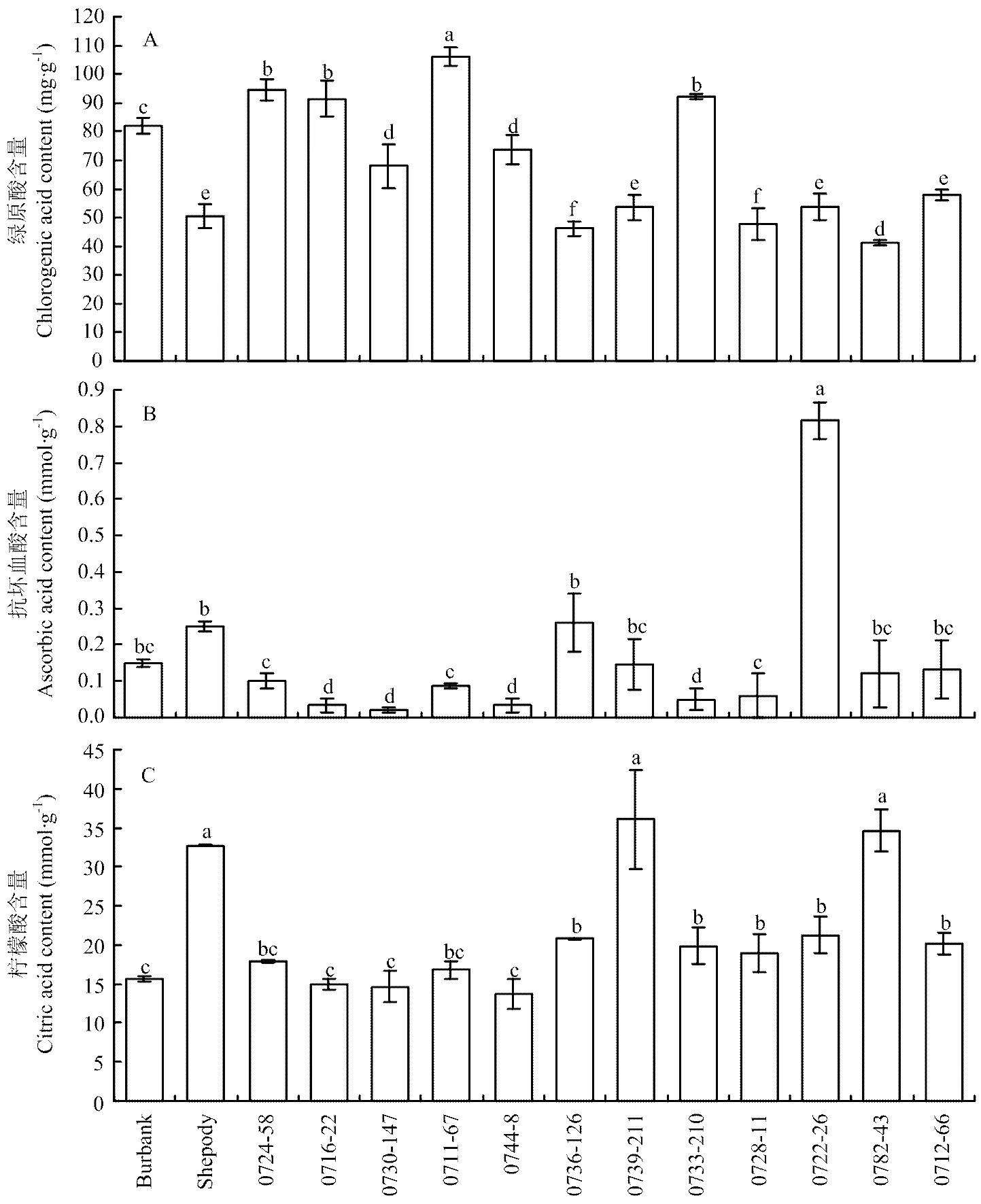
图3 马铃薯品种和品系块茎绿原酸(A)、抗坏血酸(B)和柠檬酸(C)含量
2.2.4 马铃薯品种和品系块茎色泽变化特性 色泽是马铃薯加工品质的重要性状之一,通过对品种/品系的鲜薯薯肉、蒸煮后薯肉、蒸煮后7 d薯肉颜色的测定,分析了块茎的蒸煮加工色泽变化(表2,图4)。
鲜薯薯肉颜色中,品系0711-67、0728-11的亮度值L显著高于其他品系和品种,0722-26、0782-43、0712-66的L值显著低于Burbank和Shepody,其余品系与品种Burbank和Shepody之间无显著差异。品系0744-8、0782-43和0712-66的a值为正值,其余品种和品系均为负值。品系0782-43、0712-66的b值显著低于Burbank和Shepody,其余品系的b值均显著高于Burbank和Shepody。
蒸煮后除品系0782-43的L值升高外,其他品系/品种的L值均降低。除品系0722-26的a值升高且为正值外,其余品种和品系的a值均降低且均为负值。所有品种/品系的b值均降低。品系0712-66、0739-211的Δ值变化最大,显著高于其他品系/品种。品系0724-58、0716-22、0711-67、0744-8、0733-210、0728-11、0722-26与品种Burbank和Shepody的Δ值蒸煮前后无显著差异,其中,0722-26的Δ值变化最小。
对蒸煮后薯肉色泽和蒸煮后放置7 d块茎薯肉色泽分析,品系0744-8和品种Burbank、Shepody薯肉的L值略有升高,其余品系的L值均降低。所有品种/品系的a值均升高。除品系0712-66的b值降低外,其余品种和品系的b值均升高。蒸煮7 d后品系0728-11和0711-67的Δ*值变化最大。品种Shepody和品系0722-26、0712-66、0724-58、0744-8、0782-43Δ*值变化较小。品系0722-26的Δ*值变化最小。

表2 马铃薯品种、品系的色泽测定结果
2.2.5 马铃薯品种和品系块茎硬度变化特性 马铃薯块茎蒸煮前后的硬度变化特性是对蒸煮加工类型分类的重要标准。对块茎蒸煮前后硬度值和蒸煮后的软化程度进行了测定(图5)。品系0724-58和品种Shepody的鲜薯块茎硬度较高,但蒸煮后0724-58和Shepody块茎硬度显著低于其他品系/品种,其软化度分别为97.3%和95.4%。品种Burbank的块茎软化度为89.1%,品系0716-22、0744-8、0733-210和0712-66块茎蒸煮后软化度分别为89.2%、90.9%、89.6%和91.2%。块茎蒸煮后软化度处于较低水平的品系有0730-147、0711-67、0736-126、0739-211和0722-26,其中品系0736-126的块茎软化度最低为82.7%。
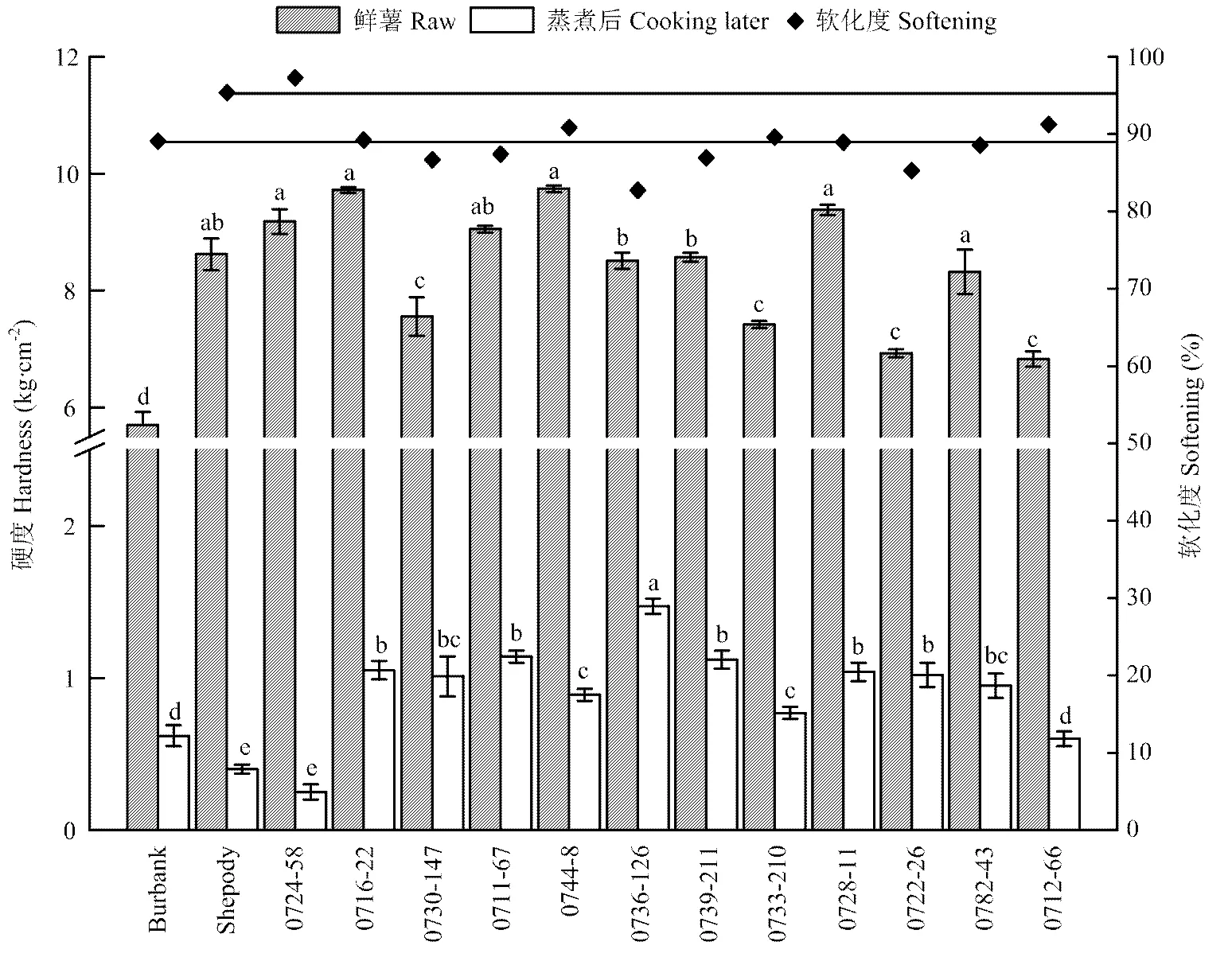
图5 马铃薯品种和品系蒸煮前后硬度、软化度测定
3 讨论
选育蒸煮加工型马铃薯品种首先要考虑田间综合农艺性状表现,需要对不同品种和品系的块茎产量、薯型、块茎整齐度、薯肉颜色、芽眼深度、抗病性、淀粉含量和商品率进行分析,这些农艺性状数据要能够满足商业化生产和加工过程工艺流程和加工机械要求。在考种过程这些基础数据的取得能够为蒸煮加工型品种的品质和分类提供基本的选择。
马铃薯蒸煮风味主要包括甜、鲜、酸和苦[11-12]。块茎中蔗糖和还原糖增加会导致蒸煮后块茎口味变甜,还会在块茎为原料蒸煮加工马铃薯全粉再加工中和游离氨基酸发生“美拉德反应”,影响最终产品的色泽、风味和品质,但是蒸煮过程中并不能发生“美拉德反应”[13-14]。严格控制块茎还原糖含量是商业化加工的要求,蒸煮品种的还原糖控制的标准可以按照鲜重的0.1%,上限不超过0.4%的炸片炸条品种标准进行控制。游离氨基酸含量不仅是块茎品质中的重要营养成分,也与蒸煮风味中鲜味有关,所有品种和品系的游离氨基酸含量介于30—70 µmol·g-1,这种含量差别对感官上还不能构成显著的差别,还需要对呈味氨基酸进行精确测定来判断蒸煮后鲜味的程度[15]。蒸煮加工型品种风味构成中的苦味来源主要是糖苷碱含量,小于200 mg·kg-1是马铃薯食品安全计量[16],通常含量大于150 mg·kg-1时食用时产生苦味,所有品种和品系的糖苷碱含量均小于150 mg·kg-1。蒸煮加工后柠檬酸还可以比较稳定的存在,所以柠檬酸是蒸煮后的块茎中酸味的来源,所有品系的柠檬酸含量均大于15 µmol·g-1,这种适当的酸度也减弱或抑制微生物的生长并保持蒸煮后块茎的品质。
色泽是蒸煮加工型马铃薯品种的重要衡量指标。对蒸煮加工型马铃薯块茎色泽的分析使用鲜薯块茎色泽,蒸煮后色泽和蒸煮7 d后色泽来判定。蒸煮后色差Δ反映鲜薯块茎与蒸煮后的色泽差别,蒸煮前后的色差Δ小于15时,蒸煮前后的色差变化不显著。蒸煮后Δ和蒸煮7 d后Δ*的结果反映了蒸煮后块茎继续氧化导致色泽变化,蒸煮加工型品种在蒸煮后通常根据不同需要进行存放,蒸煮后7 d的块茎已经处于色泽比较稳定的状态,能够反映品种加工后色泽,对蒸煮后的Δ和蒸煮7 d后Δ*的结果比较表明,放置7 d后Δ*变化大于10的品系0711-67、0733-210、0728-11和0712-66色泽显著变黑。影响块茎蒸煮前后的色泽变化的主要成分是绿原酸含量,绿原酸能够与块茎中的金属离子反应生成稳定的化合物并使块茎色泽变黑[17-18],绿原酸含量较高的品系0711-67、0733-210蒸煮7 d后Δ*的结果显著高于其他品种和品系,而绿原酸含量比较高的品种Burbank、0724-58和0716-22的品种色泽变化不显著,可能与品种块茎富集的金属离子含量较低有关[19-20]。柠檬酸和抗坏血酸是具有强的抗氧化作用,能够防止鲜薯块茎因多酚氧化酶氧化变色。柠檬酸在块茎蒸煮加热过程中不改变,还能够在蒸煮后维持比较好的抗氧化性能,对块茎蒸煮后色泽的稳定起重要作用[21]。块茎中抗坏血酸蒸煮加热后分解,并可以和金属离子形成稳定的金属盐,造成块茎蒸煮后色泽呈现不同程度的浅黄色[22-23]。品系0722-26的三度色彩中值显著高于其他品系,推测是高抗坏血酸含量是引起色泽变化的主要原因。品系0716-22、0730-147、0711-67和0739-211的三度色彩中值显著高于其他品系,块茎色泽放置后明显变红,这种变化可能和β-胡萝卜素含量有关[24-25]。
马铃薯块茎蒸煮前后的质构特性变化是加工的重要品质性状[26]。块茎的硬度主要与块茎中干物质含量、纤维和果胶含量相关[27-28]。干物质含量并不能单独决定鲜薯的硬度,品系0744-8的干物质含量是所有品种/品系中最低的,但是块茎硬度显著高于其他品种和品系,品系0716-22和0728-11的干物质含量适中,但是硬度均显著高于其他品种/品系,品种Burbank干物质含量适中,但鲜薯硬度显著低于其他品种/品系,说明干物质含量并不能决定块茎硬度,块茎中纤维含量也是决定块茎硬度的主要因素。蒸煮后块茎的软化度与块茎中淀粉糊化,果胶降解、细胞壁破碎、细胞降解等相关[29],块茎蒸煮后的软化度直接决定了蒸煮后的用途,软化度较低的品系0744-8和0722-26可以用于固形化程度较高的冷冻加工产品,而软化度高的品种Burbank、Shepody和品系0724-58、0712-66可用于半固形化程度的加工产品。软化度低但干物质含量高的品种和品系在加工为速食冷冻产品过程中可能存在产品表面糊化的问题。
4 结论
马铃薯蒸煮加工型品种的选育过程中除了在田间农艺性状是否满足加工的需要外,还要考虑块茎加工后的风味、色泽和质构特性的变化。通过对14个品种和品系的农艺性状及蒸煮加工品质性状的分析,品种Burbank、Shepody和品系0724-58、0712-66是蒸煮后软化度比较高的品种和品系,而0744-8和0722-26是蒸煮后软化度比较低的品系。
References:
[1] Mosley A R, Chase R W. Selecting cultivars and obtaining healthy seed lots//. APS Press St Paul MN, 1993: 19-27.
[2] Bradshaw J, Bryan G, Ramsay G. Genetic resources (including wild and cultivated Solanum species) and progress in their utilisation in potato breeding., 2006, 49(1):49-65.
[3] 赵青霞, 林必博, 张鑫, 李辉军, 刘悦善, 徐刚, 程李香, 王玉萍, 张俊莲, 王蒂, 张峰. 马铃薯抗低温糖化渐渗系培育和炸片品系筛选. 中国农业科学, 2013, 46(20): 4210-4221.
ZHAO Q X, LIN B B, ZHANG X, LI H J, LIU Y S, XU G, CHENG L X, WANG Y P, ZHANG J J, WANG D, ZHANG F. Breeding introgression potato lines with resistance to cold-induced sweetening and screening for chip processing lines., 2013, 46(20): 4210-4221.
[4] Mori K, Asano K, Tamiya S, Nakao T, Mori M. Challenges of breeding potato cultivars to grow in various environments and to meet different demands., 2015, 65(1):3-16.
[5] CHIAVARO E, BARBANTI D, VITTADINI E, MASSINI R. The effect of different cooking methods on the instrumental quality of potatoes (cv. Agata)., 2006, 77(1): 169-178.
[6] Tian J, Chen J, Ye X, Chen S. Health benefits of the potato affected by domestic cooking: A review., 2016, 202(1):165-175.
[7] Ohara-Takada A, Matsuura-Endo C, Chuda Y, Ono H, Yada H, Yoshida M, Kobayashi A, Tsuda S, Takigawa S, Noda T, Yamauchi H, Mori M. Change in content of sugars and free amino acids in potato tubers under short-term storage at low temperature and the effect on acrylamide level after frying., 2005, 69(7):1232-1238.
[8] Lee Y P, Takahashi T. An improved colorimetric determination of amino acids with the use of ninhydrin., 1966, 14(1):71-77.
[9] Coxon D T, Price K R, Jones P G. A simplified method for the determination of total glycoalkaloids in potato tubers., 1979, 30(11): 1043-1049.
[10] Campos D, Noratto G, Chirinos R, Arbizu C, Roca W, Cisneros-Zevallos L. Antioxidant capacity and secondary metabolites in four species of Andean tuber crops: Native potato (), mashua (Ruiz & Pavón), Oca (Molina) and ulluco (tuberosus Caldas).Science, 2006, 86(10):1481-1488.
[11] SOLMS J, WYLER R. Taste components of potatoes., 1979, 115: 175-184.
[12] MONDY N I, METCALF C, PLAISTED R L. Potato flavor as related to chemical composition., 2006, 36(3): 459-461.
[13] DUCKHAM S C, DODSON A T, BAKKER J, AMES J M. Volatile flavour components of baked potato flesh: a comparison of eleven potato cultivars., 2001, 45(5): 317-323.
[14] MONDY N I, METCALF C, PLAISTED R L. Potato flavor as Related to chemical composition: I. Polyphenols and ascorbic acid., 1971, 36(3): 459-461.
[15] Muttucumaru N, Powers S J, Elmore J S, Briddon A, Mottram D S, Halford N G.Evidence for the complex relationship between free amino acid and sugar concentrations and acrylamide-forming potential in potato., 2014, 164(2): 286-300.
[16] Furrer A N, Chegeni M, Ferruzzi M G. Impact of potato processing on nutrients, phytochemicals and human health., 2016,DOI:10.1080/10408398.2016.1139542
[17] SWINIARSKI E. After cooking darkening and some chemical constituents of potato tuber., 1968, 12: 369-384.
[18] WURSTER R T, SMITH O. Potato quality XVIII: The distribution of radioiron in the potato tuber and its significance in after-cooking darkening., 1963, 40(12): 415-420.
[19] Torres-Contreras A M, Nair V, Cisneros-Zevallos L, Jacobo-Velázquez D A. Effect of exogenous amylolytic enzymes on the accumulation of chlorogenic acid isomers in wounded potato yubers., 2014, 62(31):7671-7675.
[20] GRIFFITHS D W, BAIN H. Photo-induced changes in the concentrations of individual chlorogenic acid isomers in potato () tubers and their compexation with ferric ions., 1997, 40(40): 307-315.
[21] Wang-Pruski G, Nowak J. Potato after-cooking darkening., 2004, 81(1):7-16.
[22] Méandez C del M V, Delgado M A R, Rodríguez E M R, Romero C D. Content of free phenolic compounds in cultivars of potatoes harvested in tenerife (Canary Islands)., 2004, 52(5):1323-1327.
[23] Andre C M, Ghislain M, Bertin P, Oufir M, Rosario HM d, HOFFMANN L, Hausman JF O, Larondelle Y, Evers D. Andean potato cultivars (L.) as a source of antioxidant and mineral micronutrients., 2007, 55(2):366-378.
[24] BLESSINGGTON T, NZARAMBA M N. Cooking methods and storage treatment of potato: effects on carotenoids, antioxidant activity, and phenolics., 2010, 87(6): 479-491.
[25] STEWART D. Potato flavor and texture. Oxford, UK: Elsevier, 2007: 525-540.
[26] Corzo O, Ramírez O A. Prediction of the firmness for precooked potato strips at different conditions of temperature and cooking time., 2005,38(5):529-535.
[27] Van DIJK C, FISCHER M, HOLM J, BEEKHUIZEN J G, STOLLE- SMITS T, BOERIU C. Texture of cooked potatoes (): 1. Relationships between dry matter content, sensory- perceived texture, and near-infrared spectroscopy., 2002, 50(18): 5082-5088.
[28] Nourian F, Ramaswamy H S, Kushalappa AC. Kinetic changes in cooking quality of potatoes stored at different temperatures., 2003, 60(1): 257-266.
[29] Van MARLE J T, STOLLE-SMITS T, DONKERS J, Van DIJK C, VORAGEN A G J, RECOURT K. Chemical and microscopic characterization of potato (L.) cell walls during cooking., 1997, 45(1): 50-58.
(责任编辑李莉)
Screening for cooking-processing potato lines according to potato tuber qualities and
LIU Juan1,2, LIANG Yan-chao1, SUI Jing-hang1, YU Bin1, WANG Run-run1, ZHANG Xiao-wei1,CHENG Li-xiang1,WANG Yu-ping1, ZHANG Feng1
(1College of Agronomy, Gansu Agricultural University/Gansu Provincial Key Laboratory of Aridland Crop Science/Gansu Key Laboratory of Crop Improvement & Germplasm Enhancement, Lanzhou 730070;2College of Food Science and Engineering, Gansu Agricultural University, Lanzhou 730070)
【Objective】 Cooking of potato is a main important processing method in China. The cooking quality of potato should be analyzed and classified according to the commercially processing criterion. Screening for cooking-processing potato lines according to potato tuber qualities and properties from varieties and advanced lines are efficient methods under current consumptions of potatoes. As the processing indexes are required for different production purposes, potato breeding schemes have to be improved and changed to suitable for different cooking-processing standards. 【Method】Selection at an early breeding stage, the characteristics with agronomic traits such as yield, tuber size, tuber shape, tuber colour, eye depth, diseases resistance and commodity rate were evaluated based on three different locations in three years. Fourteen potato varieties and lines were selected for cooking qualities test. Samples of potato tuber were cooked in boiling water steamer for 25 min. After cooled for 20 min and 7 days under room temperature, the tuber colour change, the hardness and softening of the tubers from before-cooking to after-cooking were determined and analyzed. The contents of dry matter, starch, total glycoalkaloid, sucrose, reducing sugars, free amino acids, chlorogenic acid, ascorbic acid, citric acid were measured. The effect of change of the above components on tubers umami, colour change and texture were analyzed. The essential cooking-processing indexes were defined. 【Result】Comprehensive analysis and assessment on agronomic characters of potato varieties and lines showed that the first-line for selecting cooking-processing potato is that the agronomic characters of potato should meet the commercial processing criteria. The content of reducing sugars should be below 0.4% because its effect on tuber sweet flavor. There were no significant difference between tuber umami and the content of free amino acids (30-70 µmol) in fourteen varieties and lines. The content of total glycoalkaloid should be below 150 mg·kg-1, which negatively influences on tuber bitter flavor. The value of Δcolour between the cooking end and seven day later after-cooking was the important colour index in potato cooking-processing. The tuber softening difference was another important index of potato cooking-processing. 【Conclusion】The present results indicated that the after-cooking tuber umami, colour change and texture are the most important cooking-processing indexes. The varieties Burbank, Shepody and lines 0724-58, 0712-66 are the better softening potato varieties and lines. The potato lines 0744-8 and 0722-26 are the better hard lines.
potato; cooking; flavor; colour; texture; softening
2016-06-16;接受日期:2016-07-19
国家自然科学基金(31171477,31471433)、国家国际科技合作专项(2014DFG31570)、甘肃省农业厅马铃薯育种专项、甘肃省高校基本科研业务费
联系方式:刘娟,E-mail:liuj@gsau.edu.cn。通信作者张峰,E-mail:zhangf@gsau.edu.cn

