深度剖析质子守恒式的书写
◇ 江苏 张而立
(作者单位:南通大学附属中学)
深度剖析质子守恒式的书写
◇江苏张而立
在比较溶液中离子浓度大小时经常用到3个守恒关系是电荷守恒、物料守恒和质子守恒,其中质子守恒表达式最为难写,易于出错,如能掌握一种行之有效又较为简单快捷的书写质子守恒式的方法,可加快离子浓度大小比较题的解题速度,并提高准确率.本文向大家介绍一种灵巧又可靠的书写质子守恒式的方法.
所谓“质子守恒”是指在盐的水解、酸碱电离平衡体系的建立过程中,所有质子(H+)供给体所提供的质子总数必定等于所有质子接受体所得到的质子总数.如NaAc溶液中,与质子供受有关的微粒为H2O、Ac-,在建立平衡的过程中,H2O得质子产生H3O+、失质子产生OH-,Ac-只能得质子产生HAc,不能失质子.将上述过程绘制成图1(其中“×”表示该过程不能发生).
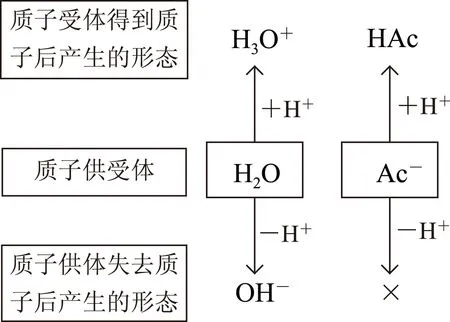
图1
依据图示及 “失去质子数等于得到质子数”关系,不难得出:c(H3O+)+c(HAc)=c(OH-) [注:式中c(H3O+)即为c(H+),下同],该式即为NaAc溶液中的质子守恒表达式.
这种写质子守恒式的方法,较通常使用的“电荷、物料平衡法”更为高效,易于操作,但要正确运用此种方法,关键有2点:
1) 找出溶液中直接参与质子转移的微粒,即本文所述的质子供给体和质子接受体,这些微粒包括溶剂提供的H2O,溶质直接提供的能发生电离的酸、碱或能发生水解的阳、阴离子.
2) 正确绘制出如图1的图示.

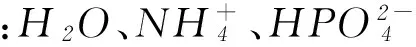
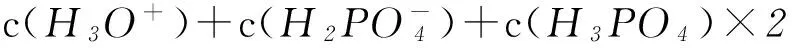

图2
显然对类似于HAc、H2S、NH3·H2O、NaHCO3、NaAc、NH4Cl、 (NH4)2CO3、NH4HCO3这些由弱酸、弱碱、两性物质、可水解的盐形成的单一溶质的溶液都能用这种方法直接写出溶液中的质子守恒关系式.下面笔者通过例2、例3再与大家讨论这种方法在2种特殊情况下的应用.

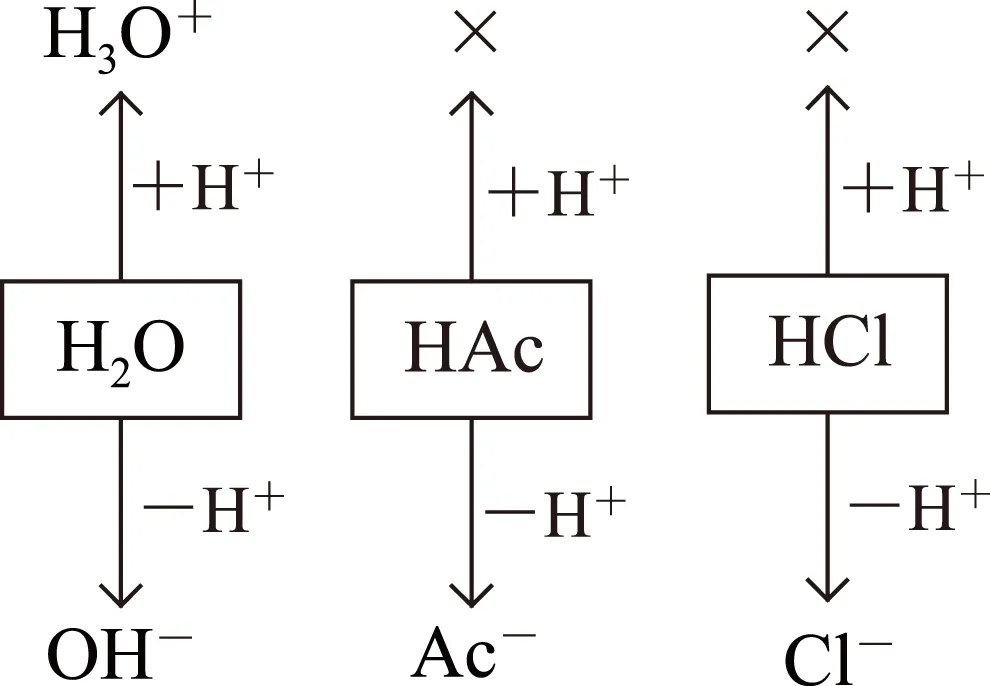
图3
分析本例中HCl为强酸,在溶液中可完全电离出质子,所以与HAc一样是体系中质子的供给体,绘图时对其处理的方式同HAc.绘出图3,并依图3可得该体系中的质子守恒式为c(H3O+)=c(OH-)+c(Ac-)+c(Cl-),很明显,该式亦为该溶液中的电荷守恒式.



图4
分析本例中的质子供受体有3种,分别是溶剂提供的H2O、溶质NaAc完全产生电离产生的Ac-、原溶质提供的HAc分子.依本文所示方法绘出图4.
本题与前2例有明显不同,即当HAc的电离与NaAc水解都达到平衡时,溶液中的HAc分子不仅有NaAc水解产生的一部分,还有原溶质HAc未发生电离的分子;溶液中的Ac-也不仅有原溶质HAc电离产生的一部分,还有原溶质NaAc未发生水解的那一部分Ac-.此时如直接写出等式:
c(OH-)+c(Ac-)=c(H3O+)+c(HAc).
①
经“电荷-物料平衡法”验证,式①是一个书写错误的质子守恒式,所以对于本例还须作如下的进一步处理.
首先在图4的基础上绘制图5,在图5中,HAc分子出现2次分别在A1、A2处,A1处HAc起始浓度为0.1mol·L-1,A2处HAc最大浓度为0.2mol·L-1(即B2处Ac-完全水解后生成的HAc浓度).所以溶液中HAc分子总浓度理论极限值为0.3mol·L-1,B2处Ac-水解产生的HAc理论极限值为0.2mol·L-1,是前者的2/3,此时应将式①右侧改作:
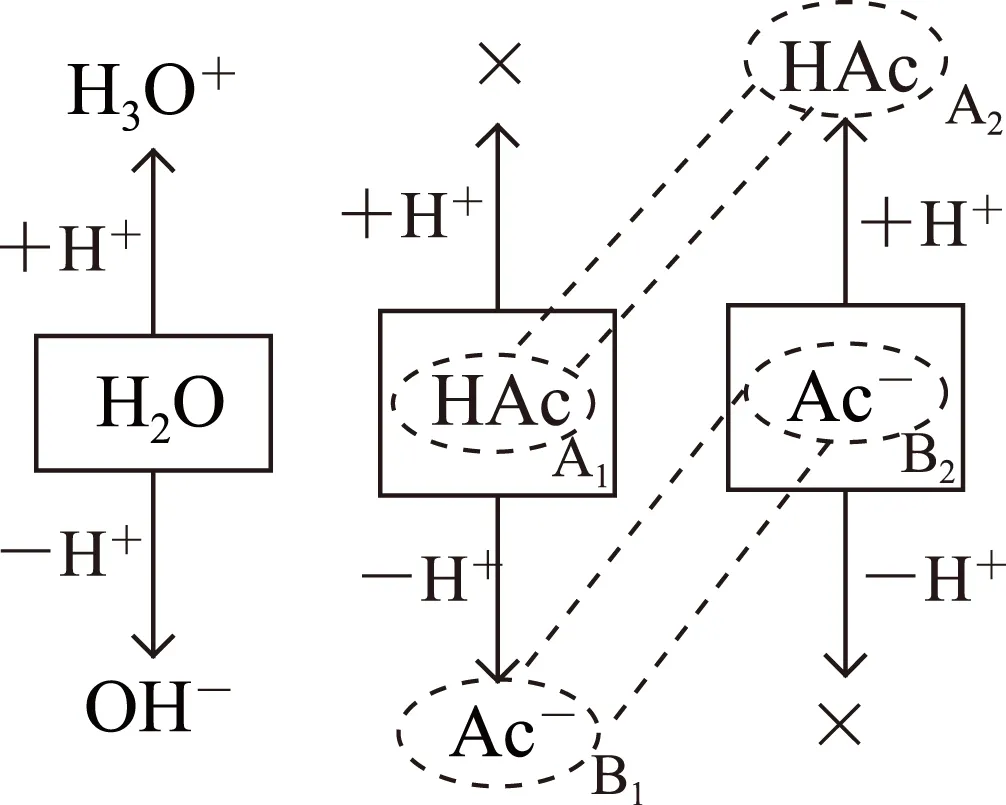
图5
同理,在图5中,Ac-出现2次,分别在B1、B2处,B2处HAc起始浓度为0.2mol·L-1,B1处最大浓度为0.1mol·L-1(即A1处HAc完全电离后生成的Ac-浓度).所以溶液中HAc分子总浓度理论极限值为0.3mol·L-1,由A1处HAc电离产生的Ac-理论极限值为0.1mol·L-1,是前者的1/3,此时应将式①左侧改作:
经以上2步处理后,就可得到在浓度分别为0.1、 0.2mol·L-1的HAc、NaAc混合溶液中正确的质子守恒式:
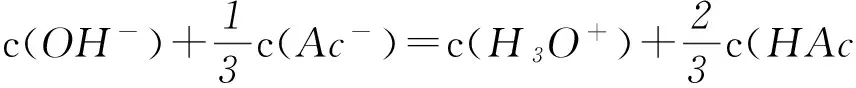
本文所举3例的质子守恒表达式的书写都较为复杂,尤以例3为最,读者可以依据“电荷-物料平衡法”一一进行验证.相对于“电荷-物料平衡法”,此法简洁、高效、易学,学习者只要能依本文所示方法,按部就班,依样而行,都能以较快的速度得出正确的质子守恒表达式.
(作者单位:南通大学附属中学)

