参天一棵树,扎根于沃土——根据中和滴定曲线剖析溶液中微粒浓度关系
◇ 四川 付安平
(作者单位:四川省成都市第七中学高新校区)
参天一棵树,扎根于沃土
——根据中和滴定曲线剖析溶液中微粒浓度关系
◇四川付安平
在选修4《化学反应原理》中根据酸碱中和滴定曲线剖析溶液中微粒浓度关系,往往涉及的知识点有:弱电解质电离平衡(或电离平衡常数)和盐的水解平衡(或水解平衡常数)及其相互关系;从定性角度是比较二者的相对大小,定量角度主要有电荷守恒、物料守恒(原子守恒)、质子守恒(单一盐溶液).从溶液组成来看:分为单一溶液和混合溶液(即多溶质).现在的高考热点是用熟悉的酸碱滴定曲线解决多溶质溶液中微粒浓度关系的问题,以不定量或图象等多种形式呈现,有些问题过于抽象,学生很难理解,笔者从简单的知识入手,层层推进,从定性到定量,由单曲线到多曲线,收到了良好效果.“参天一棵树,扎根于沃土”,一切高考试题既来源于教材又高于教材.
1 题根
已知室温下醋酸的电离平衡常数K=1.6×10-5.在室温下,向20mL0.01mol·L-1的醋酸中滴加 0.01mol·L-1的KOH溶液(忽略温度的变化).请回答下列问题:
(1) 绘制V(KOH)-pH图.
(2) 进行过程分析(写出对应的物质和酸碱性).

K=c2(H+)/c(CH3COOH),
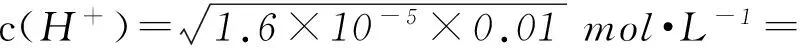
4×10-4mol·L-1.
pH约为3.4.V(KOH)-pH图如图1.
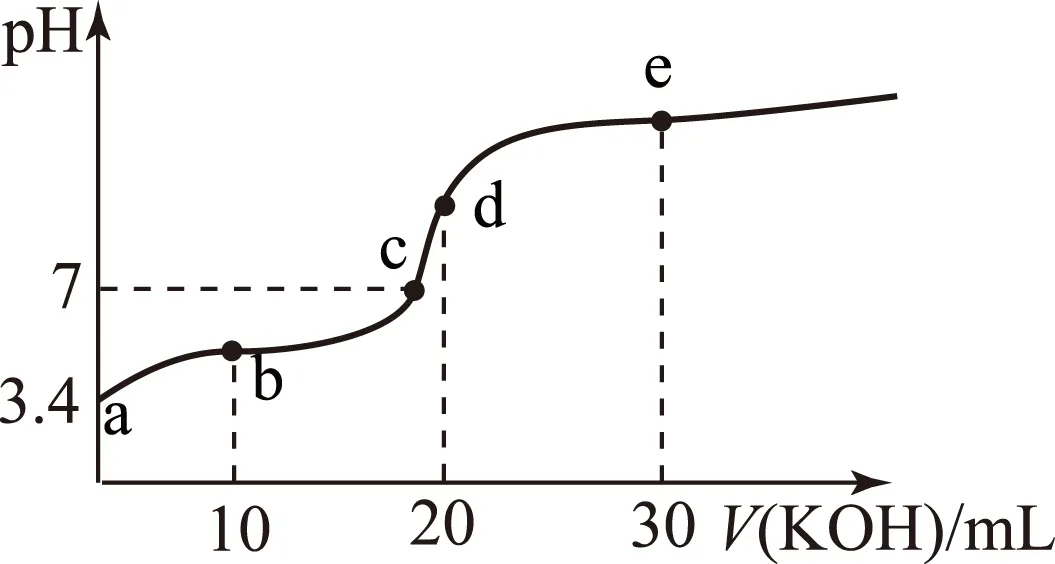
图1
(2)滴定前,a点是醋酸溶液(很多),溶液显酸性,pH约为3.4;滴定中,b点是n(CH3COOH)∶n(CH3COOK)=1∶1的混合溶液(醋酸的电离大于醋酸钾的水解),溶液为酸性;c点是CH3COOK(较多)和醋酸(很少)的混合溶液,溶液为中性(醋酸的电离等于醋酸钠的水解);d点是CH3COOK溶液(很多),为滴定终点,溶液显弱碱性;e点是CH3COOK(多)和KOH(可多可少)的混合溶液,溶液显较强碱性.
2 题根知识延伸
延伸1何为滴定终点?pH=7的点是滴定终点吗?

延伸2图1中a、b、c、d、e这5点中水的电离程度最大的点是哪个点?滴定终点是哪个点?选什么做指示剂?

延伸3当KOH溶液体积为10.00mL时,请写出微粒浓度大小顺序,并写出电荷守恒式、物料守恒式及其总的式子关系.

电荷守恒式:
c(K+)+c(H+)=c(CH3COO-)+c(OH-);
物料守恒式:
c(CH3COO-)+c(CH3COOH)=2c(K+);
总的式子c(CH3COOH)+2c(H+)=
c(CH3COO-)+2c(OH-).
延伸4当KOH溶液体积为20.00mL时,请写出离子浓度大小顺序、电荷守恒式、物料守恒式及其质子守恒式.

电荷守恒式:
c(K+)+c(H+)=c(CH3COO-)+c(OH-);
物料守恒式:
c(CH3COO-)+c(CH3COOH)=c(K+);
质子守恒式:c(OH-)=c(CH3COOH)+c(H+).
延伸5将20mL0.01mol·L-1的醋酸改成20mL0.01mol·L-1的盐酸,用何指示剂?请画出V(KOH)-pH图.

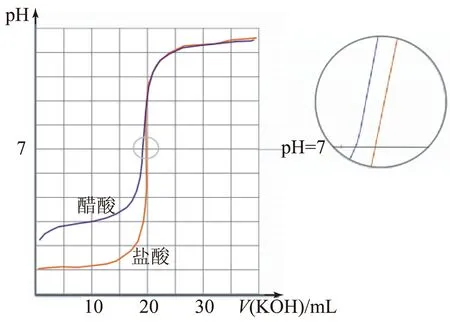
图2
延伸6根据 “有序原则”“渐变思想”完整分析出在醋酸溶液中逐滴加入KOH溶液至过量时的离子浓度关系,如表1.
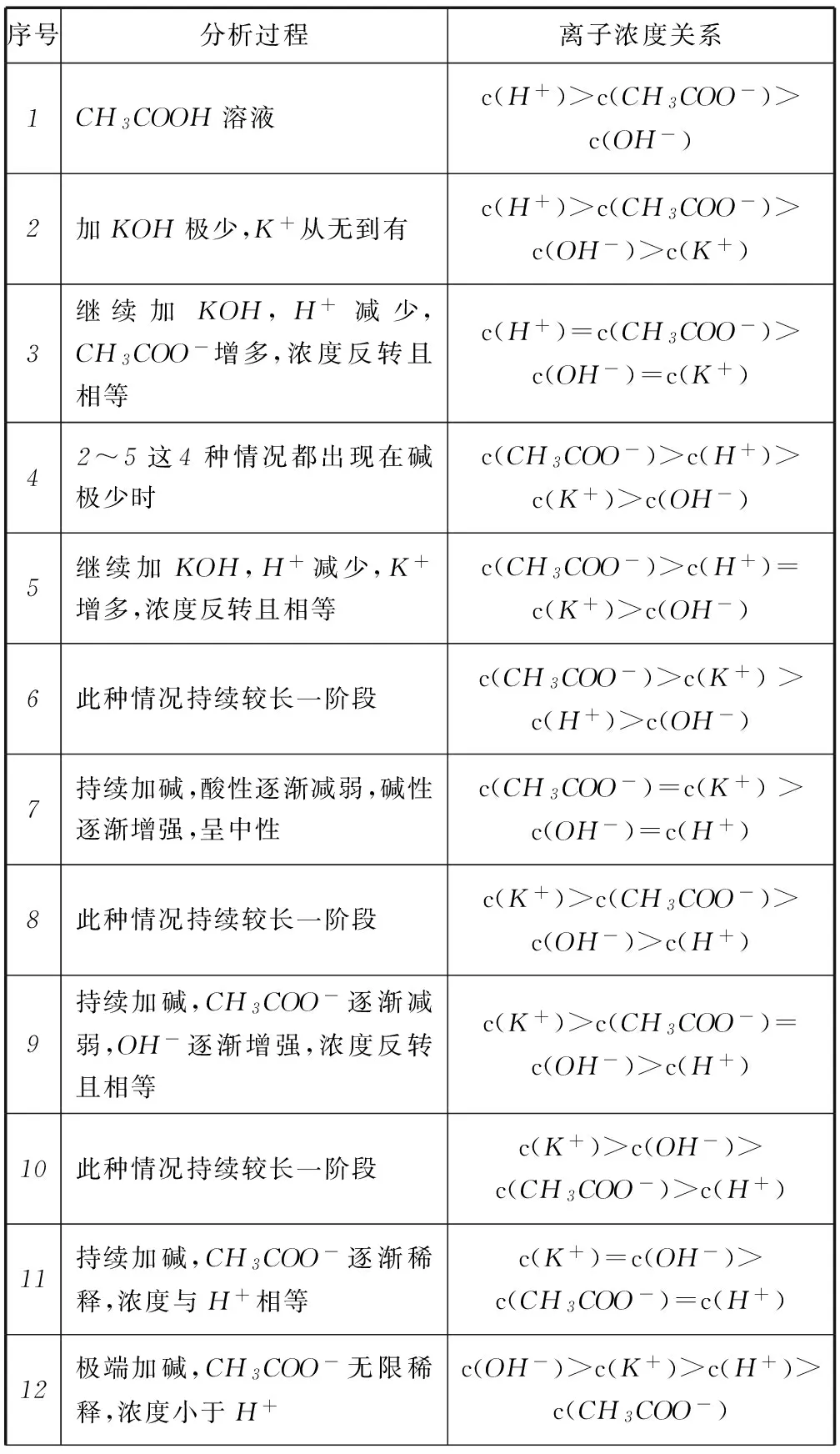
表1 滴定过程中离子浓度关系
延伸7将20mL0.01mol·L-1的醋酸改成20mL0.01mol·L-1的HA(已知Ka(CH3COOH)>Ka(HA)),用何指示剂?请画出V(KOH)-pH图.

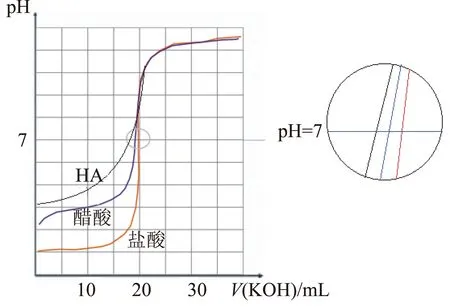
图3
根据图象得出的结论:
1)pH=7时,V(KOH)的用量:HCl>CH3COOH>HA.即酸的酸性越弱,曲线向左平移,碱的用量越少.
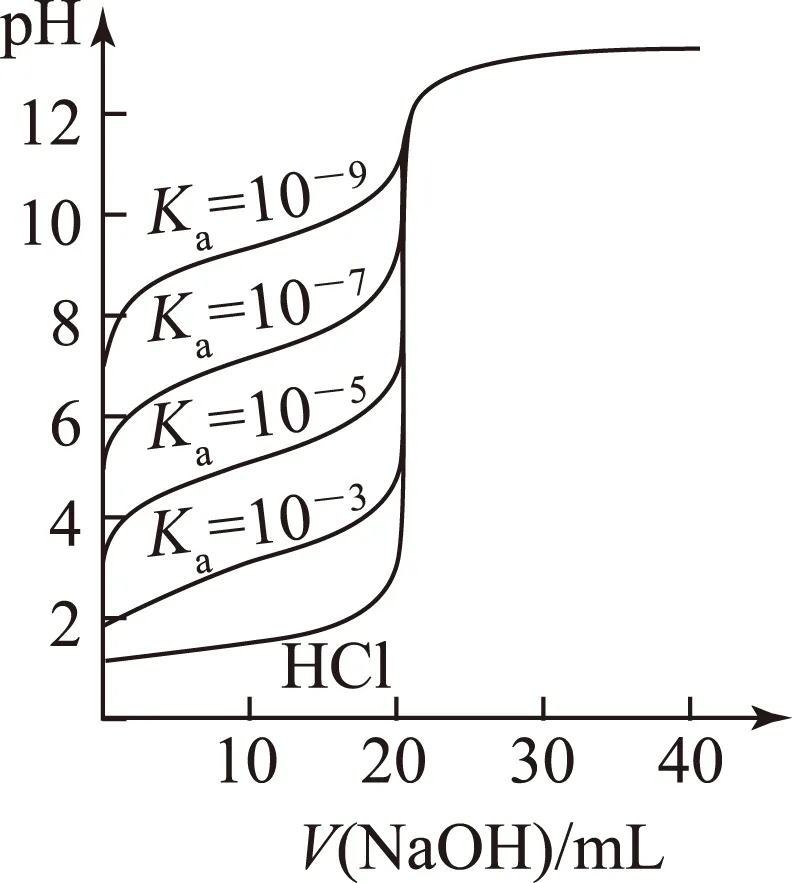
图4
2) 当滴定终点时,即碱的用量相同,酸性越弱,终点pH越大,即曲线向上移.
总结0.1000mol·L-1NaOH溶液分别滴定20.00mL0.1000mol·L-1的5种酸的滴定曲线如图4所示.
延伸8一元强碱滴定多元弱酸滴定曲线分析如何?
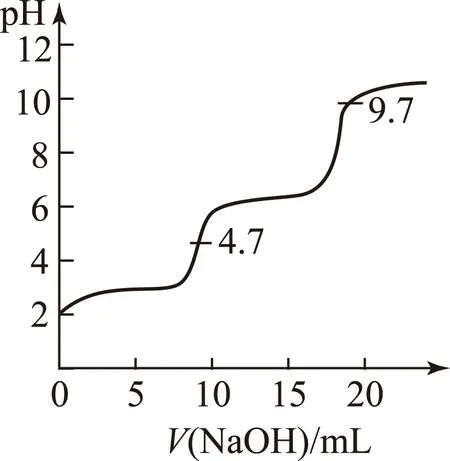
图5
如:0.1000mol·L-1NaOH溶液滴定10.00mL0.1000mol·L-1H3PO4溶液的滴定曲线如图5所示.
H3PO4
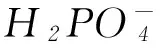

第1计量点:甲基橙由红色变黄色. 第2计量点:酚酞由无色变浅红色.
对于多元弱酸,当Ka1/Ka2≥105时,滴定时有分次突跃.
延伸9数字传感设备和数字化分析系统分析酸碱中和滴定曲线(如图6、7):
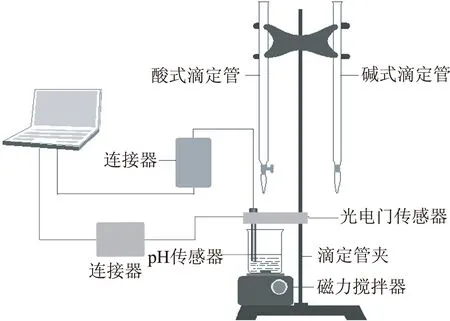
图6
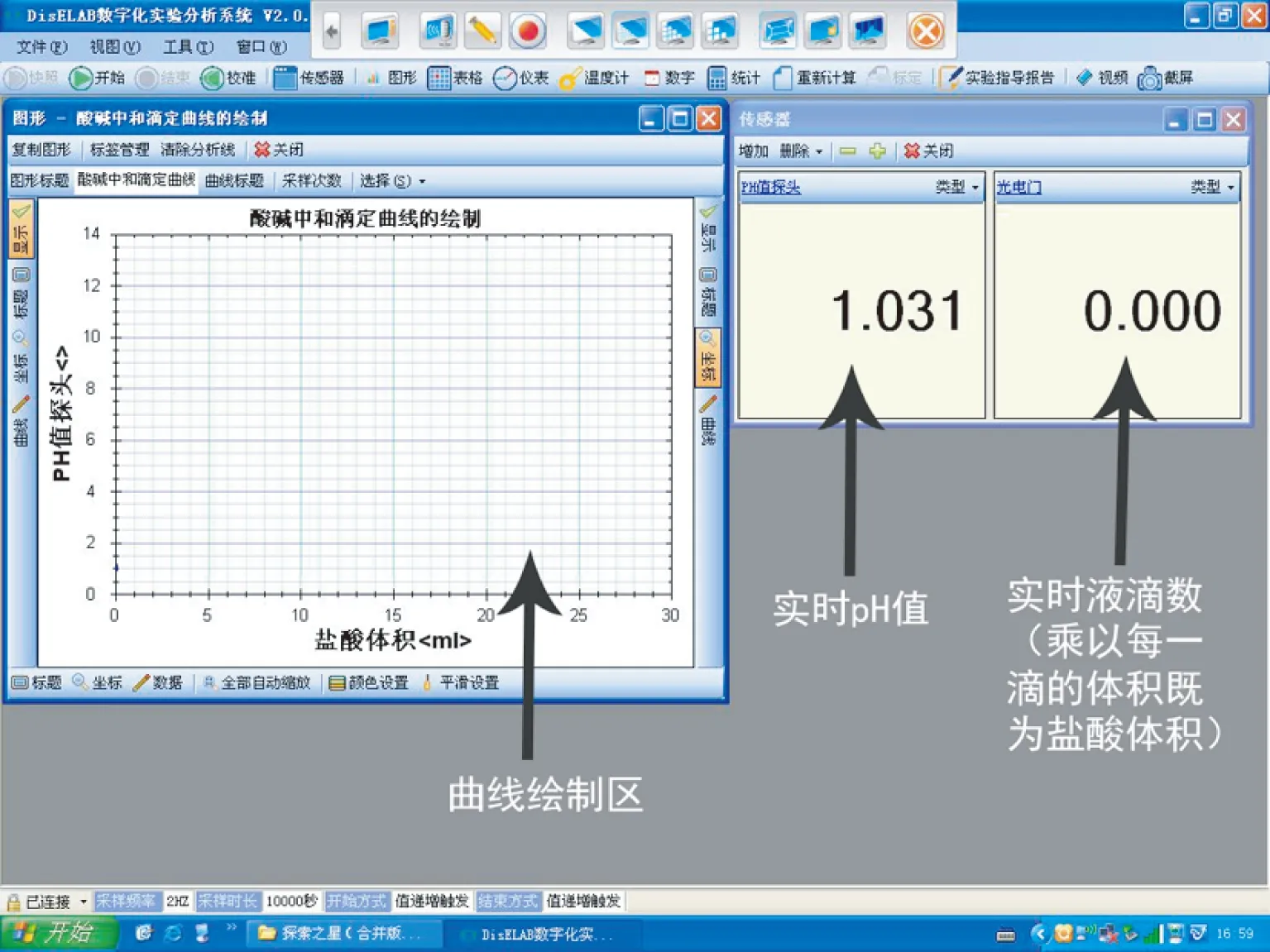
图7
延伸10利用温度传感器和电导率传感器分析酸碱中和滴定曲线,图8是1.0mol·L-1NaOH溶液滴定25mL未知浓度的盐酸的温度变化曲线,图9是1.0mol·L-1NaOH溶液滴定25mL未知浓度的盐酸的电导率变化曲线.
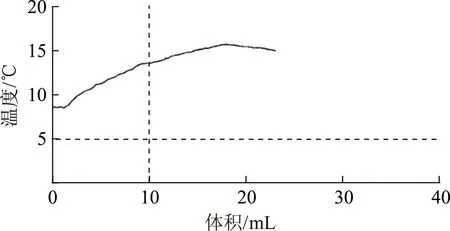
图8
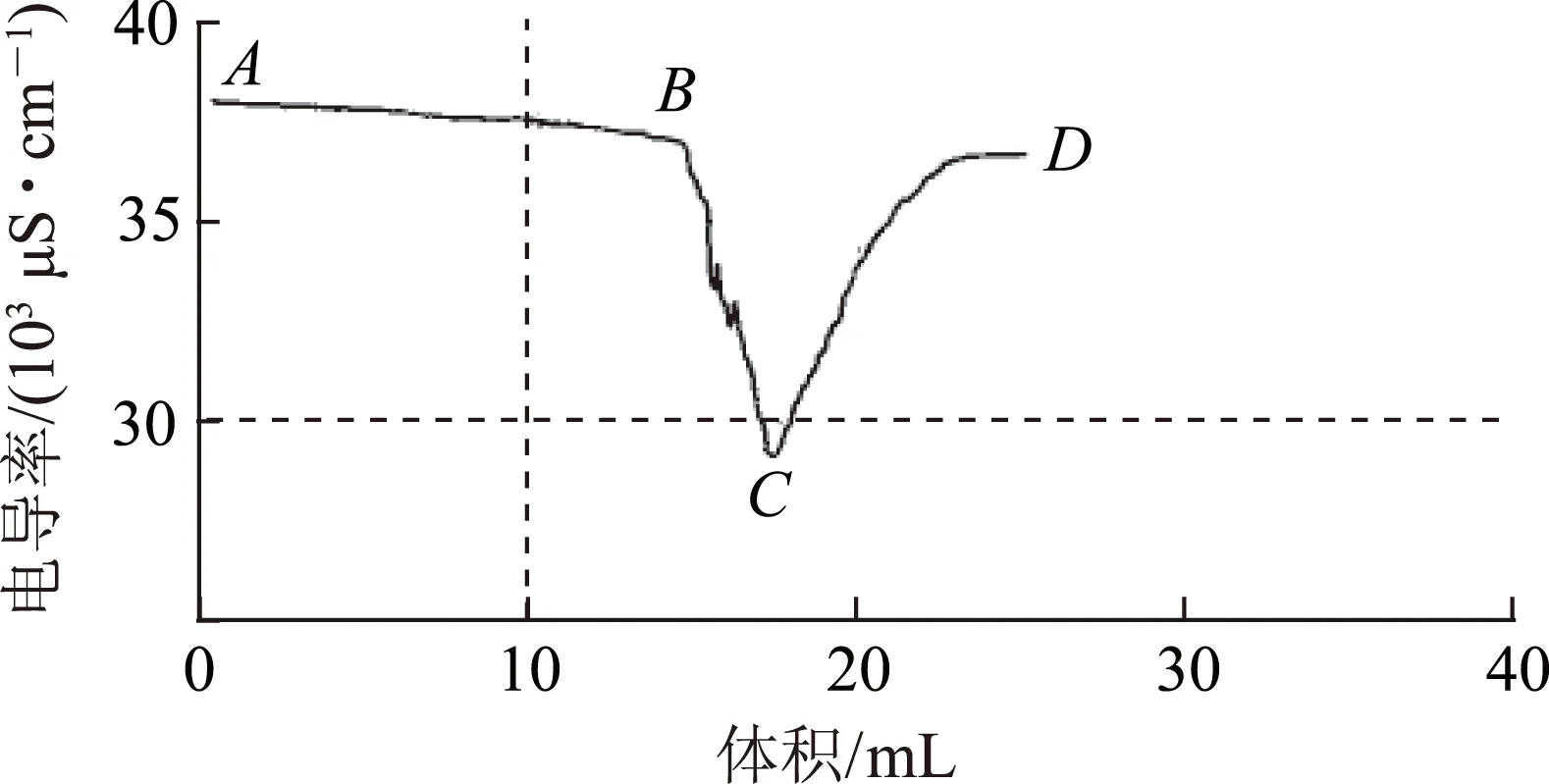
图9
归纳:1.0mol·L-1的NaOH溶液滴定25mL的未知浓度的盐酸,当反应液温度最高或导电率最小时为滴定终点.
总之,“一个比较(水解与电离哪个较强)、2个微弱(水解与电离程度如何)、三类守恒(电荷守恒、物料守恒、质子守恒)、4种溶液(CH3COONa、Na2CO3、NaHCO3、NH4Cl)”是解决问题的核心知识.
3 应用实例
3.1单曲线图
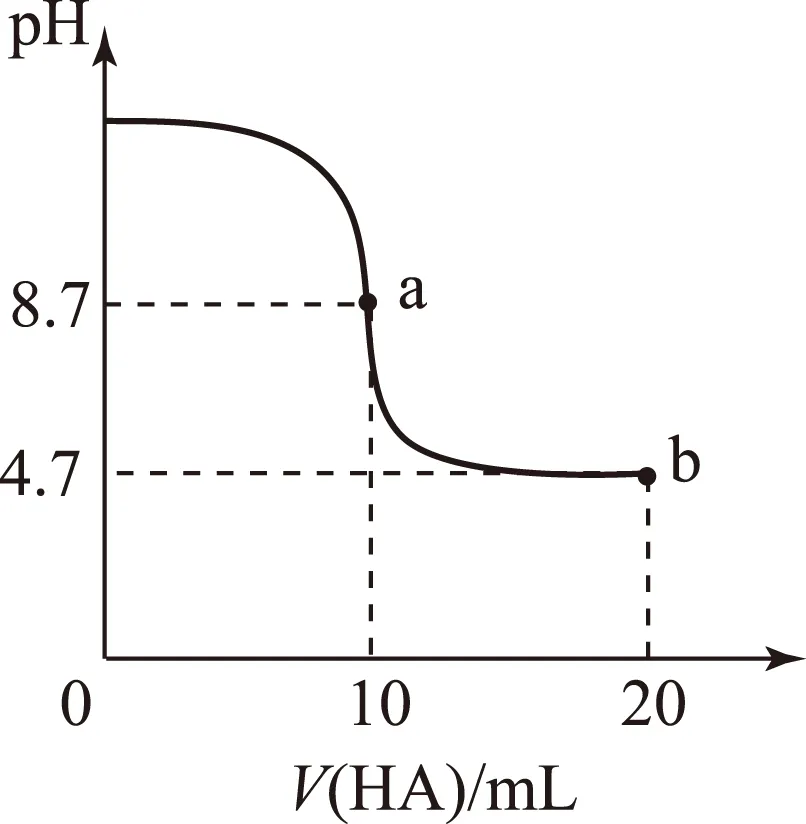
图10

Aa点所示溶液中
c(Na+)>c(A-)>c(H+)>c(HA);
Ba、b这2点所示溶液中水的电离程度相同;
CpH=7时,c(Na+)=c(A-)+c(HA);
Db点所示溶液中c(A-)>c(HA)
答案D.
3.2双曲线图
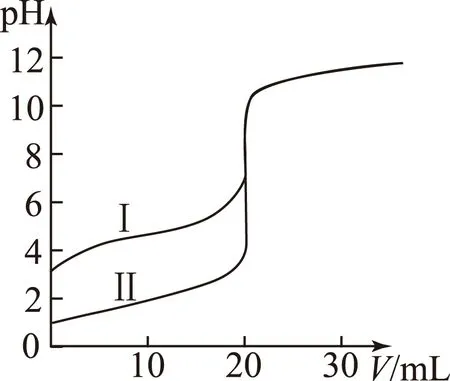
图11

AⅡ表示的是滴定盐酸的曲线;
BpH=7时,滴定醋酸消耗V(NaOH)小于20mL;
CV(NaOH)=20mL时,
c(Cl-)=c(CH3COO-);
DV(NaOH)=10mL时,醋酸溶液中:
c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
答案B.

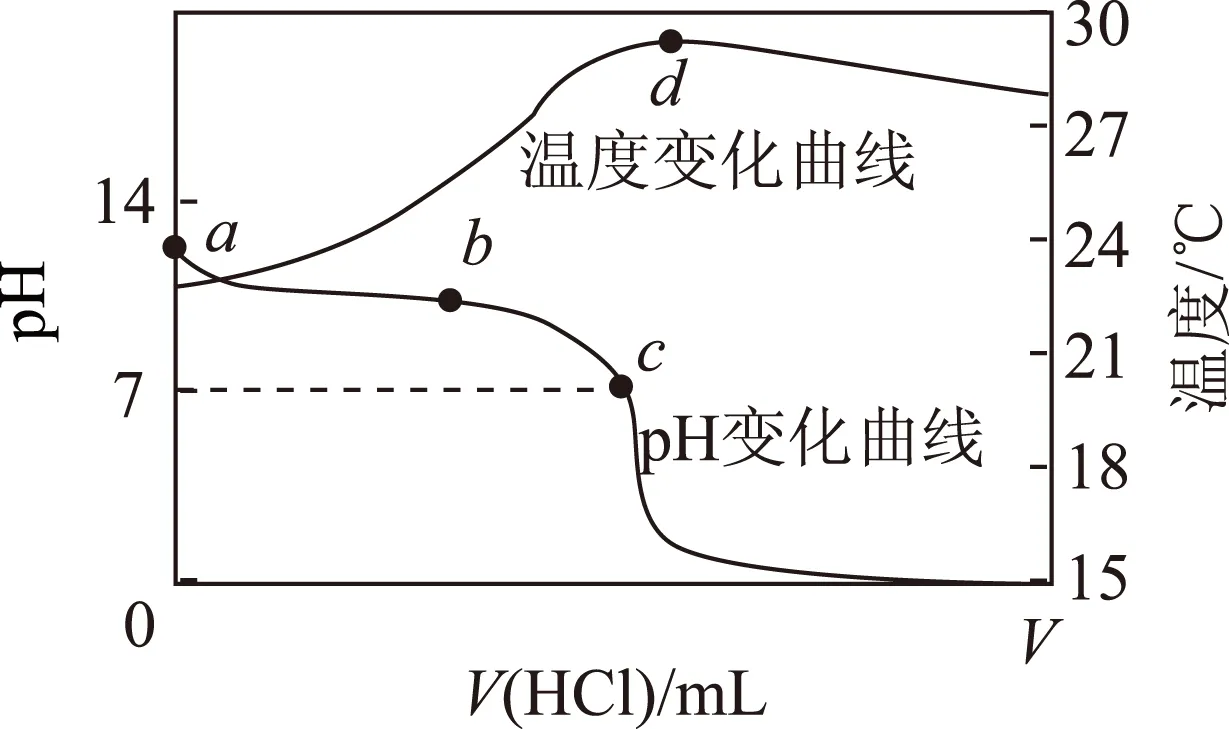
图12
Aa点:由水电离出的
c(H+)=1.0×10-14mol·L-1;
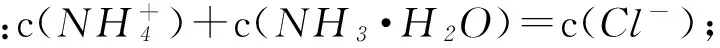
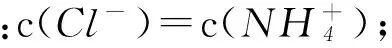
Dd点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
答案C.
3.3多曲线图

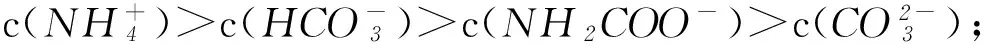
B不同pH的溶液中存在关系:
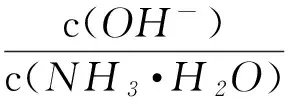
D在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成
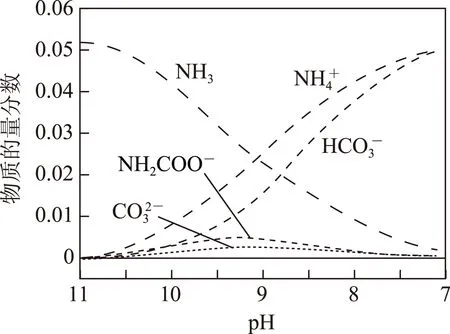
图13
答案C.
(作者单位:四川省成都市第七中学高新校区)


