重组PEDV-S干酪乳杆菌的构建及其表达
岳璐,李昆鹏,侯喜林,余丽芸,
(1.黑龙江八一农垦大学生命科学技术学院,大庆 163319;2.黑龙江八一农垦大学动物科技学院)
重组PEDV-S干酪乳杆菌的构建及其表达
岳璐1,李昆鹏1,侯喜林2,余丽芸1,2
(1.黑龙江八一农垦大学生命科学技术学院,大庆163319;2.黑龙江八一农垦大学动物科技学院)
猪流行性腹泻病毒(PEDV)可引起猪的呕吐、腹泻及脱水。通过将其S1片段逆转录连接到干酪乳杆菌表面表达载体pLA上,使其表达蛋白,为进一步研究其特性及免疫原性奠定基础。采用TRIzol的方法从PEDV中提取RNA为模板,通过RT-PCR技术获得该病毒的S1片段,然后将该基因连接到载体pLA中并表达。重组菌经过培养表达之后,利用Western blot检测融合蛋白大小约为81 kDa;重组蛋白可被兔源的抗PgsA血清和鼠源的抗PEDV血清所识别。表明重组干酪乳杆菌成功的表达了融合蛋白。
猪流行性腹泻病毒;干酪乳杆菌;RT-PCR技术;Western blot技术
猪流行性腹泻(PED)是由猪流行性腹泻病毒(PEDV)引起的一种接触性传染病[1]。其主要引起仔猪呕吐、严重腹泻和脱水,死亡率高,给我国乃至世界养猪业带来巨大的经济损失。所以研制PEDV新型疫苗是十分必要的。S蛋白是PEDV一个表面的结构蛋白,它既含有介导病毒侵入宿主细胞的受体结合域,又拥有介导机体产生病毒中和抗体的抗原表位。所以,PEDV S蛋白在介导感染宿主产生中和抗体的过程中发挥重要作用。
乳酸菌是食品级安全菌[2],利用乳酸菌为表达载体研制口服疫苗安全无毒,能诱导机体产生有效的免疫应答。乳酸菌口服疫苗通过胃肠粘膜进行抗原呈递,使用方便而且较传统注射途径的免疫效果和依从性好,是理想的疫苗,有广阔的发展前景[3-5]。
实验所用的载体为本实验室所构建的pLA表达型载体[6-7],目的蛋白能够在细胞外表达,而且重组乳酸菌在表达过程中不需要诱导剂,如果使用诱导型启动子,构建的重组菌应用于本体动物会受到诱导剂使用限制,增加了应用的困难。现设计的载体很好地解决了这个问题,突破了应用的瓶颈。PEDV S1片段上包括了S抗原的所有4个抗原表位,因此,为了更好地表达S抗原,选择了S1片段作为克隆目的基因。利用RT-PCR获得PEDV全长cDNA,通过PCR扩增出DNA,然后连接到大肠杆菌-干酪乳杆菌穿梭表达载体pLA上,电转化到干酪乳杆菌中,利用pLA/L.casei系统进行原核表达,为进一步研究其特性及免疫原性奠定基础。
1 材料和方法
1.1材料
1.1.1菌株和质粒
非洲绿猴肾细胞(Vero)由实验室保存;PEDV CH/HLJHRB/2011由实验室分离鉴定;大肠杆菌(E. coli)-干酪乳杆菌(L.casei)穿梭表达质粒pLA由本实验室构建保存,该质粒含有pgsA融合蛋白基因。
1.1.2主要试剂和仪器
TRIzol试剂购自Intrivigen公司;M-MLV RNase H购自Fermentas公司;rTaq购自TaKaRa公司;HRP标记的羊抗鼠IgG(IgG-HRP)或羊抗兔IgG-HRP抗体及FITC标记的羊抗兔(IgG-FITC)或羊抗鼠IgGFITC均购自Sigma公司;鼠源抗PEDV或兔源抗PgsA多克隆阳性血清由本实验室制备保存;CR21型高速立式离心机,日本日立公司(HITACHI);ABI Veriti PCR仪,美国Applied Biosystems公司;TDL-5M台式大容量冷冻离心机,上海卢湘仪离心机有限公司,DYY-8B型稳压稳流电泳仪,北京六一仪器厂,powerpac universal电泳仪,美国Bio-Rad公司。
1.2方法
1.2.1引物设计与合成
根据基因序列,设计两对特异性引物,扩增PEDV-S1(1 086 bp)。引物序列为:P1 5′-CGCGGATCCGATGTCACCAGGTGCTCAG(BamHⅠ)、P2 5-CGCGTCGACTTAAGTGGAGTTGTAAGTATC(SalⅠ),引物由上海生物工程技术服务有限公司合成。PCR反应参数:94℃预变性5 min,94℃变性30 s,56.5℃退火30s,72℃延伸1min,35个循环后,72℃延伸10 min。反应结束后用1%的琼脂糖凝胶电泳进行鉴定。
1.2.2PEDV的扩繁
将PEDV病毒接种于细胞覆盖率达到70%~80%的Vero单层细胞,37℃二氧化碳恒温培养箱感作1 h后,倒掉病毒液,加入2%胎牛血清的DMEM细胞培养液,置于37℃二氧化碳恒温培养箱中培养,待细胞病变达到75%以上时,收获病毒悬液,反复冻融三次,3 000 r·min-1离心10 min,取上清液即为病毒液。
1.2.3病毒基因组RNA提取
采用TRIzol法提取PEDV病毒基因组RNA。首先取经Vero细胞扩繁的PEDV病毒液200 μL加在1.5 mL的eppendorf管中,再加入800 μL Trizol试剂,充分混匀,放置10 min;加入200 μL氯仿,用力震荡离心管,室温放置10 min;4℃,13 000 r·min-1离心15 min,将上层RNA吸到另一新的eppendorf管中;加入等体积的异丙醇,轻轻颠倒混匀,室温放置10 min;4℃,13 000 r·min-1离心15 min,小心弃去上清;用75%乙醇清洗一遍,4℃,10 000 r·min-1离心15 min,小心弃去上清,室温放置10 min,待乙醇挥发干净后;向管内加入10 μL的DEPC水,进行RT-PCR。
1.2.4目的基因的RT-PCR扩增
以基因组RNA为模板,按照M-MLV反转录说明书操作方法利用下游引物特异性反转录合成cDNA。在灭菌的无RNA酶的PCR eppendorf管内,加入RNA模板12.5 μL,下游引物1 μL,70℃水浴5 min,立即冰上放置2 min,取出后加入5× Buffer 5 μL,dNTP 5 μL,RNase Inhibitor 0.5 μL,37℃水浴5 min,然后加入MMLV RNase 1 μL,混匀后42℃2.5 h,70℃灭活10 min,终止反应,冰上放置2 min。然后以cDNA为模板,通过PCR方法合成DNA。
1.2.5重组L.casei的构建
通过设计的引物扩增出S1片段,然后利用PCR产物回收试剂盒回收S1片段,利用酶BamHⅠ和SalⅠ分别对S1片段和pLA载体进行双酶切,酶切之后用琼脂糖凝胶回收试剂盒进行回收;然后将回收的S1片段与pLA载体相连接。得到的重组质粒命名为pLAPEDV-S1载体。采用常规方法制备L.casei感受态细胞,将重组质粒及空载体质粒对照在2.5 kV、200 Ω、25 μF的电击条件下电转化,电击时间约为4~5 ms,电转之后将其涂布于MRS固体培养基上(含氯霉素34 μg·mL-1),37℃厌氧倒置培养48 h,挑取单菌落,用PCR的方法进行阳性克隆鉴定。
1.2.6Western blot检测
将重组菌pLA-PEDV-S1/L.casei和pLA/L.casei分别按2%接种于含有氯霉素的MRS液体培养基中培养,37℃静置过夜。第二日,取昨天的菌液接种于含氯霉素抗性的MRS液体培养基中,37℃静置培养,取表达8 h的菌液1 mL,4 500 r·min-1离心5 min,弃去上清,收集沉淀后加入500 μL的10 mg·mL-1溶菌酶37℃孵育35 min,4 500 r·min-1离心5 min,弃上清,收集沉淀,然后加入80 μL的SDS-PAGE Loading Buffer(含β-巯基乙醇)重悬,沸水浴煮沸10 min,12 000 r·min-1离心3 min,取上清20 μL点样,以10%的SDS-PAGE检测重组蛋白。然后将跑完的胶转印到PVDF膜上,以鼠源PEDV和兔源PgsA阳性血清为一抗,以相应的辣根过氧化物酶标记的羊抗鼠或羊抗兔IgG(1∶5 000)为二抗,对重组菌进行Western blot鉴定重组表达蛋白。
2 结果
2.1PEDV S1基因反转录的PCR结果
以反转录得到的cDNA为模板,通过设计的特异性引物进行PCR扩增,结果可见1条约为1 086 bp的特异性条带,与预期DNA片段大小一致。结果如下图1所示。

图1 RT-PCR产物的琼脂糖凝胶电泳Fig.1Agarose gel electrophoresis of RT-PCR product
2.2重组质粒酶切鉴定结果和PCR结果
①重组质粒经BamHⅠ和SalⅠ双酶切,结果切出了大小约为1 086 bp和6 346 bp的两个片段,与预期结果相符,筛选出阳性重组子pLA-PEDV-S1(见图2)。

图2 重组质粒pLA-PEDV-S1的酶切产物Fig.2Identification of pLA-PEDV-S1 by enzyme digestion
②以重组质粒为模板,通过PCR鉴定,得到一条大小约为1086 bp的片段,与预期结果相符(见图3)。

图3 重组质粒pLA-PEDV-S1的PCR产物Fig.3Identification of recombinant plasmid by PCR
2.3PCR扩增干酪乳杆菌转化子的结果
将鉴定好的重组质粒pLA-PEDV-S1电转化到干酪乳杆菌中,提取质粒,通过PCR方法进行鉴定,可见明显的目的条带(1 086 bp),与插入片段的大小一致,而对照组未见目的条带(图4)。
2.4重组蛋白表达的Western blot鉴定
以PgsA阳性血清为一抗,以羊抗兔为二抗进行Western blot检测。结果显示,PgsA阳性血清能够与pLA-PEDV-S1/L.casei和空载体转化的对照菌发生反应,表达的重组菌分别为81kDa和41 kDa(图5)。
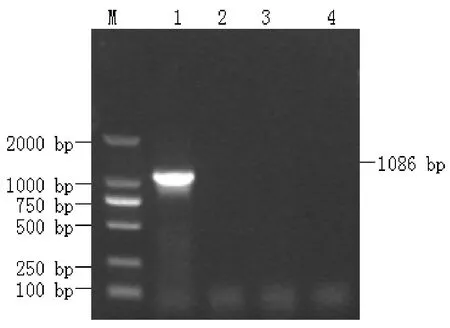
图4 重组干酪乳杆菌的PCR鉴定结果Fig.4Identification of recombinant L.casei by PCR
3 讨论
PEDV可引起仔猪呕吐、严重腹泻和脱水,致死率高,主要是通过感染猪排出的粪便或其他污染物经口感染,新生仔猪的潜伏期为1~2 d,育肥猪为2天以上。PEDV感染之后引起的相关疾病为猪肠壁变薄、水样腹泻及脱水等等。在过去的30年里,猪流行性腹泻病毒在亚洲尤其是我国猪场感染非常严重,其感染率明显高于猪传染性胃肠炎病毒和猪轮状病毒。其危害之大,给养猪业带来极大的经济损失。
PEDV S蛋白由1 383个氨基酸组成,S蛋白具有识别靶细胞,促进病毒和细胞膜的融合的作用[8]。S蛋白被人为划分为受体结合区(S1)和膜融合区(S2),即使S蛋白不被切割成S1和S2两个亚基,但是在相应的位置上存在这两个基因序列,所以这为其划分为S1区和S2区提供了依据。
研究以食品级的干酪乳杆菌Lactobacillus casei作为递送疫苗抗原的活载体,利用质粒pLA即PHCE1LB-pgsA,它是一种大肠杆菌和干酪乳杆菌穿梭表达载体[9],构建了细胞表面表达PEDV S1融合蛋白的重组干酪乳杆菌系统,以期利用该重组菌作为口服疫苗,达到预防PEDV感染的目的。对构建的重组干酪乳杆菌表达的融合蛋白经Western blot免疫学检测分析,外源重组蛋白能够被相应的血清所识别,表明所构建的重组干酪乳杆菌表达系统能够有效的表达外源目的蛋白,重组蛋白与天然抗原一样具有相同的免疫原性[10-13]。

图5 重组菌的anti-pgsA(A)、anti-PEDV(B)Western blot检测结果Fig.5Western blot analysis of recombinant protein by using anti-pgsA(A)and anti-PEDV(B)antibody
4 结论
利用RT-PCR技术从PEDV获得了1 086 bp的S1片段,连接到大肠杆菌和乳酸菌之间穿梭的表面表达载体pLA上,并电转化到干酪乳杆菌中,成功构建了重组干酪乳杆菌,并且在干酪乳杆菌上成功表达了目标蛋白,为后续的免疫原性研究奠定基础。
[1]孙东波,冯力,陈建飞,等.猪流行性腹泻病毒CH/JL毒株S基因的克隆、序列分析及线性抗原表位区的鉴定[J].病毒学报,2007,23(3):224-229.
[2]Ren D Y,Li C,Qin Y Q,et al. Development review on healthy function and potential menchanisms of Lactic Acid Bacteria[J]. Chin J Vet Drug,2011,45(2):47-50.
[3]刘建奎,魏春华,余丽芸,等. 表达ETEC F41 重组干酪乳杆菌口服及滴鼻免疫效果的比较[J]. 微生物学报,2009,49(4):524-530.
[4]Liu J K,Hou X L,Wei C H,et al. Induction of immune responses in mice after oral immunization with recombinant Lactobacillus casei strains expressing En terotoxigenic Escherichia coli F41 fimbrial protein [J]. Appl Environ Microbial,2009,75(13):4491-4497.
[5]Wei C H,Liu J K,Hou X L,et al. Immunogenicity and protective efficacy of orally or intranasally administ recombinant Lactobacillus casei expressing ETEC K99[J]. Vaccine,2010,28:4113-4118.
[6]Lee J S,Poo H,Han D P,et al. Mucosal immunization with surface-displayed severe acute respiratory syndrome coronavirus spike protein on Lactobacillus casei induces neutralizing antibodies in mice[J]. Journal of Virology,2006,80(8):4097-4097.
[7]Scheppler L,Vogel M,Zuercher A W,et al. Recombinant johnsonii as a mucosal vaccine delivery vehicle[J]. Vaccine,2002,20:2913-2920.
[8]张敏强,郭福生,尹燕博,等.猪流行性腹泻病毒分子生物学特征[J].中国病毒学,2002,17(4):381-384.
[9]林红丽,王嵩,王宇鹏,等.干酪乳杆菌表面展示IBDV VP2蛋白[J]. 黑龙江八一农垦大学学报,2014,26(5):39-43.
[10]余丽芸,赵志刚,侯喜林,等.乳酸菌表面展示表达PEDV S1蛋白的研究[J]. 黑龙江八一农垦大学学报,2008,20(4):45-47.
[11]Ashiuchi M,Nawa C,Kamei T,et al. Physiological and biochemical characteristics of poly gamma-glutamate synthetase complex of Bacillus subtilis [J]. European Journal of Biochemistry,2001,268(20):5321-5328.
[12]Ashiuchi M,Misono H. Biochemistry and molecular genetics of poly-γ-glutamate synthesis [J]. Applied and Environmental Microbiology,2002,59:9-14.
[13]温丽娟,王桂华,侯喜林,等.共表达ETEC K99、K88菌毛蛋白重组干酪乳杆菌的构建[J].黑龙江八一农垦大学学报,2011,23(3):34-39.
Cloning and Expression of PEDV-S on Lactobacillus casei
Yue Lu1,Li Kunpeng1,Hou Xilin2,Yu Liyun1,2
(1.College of Life Science and Technology,Heilongjiang Bayi Agricultural University,Daqing 163319;2.College of Animal Science and Technology,Heilongjiang Bayi Agricultural University)
Porcine epidemic diarrhea(PEDV)can cause vomit,diarrhea and dehydration.The gene fragments encoding PEDV S1 protein was cloned into Lactobacillus casei surface expression vector pLA to express the protein,which laid the foundation for further study of characteristics and immunogenicity.By TRIzol method of extracting RNA from PEDV template,it got the virus by RT-PCR technique of S1 fragments,and then connected the gene to carry and express in the pLA.After expressing recombinant bacteria culture,the results showed that the molecular weight of about 81 kDa was detected.According to the result of Western-blot,the expressed protein possessed the antigenic specificity,which could be recognized by Rabbit anti-PgsA and Mouse anti-PEDV serum. The recombinant strains were successfully induced to express protein.
PEDV;lactobacillus casei;RT-PCR;western blot
S482
A
1002-2090(2016)02-0076-04
10.3969/j.issn.1002-2090.2016.02.015
2014-12-26
农垦总局攻关项目(HNK11A-08-03-03)。
岳璐(1988-),女,黑龙江八一农垦大学生命科学技术学院2012级硕士研究生。
余丽芸,女,教授,硕士研究生导师,E-mail:xly_hou@yahoo,com.cn。

