香樟幼苗对NaCl胁迫的生理响应
王金平,王舒甜,岳健敏,张金池,张亮,尤炎煌,赵文瑞
(南京林业大学,南方现代林业协同创新中心,江苏省水土保持与生态修复重点实验室,210037,南京)
香樟幼苗对NaCl胁迫的生理响应
王金平,王舒甜,岳健敏,张金池†,张亮,尤炎煌,赵文瑞
(南京林业大学,南方现代林业协同创新中心,江苏省水土保持与生态修复重点实验室,210037,南京)
为研究香樟(Cinnamomum camphora)的耐盐性,为南方沿海盐碱地的引种栽培提供参考。本文以实生香樟苗为材料,采用盆栽法,设置0(CK)、2‰、4‰、6‰、8‰5种盐处理,对不同NaCl盐处理下香樟生长指标,水分生理指标,叶片光合色素质量分数、光合作用参数、叶绿素荧光参数、抗氧化酶活性、渗透调节物质、膜稳定性等进行分析。结果表明:1)香樟苗高、基径相对生长量随着盐处理浓度的增加依次降低,且超过4‰的盐处理对其生长量的抑制作用显著(P<0.05)。2)随着盐处理浓度的增加,香樟叶片水分饱和亏损、丙二醛含量逐渐增加,膜稳定性指数、光合能力逐渐降低。3)2‰盐处理下香樟叶片相对含水率、光合色素质量分数、Fv/Fm、NPQ、抗氧化酶活性、脯氨酸含量、可溶性蛋白含量高于CK,而膜稳定性指数、Yield、ETR虽然有所下降但降幅较小。4)盐处理达4‰后,香樟叶片光合色素质量分数、净光合速率、光化学效率、水分利用效率、膜稳定性指数显著减小(P<0.05),丙二醛含量、脯氨酸含量显著上升(P<0.05),水分状况显著变差,与此同时抗氧化酶活性、可溶性糖含量,可溶性蛋白含量降低。综上所述,香樟的耐盐性处理在2‰~4‰,超过4‰的盐处理能显著抑制香樟的生长,2‰盐胁迫下,香樟可通过提高相对含水率、光合色素质量分数、NPQ的耗散,关闭部分气孔,提高抗氧化酶活性,增大脯氨酸、可溶性蛋白含量来应对盐胁迫。盐处理达4‰后,香樟抗氧化酶活性逐渐下降,酶系统损伤越来越严重;可溶性糖和可溶性蛋白含量所起的调节作用逐渐变小;脯氨酸含量大量增加,所起的渗透调节作用逐渐变大,但远不足以应对盐胁迫,因此叶片严重失水;膜脂过氧化,膜稳定性遭破坏,光合机构损伤严重,危及其生命。
盐胁迫;香樟;生长量;光合作用;渗透调节物质;抗氧化酶活性;耐盐性
香樟(Cinnamomum camphora)为高大常绿乔木,主根发达,树形巨大如伞,气势雄伟,枝叶茂密,有很强的吸烟滞尘、涵养水源、固土防沙、美化环境和吸收多种有毒气体的能力[1],是优良的绿化树、行道树及庭荫树,其材质上乘,是制造家具的好材料,体内有樟脑香气,可提制樟脑和提取樟油,是南方珍贵用材和特用经济树种。香樟喜光,喜温暖湿润气候,对土壤环境要求不高,较耐水湿,存活期长,抗海潮风;此外,香樟根系发达,能固土改土,防止水土流失,在南方沿海地区极具应用价值。沿海地区普遍存在着不同程度的土壤盐碱化,研究香樟的耐盐性可为其在南方沿海地区的引种栽培提供理论依据。国内外关于香樟的耐盐性研究较少,韩浩章等[1]、梅海军等[2]、赵清贺等[3]对香樟的耐盐性研究,在一定程度上揭示香樟的耐盐机理;但是他们的研究都是从香樟生理响应的某一部分进行研究,因此,有必要较全面系统的研究香樟盐胁迫下的生理响应,进一步揭示其耐盐机理。笔者主要从生长指标,水分生理指标,叶片光合色素含量、光合作用参数、叶绿素荧光参数、抗氧化酶活性、渗透调节物质、膜稳定性等指标来研究香樟耐盐性。
1 材料与方法
1.1 供试材料与处理
2014年11月3日从南京林业大学校园内收集香樟种子,种子先用自来水加少许洗衣粉漂洗,除去杂物与不饱满的种子,再用H2O2处理30 min,之后将瓶口包纱布,用自来水流动冲洗24 h倒掉;取出种子,用滤纸将其表面的水分吸干,置于45℃恒温培养箱中,培养24 h,取出后均匀置于沙床上,放入温度25℃,3000LX光照培养箱诱导发芽,待种子露白,将其播种于15 cm×20 cm的育苗袋,置于南京林业大学句容下蜀林场智能温室中。2015年5月2日,苗高超过30 cm,取大小、长势一致的苗木60株,将其取出定植于25 cm×25 cm的花盆中,苗木的培养基质为沙:蛭石=1:1(体积比),质量大致为3.5 kg,苗木生长期间保证水分供应,5—8月,每隔25天浇一次Hoagland's营养液,每次浇0.5 L。
本实验设置5个盐处理(累计NaCl质量与盆土总质量的比值):0(CK)、2‰、4‰、6‰、8‰。2015年8月2日开始浇盐溶液,盐溶液处理分别为0、2‰、4‰、6‰、8‰,每个盐处理浇12棵。每周浇一次,每次每盆0.5 L,共浇7次,此时各个盐处理下NaCl质量分别为盆土总质量的0、2‰、4‰、6‰、8‰。为防止盐分流失,处理时花盆下放置拖盘,渗出的溶液再倒回盘中。2015年10月8日开始进行各项指标的测定。
1.2 测定方法
1.2.1 形态指标 分别在8月1日和10月15日进行测定,采用卷尺测量苗高,分别记为M0、M1;基径采用电子游标卡尺测量,分别记为J0、J1。苗高相对生长量MR=(M1-M0)/M0,基径相对生长量JR=(J1-J0)/J0,比叶面积(SLA):每个处理取5片鲜叶分别测定叶鲜重和叶面积,比叶面积为叶面积与叶鲜重的比值。
1.2.2 光系统活性指标 光合参数采用用英国PP-system公司生产的CIRAS-2便携式全自动光合测定系统测定,叶绿素荧光参数采用用叶绿素荧光成像系统(CFI)测定,光合色素含量的测定采用乙醇-丙酮法[4]。
1.2.3 水分生理指标 水分饱和亏损(WSD)参照吕全等[5]的方法;叶片保水能力每个处理取成熟鲜叶各5片,放置于室内自然失水,每隔1.5 h称量,共测定24 h,计算每个时间点的累计失水率。
1.2.4 其他生理指标的测定 细胞膜稳定性指数(MSI)参照R.K.Sairam等[6]的方法,过氧化物酶(POD)、过氧化氢酶(CAT)活性、超氧化物歧化酶(SOD)、抗坏血过氧化物酶(APX)活性、可溶性蛋白(SP)含量以及脯氨酸的测定参照《植物生理学实验技术》[7],丙二醛(MDA)含量和可溶性糖(SS)含量的测定采用林艳等[8]的方法。
1.2.5 采用Excel 2003进行数据统计,SPSS19.0软件对试验数据进行One-way ANOVA分析,Duncan新复极差法进行不同处理间的多重比较,用Origin 8.5作图。
2 结果与分析
2.1 NaCl胁迫对香樟生长及水分生理指标的影响
由图1(A)可以看出,随着盐处理浓度的增加,MR和JR逐渐下降,说明盐胁迫抑制植物的生长;当盐处理浓度达4‰以后抑制作用显著(P<0.05),当盐处理浓度达8‰时,苗高相对生长量仅为3.32%。从图1(B)可得,随着盐处理浓度的增加,SLA逐渐增加,说明单位面积的叶鲜重逐渐下降。由图1(C)可知,MSI随着盐处理浓度的增加有逐渐降低的趋势,在盐处理浓度为6‰时,与对照相比下降显著(P<0.05),盐处理浓度为8‰时,极剧下降,2个处理浓度下分别下降9.57%和31.74%,表明8‰的盐处理,对细胞膜的损伤十分大。
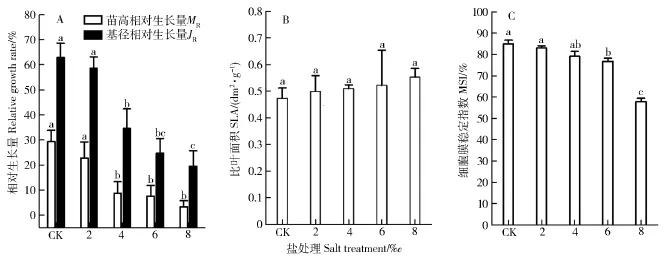
图1 NaCl胁迫对香樟形态指标和细胞膜稳定性指数的影响Fig.1 Effects of NaCl stress on the morphological indexes and MSI of Cinnamomum camphora seedlings
由图2(A)可以看出,与对照相比,WSD在盐处理浓度为2‰时,降低不显著,此后随着盐处理浓度的增加,WSD逐渐下降。叶片保水力反映了植物离体叶片的保水能力[9]。为减少叶片本身含水量差异的影响,以叶片各时间点失水量占总水量的比例来表示其保水能力[10]。由图2(B)可知,24 h内,2‰的盐处理下,香樟叶片失水最快,其他3个盐处理处理下的叶片保水力均比对照大,其中4‰的盐处理下,保水力最好,叶片最不容易失水。
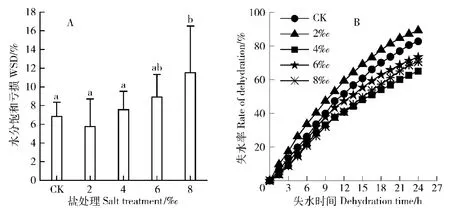
图2 NaCl胁迫对香樟水分生理指标的影响Fig.2 Effects of NaCl stress on themoisture physiological indexes of Cinnamomum camphora seedlings
2.2 NaCl胁迫对香樟叶片光合色素质量分数的影响
随着盐处理浓度的增加,Chla、Chlb、Chl、Car以及Chla/Chlb的变化趋势均是先增加后减少,而Car/Chl则是逐渐增加的趋势(表1)。当盐处理浓度为2‰时,除却Car/Chl外,其他指标与CK相比均有所增加,但增加不显著(P<0.05),此后随着盐处理浓度的增加逐渐减少,盐处理浓度为4‰时,与2‰的盐处理相比,显著降低(P<0.05),盐处理浓度4‰到6‰的变化不显著,当盐处理浓度达8‰时,变化显著(P<0.05),各指标值分别仅为CK的45.59%、55.66%、49.84%、63.07%和86.09%。表明盐胁迫改变香樟光合色素的组成与比例。
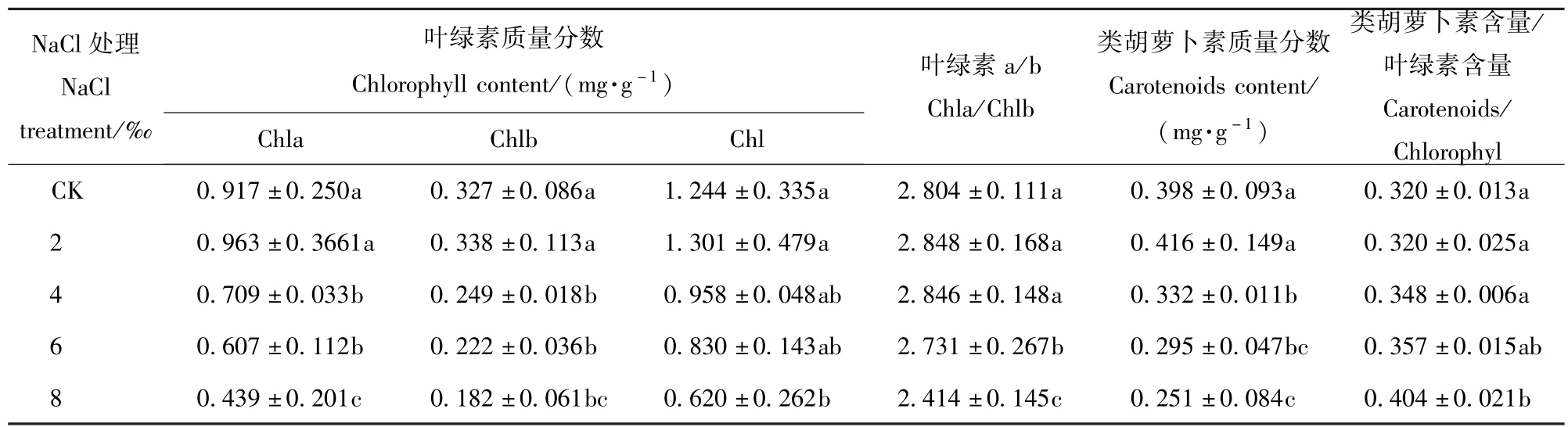
表1 NaCl胁迫对香樟叶片光合色素质量分数的影响Tab.1 Effects of5 different NaCl treatments on the photosynthetic pigment contents in Cinnamomum camphora seedling leaves(mean±SE)
2.3 NaCl胁迫对香樟光合作用参数的影响
由表2可知,随着盐处理浓度的增加,E、Gs、Pn和WUE均逐渐下降,与对照相比,各盐处理浓度下这4个参数均下降显著(P<0.05),2‰与4‰的盐处理间变化显著(P<0.05),4‰~8‰的盐处理间变化不显著(P>0.05),当盐处理浓度达8‰时,Gs降到2.08±1.66mol·m-2·s-1,而E、Pn和WUE,则几乎降为0。VPD则随盐处理浓度的上升而上升,4‰的盐处理下上升显著,4‰盐处理浓度以上,上升不显著。盐胁迫后Gs有所下降,但下降不显著,各盐处理浓度间则几乎没变化。
2.4 NaCl胁迫对香樟叶绿素荧光参数的影响
Fv′/Fm′、Yield、ETR随着盐处理浓度的上升而下降,与CK相比,Fv′/Fm′在8‰时显著下降(P<0.05),而Yield和ETR在盐处理浓度为6‰时显著下降(表3)。Fv/Fm在2‰的盐处理下高于CK,4‰、6‰、8‰的盐处理浓度下分别比对照下降9.66%、18.15%、25.44%。qP和NPQ均随着盐处理浓度的升高先上升后下降,qP在盐处理浓度为4‰时达到最大值,之后虽然随着盐处理浓度的增加而下降,但降幅很小,NPQ在盐处理浓度浓度为2‰时达到最大值,在盐处理浓度为8‰时下降显著(P<0.05)。
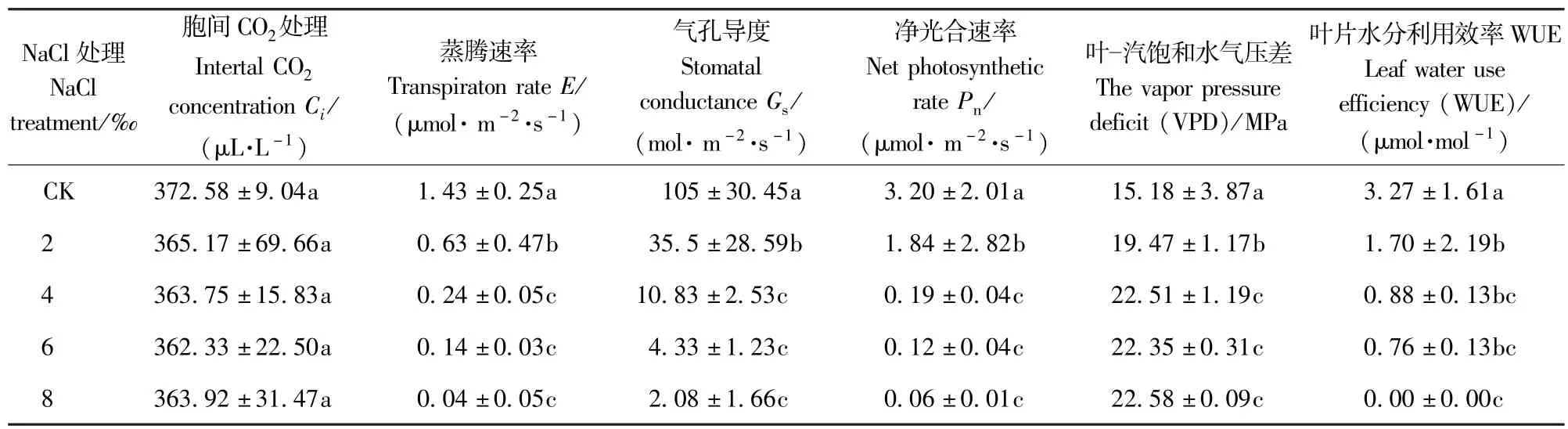
表2 NaCl胁迫对香樟光合作用参数的影响Tab.2 Effects of 5 different NaCl treatments on the photosynthetic parameters of Cinnamomum camphora seedling leaves(mean±SE)
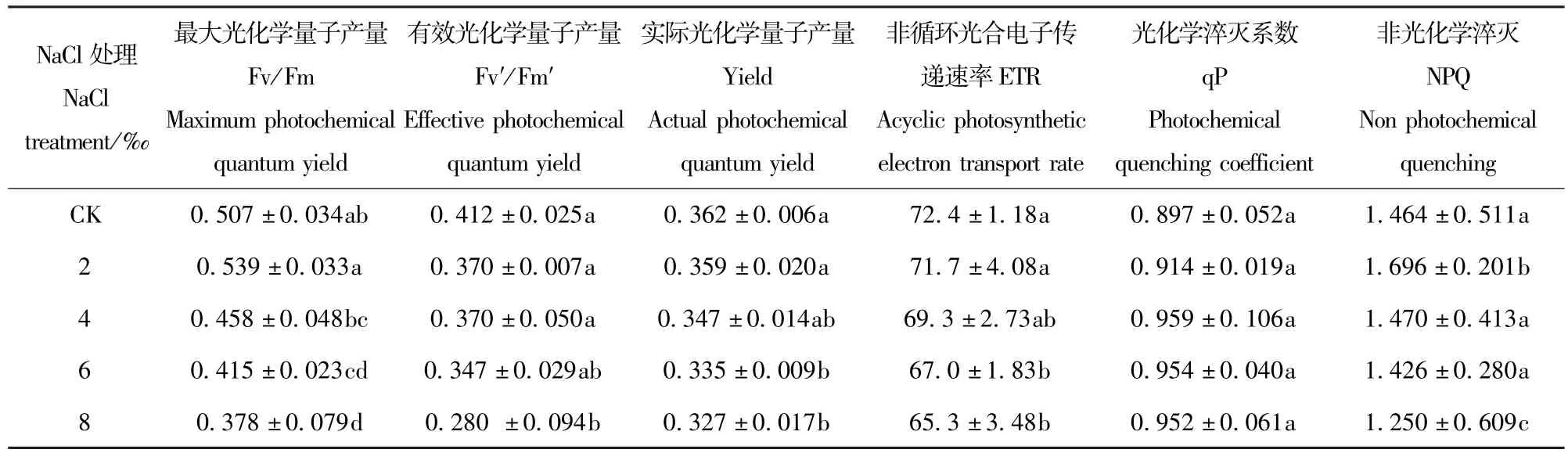
表3 NaCl胁迫对香樟叶绿素荧光参数的影响Tab.3 Effects of5 different NaCl treatments on the chlorophyll fluorescence characteristics of Cinnamomum camphora seedling leaves(mean±SE)
2.5 NaCl胁迫对香樟抗氧化酶系统和有机渗透调节物质的影响
由表4可以看出,随着盐处理浓度的增加4种抗氧化酶活性的变化趋势均是先增加后减少,所不同的是POD和SOD活性最大值出现在盐处理为4‰时,CAT活性和APX活性最大值则分别出现在6‰、2‰。当受到2‰的盐胁迫后CAT活性和APX活性显著高于对照(P<0.05),SOD活性则在盐处理浓度为4‰时显著高于对照(P<0.05)。
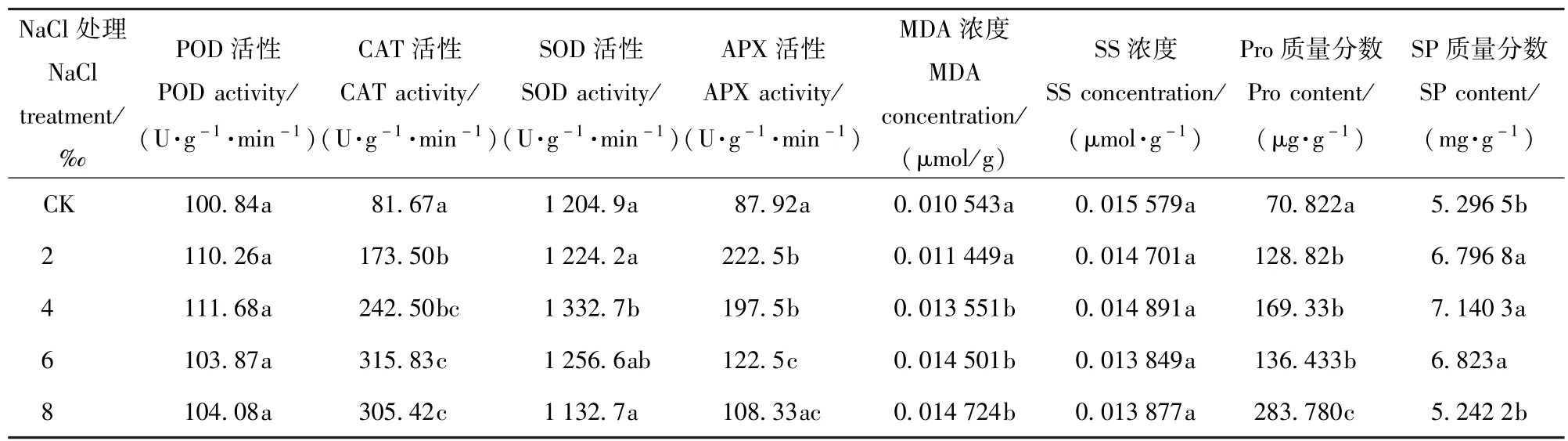
表4 NaCl胁迫对香樟抗氧化酶系统和有机渗透调节物质的影响Tab.4 Effects of5 different NaCl treatments on the antioxidase system and organic osmoregulation substance of Cinnamomum camphora seedlings
盐胁迫影响香樟MDA质量分数,随着盐处理浓度的增加MDA处理逐渐升高,盐处理浓度为4‰时开始显著高于CK。SS处理、和SP质量分数随着盐处理浓度的增加先增加后降低,且均在4‰时达到最大值。Pro质量分数在盐处理浓度为2‰时显著高于CK(P<0.05),当盐处理浓度达8‰时,显著高于6%盐处理下的Pro含量(P<0.05)。
3 讨论
盐胁迫能够严重影响植物的生长,笔者的研究结果表明香樟苗高、基径的相对生长量在盐处理浓度为4‰开始受到明显抑制作用显著,说明香樟具有一定的耐盐性,这与韩浩章等的研究结果[1]相同。研究证明,植物受盐胁迫越严重,其叶片吸水越困难,相对含水量也越低,本研究中盐处理浓度达4‰后香樟幼苗开始出现吸水困难。另外,随着盐处理浓度的增加,SLA逐渐增加的原因可能是叶片含水量的减少引起的,由于叶片含水量的减少,导致单位面积的叶鲜重减少,从而SLA增加。NaCl对幼苗又有双重作用:一方面它能破坏叶片构造,降低叶片维持水分平衡的能力;另一方面又能增加叶片的渗透势,增强其渗透吸水能力,减少自然失水量[11]。笔者研究表明盐胁迫破坏了香樟的膜稳定性,且在6‰的盐处理下受到严重破坏,而保水力则是4‰>8‰>6‰>CK>2‰,4‰处理下的香樟叶片保水力大于6‰和8‰的原因是,6‰和8‰盐处理下的MSI显著低于4‰,使得其维持水分平衡的能力显著低于4‰盐处理下,4‰的保水力大于CK和2‰则是由于一方面4‰处理下的MSI并未显著低于CK和2‰,另一方面4‰处理下香樟叶片中的离子处理更高,因为叶片的渗透势更大,所以失水速率更慢。
光合作用是植物遭受环境胁胁程度的重要反应指标[11]。叶片中光合色素含量、光合作用参数和叶绿素荧光参数是反映光合作用的重要指标,能较全面的反映光合机构活性的变化。本试验中,在2‰的盐处理下光合色素与对照相比均有所增加,这可能是香樟应对低盐胁迫生理代谢调节的结果,在4‰的盐处理下,光合色素质量分数均显著降低,这可能是由于较高浓度盐胁迫导致叶绿素与类囊体膜上的蛋白之间的结合变得松弛[12],叶绿素酶活性逐渐增强[13],类胡萝卜素质量分数的降低,减少了对活性氧的淬灭,导致细胞内积累较多的氧自由基,破坏叶绿体膜结构[14],从而加速叶绿素分解,Chla/ Chb显著降低也表明香樟叶片类囊体垛叠程度被明显削弱,光抑制较严重,抵抗氧化胁迫的能力显著变小[15]。这说明较高浓度盐胁迫破坏了叶绿体精细结构,严重伤害了光合色素蛋白复合体,抑制了捕光色素蛋白对光能的捕捉。植物遭受逆境胁迫时,光合速率降低的自身因素主要有气孔限制和非气孔限制,当Gs与Ci同时下降时说明Pn下降的主要因素是气孔限制[16]。梅海军等[2]从胁迫时间的角度来分析香樟随着盐胁迫下Pn下降的原因。本试验从胁迫浓度的角度研究,结果表明在2‰和4‰的盐处理下,Pn下降的原因主要是气孔限制,而当盐处理大于4‰时,Pn下降的因素主要是非气孔限制。另外,随着盐处理浓度的增加,植物吸收水分越来越困难,植物吸收的水分越来越不足以维持其蒸腾,再加上VPD变低,细胞水势下降,导致E、WUE越来越低,E的降低又进一步影响矿质元素和水的吸收,进而影响光合作用的进行,同时E的降低也会使光合产物输出变慢,产生反馈抑制,也会降低光合速率[17]。另外,通过结果可知2‰盐胁迫能促进香樟光系统PSⅡ的Fv/Fm、Fv′/Fm′、Yield、ETR,这可能是因为香樟可通过自身的调节,耗散掉过剩的光能,避免光合机构遭到破坏[18],而在较高浓度盐处理下香樟受到严重胁迫,光合系统功能严重下降,Fv′/Fm′、Yield、ETR显著低于对照。
植物在盐胁迫下会产生大量的氧自由基ROS,进而造成氧化胁迫,为了应对氧化胁迫,植物可通过提高体内抗氧化酶的活性来解除O2-及它的歧化产物H2O2等的毒害,POD、CAT、SOD、APX是其体内主要的抗氧化酶[19]。以往的研究表明POD、CAT、SOD是香樟盐胁迫下的3种保护酶[3],本试验结果显示0~6‰的盐处理范围内,4种酶的活性与对照相比均增加,这在一定程度缓解了氧化胁迫,表明这4种酶都是香樟主要的抗氧化酶,虽然0~6‰的盐处理浓度范围内4种酶活性有所增加,但MDA含量和膜脂氧化程度依然随着盐处理浓度增加而增加,且都在6‰时达到显著水平。说明抗氧化酶不足以完全清楚其体内的活性氧自由基,这可能是由于离子毒害引起的。
盐胁迫下植物另一个应对氧化胁迫的途径是调节体内环境,Pro、SS、SP是植物体内主要的有机渗透调节物质,其中SS还可为有机物的合成提供碳架和能量来源[20]。本试验中2‰盐处理下的SS低于CK可能是由于光合速率的显著下降减少了SS的合成和运输,4‰盐处理下的SS含量比2‰稍微增加,有利于维持细胞膜碳架和原生质胶体的稳定性。当盐处理浓度继续提高时,由于光合速率的继续下降,加上香樟较高浓度盐胁迫下进行渗透调节及渗透势的维持需要耗费大量的能量[21],因此SS含量逐渐下降。SP含量在一定的盐处理浓度范围内高于CK,这可能是盐胁迫刺激了香樟SP的合成以抵抗渗透胁迫,或膜蛋白随着膜脂的过氧化转变成SP,当盐处理浓度为8‰时,SP含量明显降低,这可能是高盐抑制了SP的合成。结果显示香樟叶片中Pro的合成对盐胁迫的反应非常敏感,2‰的盐处理浓度下Pro含量显著高于对照,这说明合成Pro是香樟应对盐胁迫的一种重要的调节方式,通多大量合成Pro来降低细胞渗透势,试验中8‰处理浓度下的Pro含量显著高于6‰,可能是由于8‰盐处理下SP大量分解引起的[22]。
4 结论
1)香樟的耐盐性在2‰到4‰,超过4‰的盐处理浓度能显著抑制香樟的生长。
2)2‰盐胁迫下,香樟可通过提高RWC、光合色素质量分数、NPQ的耗散,关闭部分气孔,提高抗氧化酶活性,增大Pro、SP含量来应对盐胁迫。
3)较高浓度盐胁迫下香樟抗氧化酶活性逐渐下降,酶系统损伤越来越严重;SS和SP所起的调节作用逐渐变小;Pro大量增加,所起的渗透调节作用逐渐变大,但远不足以应对盐胁迫,因此叶片严重失水;膜脂过氧化,膜稳定性遭破坏,光合机构损伤严重,危及其生命。
[1] 韩浩章,王晓立,章颖,等.盐胁迫对秋季香樟幼苗抗氧化酶系统和光合特性的影响[J].浙江农业学报,2014,26(5):1235. Han Haozhang,Wang Xiaoli,Zhang Ying,et al.The effect of salt stress on the antioxidant enzyme system and photosynthetic characteristics of the autumn camphor seedlings[J].Acta Agriculturae Zhejiangensis,2014,26(5):1235.(in Chinesse)
[2] 梅海军,王宁,李自阳,苏金乐.NaCl和Na2SO4胁迫对香樟幼苗生理特性的影响[J].西北林学院学报,2011,26(6):30. Mei Haijun,Wang Ning,Li Ziyang,et al.Effects of NaCl and Na2SO4stress on leaf photosynthetic parameters of Cinnamomum camphora seedling[J].Journal of Northwest Forestry University,2011,26(6):30.(in Chinesse)
[3] 赵清贺.香樟抗寒抗盐性生理特征的研究[D].郑州:河南农业大学,2009:1. Zhao Qinghe.Studies on physiological characteristics of Cinnamomum camphora under chilling stress and salt stress[D].Zhengzhou:Henan Agricultural University,2009:1.(in Chinesse)
[4] 高俊凤,孙群.植物生理学实验指导[M].西安:陕西科学技术出版社,1986:74. Gao Junfeng,Sun Qun.Plant physiology experiment instruction[M].Xi′an:Shaanxi Science and Technology Company,1986:74.(in Chinesse)
[5] 吕全,雷普普.外生菌根提高板栗苗木抗旱性能及其机理的研究[J].林业科学研究,2000,13(3):249. Lyu Quan,Lei Pupu.A study on effect of ectomycorrhiza on Promoting Castaneamollissima resistance to drought and its mechanism[J].Research of the Forestry Science,2000,13(3):249.(in Chinesse)
[6] Sairam R K,Siukla D S,Saxena D C.Stress induced injury and antioxidantenzymes in relation to drought tolerance in wheat genotypes[J].Biologia Plantarum,1997/1998,40:357.
[7] 张治中,陈展宇.植物生理学实验技术[M].长春:吉林大学出版社,2008:110. Zhang Zhizhong,Chen Zhanyu.Plant physiology experiment technology[M].Changchun:Jilin University Press,2008:110.(in Chinesse)
[8] 林艳,郭伟珍,徐振华,等.大叶女贞抗寒性及冬季叶片丙二醛和可溶性糖含量的变化[J].中国农学通报,2012,28(25):68. Lin Yan,Guo Weizhen,Xu Zhenhua,et al.Cold resistance and changes on MDA and soluble sugar of leaves of Ligustrunlucidum ait in winter[J].Chinese Agricultural Science Bulletin,2012,28(25):68.(in Chinesse)
[9] 肖春旺,董鸣,周广胜,等.鄂尔多斯高原沙柳幼苗对模拟降雨量变化的响应[J].生态学报,2001,21(1):171. Xiao Chunwang,Dong Ming,Zhou Guangsheng,et al.Response of Salix Psammophila seedlings to the simulated precipitation change in Ordas plateau[J].Acta Ecologica Sinica,2001,21(1):171.(in Chinesse)
[10]尤禄祥,摇瑞玲,方升佐,等.盐胁迫下青钱柳叶片发育特征和保水能力的变化[J].南京林业大学学报(自然科学版),2009,33(6):155. You Luxiang,Yao Ruifang,Fang Shengzuo,et al.Variation in leaf development characteristics and leaf water holding ability of young Cylocarya paliures seedlings under NaCl stress[J].Journal of Nanjing Forestry University(Natural Science Edition),2009,33(6):155.(in Chinesse)
[11]高飞,贾志宽,路文涛,等.秸秆不同还田量对宁南旱区土壤水分、玉米生长及光合特性的影响[J].生态学报,2011,31(3):777. Gao Fei,Jia Zhikuang,Lu Wentao,et al.Effect of different straw returning treatment on soil water,maize growth and photosynthetic characteristics in the semi-arid area of Southern Ningxia[J].Acta Ecologica Sinica,2011,31(3):777.(in Chinesse)
[12]董晓霞,赵树慧,孔令安,等.苇状羊茅盐胁迫下生理效应的研究[J].草业科学,1985,(5):9. Dong Xiaoxia,Zhao Shuhui,Kong Lingan,et al.Physiological responses of tall Fescue to salt stress[J].Pratacultural Science,1985,(5):9.(in Chinesse)
[13]殷立娟,石德成,王萍,等.盐碱化草地羊草生长的适应性与耐盐渗透调节[J].植物学报,1993,35(8):619. Yin Lijuan,ShiDecheng,Wang Ping,etal.Growth adaptability and salt tolerance osmoregulation of Aneurolepidium chinense grown on saline grassland[J].Acta Botanica Sinica,1993,35(8):619.(in Chinesse)
[14]Sakaki T,Kondo N,Sugahara.Breakdown of photosynthetic pigments and lipids in spinach leaveswith ozone fumigation:Role ofactive oxygens[J].Physiologia Plantarum,1983,59(1):28.
[15]McCord JM,Fridovich I.Superoxide dismutase:An enzymic funnction for erythrocuprein(hemocuprein)[J]. Journal of Biological Chemistry,1969,244(22):6049.
[16]Farquhar G D,Sharkey T D.Stomatal conductance and photosynthesis[J].Annual Review of Plant Physiology,1982,33(1):317.
[17]Lyu Jinhui,Wang Xuan,Feng Yaomeng,et al.Effects of shading on the photosynthetic characteristics and anatomical structure of Trolliu schinensis Bunge[J].Acta Ecologica Sinica,2012,32(19):6033.
[18]陈建明,俞晓平,程家安.叶绿素荧光动力学及其在植物抗逆生理研究中的应用[J].浙江农业学报,2006,18(1):51. Chen Jianming,Yu Xiaoping,Chen Jia'an.The application of Chlorophyll fluorescence kinetics in the study of physiological responses of plants to environmental stresses[J].Acta Agriculturae Zhejiangensis,2006,18(1):51.(in Chinesse)
[19]孟凡娟,王秋玉,王建中,等.四倍体刺槐的抗盐性[J].植物生态学报,2008,32(3):654. Meng Fanjuan,Wang Qiuyu,Wang Jianzhong,et al.Salt resistance of tetraploid Robinia pseudoacaca[J].Journal of Plant Ecology,2008,32(3):654.(in Chinesse)
[20]张海燕,赵可夫.盐分和水分胁迫对盐地碱蓬幼苗渗透调节效应的研究[J].植物学报,1998,40(1):56. Zhang Haiyan,Zhao Kefu.Effects of salt and water stresses on osmotic adjustment of Suaeda salsa seedlings[J]. Acta Botanica Sinica,1998,40(1):56.(in Chinesse)
[21]徐云岭,余叔文.植物适应盐逆境过程中的能量消耗[J].植物生理学通讯,1990(6):70. Xu Yunling,Yu Shuwen.The energy consumption in the process of plantadapted to salt stress[J].Plant Physiology Communications,1990(6):70.(in Chinesse)
[22]汪贵斌,曹福亮.盐胁迫对落羽杉生理及生长的影响[J].南京林业大学学报(自然科学版),2003(3):11. Wang Guibing,Cao Fuliang.Effect of salinity on growth and physiology of bald cypress seedlings[J].Journal of Nanjing Forestry University(Natural Science Edition),2003(3):11.(in Chinesse)
Physiological response of Cinnamomum camphora seedlings to NaCl stress
Wang Jinping,Wang Shutian,Yue Jianmin,Zhang Jinchi,Zhang Liang,You Yanhuang,Zhao Wenrui
(Key Laboratory of Soil and Water Conservation and Ecological Restoration in Jiangsu Province,Collaborative Innovation Center of Sustainable Forestry in Southern China,Nanjing Forestry University,210037,Nanjing,China)
[Background]Cinnamomum camphora is a precious economic tree species,it has important application value in the southern coastal areas of soil and water conservation.There are varied degrees of salinity in the southern coastal regions,the research on C.camphora's salt tolerance had been little reported,nor systematically.The purpose of this work is to study the salt tolerance of C.camphora,and to provide the reference for the cultivation in saline alkali soil in southern coastal regions.[Methods]We chose C.camphora seedlings as test materials and used potted method,the seedlings were treated with NaCl treatment at 2‰,4‰,6‰and 8‰,and fresh water as the control(CK).With different NaCl salt treatment,the C.camphora growth indexes,moisture physiological indexes,photosynthetic pigmentcontent,antioxidant enzymes activity,osmotic regulation substances and membrane stability of leaves weremeasured;the photosynthesis parameters and chlorophyll fluorescence parameters were measured by CIRAS-2 and CFI,respectively.[Results]1)With the increasing of salt concentration,C.camphora seedling height and relative growth rate of base diameter decreased,and more than 4‰of the salt treatment had significant inhibitory effect on the growth(P<0.05).2)With the increasing of salt treatment concentration,the water saturation deficit(WSD)and malondiadehyde(MDA)content of seedling leaf rose gradually,while the membrane stability index(MSI)and photosynthetic capacity decreased gradually.3)The leaf relative water content(RWC),the photosynthetic pigment content,Fv/Fm,NPQ,antioxidant enzyme activity,proline(Pro)content,and soluble protein(SP)content of seedling leaves at the salt concentration of 2‰were higher than CK,while the MSI,Yield,and ETR reduced in a little magnitude.4)The photosynthetic pigment content,net photosynthetic rate,photochemical efficiency,WUE,and MSI reduced significantly when the salt concentration was 4‰(P<0.05),while MDA content,and Pro content increased significantly(P<0.05),moisture conditions became worse;at the same time,the antioxidant enzyme activity,soluble sugar(SS)content,and SP content decreased.[Conclusions]The salt tolerance of camphor seedlings is 2‰to 4‰,and when the salt concentration over 4‰,the growth of seedlings could be inhibited significantly.C. camphora seedlings could endure low salt stress(2‰)via increasing RWC,photosynthetic pigment content,the dissipation of NPQ,the activity of antioxidant enzymes,the content of Pro and SP,and shutting down part of the stomas.But when the salt concentration reached 4‰,with the increase of salt concentration,the antioxidant enzyme activity of seedling leaves gradually declined,the damage of enzyme system was more and more serious;the regulating effect of SS and SP became smaller;Pro was producing massively,and the regulating effect of osmotic regulation increased gradually,but far enough to resist the salt stress.Thus,the water in leaves lost severely,membrane lipid peroxided,membrane stability deteriorated,photosynthetic agencies seriously damaged,which resulted in their lives in danger.
salt stress;Cinnamomum camphora;growth;photosynthesis;osmoregulation substance;antioxidant enzyme activity;salt tolerance
S718;Q945
A
1672-3007(2016)05-0082-08
10.16843/j.sswc.2016.05.011
2016- 03- 06
2016- 05- 31
项目名称:江苏省科技项目“耐盐树种新品种选育及栽培技术研究与示范”(BE2012344);江苏省林业三新工程项目“沿海耐盐生态经济树种种质资源的创新与应用”(LYSX[2014]05);江苏高校优势学科建设工程项目(PAPD)
王金平(1990—),男,博士研究生生。主要研究方向:林业生态工程。E-mail:943517134@qq.com
†通信作者简介:张金池(1962—),男,教授,博士生导师。主要研究方向:水土保持和林业生态工程。E-mail:zhang8811@ njfu.edu.cn

