阿特拉津胁迫对菖蒲的生理毒性效应
李翠,温海峰,郑瑞伦,陈洁,马雪菊,王庆海
(北京市农林科学院北京草业与环境研究发展中心,北京100097)
阿特拉津胁迫对菖蒲的生理毒性效应
李翠,温海峰,郑瑞伦,陈洁,马雪菊,王庆海*
(北京市农林科学院北京草业与环境研究发展中心,北京100097)
为明确阿特拉津对菖蒲的毒性效应,本文通过水培实验研究了阿特拉津浓度和培养时间在抑菌和不抑菌条件下对菖蒲叶绿素含量、叶绿素a/b值、丙二醛含量(MDA)、抗氧化酶(SOD和POD)活性和最大光能转化效率的影响。结果表明:不抑菌条件下,叶绿素a和叶绿素总量随处理浓度的增加和培养时间的延长逐渐降低,叶绿素a/b值无显著变化;MDA含量随着培养时间延长呈现先升高后降低的趋势,至培养第5周,≤2 mg·L-1处理的MDA含量恢复至对照水平;SOD和POD活性随培养时间延长和处理浓度增加均无显著变化;最大光能转化效率(Fv/Fm)随处理浓度的增加而降低,0.5 mg·L-1处理与对照无显著差异,≥1 mg·L-1处理培养1~4周显著低于对照,第5周时恢复至对照水平。抑菌条件下,培养第1周叶绿素含量和Fv/Fm均显著低于不抑菌处理,培养4~5周时,≥1 mg·L-1处理Fv/Fm亦显著低于不抑菌处理;整个试验期间≥2 mg·L-1处理Fv/Fm均显著低于对照水平。可见,菖蒲对阿特拉津胁迫具有较好的耐受能力,水培系统中的微生物可在一定程度上减轻阿特拉津胁迫对菖蒲的毒性效应。
阿特拉津;菖蒲;生理特性;水污染;抑菌条件;耐受性
阿特拉津是一种光合抑制型广谱除草剂,自1959年投入商业生产以来,被广泛应用于玉米、高粱、甘蔗等农田以及果园、茶园中一年生禾本科杂草以及阔叶杂草的防除。该除草剂低廉的价格以及对防除杂草的有效性使得其在全世界范围内广泛使用[1]。阿特拉津结构稳定,水溶性强,难以降解,在水中的半衰期为15~20 d,在土壤中的半衰期可以达到330~385 d[2]。农田土壤中的阿特拉津残留量可达到86.9 μg·kg-1[3],农田土壤中的阿特拉津随径流或者深层渗漏进入水体。因此,在我国部分地区的地表水和地下水中都检测到了痕量阿特拉津的存在[4-5]。任晋等[6]对张家口地区的洋河水系及地下水进行了调查,测得官厅水库阿特拉津浓度在0.67~3.9 μg·L-1,并且地下水中阿特拉津的代谢物高达7.2 μg·L-1。
水体中阿特拉津及其降解产物的残留会导致水生生物群落的种类发生变化,物种数量减少[7]。水生植物对阿特拉津具有较高的敏感性,低浓度的阿特拉津即可对水生植物造成严重的毒性效应[8]。阿特拉津抑制水生植物的光合作用,并且不同植物对阿特拉津的敏感性差异比较大。沉水植物狐尾藻暴露在含有1 mg·L-1阿特拉津的底泥中时,60%的生长被抑制[9];当阿特拉津浓度达到20 mg·L-1时,狐尾藻便出现叶子卷曲变短等生长异常[10]。Mayasich等[11]研究表明0.05 mg·L-1的阿特拉津不影响三角褐指藻的生长,而该浓度处理下微绿球藻的生长率则降低了35%。
微生物可以改善阿特拉津胁迫下植物的生长环境并促进植物生长。一方面,微生物可以降解环境中的阿特拉津,外源微生物的添加对低浓度阿特拉津的降解可以达到99.91%[12],天然水体中的微生物对阿特拉津降解的贡献率可以达到17.4%[13];另一方面,微生物附着在植物根际,与植物相互作用,提高植物在不良环境下的抵御能力,促进植物生长[14]。Glick等[15]研究表明,在严重污染的环境下微生物可以增加种子萌发和幼苗存活率。
水生植物在维持水生态系统的结构和功能以及生物多样性方面具有重要作用[16]。菖蒲(Acorus calamus L.)是天南星科多年生挺水草本植物,常见于浅水池塘、水沟和湿地,被广泛应用于污染水体的修复[17]。本实验以菖蒲作为主要材料,研究了抑菌和不抑菌条件下阿特拉津浓度和培养时间对菖蒲叶绿素含量、抗氧化酶活性、最大光能转化效率等生理指标的影响,明确菖蒲对阿特拉津的生理响应,旨在为研究阿特拉津水体污染的植物修复技术提供依据。
1 材料与方法
1.1 实验材料
实验所用植物材料菖蒲为北京市农林科学院温室苗盘培育。挑选长势一致的幼苗进行移栽(单株平均鲜重25.0±2.8 g),移栽前清洗幼苗根部泥土,置于10%Hoagland营养液中培养1周进行缓苗,将预培养后的幼苗移入塑料培养桶(直径30 cm,高26 cm)中用于实验。塑料桶外用锡箔纸包裹遮光,每个培养桶中放入3株幼苗,并添加1 L 10%Hoagland营养液。实验所用阿特拉津为38%阿特拉津悬浮剂(山东滨农科技有限公司生产)。
1.2 实验设计
本实验设定阿特拉津浓度和抑菌两个因素。阿特拉津浓度设4个水平,分别为0.5、1、2、4 mg·L-1。抑菌因素设2个水平,添加氨苄青霉素(10 mg·L-1)作为抑菌处理[12],不添加氨苄青霉素作为不抑菌处理。每个处理设置3个重复,每个重复含有3株幼苗,共计150个样本,450株幼苗。所有处理均置于日光温室培养,共培养5周。
阿特拉津在环境水体中的最高浓度为200 μg· L-1[18],为保证阿特拉津对菖蒲保持高浓度的逆境胁迫,快速得到阿特拉津对菖蒲生理毒性效应的相关数据,按最高浓度的2.5倍设置本试验的最低处理浓度为0.5 mg·L-1,按倍数法设置浓度梯度依次为1、2、4 mg· L-1,空白对照不添加阿特拉津。为保持水体中阿特拉津浓度的相对稳定,在每个培养桶上标记水位线,每日添加营养液至水位线。每周更换含有相应阿特拉津浓度的培养液,使得整个实验周期阿特拉津对菖蒲的胁迫浓度保持相对稳定。
1.3 取样和生理指标的测定
分别于培养1、2、3、4、5周时进行取样,每次取30个样本(抑菌处理15个样本,不抑菌处理15个样本),原位测定叶绿素荧光后,将幼苗从培养液中取出,用自来水冲洗后带回实验室进行生理指标的测定。叶绿素的测定采用乙醇∶丙酮(1∶1)浸泡过夜法[19];丙二醛(MDA)采用硫代巴比妥酸法[20];超氧化物歧化酶(SOD)采用氮蓝四唑法[20];过氧化物酶(POD)采用愈创木酚法[21]。叶绿素荧光采用IMAGING-PAM(Walz,德国)测定,测定前先将叶片暗适应20 min,照射检测光后测得初始荧光F0,照射饱和激发光后测得Fm和Fv/Fm,每个处理测定9个点。
1.4 数据分析
采用软件SPSS20.0对所得数据进行统计分析,差异显著性采用LSD法,显著性水平为0.05。采用Origin9.0作图。
2 结果与分析
2.1 阿特拉津胁迫对菖蒲叶绿素及光合效率的影响
阿特拉津胁迫对叶绿素a和叶绿素总量均有显著影响(图1、图2)。叶绿素a和叶绿素总量均随阿特拉津浓度的增加而降低。不抑菌条件下,培养第1周,叶绿素a含量仅在最高浓度处理组(4 mg·L-1)与对照差异显著,与对照相比减少了24.5%;而培养2、4和5周时,0.5 mg·L-1的低浓度处理就使叶绿素a含量显著下降,在培养第5周,最高浓度处理组(4 mg·L-1)的叶绿素a含量与对照相比减少了39.2%。这表明,随着处理时间的增加,阿特拉津胁迫对叶绿素a的破坏程度增大。阿特拉津胁迫对叶绿素总量的影响趋势与对叶绿素a的影响趋势一致,叶绿素总量随处理浓度的增加而降低(图2)。培养第1周,低于2 mg·L-1处理,叶绿素总量变化不大,而4 mg·L-1处理,叶绿素总量显著降低32.3%(图2A)。随着处理时间的延长,阿特拉津对叶绿素总量的影响增强,培养2周和4周时,0.5 mg·L-1处理即与对照差异显著,并且培养第5周,最大处理浓度组(4 mg·L-1)的叶绿素总量与对照相比降低了60.0%。
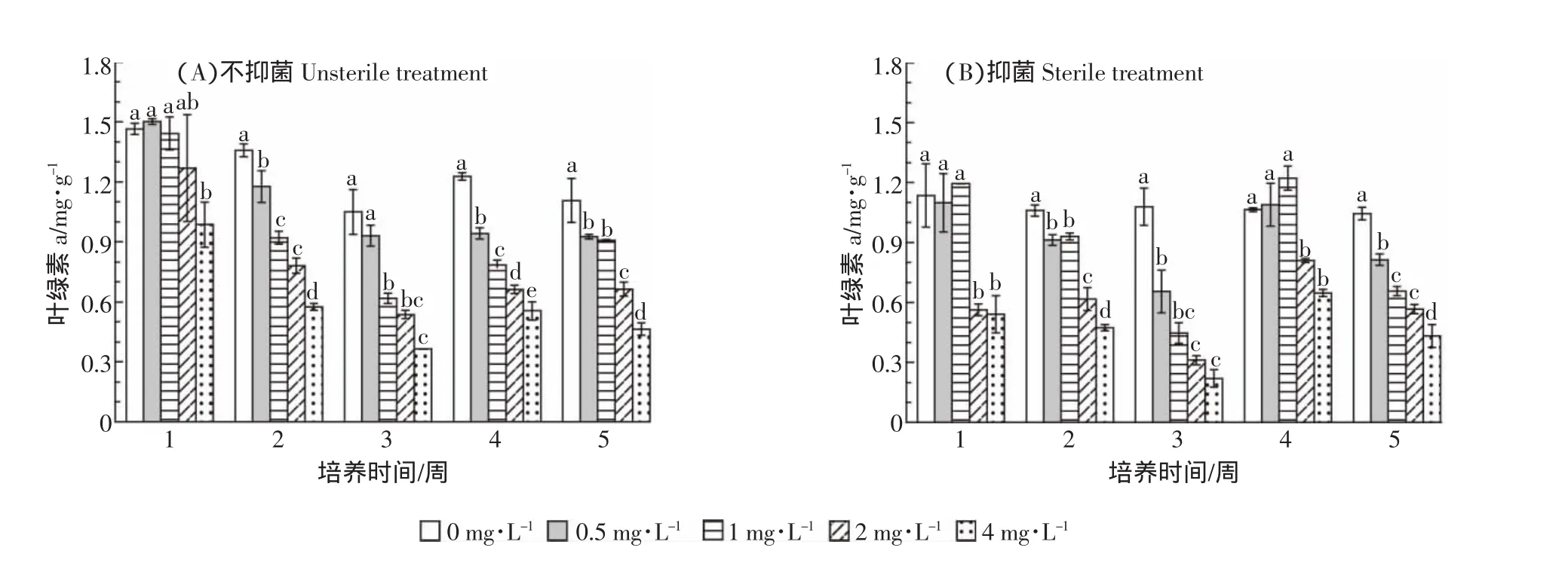
图1 阿特拉津对菖蒲叶绿素a含量的影响Figure 1 Effect of atrazine on chlorophyll a content of A.calamus L.

图2 阿特拉津对菖蒲总叶绿素含量的影响Figure 2 Effect of atrazine on total chlorophyll content of A.calamus L.
抑菌条件下叶绿素a和叶绿素总量的变化趋势与不抑菌条件下大体一致。不同的是在培养第1周,2 mg·L-1的处理组中叶绿素a的含量以及叶绿素总
量即与对照差异显著,并且在最大浓度处理(4mg·L-1),叶绿素a含量和叶绿素总量与对照相比分别减少了56.7%和42.5%。培养第1周,不抑菌条件下各处理浓度叶绿素a和叶绿素总量均显著低于抑菌条件下的叶绿素含量。这表明,抑菌条件造成培养第1周阿特拉津对叶绿素的破坏程度增大。
阿特拉津对叶绿素a/b的影响见图3。不抑菌条件下,随着阿特拉津浓度的升高以及培养时间的延长,叶绿素a/b的含量与对照相比均无显著变化。抑菌条件下,培养1~3周,随处理浓度的增加,叶绿素a/ b的含量逐渐降低,并且在2 mg·L-1和4 mg·L-1的处理下显著低于对照。培养5周各浓度处理叶绿素a/b值均恢复至对照水平。培养2~3周,4 mg·L-1处理组抑菌条件下的叶绿素a/b含量显著低于不抑菌条件下叶绿素a/b含量。
阿特拉津对菖蒲最大光能转化效率(Fv/Fm)的影响见图4。不抑菌条件下,Fv/Fm随处理浓度的增加逐渐降低,培养1~3周,1 mg·L-1处理,Fv/Fm与对照相比显著降低,培养4周Fv/Fm仅在最大浓度处理(4 mg·L-1)与对照相比有显著降低,培养5周各浓度处理组的Fv/Fm均恢复至对照水平。培养1~5周,最大浓度处理组(4 mg·L-1)的Fv/Fm与对照相比分别降低了28.1%、30.2%、16.1%、21.2%和0.0%。抑菌条件下,最大浓度处理组(4 mg·L-1)的Fv/Fm与对照相比分别降低了54.6%、28.2%、20.4%、27.5%和8.9%。整个培养期间,≥2 mg·L-1处理均与对照差异显著。培养第1周,不抑菌条件下各浓度处理组的Fv/Fm均显著高于抑菌条件下。培养4~5周,不抑菌条件下≥1 mg·L-1处理Fv/Fm均显著大于抑菌条件下。
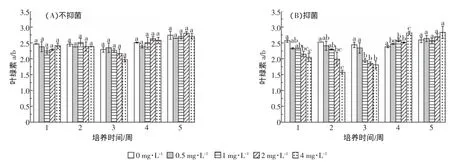
图3 阿特拉津对菖蒲叶绿素a/b的影响Figure 3 Effect of atrazine on chlorophyll a/b ratios of A.calamus L.

图4 阿特拉津对菖蒲最大光能转化效率的影响Figure 4 Effect of atrazine on maximal photochemical efficiency(Fv/Fm)of A.calamus L.
2.2 阿特拉津胁迫对菖蒲MDA含量的影响
不抑菌条件下,培养第1周,各浓度处理MDA含量均与对照无显著差异(图5)。随着处理时间的延长,MDA含量先增加后降低,培养2~3周,最大浓度处理组(4 mg·L-1)的MDA含量显著高于对照,培养4
周,1 mg·L-1和2 mg·L-1浓度处理组的MDA含量与对照差异显著,培养5周仅最大浓度处理(4 mg·L-1)与对照差异显著,≤2 mg·L-1处理均恢复至对照水平。抑菌条件下,培养1~3周,各浓度处理下的MDA含量与对照相比均无显著变化。培养5周,各浓度处理均与对照相比显著增加。

图6 阿特拉津对菖蒲SOD活性的影响Figure 6 Effect of atrazine on SOD activity of A.calamus L.
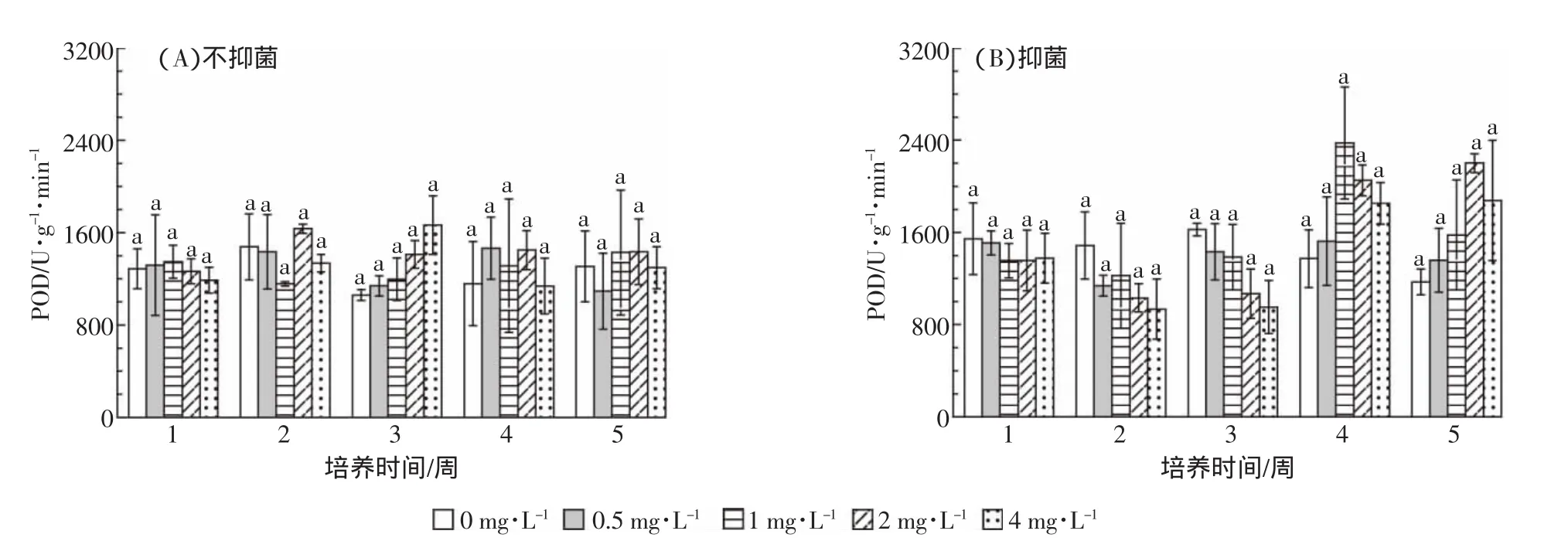
图7 阿特拉津对菖蒲POD活性的影响Figure 7 Effect of atrazine on POD activity of A.calamus L.
2.3 阿特拉津胁迫对菖蒲抗氧化酶活性的影响
如图6和图7所示,不抑菌条件下,SOD的活性仅在培养至2周时,1 mg·L-1和2 mg·L-1浓度处理与对照有显著差异,除此之外,随处理浓度的增加和培
养时间的延长,SOD活性与对照相比均无显著差异。抑菌条件下,SOD变化趋势与不抑菌条件下大体一致。在抑菌处理下,SOD的活性仅在培养2周时0.5 mg·L-1处理与对照差异显著,随着处理浓度的升高和培养时间的延长,SOD的活性并无显著变化。POD的活性在抑菌和不抑菌条件下各浓度处理与对照相比均无显著变化。随培养时间的延长,POD活性均无显著变化。在相同浓度阿特拉津处理下,抑菌和不抑菌条件下菖蒲叶片SOD活性和POD活性均无显著差异。
3 讨论
植物对阿特拉津的生理响应能反映植物对阿特拉津胁迫的耐受性[22]。在本实验中,我们对抑菌和不抑菌条件下不同浓度阿特拉津胁迫以及不同培养时间下,菖蒲叶片的叶绿素含量、最大光能转化效率(Fv/Fm)、丙二醛(MDA)含量以及抗氧化酶活性(SOD、POD)进行了测定,用以评价阿特拉津胁迫对菖蒲的毒性效应。
本实验中叶绿素a和叶绿素总量均随处理浓度的增加而降低,并且随着培养时间的延长,叶绿素a和叶绿素总量均有一定程度的降低,说明阿特拉津胁迫对菖蒲叶绿素造成了一定的破坏。这与前人的研究结果是一致的。王庆海等[23]研究表明,16 mg·L-1阿特拉津浓度处理挺水植物千屈菜的叶绿素含量降低了29%。Torres等[24]发现浮游植物绿藻在1 μg·L-1的阿特拉津浓度培养7 d后,叶绿素含量降低41%~67%。这主要是因为叶绿体是植物进行光合作用的器官,阿特拉津对植物的毒性效应主要是影响植物的光合作用[25]。
叶绿素荧光是反映逆境胁迫下光合作用效率的有效指标。其中,Fv/Fm反映逆境胁迫下植物的最大光能转化效率[26]。在本实验中,不抑菌条件下,最大光能转化效率Fv/Fm随处理浓度的增加而降低,整个培养周期,0.5 mg·L-1处理Fv/Fm与对照相比无显著变化,说明低浓度阿特拉津不影响菖蒲Fv/Fm。培养1~3周,≥1 mg·L-1处理与对照差异显著,但是随着处理时间的延长,阿特拉津对Fv/Fm的影响逐渐减弱,各浓度处理Fv/Fm均在培养5周时恢复至对照水平,说明菖蒲对阿特拉津胁迫具有较高的耐受性。Stefanie等[27]对沉水植物光合效率的研究中表明,伊乐藻和狐尾藻的光合效率在阿特拉津以及异丙隆等除草剂胁迫下培养5 d时有显著降低,至12 d时即恢复至对照水平,说明两种沉水植物对阿特拉津具有高的适应能力。这与本研究结果是一致的。Fv/Fm值是检测逆境胁迫的有效指标,在敏感植物中迅速降低,在抗性植物中通过调节其他生理指标来适应抗性机制,从而维持正常的光合作用,因此会出现光能转化效率先降低后恢复的现象[28]。在本实验中,菖蒲叶绿素a/b值在不同浓度处理均无显著变化或有一定程度降低,Burke等[29]研究表明,阿特拉津抗性植物倾向于降低叶绿素a/b值以提高光合效率。综上可知,虽然阿特拉津的毒性效应使得菖蒲叶绿素含量有所降低,但是通过调整菖蒲最大光能转化效率和叶绿素a/b值,光合作用并未受到抑制,满足了菖蒲的生长需要。因此,在本试验结束时,各浓度阿特拉津处理下的植株均能正常生长,未发现枯黄现象。
MDA是膜质过氧化的最终产物,对植物细胞有毒害作用,其含量的高低反映了植物细胞膜受伤害的程度,即MDA含量越高,其产生的活性氧自由基越多,膜质过氧化反应越大,对细胞膜的伤害越大[30]。植物体内的抗氧化酶可以消除自由基等对植物细胞的伤害,维持植物在逆境条件下的正常生长。在本实验中MDA含量随培养时间的延长呈现先升高后降低的趋势,培养第1周,MDA含量与对照相比无显著差异,培养3~4周,MDA含量在≥2 mg·L-1处理组与对照差异显著,培养5周仅在最大浓度处理(4 mg·L-1)与对照相比显著升高。这说明随时间的延长,阿特拉津对MDA含量的影响逐渐降低[31]。但阿特拉津对菖蒲造成的毒性效应并未引起抗氧化酶(SOD和POD)活性的升高。以往的研究表明,在受到胁迫后植物的抗氧化酶活性都有一个先升高后降低的趋势[32]。本实验结果可能是由于菖蒲对阿特拉津的抗性机制不依赖于抗氧化酶系统活性的升高[33],或者在当前浓度的处理下阿特拉津对菖蒲造成的毒性效应不足以诱导抗氧化酶系统。Li等[34]在玉米对阿特拉津的吸收和响应的研究中表明,仅在阿特拉津浓度达到10 mg·L-1时,SOD、POD等抗氧化酶活性才被诱导。
在本实验中,抑菌条件下叶绿素含量以及Fv/Fm的变化趋势均与不抑菌条件下一致。不同的是,在培养第1周叶绿素a和叶绿素总量均在2 mg·L-1和4 mg·L-1处理下与对照相比有显著降低,并且抑菌条件下的叶绿素含量均显著低于不抑菌条件下的叶绿素含量。Fv/Fm在培养第1周,抑菌和不抑菌条件下均在阿特拉津浓度≥1 mg·L-1时与对照差异显著,但是在4 mg·L-1处理,不抑菌条件下Fv/Fm降低了28.1%,而抑菌条件下降低了54.6%。并且不抑菌条件下培养
5周时,各处理浓度Fv/Fm均恢复至对照水平,而抑菌条件下Fv/Fm在阿特拉津浓度≥2 mg·L-1处理均显著低于对照,培养4~5周,不抑菌条件下≥1 mg·L-1处理Fv/Fm均显著大于抑菌条件下。Wang等[13]研究了挺水植物在抑菌和不抑菌条件下对水溶液中阿特拉津的去除效率,结果表明不抑菌条件下水溶液中阿特拉津的去除速率大于抑菌条件下的去除速率,一方面因为微生物降解了水体中的阿特拉津,另一方面促进了植物对阿特拉津的吸收。因此,不抑菌条件可以减轻阿特拉津对菖蒲的毒性效应。
4 结论
低浓度阿特拉津的短时间胁迫,不会导致菖蒲生理指标的显著变化。随着处理浓度和培养时间的增加,菖蒲叶绿素含量下降,但叶绿素a/b无显著变化,菖蒲通过调整叶绿素组分比例来维持正常的光合作用。最大光能转化效率对阿特拉津胁迫敏感,短时间处理即显著低于对照,但是随着处理时间的延长逐渐恢复至对照水平。抑菌条件下,叶绿素含量在培养初期显著低于不抑菌处理,Fv/Fm在培养初期和后期均显著低于不抑菌处理。可见,菖蒲对阿特拉津胁迫具有一定的耐受能力,微生物可以减轻阿特拉津对菖蒲的胁迫。
[1]Jablonowski N D,Schäffer A,Burauel P.Still present after all these years:Persistence plus potential toxicity raise questions about the use of atrazine[J].EnvironmentalScienceandPollutionResearch,2011,18(2):328-331.
[2]Jones T,Kemp W,Stevenson J,et al.Degradation of atrazine in estuarine water/sediment systems and soils[J].Journal of Environmental Quality,1982,11(4):632-638.
[3]叶常明,雷志芳,王杏君,等.除草剂阿特拉津的多介质环境行为[J].环境科学,2001,22(2):69-73.
YE Chang-ming,LEI Zhi-fang,WANG Xing-jun,et al.Multimedia environmental behavior of herbicide atrazine[J].Environmental Science,2001,22(2):69-73.
[4]王子健,吕怡兵,王毅,等.淮河水体取代苯类污染及其生态风险[J].环境科学学报,2002,22(3):300-303.
WANG Zi-jian,LÜ Yi-bing,WANG Yi,et al.Assessing the ecological risk of substituted benzenes in Huaihe River,China[J].Acta Scientiae Circumstantiae,2002,22(3):300-303.
[5]何书海,陈盛,张鸣珊,等.海南饮用水源地水体中阿特拉津健康风险评价[J].中国环境监测,2015,31(2):12-16.
HE Shu-hai,CHEN Sheng,ZHANG Ming-shan,et al.Health risk assessmenton atrazine in drinking water source of Hainan[J].Environmental Monitoring in China,2015,31(2):12-16.
[6]任晋,蒋可.阿特拉津及其降解产物对张家口地区饮用水资源的影响[J].科学通报,2002,47(10):748-762.
REN Jin,JIANG Ke.Effects of atrazine and its decomposition products on drinking water resources in Zhangjiakou Region[J].Chinese Science Bulletin,2002,47(10):748-762.
[7]Knauert S,Singer H,Hollender J,et al.Phytotoxicity of atrazine,isoproturon,and diuron to submersed macrophytes in outdoor mesocosms[J]. Environmental Pollution,2010,158(1):167-174.
[8]于晓宁,徐冰冰,李会仙,等.淡水水生生物对阿特拉津除草剂的敏感度[J].环境科学研究,2013,26(4):418-424.
YU Xiao-ning,XU Bing-bing,LI Hui-xian,et al.Species sensitive distribution for aquatic biota exposed to atrazine in freshwater[J].Research of Environmental Sciences,2013,26(4):418-424.
[9]Forney D R,Davis D E.Effects of low concentrations of herbicides on submersed aquatic plants[J].Weed Science,1981:677-685.
[10]Christopher S V,Bird K T.The effects of herbicides on development of Myriophyllum spicatum L.cultured in vitro[J].Journal of Environmental Quality,1992,21(2):203-207.
[11]Mayasich J M,Karlander E P,Terlizzi D E.Growth responses of Nannochloris oculata Droop and Phaeodactylum tricornutum Bohlin to the herbicide atrazine as influenced by light intensity and temperature[J]. Aquatic toxicology,1986,8(3):175-184.
[12]刘虹,张兰英,刘娜,等.低温下固定化微生物降解水体中阿特拉津的效果[J].吉林大学学报,2008,38(6):1027-1031.
LIU Hong,ZHANG Lan-ying,LIU Na,et al.Effect of biodegradation of atrazine in the waterbody by immobilized microorganism in low temperation[J].Journal of Jilin University,2008,38(6):1027-1031
[13]Wang Q H,Zhang W,Li C,et al.Phytoremediation of atrazine by three emergent hydrophytes in a hydroponic system[J].Water Science and Technology,2012,66(6):1282-1288.
[14]吴建峰,林先贵.土壤微生物在促进植物生长方面的作用[J].土壤,2003,35 (1 ):18-21.
WUJian-feng,LIN Xian-gui.Effects of soil microbes on plant growth[J]. Soils,2003,35(1):18-21.
[15]Glick B R.Phytoremediation:Synergistic use of plants and bacteria to clean up the environment[J].Biotechnology Advances,2003,21(5):383-393.
[16]李冬林,王磊,丁晶晶,等.水生植物的生态功能和资源应用[J].湿地科学,2011,9(3):290-296.
LI Dong-lin,WANG Lei,DING Jing-jing,et al.Ecological functions and resource utilization of aquatic plants[J].Wetland Sciences,2011,9(3):290-296.
[17]任珺,陶玲,杨倩,等.芦苇菖蒲和水葱对水体中Cd富集能力的研究[J].农业环境科学学报,2010,29(9):1757-1762.
REN Jun,TAO Ling,YANG Qian,et al.Accumulation ability of Cd in water for Phragmites australis,Acorus calamus and Scirpus tabernaemontani[J].Journal of Agro-Environment Science,2010,29(9):1757-1762.
[18]李宏园,马红,陶波.除草剂阿特拉津的生态风险分析与污染治理[J].东北农业大学学报,2006,37(4):552-556.
LI Hong-yuan,MA Hong,TAO bo.Ecological risk assessment of a-
trazine and control strategy[J].Journal of Northeast Agricultural University,2006,37(4):552-556.
[19]Xia H L,Ma X J.Phytoremediation of ethion by water hyacinth(Eichhornia crassipes)from water[J].Bioresource Technology,2006,97(8):1050-1054.
[20]Shen W Q.Extraction of mixed solution for determination of chlorophyll content in rice leaf blade[J].Plant Physiology Communications,1988,3:62-64.
[21]邹琦.植物生理学实验指导[M].北京:中国农业出版社,2000:163-174.
ZOU Qi.Experimental instruction of plant physiology[M].Beijing:China Agricultural Press,2000:163-174.
[22]金彩霞,郭桦,刘军军.磺胺间甲氧嘧啶胁迫对小麦幼苗生理生化指标的影响[J].农业环境科学学报,2014,33(4):634-639.
JIN Cai-xia,GUO Hua,LIU Jun-jun.Physiological and biochemical changes in wheat seedlings under sulfamonomethoxine stress[J].Journal of Agro-Environment Science,2014,33(4):634-639.
[23]王庆海,张威,李翠,等.水体阿特拉津残留对千屈菜的毒性效应[J].应用与环境生物学报,2011,17(6):814-818.
WANG Qing-hai,ZHANG Wei,LI Cui,et al.Phytotoxicity of atrazine residue in water to Lythrum salicaris[J].Chinese Journal of Applied and Environmental Biology,2011,17(6):814-818.
[24]Torres A M R,O′Flaherty L M.Influence of pesticides on Chlorella,Chlorococcum,Stigeoclonium(Chlorophyceae),Tribonema,Vaucheria(Xanthophyceae)andOscillatoria(Cyanophyceae)[J].Phycologia,1976,15(1):25-36.
[25]El-Sheekh M M,Kotkat H M,Hammouda O H.Effect of atrazine herbicide on growth,photosynthesis,protein synthesis,and fatty acid composition in the unicellular green alga Chlorella kessleri[J].Ecotoxicology and Environmental Safety,1994,29(3):349-358.
[26]张守仁.叶绿素荧光动力学参数的意义及讨论[J].植物学通报,1999,16(4):444-448.
ZHANG Shou-ren.A discussion on chulrophyll fluorescence kinetics parameters and their significance[J].Chinese Bulletin of Botany,1999, 16(4):444-448.
[27]Stefanie K,Heinz S,Juliane H,et al.Phytotoxicity of atrazine,isoproturon,and diuron to submersed macrophytes in outdoor mesocosms[J]. Environmental Pollution,2010,158(1):167-174.
[28]段发平,张明永,范树国,等.草丁膦对转bar基因水稻GS酶活性和光合功能的影响[J].植物生理与分子生物学学报,2003,29(6):530-534.
DUAN Fa-ping,ZHANG Yong-ming,FAN Shu-guo,et al.Effects of glufosinate on GS activity and photosynthetic function of bar-transgenic rice[J].Journal of Plant Physiology and Molecular Biology,2003,29(6):530-534.
[29]Burke J J,Wilson R F,Swafford J R.Characterization of chloroplasts isolated from triazine-susceptible and triazine-resistant biotypes of Brassica campestris L.[J].Plant Physiology,1982,70(1):24-29.
[30]李兆君,马国瑞,徐建民,等.植物适应重金属Cd胁迫的生理及分子生物学机理[J].土壤通报,2004,35(2):234-238.
LI Zhao-jun,MA Guo-rui,XU Jian-min,et al.Physiological and biological mechanism of plant for adapting the stress by cadmium[J].Chinese Journal of Soil Science,2004,35(2):234-238.
[31]Wang Q H,Que X E,Zheng R L,et al.Phytotoxicity assessment of atrazine on growth and physiology of three emergent plants[J].Environmental Science and Pollution Research,2015,22(13):9646-9657.
[32]何洁,贺鑫,高钰婷,等.石油对翅碱蓬生长及生理特性的影响[J].农业环境科学学报,2011,30(4):650-655.
HE Jie,HE Xin,GAO Yu-ting,et al.The influence of oil concentration in soil on growth and physiological characteristics of Suaeda heteroptera[J].Journal of Agro-Environment Science,2011,30(4):650-655.
[33]Zoltán S,Endre L.A review of physiological and biochemical aspects of resistance to atrazine and paraquat in Hungarian weeds[J].Pest Management Science,2003,59(4):451-458.
[34]Li X Y,Wu T,Huang H L,et al.Atrazine accumulation and toxic responses in maize Zea mays[J].Journal of Environmental Sciences,2012,24(2):203-208.
Phytotoxicity of atrazine to Acorus calamus L.
LI Cui,WEN Hai-feng,ZHENG Rui-lun,CHEN Jie,MA Xue-ju,WANG Qing-hai*
(Beijing Research&Development Center for Grass and Environment,Beijing Academy of Agriculture and Forestry Sciences,Beijing 100097,China)
Long term applications of atrazine have resulted in water and soil contamination.In this study,a hydroponic experiment was designed to assess the toxicity of atrazine to emergent macrophyte Acorus calamus L.,by measuring chlorophyll content,chlorophyll a/b ratio,maximal photochemical efficiency(Fv/Fm),malondialdehyde(MDA)content,peroxidase(POD),and superoxide dismutase(SOD)activities under unsterile and sterile conditions.In unsterile treatment,plant chlorophyll content in leaves reduced with increases in atrazine concentrations and cultivation time.Chlorophyll a/b ratio had no significant difference compared with that of the control during the entire cultivation period.MDA content increased initially and then decreased with the prolongation of cultivate time.After 5-week exposure,MDA content had no significant differences between atrazine treatment groups at concentrations less than 2 mg·L-1,as compared with control.Fv/Fm ratio reduced with increasing atrazine concentrations,but no significant difference was found between 0.5 mg·L-1treatment and the control. It,however,recovered to the control’s level after the 5th week exposure.Under sterile condition,chlorophyll content and Fv/Fm decreased significantly compared with those in unsterile condition within 1-week exposure.Such significant difference in Fv/Fm still existed at atrazine level above 1 mg·L-1under 4-and 5-week exposures.During the whole experimental period,Fv/Fm ratio was significantly lower in atrazine treatments than in the control when atrazine concentration exceeded 2 mg·L-1under sterile condition.Acorus calamus L.was highly tolerant to atrazine stress and microorganism in the hydrophic system,to a certain extent,can alleviate the phytotoxicity of atrazine stress.
atrazine;Acorus calamus L.;physiological index;water pollution;sterile condition;tolerance
X171.5
A
1672-2043(2016)10-1895-08
10.11654/jaes.2016-0301
李翠,温海峰,郑瑞伦,等.阿特拉津胁迫对菖蒲的生理毒性效应[J].农业环境科学学报,2016,35(10):1895-1902.
LI Cui,WEN Hai-feng,ZHENG Rui-lun,et al.Phytotoxicity of atrazine to Acorus calamus L.[J].Journal of Agro-Environment Science,2016,35(10):1895-1902.
2016-03-09
国家自然科学基金项目(31370540)
李翠(1984—),女,助理研究员,硕士学位,主要研究方向为恢复生态学。E-mail:biolicui@163.com *通信作者:王庆海E-mail:qinghaiw@sina.com

