TSC1在肝纤维化中的表达及基因甲基化
陈 晨,黄 成,孟晓明,李 俊
TSC1在肝纤维化中的表达及基因甲基化
陈 晨1,2,黄 成1,2,孟晓明1,2,李 俊1,2
目的 通过检测在大鼠肝纤维化模型及转化生长因子-β1(TGF-β1)刺激的大鼠肝星形细胞(HSC)T6中结节性硬化症(TSC)相关蛋白错构素(hamartin)的表达,并检测HSC T6细胞TSC1基因启动子甲基化状态,探讨肝纤维化疾病治疗的新靶点。方法 构建大鼠肝纤维化模型,培养HSC T6细胞。利用Western blot法检测hamartin蛋白表达,利用焦磷酸测序检测TSC1启动子甲基化。结果 与正常对照组比较,肝纤维化模型组TSC1蛋白表达量较小(P<0.01),且TSC1基因启动子甲基化程度较高。结论 TSC1可能与肝纤维化形成有一定关联。
TSC1;肝纤维化;甲基化
肝纤维化是许多慢性肝病发展到肝硬化的中间过渡阶段,其中有25%~40%最终发展成为肝硬化,更严重的发展为肝癌。肝脏的细胞外基质(extracellular matrix,ECM)的合成和降解不平衡,而导致纤维结缔组织的过度沉积,是肝纤维化的主要病理表现[1]。HSCs的激活与增殖是肝纤维化发生发展其中的中心环节[2]。肝纤维化的形成是受各类因素网路调控的,目前的研究[1]表明其涉及多种相关细胞因子以及诸多信号转导通路。结节硬化症(tuberous sclerosis complex,TSC)是一种罕见的常染色体显性遗传病,其发病机制是由于TSC1和TSC2基因中任何一个发生变异。TSC1基因定位9q34,TSC2基因定位于16p13.3,TSC1和TSC2编码的基因产物分别为错构素(hamartin)和结节素(tuberin),蛋白分子量大小为130 ku与200 ku[3-4]。研究[5]显示TSC1在肾纤维化模型中低表达,并且敲除TSC1基因的转基因小鼠可以显示出肾间质纤维细胞的激活以及肾纤维化。该研究旨在探讨TSC1是否在肝纤维化中有表达变化。
1 材料与方法
1.1 实验材料 HSC T6细胞株来自安徽医科大学药学院。ECL发光试剂盒购自美国Thermo公司;TSC1、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)和胶原蛋白Ⅰ型(Collagen typeⅠ,ColⅠ)抗体均购自美国Santa Cruz公司;DNA抽提Kit、Eppendorf管、PCR管、移液器吸头购自美国Axygen公司;亚硫酸盐转化试剂盒购自德国QIAGEN公司;TSC1引物由上海英骏生物技术有限公司提供;双蒸水、TBE购自上海希匹吉生物技术有限公司。
1.2 动物及模型制备 清洁级SD大鼠50只,雌雄不限,180~220 g,由安徽医科大学实验动物中心提供。将大鼠随机分为正常对照组、肝纤维化模型组,每组10只。模型组的大鼠皮下注射以橄榄油稀释的10%CCl4(0.5 mg/kg),每周2次,正常对照组的大鼠则注射同等体积的橄榄油溶媒;将肝纤维化模型组的大鼠于第12周末处死,正常对照组的大鼠在20周末处死,迅速取出肝组织,从肝右叶中部切取肝组织两块,分别置于10%甲醛中固定、采用石蜡包埋并提取肝脏总蛋白。
1.3 Western blot法检测大鼠肝组织蛋白 取各组100 mg大鼠肝脏组织,将其剪成细小的碎片,置于匀浆器中加入裂解液,研磨至肝脏组织消失。12 000 r/min离心5 min,取上清液,测定蛋白浓度。取各组蛋白提取液,并加入等体积的上样缓冲液,混合,于100℃沸水煮沸5 min,使蛋白变性。提取各组细胞总蛋白,弃掉旧培养液,使用PBS清洗待处理细胞2遍,每孔加RIPA裂解液200 μl(含2 μl蛋白酶抑制剂1 mmol/L PMSF),放置在冰上裂解30 min,并收集细胞裂解悬液,于12 000 r/min冷冻离心机离心30 min后收集上清液。采用BCA法定量,取20 μg蛋白样品进行SDS-PAGE垂直电泳,分离蛋白质,并将样品蛋白从凝胶转移至PVDF膜上。使用5%脱脂奶粉室温封闭3 h。TBST洗膜3次,每次10 min,分别使用β-actin、TSC1、α-SMA和ColⅠ抗体4℃孵育过夜(稀释浓度为1∶1 000),再用TBST洗膜3次,每次约10 min,对应加入二抗山羊抗鼠和抗兔(稀释比均为1:10 000)室温孵育1 h,TBST洗膜3遍后,最后加入ECL化学发光试剂显影。
1.4 焦磷酸测序 按照Axygen DNA抽提Kit说明提取基因组DNA,并对基因组DNA进行亚硫酸盐修饰。PCR反应体系[50 μl:H2O 8.5 μl、KAPA 2G Robust HS ReadyMix 12.5 μl、up-Primer(50 pmol/μl)1 μl、down-Primer(50 pmol/μl)1 μl、Template(DNA)2 μl]。引物设计TSC1上游引物:5′-GGGATTGTGAGGTAAATAGTTGAG-3′;TSC1下游引物:5′-CCCTACCAAACAAATAAATCTCTT-3′;TSC1测序引物:5′-GGGTTTTTTGGGGTAG-3′,另PCR长度为161 bp。PCR扩增后,使用QIAGEN PyroMark Q96 ID焦磷酸测序仪进行测序。
1.5 统计学处理 采用SPSS 13.0软件进行分析,计量数据均以±s表示;两两比较采用t检验,采用Pearson法进行相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 大鼠肝脏组织的TSC1蛋白表达 使用Western blot法检测正常对照组及肝纤维化模型组的大鼠肝脏组织的蛋白表达量。与正常对照组的大鼠肝组织比较,肝纤维化模型组的α-SMA和ColⅠ蛋白表达量明显升高(t=7.283、9.118,P<0.01),而TSC1蛋白的表达量明显减小(t=15.35,P<0.05)。见图1。
2.2 HSC T6的TSC1蛋白表达 采用Western blot法检测正常对照组及TGF-β1刺激组的α-SMA、ColⅠ和TSC1。与正常对照组比较,TGF-β1刺激组α-SMA、ColⅠ表达上升(t=12.60、16.49,P<0.01),TSC1表达减少(t=4.256,P<0.01)。见图2。
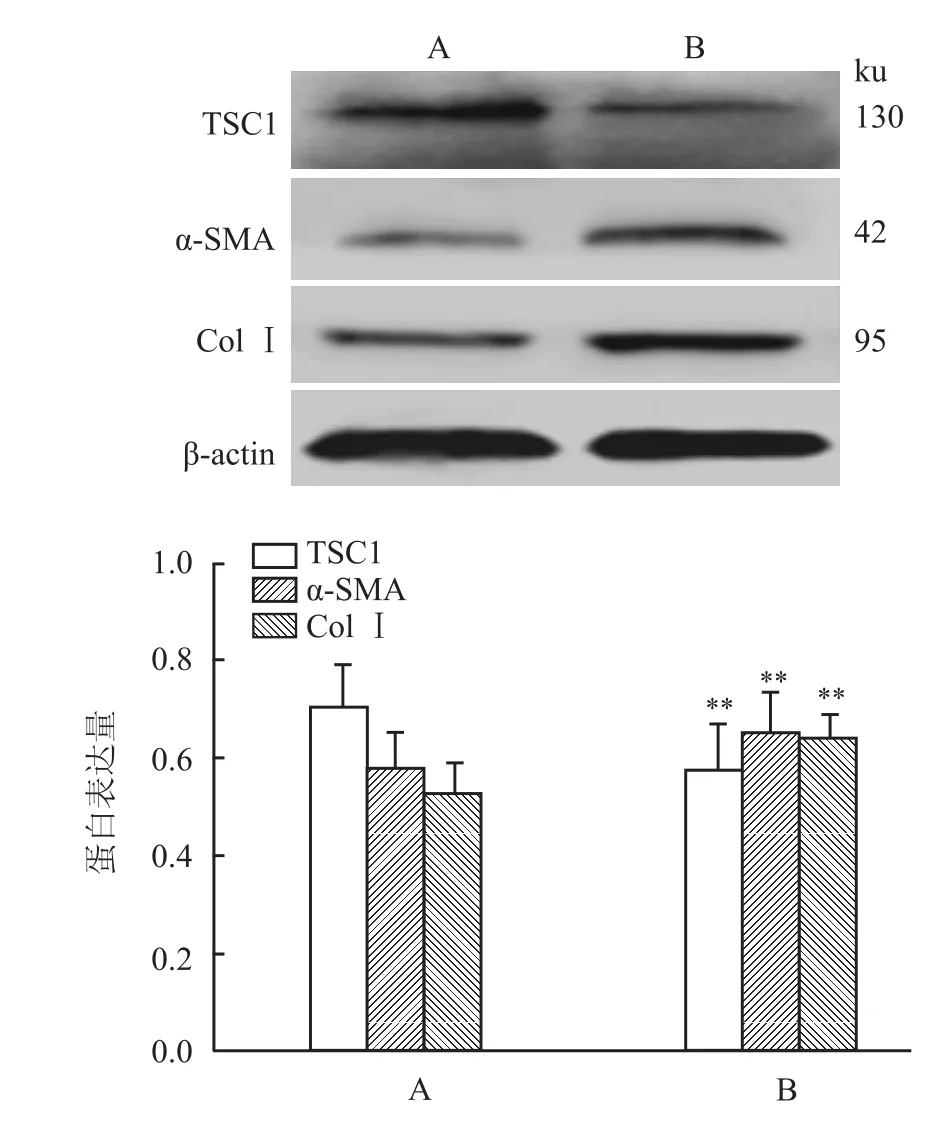
图1 Western blot法检测大鼠肝脏组织的蛋白表达
2.3 TSC1启动子甲基化焦磷酸测序 提取HSC T6细胞的基因组DNA,采用焦磷酸测序,结果见图3。可以看到测序峰清晰。正常对照组及TGF-β1刺激组均检测了同样的3个位点。正常对照组3个位点Pos.1、Pos.2、Pos.3的TSC1启动子甲基化程度分别为18.13%、16.84%、9.49%。TGF-β1刺激组3个位点的TSC1启动子甲基化程度分别为10.73%、32.16%、0。参照文献[6],将甲基化程度在20%以下视为无甲基化,而20%~50%可视为低甲基化,50%以上视为高甲基化。正常对照组的Pos.1、Pos.2、Pos.3的甲基化程度均低于20%,可视为无甲基化。而TGF-β1刺激组的Pos.2甲基化程度为32.16%,高于20%,可视为低甲基化。说明TGF-β1刺激组的TSC1启动子甲基化程度高于正常对照组。

图3 HSC T6细胞TSC1启动子甲基化焦磷酸测序
3 讨论
肝纤维化被认为是由多种因素如肝炎病毒、酒精、血吸虫病、毒物等长期持续损害肝脏导致的慢性炎症反应[2]。多种信号转导通路与细胞因子构成了调控肝纤维化的网络。研究探索与肝纤维化形成,进展有关的新机制也是当下的热点。
抑癌基因TSC1与TSC2分别编码错构素和结节素[3]。在人体大部分器官组织中,错构素和结节素可共表达;两者在细胞质内形成异二聚体而发挥作用,参与调节细胞生长与增殖、调节细胞周期、调节细胞内吞作用、调节细胞黏附作用、参与TGF-β/ Smad通路等[7]。肺淋巴管平滑肌瘤病、口腔鳞癌、子宫内膜癌、胰腺癌等各种肿瘤组织中的TSC1、TSC2蛋白表达低或缺失[8]。TSC1-TSC2肿瘤抑制因子位于mTOR信号通路的上游,可负调控mTOR。mTOR/p70S6K信号通路参与调节胶原蛋白的表达、细胞周期的控制、肝星状细胞的激活与增殖,进而对肝纤维化起着至关重要的作用。Patsenker et al[9]以及Yu et al[10]发现,抑制mTOR可以明显减少纤维化进程。TSC1在肾纤维化模型中低表达,并且敲除TSC1基因的转基因小鼠可以显示出肾间质纤维细胞的激活以及肾纤维化[5]。本研究在肝纤维化模型中检测了TSC1蛋白的表达,表明TSC1蛋白在肝纤维化模型中与正常对照组比较表达较低;并在HSC T6细胞中进行检测,由TGF-β1刺激的HSC T6细胞表达TSC1比正常对照组低。提示TSC1的表达可能与肝纤维化有一定关联。
蛋白质的表达受多个环节影响,如DNA的复制、转录、翻译、翻译后修饰等,任何环节的一丝差错都会最终影响蛋白质的表达。针对TSC1蛋白在肿瘤组织中低表达的现象,研究[3]表明TSC1基因突变及杂合性缺失都可影响其蛋白质表达。至今大约有超过400篇关于TSC的基因突变、基因缺失等报道,研究[11]显示人乳腺癌中TSC1蛋白表达低于正常组织,并且TSC1基因启动子的甲基化程度高于正常组织。DNA甲基化属于表观遗传学,是基因表型改变形式之一。正常的甲基化在维持细胞及机体的正常功能中有着十分重要的作用,但是异常的甲基化则会参与引发多种疾病,如各种肿瘤,自身免疫疾病等等。本研究检测了TSC1基因在HSC T6细胞中的甲基化程度,显示由TGF-β1刺激的HSC T6细胞的TSC1基因某位点甲基化程度为32.16%,高于20%,可视为低甲基化。而检测的正常对照组各位点的甲基化程度均低于20%,可视为无甲基化。这有可能是肝纤维化模型组及TGF-β1刺激的HSC T6细胞表达TSC1蛋白低的原因。虽然这可能不是TSC1蛋白表达低的唯一原因,但是肯定也是有着十分紧密的关联。
本研究表明肝纤维化中TSC1蛋白表达比正常对照组低,并且检测到由TGF-β1刺激的HSC T6细胞表达TSC1比正常对照组低。并采用焦磷酸测序实验揭示了TSC1基因启动子甲基化有可能是这一现象出现的原因。有关TSC1基因启动子甲基化的具体机制和具体作用,目前还没有相关报道,有待进一步的研究。本研究为肝纤维化的形成提供了新的可能机制,并为治疗肝纤维化提供了新的作用靶点。
[1] Poelstra K.Liver fibrosis in 2015:Crucial steps towards an effective treatment[J].Nat Rev Gastroenterol Hepatol,2016,13(2):67-8.
[2] Elpek G Ö.Cellular and molecular mechanisms in the pathogenesis of liver fibrosis:an update[J].World J Gastroenterol,2014, 20(23):7260-76.
[3] Islam M P,Roach E S.Tuberous sclerosis complex[J].Handb Clin Neurol,2015,132:97-109.
[4] Wheless J W.Use of the mTOR inhibitor everolimus in a patient with multiple manifestations of tuberous sclerosis complex including epilepsy[J].Epilepsy Behav Case Rep,2015,4:63-6.
[5] Jiang L,Xu L,Mao J,et al.Rheb/mTORC1 signaling promotes kidney fibroblast activation and fibrosis[J].J Am Soci Nephrol,2013,24(7):1114-26.
[6] 杜传清,毛平,王艳茹,等.急性髓系白血病BCL2L10基因启动子区异常甲基化定量研究[J].实用医学杂志,2012,28(20):3397-400.
[7] Thien A,Prentzell M T,Holzwarth B,et al.TSC1 activates TGF-β-Smad2/3 signaling in growth arrest and epithelial-to-mesenchymal transition[J].Dev Cell,2015,32(5):617-30.
[8] Csibi A,Blenis J.Appetite for destruction:the inhibition of glycolysis as a therapy for tuberous sclerosis complex-related tumors[J].BMC Biol,2011,9:69.
[9] Patsenker E,Schneider V,Ledermann M,et al.Potent antifibrotic activity of mTOR inhibitors sirolimus and everolimus but not of cyclosporine A and tacrolimus in experimental liver fibrosis[J].J Hepatol,2011,55(2):388-98.
[10]Yu S Y,Liu L,Li P,et al.Rapamycin inhibits the mTOR/ p70S6K pathway and attenuates cardiac fibrosis in adriamycin-induced dilated cardiomyopathy[J].Thorac Cardiovasc Surg,2013,61(3):223-8.
[11]Jiang W G,Sampson J,Martin T A,et al.Tuberin and hamartin are aberrantly expressed and linked to clinical outcome in human breast cancer:the role of promoter methylation of TSC genes[J]. Eur J Cancer,2005,41(11):1628-36.
The expression and the DNA methylation of TSC1 in liver fibrosis
Chen Chen1,2,Huang Cheng1,2,Meng Xiaoming1,2,et al
(1School of Pharmacy,Anhui Medical University,
2Institute for Liver Disease of Anhui Medical University,Hefei 230032)
Objective To explore the expression and the promoter methylation status of the TSC1 in HSC T6 differentiation induced by transforming growth factor β1(TGF-β1)in vitro,and the expression of the TSC1 in CCl4-induced liver fibrosis in rat.Methods Western blot was used to detect the expression of the TSC1.Pyrosequencing was used to test the methylation status of the TSC1 promoter.Results The expression of TSC1was significantly reduced in response to TGF-β1 and CCl4(P<0.01),and the TGF-β1 treated group TSC1 promoter was found to be higher methylated than the control group.Conclusion A novel evidence has been provided that TSC1,which may be affected by DNA methylation in TGF-β1 treated HSC T6,may play a vital role in liver fibrosis.
TSC1;liver fibrosis;methylation
R 34
A
1000-1492(2016)08-1132-04
时间:2016-6-22 14:44:58
http://www.cnki.net/kcms/detail/34.1065.R.20160622.1444.026.html
2016-04-14 接收
国家自然科学基金(编号:81273526、81473268);安徽省科技攻关项目(编号:1301042212)
1安徽医科大学药学院,2安徽医科大学肝病研究所,合肥230032
陈 晨,女,硕士研究生;
李 俊,男,教授,博士生导师,责任作者,E-mail:lj@ahmu.edu.cn

