四逆散对2型糖尿病大鼠血糖、11βHSD1及GR的影响
梁绍满 邓小敏
【实验研究】
四逆散对2型糖尿病大鼠血糖、11βHSD1及GR的影响
梁绍满1邓小敏2△
目的 观察研究四逆散对2型糖尿病大鼠胰岛素抵抗的影响及作用机制。方法 利用高糖高脂饲料喂养联合腹腔注射链脲佐菌素(STZ)的方法建立2型糖尿病大鼠模型。设空白对照组、模型组、四逆散高剂量组及四逆散低剂量组,给药4周后测各组大鼠体质量、空腹血糖 (FPG)、随机血糖、血清胰岛素(FINS) 水平、血浆皮质酮含量,并计算胰岛素抵抗指数,采用Western blot法检测肝脏组织中11β-HSD1、GR蛋白表达。结果 给药后,四逆散可以控制糖尿病大鼠体质量增长(P<0.05),具有降低空腹及随机血糖的作用(P<0.01),且中药高剂量组降血糖效果更佳,降低血清胰岛素水平、胰岛素抵抗指数水平(P<0.05 或P<0.01),降低血浆皮质酮含量(P<0.05)。模型组肝脏11β-HSD1、GR蛋白表达量上调,经中药治疗后两种蛋白的表达量均有所下调(P<0.01)。结论 四逆散能够改善 2型糖尿病大鼠胰岛素抵抗,其作用机制可能与下调11β-HSD1、GR蛋白的表达有关。
四逆散;2型糖尿病;从肝论治;11β-HSD1;GR
糖尿病(Diabetes Mellitus,DM)是一种由遗传因素和多种环境因素引起以慢性高血糖为特征的代谢性疾病,是一种可伴随因胰岛素分泌绝对不足或相对不足,以及靶组织细胞对胰岛素敏感性降低引起糖、脂质、蛋白质、水和电解质代谢紊乱综合征,临床常表现为多饮、多食、多尿,体质量下降。目前在我国糖尿病患者中大约90%~95%属于2型糖尿病(TyPe 2 Diabetes Mellitus,T2DM),而IR和胰岛β细胞分泌功能障碍是T2DM发生发展进程中的两个重要环节。研究发现精神创伤、易激易郁或持久性紧张可诱发或加重糖尿病,这可能由于各种情志刺激影响大脑皮质以及皮质下中枢以致影响脑垂体、肾上腺、胰腺等,即通过神经和内分泌系统影响糖脂代谢而发病[1]。也有研究[2]认为抑郁是糖尿病的最常见的心理障碍之一,给患者带来沉重的精神压力。四逆散是中药复方制剂,我们在临床主要用于治疗2型糖尿病胰岛素抵抗并发情志异常疾病,本研究从糖代谢、糖皮质激素方面,采用分子生物学方法探讨四逆散治疗糖尿病胰岛素抵抗的药效作用及其作用机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 清洁级雄性SD大鼠110只,12周龄,体质量(200±20)g,购自广西医科大学动物实验中心。饲养于广西中医药大学第一附属医院医学分子生物学实验室,实验室温度恒定为:(26±2)℃,相对湿度60%~80%。饲养环境符合医学实验动物环境设施要求,实验过程中对动物的处置符合动物伦理学标准。
1.1.2 饲料 动物饲料购自广西医科大学动物实验中心,分为普通基础饲料和高糖高脂饲料,高糖高脂饲料由基础饲料67.7%、猪油10%、蔗糖20%、胆固醇2.0%、胆酸盐0.3%组成,经广西中医药研究院加工为颗粒饲料。
1.1.3 药物准备 四逆散组成:柴胡、白芍、枳实、甘草,按原方比例1∶1∶1∶1配齐药物,购于广西中医药大学第一附属医院中药房。加入5倍蒸馏水浸泡60 min,快速加热至沸腾,而后保持微沸状态15 min,趁热抽滤;剩余药渣中加入3倍蒸馏水,浸泡30 min,快速加热至沸,微沸10 min,趁热抽滤。合并2次滤液,水浴浓缩至含生药量1 g·mL-1,分装灭菌,4℃储存备用。灌胃前提前取出药液,加热至常温后使用。
1.2 实验方法
1.2.1 模型制备 所有大鼠均予自由摄食基础饲料及饮水适应性喂养1周,随后高糖高脂组换予高糖高脂饲料饲养。采用高糖高脂饲料加小剂量STZ注射造模。高糖高脂组大鼠在高糖高脂饲料喂养4周后空腹腹腔注射低剂量STZ(35 mg/kg,Sigma公司)1次,正常对照组腹腔注射等剂量的柠檬酸缓冲液(STZ 用PH4.2的 0.1mmol/L 柠檬酸缓冲液配制)。造模时,STZ需要现配现用。剔除血糖值升高不符合要求的动物并选出健康状态相对较好的60只大鼠在进行随机分组治疗。糖尿病大鼠成模标准为STZ造模72 h(3天)后剪尾取血测血糖,以随机血糖≥16.7mmol/L 认为造模成功。
1.2.2 动物分组 按随机分配原则选取SD大鼠110只,分为空白对照组20只,高糖高脂组90只。将60只高糖高脂组中造模成功的大鼠随机分为模型组、中药高剂量组、中药低剂量组,共三组,每组20只。
1.2.3 给药 造模后空白对照组与模型组、中药高剂量组、中药低剂量组继续予标准大鼠基础饲料喂养。正常对照组给予生理盐水灌胃(5ml/kg),模型组给予生理盐水灌胃(5ml/kg),中药高剂量组给予四逆散煎剂浓缩液灌胃(10 g生药量/kg),中药低剂量组给予四逆散煎剂浓缩液灌胃(5 g生药量/kg),各组每日灌胃1次,连续灌胃4周。
1.2.4 取材 实验结束后,大鼠禁食12 h,空腹血糖的检测采用腹主动脉取血,不抗凝取血清测胰岛素(FINS),抗凝取血浆测皮质酮(CORT),低温保存,待检;随后分离出肝脏组织,取肝右叶下缘2cm×1cm大小组织并分割成数小块,用生理盐水冲洗干净后,置于滤纸上吸干,放入事先编号的冻存管中,液氮保存,置于-80℃冰柜冰冻保存,以留待制备蛋白标本。
1.2.5 检测 采用酶联免疫吸附测定法(ELISA法)测胰岛素(FINS)、皮质酮(CORT),指标检测严格按照ELISA试剂盒说明书进行操作。胰岛素抵抗指数(HOMA-IR)的计算方法:FPG×FINS/22.5;采用Western Blot法检测肝脏11β-HSD1、GR蛋白,用Image J软件对胶片进行扫描,将各组大鼠肝脏蛋白水平以β-actin标准化后进行量化分析。

2 结果
2.1 各组大鼠体质量比较 造模前1周模型组、中药高剂量组、中药低剂量组大鼠体质量较空白对照组明显增加,差异具有非常显著的统计学意义(P<0.01),提示高脂饲料对比普通饲料更能增加大鼠体质量。造模第0周(即造模成功伊始),造模大鼠出现体质量骤降、血糖增高现象,且造模大鼠的进食量、进水量较空白对照组明显增多,多数大鼠开始出现多尿的情况,说明成功造成2型糖尿病大鼠模型;但此时造模的三个组之间比较,大鼠体质量变化并没有统计学意义。造模第4周(即给药治疗后第4周),两个给药组体质量与模型组比较,明显降低,差异具有统计学意义(P<0.05),中药低剂量组体质量与中药高剂量组比较,差异无统计学意义(P>0.05),提示四逆散治疗对大鼠体质量增长具有抑制作用,不论汤药剂量的高低均可控制糖尿病大鼠体质量增长。见表1。

表1 各组大鼠体质量(g)的变化 (只,
注:与空白对照组比较,1)P<0.01,与模型组比较,2)P<0.05
2.2 各组大鼠随机血糖比较 实验过程中,模型组大鼠与中药高剂量组、中药低剂量组血糖均维持在较高水平,明显高于空白对照组,差异具有显著统计学意义(P<0.01)。造模伊始,模型组、中药高剂量组、中药低剂量组间血糖差异无统计学意义(P>0.05)。经中药灌胃4周后,模型大鼠的血糖有下降趋势,与模型组对比,中药高剂量组、中药低剂量组血糖下降明显,差异有显著统计学意义(P<0.01),中药高剂量组血糖对比其治疗前血糖下降明显(P<0.01),中药低剂量组血糖对比其治疗前血糖虽然也有下降,但差异无统计学意义(P>0.05),提示四逆散具有降低糖尿病大鼠随机血糖的作用,且高剂量的四逆散降血糖效果更佳。见表2。

表2 各组大鼠随机血糖浓度比较(mmol/L) (只,
注:与空白对照组比较,1)P<0.01;与模型组比较,2)P<0.01;同组间,与造模第0周相比,3)P<0.01
2.3 各组大鼠空腹血糖(FBG)及血清胰岛素(FINS)水平比较 给药四周后,检测各组FBG,与空白对照组相比,造模大鼠(模型组、中药高剂量组、中药低剂量组)FBG明显升高,差异有显著统计学意义(P<0.01)。中药高剂量组较模型组FBG降低,有统计学意义(P<0.01),中药低剂量组对比模型组血糖有所下降,但差异无统计学意义。提示四逆散高剂量组可以有效降低空腹血糖。给药四周后检测各组血清胰岛素水平,与空白对照组相比,模型组、中药高剂量组、中药低剂量组血清胰岛素水平升高,差异有显著统计学意义(P<0.01)。经治疗后,两个中药组FINS均有降低,中药高剂量组与模型组相比,差异有显著统计学意义,中药低剂量组有统计学差异,中药高剂量组和中药低剂量组比较无统计学差异,提示四逆散高剂量及四逆散低剂量均可降低2型糖尿病大鼠血清胰岛素水平,但二者对血清胰岛素的干预作用没有很大差别。见表3。

表3 各组大鼠空腹血糖及血清胰岛素水平变化情况
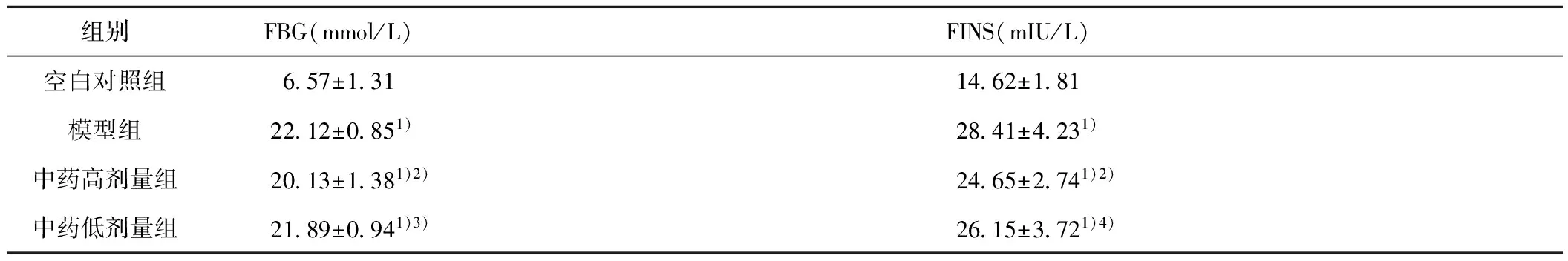
组别FBG(mmol/L)FINS(mIU/L)空白对照组657±1311462±181模型组2212±0851)2841±4231)中药高剂量组2013±1381)2)2465±2741)2)中药低剂量组2189±0941)3)2615±3721)4)
注:与空白对照组比较,1)P<0.01,与模型组比较,2)P<0.01。与高剂量组比较,3)P<0.01
2.4 各组大鼠胰岛素抵抗指数变化比较 给药四周后根据大鼠空腹血糖及血清胰岛素水平计算各组大鼠胰岛素抵抗指数,与空白对照组相比,模型组、中药高剂量组、中药低剂量组HOMA-IR明显升高,差异具有显著统计学意义(P<0.01)。药物治疗后,两个中药组HOMA-IR较模型组比较均有降低,与模型组相比,中药高剂量组有显著统计学差异,中药低剂量组有统计学差异,中药高剂量组对比中药低剂量组HOMA-IR下降具有显著统计学差异,提示四逆散高剂量及四逆散低剂量均可降低2型糖尿病大鼠胰岛素抵抗指数水平,且高剂量组干预作用优于低剂量组。见表4。
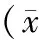
表4 各组大鼠胰岛素抵抗指数水平变化情况 ±s)
注:与空白对照组比较,1)P<0.01,与模型组比较,2)P<0.01,3)P<0.05。与高剂量组比较,4)P<0.01
2.5 各组大鼠血浆皮质酮比较 随着实验的进展,空白对照组大鼠血糖处于正常水平,由于空白对照组未给予任何药物及饮食干预,其体质量持续增长,重量重于各组大鼠,血糖低于各组大鼠。即使空白对照组此时的体质量较重,但其血浆皮质酮含量较模型组低,差异有显著统计学意义(P<0.01);并且空白对照组也低于中药高剂量组与中药低剂量组的皮质酮含量,与中药高剂量组、中药低剂量组对比,皮质酮含量差异有统计学意义(P<0.05)。由于经中药治疗后,中药高剂量组、中药低剂量组CORT含量对比模型组有下降趋势,且中药高剂量组对比模型组明显降低,差异有统计学意义(P<0.05),中药低剂量组对比模型组虽然也有下降趋势,但是差异没有统计学意义,因此提示四逆散高剂量组较低剂量组降低血浆皮质酮含量更为有效。见表5。

表5 各组大鼠血浆皮质酮(CORT)含量 (只,
注:与空白对照组比较,1)P<0.01,2)P<0.05,与模型组比较,3)P<0.05
2.6 Western Blot法检测四逆散对2型糖尿病大鼠肝脏组织蛋白中11β-HSD1表达的影响 11β-HSD1蛋白含量在模型组、中药高剂量组、中药低剂量组均明显升高,与空白对照组相比具有明显统计学意义(P<0.01)。中药高剂量组、中药低剂量组较模型组表达下降,且均与模型组相比有显著性差异(P<0.01)。提示四逆散高低剂量组均可降低11β-HSD1蛋白在糖尿病大鼠肝脏的表达。见表6,图1。

表6 各组大鼠11β-HSD1蛋白表达
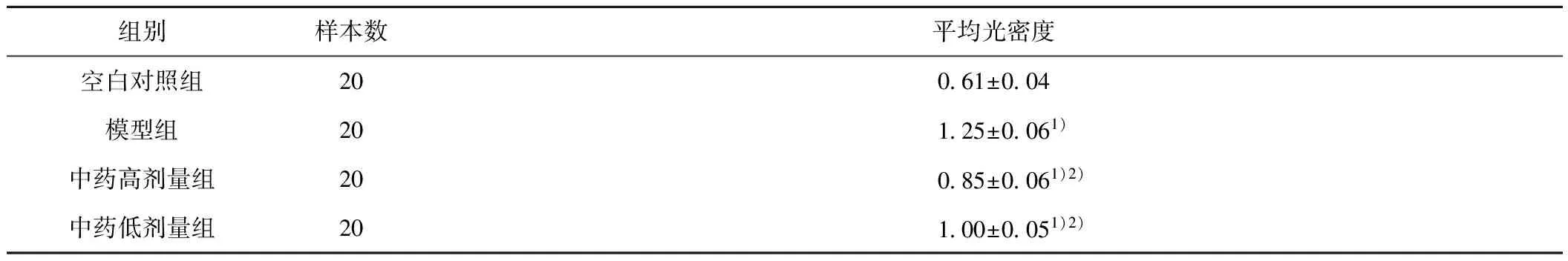
组别样本数平均光密度空白对照组20061±004模型组20125±0061)中药高剂量组20085±0061)2)中药低剂量组20100±0051)2)
注:与空白对照组比较,1)P<0.01,与模型组比较,2)P<0.01
2.7 Western Blot法检测四逆散对2型糖尿病大鼠肝脏组织蛋白中GR表达的影响 GR蛋白含量在模型组、中药高剂量组、中药低剂量组均明显升高,与空白对照组相比具有明显统计学意义(P<0.01)。中药高剂量组、中药低剂量组较模型组表达下降,且均与模型组相比有显著性差异(P<0.01)。提示四逆散高低剂量组均可降低GR蛋白在糖尿病大鼠肝脏的表达。见表7,图2。

表7 各组大鼠GR蛋白表达

组别样本数平均光密度空白对照组20182±012模型组20279±0161)中药高剂量组20263±0171)2)中药低剂量组20271±021)2)
注:与空白对照组比较,1)P<0.01,与模型组比较,2)P<0.01
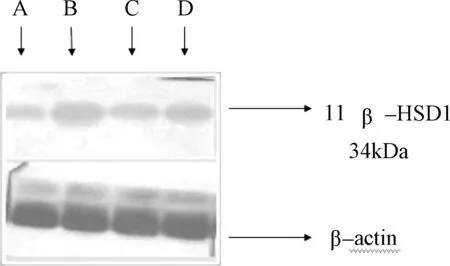
图1

图2
3 结论
本实验证明在2型糖尿病大鼠中11β-HSD1、GR蛋白的含量均明显增高,在运用四逆散干预治疗后,二者均可以表现出目标蛋白的表达量下降,提示二者之间确实具有相互调节作用。同时,造模大鼠血浆皮质酮(啮齿类动物血浆中的糖皮质激素主要是皮质酮)含量也有升高,在中药治疗后可下降。提示三者之间存在紧密的联系,通过三者之间相互作用,表达上调,从而使肝糖产生过多,导致发生血糖升高、胰岛素抵抗。本课题的研究表明,四逆散高剂量组随机血糖、空腹血糖、血清胰岛素、胰岛素抵抗指数明显降低,11β-HSD1、GR蛋白表达量也有下降,与模型组比较,差异有显著统计学意义(P<0.01)。四逆散低剂量组在血清胰岛素、胰岛素抵抗指数上与模型组比较,差异有统计学意义(P<0.05)。高剂量组在降低皮质酮含量方面优于低剂量组(P<0.05)。由此可知,经典名方四逆散能有效降低2型糖尿病大鼠血糖水平,其降血糖机理可能与降低肝脏11β-HSD1、GR蛋白表达有关。该研究结果可为丰富中医药防治2型糖尿病胰岛素抵抗从肝论治理论提供依据及作用机制指导。
4 讨论
4.1 四逆散从肝论治理论基础 《黄帝内经》中认为肝的生理功能为“主疏泄”“喜条达而恶抑郁”, 元代朱丹溪曾经说过:“气血冲和,诸疾不生,一有怫郁,百病生焉”,可见他尤为强调肝的疏泄功能失调引发的情志怫郁在疾病发生的重要地位。明朝戴元礼的《证治要决·伤食门》提到:“人之饮食由脾入胃,过食伤肝”。清代医家唐容川《血证论》认为:“木之性主于疏泄,食气入胃,全赖肝木之气以疏泄之,则水谷乃化。”这两条古文则说明了肝与脾胃之间的紧密联系,肝脏促进脾胃的运化水谷的功能。肝的情志失调,气机不畅,导致气血运行受阻,郁而化热,伤津耗液,瘀毒病理产物内生,发为消渴。并且现代健康观念既包含身体健康,又含精神卫生、心理等诸多方面,愈加重视情志方面的治疗,因此在认识到肝失疏泄是糖尿病早期的胰岛素抵抗发展变化的基本病理后,现代医家常选用疏肝理气的名方——四逆散来辅助治疗2型糖尿病,以达到降低血糖,减少胰岛素抵抗,增加胰岛素敏感性的目的。
4.2 11HSD1、GR与2型糖尿病胰岛素抵抗的相关性 11β-HSD1是一种微粒体复合酶体,能催化循环中无活性的糖皮质激素与活性的糖皮质激素之间进行转化,进行受体前调解,即糖皮质激素(GCs)与糖皮质激素受体(GR)的结合,改变局部激素生物效应[3]。11β-HSD1广泛分布于肝脏、脂肪组织、脑组织等,有实验研究显示11β-HSD1活性在小鼠的肝、脂肪细胞的不正常升高与胰岛素抵抗和内脏型肥胖的发生有关[4]。11β-HSD1可逆地控制糖皮质激素的代谢,引起GCs浓度变化,影响胰岛素抵抗状态及血糖变化。11β-HSD1能增加组织中GCs浓度,影响血糖变化。并且流行病学提示2型糖尿病存在慢性应激,如易激易郁或持久性紧张可以造成局部组织糖皮质激素水平增高,扩大激素效应。长期的慢性应激导致某些升糖激素如胰高血糖素、GCs等不恰当地分泌[5],导致血糖升高。
GR是一种配体激活型核转录因子,糖皮质激素的效应就是由GR介导的。GCs与肝脏GR结合后,使糖异生的两个限速酶表达上调,加速糖异生的过程,对抗胰岛素活性、外周敏感性,从而使肝糖产生过多,血糖升高。
[1] 杜春娣.对糖尿病的发病机理及临床表现的分析与探讨[J].科技展望,2015,25(21):257.
[2] 孙晓利.2型糖尿病合并抑郁症的生物学机制探讨及抗抑郁治疗效果评估[D].郑州:郑州大学,2010.
[3] 王晋.11β-羟基类固醇脱氢酶1介导糖皮质激素受体在大量饮酒诱发2型糖尿病中的作用[D].吉林:吉林大学,2010.
[4] 郑江丽.11β-HSD-1在多囊卵巢综合征中作用的研究[D].南京:南京医科大学,2006.
[5] 王晓丽.基于HPA轴调节的米非司酮对大鼠糖耐量减低和糖脂代谢紊乱的调节作用及机制研究[D].兰州:兰州大学,2014.
广西壮族自治区教育厅课题(No.YB2014186)
1.广西中医药大学第一临床医学院硕士研究生2013级(南宁 530023);2. 广西中医药大学第一附属医院药物临床试验办公室(南宁 530023)
△通讯作者
10.3969/j.issn.1003-8914.2016.19.017
1003-8914(2016)-19-2799-05
�超峰
2016-05-16)

