甘蓝型油菜与黑芥双倍体减数分裂的原位杂交分析
陈纪鹏,李生强,刘显军,却志群
(宜春学院 生命科学与资源环境学院,江西 宜春 336000)
甘蓝型油菜与黑芥双倍体减数分裂的原位杂交分析
陈纪鹏,李生强,刘显军,却志群
(宜春学院 生命科学与资源环境学院,江西 宜春 336000)
【目的】 探明植物杂种后代减数分裂异常与花粉败育之间的关系。【方法】 通过甘蓝型油菜与黑芥种间杂交和基因组加倍,获得芸薹属三基因组双倍体,采用基因组原位杂交方法,观察三基因组双倍体花粉母细胞的减数分裂规律。【结果】 与单倍体相比,双倍体花粉育性得到一定恢复,但可育花粉的比例较低,只有10%~20%。基因组原位杂交结果显示,双倍体花粉母细胞减数分裂终变期染色体以形成同源二价体为主,但也有部分染色体形成四价体或六价体。四价体有3种形式:B基因组染色体形成的四价体、AC基因组染色体形成的四价体及B与AC基因组之间形成的异配四价体。减数分裂后期Ⅰ染色体均等分离的细胞占总数的70%左右,在第2次减数分裂期也观察到非正常分裂如非四分孢子、微核等现象。【结论】 减数分裂过程中的染色体异常行为可能是导致花粉育性不高的重要原因;虽然不正常的减数分裂导致花粉育性下降,但双亲染色体的异源联会可为双亲遗传物质的交换提供条件。
黑芥;甘蓝型油菜;减数分裂;基因组原位杂交;雄性不育
在植物进化历程中,多倍化发挥了巨大的作用。自然界约70%的高等植物都是多倍体,而且人们认为典型的二倍体植物如玉米、水稻等在进化史上也经历了至少一次多倍化[1-2]。芸薹属(Brassica)植物在进化上也经历了多倍化的历程,芸薹属栽培种包括3个基本种和3个复合种,3个基本种是白菜(B.rapa,AA,2n=20)、黑芥(B.nigra,BB,2n=16)和甘蓝(B. oleracea,CC,2n=18),3个复合种是甘蓝型油菜(B.napus,AACC,2n=38)、芥菜型油菜(B.juncea,AABB,2n=36)和埃塞俄比亚芥(B.carinata,BBCC,2n=34)。3个复合种是由3个基本种两两杂交并经过基因组自然加倍形成的,即白菜与甘蓝杂交形成甘蓝型油菜,白菜与黑芥杂交形成芥菜型油菜,黑芥与甘蓝杂交形成埃塞俄比亚芥。这种进化关系由日本学者禹长春提出,因此被称为“禹氏三角”。而且芸薹属栽培种之间的这种进化关系已被分子生物学和基因组原位杂交等方法进一步证实[3]。虽然芸薹属四倍体表现出强大的进化优势[1,4],比如四倍体的甘蓝型油菜成为世界上主要的油菜栽培种,但是自然界中却没有自然形成的芸薹属六倍体种,人工合成的六倍体也表现出不良性状,不适合栽培,而在其他种属,如小黑麦和燕麦中都有六倍体用于栽培。
十字花科大约有338个属,近3 700个种,不但有多种栽培蔬菜、油料作物、药用植物和观赏植物,还有大量的野生种。在十字花科植物中,蕴藏着大量的具有各种生物抗性和非生物抗性的基因资源,为油菜的遗传改良提供了前提。随着全球自然条件的不断恶化,油菜病虫草害以及各种非生物胁迫日益加剧,严重影响着油菜的产量和品质,培育具有良好抗性的新品种成为解决这一问题的主要途径。近年来,人们通过多种途径合成了芸薹属三基因组双倍体用于栽培物种的遗传改良[5-7]。黑芥是芸薹属的一个二倍体栽培种,其不仅具有良好的栽培性状,还具有抗黑腐病、抗黑胫病和根肿病等特性[8-9]。近年来,花椰菜、萝卜、白菜等栽培作物与黑芥的种、属间杂交均获得成功,并且成功地将抗病基因从黑芥引入栽培蔬菜中[10]。本研究通过人工杂交和基因组加倍获取甘蓝型油菜与黑芥的种间杂种,既可以将黑芥的优良基因引入甘蓝型油菜,又可创造出芸薹属栽培种三基因组双倍体,采用基因组原位杂交方法分析三基因组双倍体中各基因组间和基因组内的染色体联会情况,探明三基因组双倍体减数分裂过程中染色体的行为规律,以期为人类创造有经济价值的芸薹属六倍体提供理论依据。
1 材料与方法
1.1材料
与黑芥(B.nigra,BB,2n=16)杂交的4个甘蓝型油菜(B.napus,AACC,2n=38)品种分别为‘Oro’(世界上第1个低芥酸、低硫甙油菜品种)、‘中油821’、‘湘油15’和‘陕油15’,其中‘陕油15’为甘蓝型半冬性胞质不育三系杂交中晚熟品种,具有中抗菌核病特征。杂交种本身遗传的不稳定性可能导致杂种后代不稳定,加大选育的难度,但后代群体的遗传差异可为优良性状的选择提供更大空间。4个杂交亲本种植于宜春学院实验田,而黑芥生育期较短且喜干旱,为了使其与甘蓝型油菜花期相遇,将其种植在温室内并适当延迟播种。
1.2方法
1.2.1三基因组双倍体的获得以黑芥与4个甘蓝型油菜作为杂交亲本,于盛花期人工去除雄蕊,第2天上午取甘蓝型油菜花粉辅助授粉,对甘蓝型油菜与黑芥进行种间杂交,并在授粉后20 d左右进行胚培养获取杂种后代,计算三倍体获得频率(获得频率=获得杂种植株数/授粉花朵数×100%)。将三倍体杂种幼芽转入MS+0.25 mg/L NAA+1.5 mg/L 6-BA+1 mg/L秋水仙碱培养基中进行基因组加倍,在含有秋水仙碱的培养基中处理10 d,再转入不含秋水仙碱的培养基,使愈伤组织重新分化出幼苗,即可获得基因组加倍的三基因组双倍体(AABBCC)。
1.2.2三基因组双倍体花粉育性的醋酸洋红染色观察在天气晴朗的上午选取三基因组双倍体植株当天开放的花,取2枚花药放在载玻片上破碎使花粉散出,滴加醋酸洋红染色,盖上盖玻片后在显微镜下观察花粉形态和着色深浅,并统计可育花粉数量。每株观察花粉数量200粒以上,花粉粒大而圆且易被染色的花粉为可育花粉,较小、干瘪且不易被染色的为不育花粉。
1.2.3花粉母细胞减数分裂的荧光显微观察采用CTAB法提取黑芥和4种甘蓝型油菜总DNA。黑芥DNA采用缺口平移法以地高辛(Roche Diagnostics,Indianapolis,IN)标记作为探针。将甘蓝型油菜的DNA在沸水中煮15 min左右,将其切为200 bp左右的片段用作封阻DNA。将标记好的探针与封阻DNA用于基因组原位杂交。
在盛花期取三基因组双倍体的花蕾,立即放入卡诺固定液(无水乙醇与冰乙酸体积为3∶1的混合液)固定24 h以上,然后转入体积分数70%的乙醇中于-20 ℃冰箱保存备用。试验时,先取固定好的适宜大小(花粉母细胞正处于减数分裂终变期)的花蕾,取出花药在柠檬酸缓冲液中浸泡20 min左右并在摇床上摇动,洗去花药表面的乙醇,然后将花药取出放入混合酶液中酶解1 h左右,混合酶液由质量分数0.5%蜗牛酶(北京百泰生物药业)、质量分数0.2%果胶酶(Merck,German)和质量分数0.6%纤维素酶(Yakult Honsha)组成;将酶解后的花药置于洁净的载玻片上破碎,使花粉母细胞散出,滴加卡诺固定液使花粉母细胞均匀分散在载玻片的中央,并迅速将固定液点燃使花粉母细胞附着于载玻片上;每张载玻片上加杂交混合液50 μL(包含探针、封阻DNA和缓冲液的混合物),37 ℃恒温箱中过夜。将未杂交的信号洗脱后加抗FITC抗体(Sigma,America)检测生物素探针,然后加体积分数0.2% 4-6-二脒基-2苯基吲哚(DAPI,Roche,Sweden)对染色体复染,再加抗淬灭剂封片,在荧光显微镜(Olympus BX-51)下观察并用CCD(DP-70)拍照。
2 结果与分析
2.1三基因组双倍体植株表型及花粉育性
以黑芥为母本时,4个甘蓝型油菜作为父本均以2.5%~5.3%的频率获得了三倍体杂种(ABC)。而反交组合中只有‘陕油15’与黑芥组合以极低的频率(0.4%)获得了三倍体杂种,其他3个组合均未得到杂种后代。各个杂交组合的三倍体杂种经秋水仙碱处理后都获得了相应的双倍体,双倍体的获得频率为10%~20%。
双倍体植株与三倍体相比,营养生长更加旺盛,其植株高度增加,茎秆更粗壮,叶片更大且厚(图1-A);花蕾明显增大,可以作为鉴定双倍体的重要指标。经有丝分裂染色体计数观察发现,双倍植株体细胞含有54条染色体,说明秋水仙碱加倍成功(图1-B)。
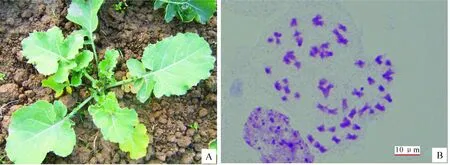
图 1 甘蓝型油菜与黑芥杂交所得三基因组双倍体植株的表现(A)和体细胞有丝分裂染色体的观察(B)Fig.1 Morphology(A) and mitosis(B) of amphiploids between B.napus and B.nigra
双倍体植株的花也比较大,雄蕊比三倍体的雄蕊长,接近柱头,而三倍体雄蕊不到雌蕊长度的一半;而且花药发育更加充分,比较饱满;开花期花药破裂,可以观察到有少量花粉散出;三倍体花药不饱满,未观察到散粉现象。经醋酸洋红染色在显微镜下观察发现,双倍体可育花粉占总花粉数的 10%~20%。在套袋自交的情况下,胚珠不发育,不能形成种子。但在田间开放授粉条件下,有部分角果形成少量种子,表明双倍体雌配子育性也得到一定恢复,通过与甘蓝型油菜回交可能产生回交后代。
2.2三基因组双倍体花粉母细胞减数分裂期的染色体联会
原位杂交后对花粉母细胞减数分裂的观察结果(表1)显示,甘蓝型油菜与黑芥杂交所得三基因组双倍体在减数分裂终变期染色体以形成二价体为主,其中B基因组染色体在每个花粉母细胞里形成的同配二价体数平均为7.28~7.58个,有些细胞B基因组的染色体全部进行同源配对形成8个二价体(图2-A1,A2),每个细胞最少形成5个二价体。AC基因组染色体在每个花粉母细胞里形成的同配二价体数平均为17.48~18.00个,部分细胞里AC基因组的染色体全部两两配对形成19个二价体。除了形成二价体外,还有少部分染色体形成四价体。A、B、C 3个基因组间部分同源关系可能导致形成四价体,尤其是A与C基因组间的亲缘关系比较近,染色体间的部分同源程度更高。四价体的形成有3种形式:4条B基因组染色体形成四价体,4条AC基因组染色体形成四价体,2条B基因组染色体和2条AC基因组染色体形成异配四价体(图2-B1,B2);每个花粉母细胞中B基因组染色体形成的四价体数平均为0.18~0.31个;AC基因组形成的四价体数平均为0.39~0.54个;而B基因组与AC基因组形成的异配四价体数平均为0.20~0.39个。其他类型的染色体联会构型也有发现,但频率极低。
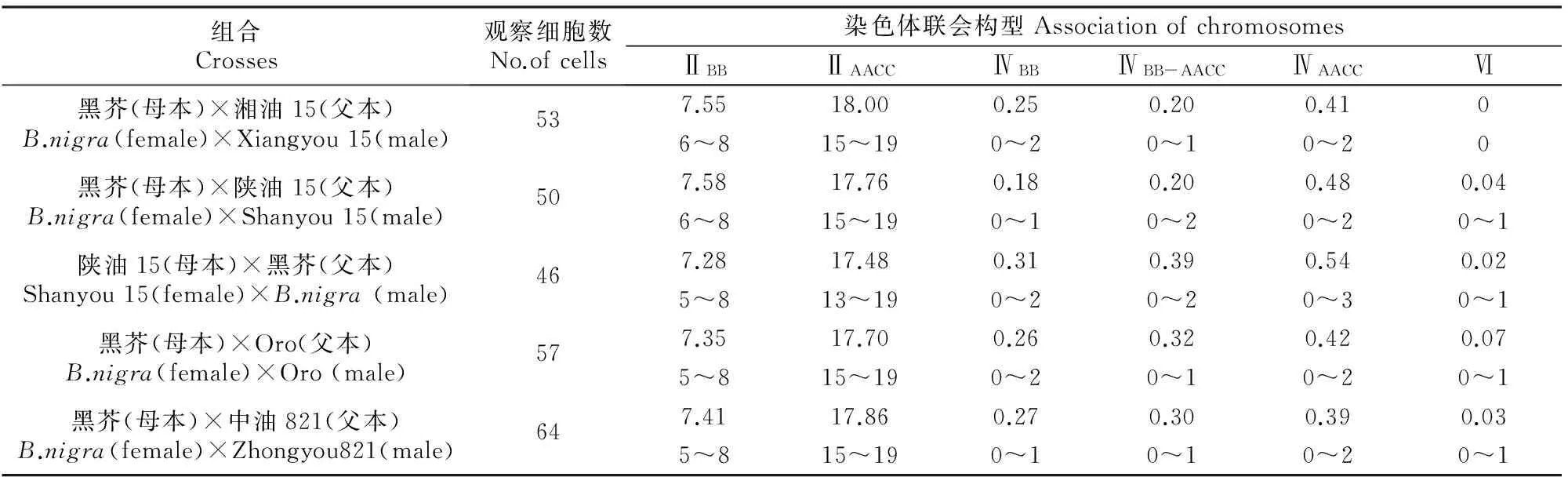
表 1 甘蓝型油菜与黑芥三基因组双倍体花粉母细胞减数分裂终变期的染色体联会观察结果Table 1 Chromosome associations in pollen mother cells (PMC) of trigenomic amphiploids between B.napus and B.nigra at diakinesis
注:ⅡBB.B基因组染色体形成的二价体;ⅡAACC.AC基因组染色体形成的二价体;ⅣBB.B 基因组染色体形成的四价体;ⅣBB-AACC.B基因组与AC基因组间染色体形成的四价体;ⅣAACC.AC基因组染色体形成的四价体;Ⅵ.六价体;每个组合第1行数字表示平均值,第2行数字表示变化范围。
Note:ⅡBB.Bivalent of B genome;ⅡAACC.Bivalent of AC genomes;ⅣBB.Tetravalent of B genome;ⅣBB-AACC.Tetravalent between B genome and AC genome;ⅣAACC.Tetravalent of AC genome;Ⅵ.Hexavalent.The first line in each square means the average value and the second means the range.
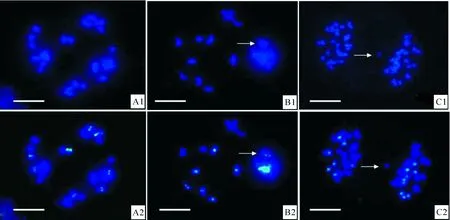
图 2 甘蓝型油菜与黑芥三基因组双倍体花粉母细胞减数分裂染色体联会和分离的原位杂交图像 A1,B1,C1.DAPI(蓝色)染色的染色体图像;A2,B2,C2.DAPI图像与探针信号融合图像,绿色信号来自黑芥基因组探针。A1,A2.16个黑芥 染色体形成8个同源二价体的终变期花粉母细胞;B1,B2.甘蓝型油菜AC基因组与黑芥B基因组形成1个异配四价体(箭头所示)的 终变期花粉母细胞;C1,C2.黑芥染色体9∶7分离并有一条甘蓝型油菜染色体落后(箭头所示)的后期Ⅰ花粉母细胞。标尺=10 μmFig.2 GISH analyses of chromosome pairings and segregation in PMCs of trigenomic amphiploids A1,B1,C1.DAPI (blue) images;A2,B2,C2.Merged images, green signals are from B.nigra probe. A1,A2.One diakinesis PMC with 8 bivalents of B genome;B1,B2.One diakinesis PMCs of with one allo-tetravalent (arrowed) between B gemone and AC genomes;C1,C2.One AI PMC with 9∶7 segregation of B genome and a lagged chromosome of AC genomes(arrowed).Bar=10 μm
2.3三基因组双倍体花粉母细胞减数分裂期的染色体分离
经基因组加倍获得的双倍体染色体分离,以 27∶27的比例均等分离细胞占总观察细胞数的70%左右,而且在绝大多数均等分离的细胞中,B基因组和AC基因组染色体也是均等分离的。同时,染色体不均等分离的细胞以较低的频率出现,主要表现为总染色体不均等分离以及B和AC基因组染色体不均等分离。总染色体不均等分离主要表现为28∶26、29∶25和30∶24的分离形式;B基因组染色体不均等分离主要表现为9∶7(图2-C1,C2)和10∶6的分离形式;AC基因组不均等分离主要表现为20∶18和21∶17的分离形式。在染色体分离过程中,有少数染色体形成染色体桥或落后染色体(图2-C1,C2)。第2次减数分裂与相应的三倍体相比表现得比较有规律,形成四分孢子的比例达到90%以上。不正常的减数分裂现象主要表现为非四分孢子和微核的形成。除了形成四分孢子以外,还有五分孢子和六分孢子出现,出现的频率分别为6%和2%;而且在第2次减数分裂结束后,还有少数细胞可以产生由少数染色体或染色体片段形成的微核,微核可能无法进入子细胞核而丢失。
3 讨论与结论
本研究通过秋水仙碱处理获得双倍体的效率比较高,而且加倍完整,无嵌合体形成。经过远缘杂交和染色体组加倍形成双倍体后,双亲的遗传物质便发生剧烈的变化,使得双倍体杂种减数分裂表现出二倍体的特征,即同源染色体进行配对[11],而且随着减数分裂期染色体行为的二倍体化,双倍体的育性也会得到较好的恢复[12]。本研究中获得的双倍体育性仍然很低,可育花粉所占比例非常低,而且自由传粉条件下结实率也不高,表明雌配子育性恢复不好。双倍体育性恢复差的现象在芸薹属其他植物的杂交中也有发生[13]。本研究获得的三基因组双倍体在减数分裂终变期染色体主要进行同源联会形成二价体,但由于A、B、C基因组亲缘关系比较近,尤其是A和C基因组之间亲缘关系更近,因此有部分染色体形成了四价体,甚至六价体。严格的同源染色体配对是二倍体植物形成可育配子的前提,双倍体中多价体的形成势必会影响减数分裂后期Ⅰ染色体分离从而导致染色体不均等分离,结果使产生配子的遗传平衡被打破,导致配子育性下降或产生非整倍体后代[14]。本研究中的双倍体不完全正常的染色体联会(除大部分染色体形成二价体外,还有一定数量的多价体形成)导致减数分裂后期Ⅰ染色体分离紊乱,均等分离的细胞仅占70%,而且还发现染色体桥和落后染色体。由此可以推测,这种不正常的减数分裂行为是导致双倍体花粉育性低的重要原因。在埃塞俄比亚芥与白菜杂交获得的芸薹属三基因组双倍体(AACCBB)中,花粉母细胞减数分裂过程中染色体表现出较好的二倍体遗传特征,同缘染色体配对的频率和减数分裂后期Ⅰ均等分离的比例都比较高,因此花粉育性也比较高,但是在自交后代中,仍然有较大比例的非整倍体出现[7,15]。本研究所得双倍体花粉育性只有10%~20%,可能是由于所用亲本不同导致。虽然杂种都含有相同的遗传物质,但是细胞质的影响也会引起性状的差异,而且来自不同亲本的同一基因组之间也会存在一定的差异。
在异源多倍体形成的早期世代,非正常减数分裂产生的配子育性丧失也许是异源多倍体形成过程中促细胞减数分裂二倍体化的一个因素。减数分裂过程中,染色体不能全部进行同源配对,将导致后期Ⅰ染色体向两极不均等的分离,结果极可能使形成的配子染色体数目异常,染色体数异常的配子极可能是不育的配子,尤其是染色体数目减少的配子。经过多代对异常配子的选择,可以使细胞的减数分裂趋于正常[16]。埃塞俄比亚芥与白菜杂交合成的芸薹属双倍体由于非整倍体的大量存在,也表现出育性下降的特点,但随着连续自交,花粉育性得到恢复[7]。本研究从花粉细胞减数分裂过程入手分析花粉不育的原因,找到了影响花粉育性的证据,所获得的三基因组双倍体减数分裂过程表现出较多异常现象,如多价体的形成、染色体不均等分离、染色体桥和落后染色体等。不正常的减数分裂势必会影响遗传物质在子细胞中的平衡分配,因此产生了大量的不育花粉。人工合成的多倍体虽然经历了雄性不育对配子的选择,但不可能在短期世代后达到遗传平衡,只有经历多代自交或回交后配子育性才能较好恢复。由此可以推测,人工合成的异源多倍体的遗传物质恢复平衡要经历一个长期的过程,这也是当前仅有极少数人工合成多倍体用于农业生产的原因。
虽然人工多倍体早期世代减数分裂出现非正常的染色体联会,使多倍体表现出遗传不稳定等不利现象。但是来自不同亲本的染色体之间的联会是双亲之间遗传物质交换的前提,异源多价体的形成为双亲优良基因的聚合提供了可能。本研究的双倍体B基因组与AC基因组染色体进行异配形成四价体在细胞中以较高的频率出现,每个细胞内达到 0.20~0.39,不同基因组内的联会为遗传物质在基因组之间的交换提供了条件,使黑芥优良性状转入甘蓝型油菜成为可能。虽然双倍体的雌雄配子的育性都比较低,但在田间开放条件下仍有少量种子产生,表明通过回交可以获得杂种后代,为创建甘蓝型油菜的附加系和代换系提供了可能。
[1]Fawcett J,Maere S,Vajknm de Peer Y.Plants with double genomes might have had a better chance to survive the Cretaceous-Tertiary extinction event [J].Proc Natl Acad Sci USA,2009,106:5737-5742.
[2]Wang X,Wang H,Wang J,et al.The genome of the mesopoly-ploid crop speciesBrassicarapa[J].Nature Genetics,2011,43(10):1035-1039.
[3]Snowdon J R.Cytogenetics and genome analysis inBrassicacr-ops[J].Chromosome Res,2007,15:85-95.
[4]Prakash S,Bhat S R,Quiros C F,et al.Brassicaand its close allies:cytogenetics and evolution [J].Plant Breed Rev,2009,31:21-30.
[5]牛妍.芥菜型油菜和白菜型油菜种间杂种遗传分析 [J].植物遗传资源学报,2013,14(4):715-722.
Niu Y.Genetic analysis on interspecific hybrids progeny betweenBrassicajunceaandBrassicarapa[J].Journal of Plant Genetic Resources,2013,14(4):715-722.
[6]富贵,赵志刚,杜德志.利用青海大黄油菜和芥蓝合成大粒甘蓝型油菜 [J].中国油料,2012(2):136-141.
Fu G,Zhao Z G,Du D Z.Large seed resynthesizedBrassicanapusfrom hybrid ofBrassicarapaandBrassicaoleraceavar.alboglabra[J].Chinese Journal of Oil Crop Sciences,2012(2):136-141.
[7]Tian E T,Jiang Y F,Chen L L,et al.Synthesis of aBrassicatrigenomic allohexaploid (B.carinata×B.rapa) de novo and its stability in subsequent generations [J].Theor Appl Genet,2010,121:1431-1440.
[8]Rimmer S R,van den Berg C G J.Resistance of oilseedBrassicaspp.to blackleg caused byLeptosphaeriamaculans[J].Can J Plant Pathol,1992,14:56-66.
[9]Chavre A M,Barret P,Tanguy X,et al.Characterization ofBr-assicanigrachromosomes and of blackleg resistance inB.napus-B.nigraaddition lines [J].Plant Breed,1996,115:113-118.
[10]王桂香,严红,曾兴莹,等.花椰菜:黑芥体细胞杂交获得抗黑腐病异附加系新材料 [J].园艺学报,2011,38(10):1901-1910.
Wang G X,Yan H,Zeng X Y,et al.New alien additon lines resistance to black rot generated by somatic hybridization between cauliflower and black mustard [J].Acta Horticulturae Sinica,2011,38(10):1901-1910.
[11]Le Comber S C,Ainouche M L,Kovarik A.Making a functional diploid:from polysomic to disomic inheritance [J].New Phytol,2010,186:113-122.
[12]Chandra A,Gupta M L,Ahuja I,et al.Intergeneric hybridization betweenErucastrumcardaminoidesand two diploid cropBrassicaspecies [J].Theor Appl Genet,2004,108(8):1620-1626.
[13]Chen J P,Ge X H,Yao X C,et al.Genome affinity and meiotic behaviour in trigenomic hybrids and their doubled allohexaploids between three cultivatedBrassicaallotetraploidsandB.fruticulosa[J].Genome,2012,55(2):164-171.
[14]Gaeta R T,Pires J C.Homoeologous recombination in allopo-lyploisd:the polyploidy ratchet [J].New Phytol,2009,186:18-28.
[15]Ge X H,Li Z Y.Intra- and intergenomic homology of B-genome chromosomes in trigenomic combinations of the cultivatedBrassicaspecies revealed by GISH analysis [J].Chromosome Res, 2007,15:849-861.
[16]Ramsey J,Schemske D W.Neoplolyploidy in flowering plants [J].Annu Rev Ecol Syst,2002,33:589-639.
Insituhybridization analysis on meiosis ofBrassicanapusandBrassicanigraamphiploids
CHEN Jipeng,LI Shengqiang,LIU Xianjun,QUE Zhiqun
(CollegeofLifeScienceEnvironmentandResource,YichunUniversity,Yichun,Jiangxi336000,China)
【Objective】 This study investigated the relationship between abnormal meiosis and pollen fertility of plant hybrid offspring. 【Method】 Trigenomic amphiploids betweenBrassicanapusandBrassicanigrawere obtained by interspecific hybridization and genome doubling.Genomicinsituhybridization (GISH) was carried out to observe chromosome behavior in meiosis of pollen mother cells (PMC) of the amphiploids.【Result】 Pollen fertility of the amphiploids was determined and majority of pollen grains was sterile with fertile ratio of 10%-20%.Multivalents were formed as quadrivalents and hexavalents at diakinesis.The quadrivalents included autosyndetic quadrivalents of B genome,AC genomes and allosyndetic quadrivalents betwee B and AC genomes.The hexavalents also appeared in amphiploids at very low frequencies.Total chromosomes were segregated equally at about 70% PMCs at anaphase Ⅰ.At the end of second stage of meiosis,non-tetrads and micro-nucleus were also observed.Some abnormalities including chromosome bridges and laggards were observed at low frequency in some PMCs at anaphase Ⅱ/Ⅱ.【Conclusion】 The non-diploidized cytological behavior of these amphiploids contributed to their low fertility.Although abnormal meiosis decreased pollen fertility,heterologous recombination improved exchange of genetic materials between parents.
Brassicanapus;Brassicanigra;meiosis;genomicinsituhybridization; male sterility
时间:2016-09-0709:02DOI:10.13207/j.cnki.jnwafu.2016.10.007
2015-04-15
国家自然科学基金项目(31460357);江西省科技支撑项目(20141BBF60010);江西省自然科学基金项目(20151BAB204026)
陈纪鹏(1974-),男,河南西平人,副教授,博士,主要从事油菜远缘杂交和细胞遗传研究。
E-mail:chensi20020606@163.com
S565.403.51
A
1671-9387(2016)10-0045-06
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160907.0902.014.html

