基于SSR荧光标记的吉单系列玉米品种遗传分析
刘文国,张志军,赵万庆,杨伟光,路 明
(1 吉林农业大学 农学院,吉林 长春 130118;2 吉林省农业科学院 玉米研究所/玉米国家工程实验室(长春),吉林 公主岭136100)
基于SSR荧光标记的吉单系列玉米品种遗传分析
刘文国1,2,张志军2,赵万庆2,杨伟光1,路明2
(1 吉林农业大学 农学院,吉林 长春 130118;2 吉林省农业科学院 玉米研究所/玉米国家工程实验室(长春),吉林 公主岭136100)
【目的】 利用分子标记技术对吉单系列玉米品种亲本自交系的遗传关系进行剖析,为今后自交系类群划分和杂交种组配奠定基础。 【方法】 利用49对SSR荧光标记对2000-2009年审定的吉单系列玉米品种亲本自交系进行分析,根据Nei’s遗传距离,利用UMGMA 聚类法和主成分分析法进行分析。【结果】 49对标记在65份自交系间共检测出340个等位基因变异,每对引物检测出3~12个等位基因,平均6.94个,平均多态性信息量0.601,平均基因多样性指数0.644。Nei’s遗传距离变化于0.15~2.26,平均1.05。将65份自交系划分为Reid群、兰卡斯特、PB、四平头、旅大红骨、Volga和其他等7个类群,其中以Reid群、兰卡斯特、四平头、PB和Volga这5个类群为主。主要应用的杂种优势模式有Reid群×四平头群、兰卡斯特群×四平头群、Reid群×Volga群、兰卡斯特群×PB群、Reid群×兰卡斯特群和Reid群×PB群等6种,尤其以Reid群×四平头群、兰卡斯特群×四平头群和Reid群×Volga群这3种杂种优势模式占优势。确定了以吉V022、吉V993为代表的欧洲Volag种质与我国的Reid群、兰卡斯特、四平头等类群存在距离,并独立成群,建立了Reid群×Volga和四平头群×Volga 2个新的杂种优势模式,育成吉单519、吉单535、吉单522、吉单505、吉单517等一系列玉米品种并大面积推广应用。【结论】 2000-2009年的吉单系列玉米品种具有较丰富的遗传多样性,在涵盖我国主要玉米类群的基础上,还具有Volag这一独特类群。
吉单系列玉米;SSR荧光标记;遗传基础
吉林省是我国重要的玉米主产区,2013年玉米种植面积和产量分别占全国的9.7%和12.7%,单产水平位于全国首位。因此,提高该地区的玉米产量和品质对保障国家粮食安全具有重要意义。在过去的几十年里,吉单(四单)系列品种如吉单101、四单8、吉单131、吉单180、吉单159、四单19、吉单209、吉单27等均为吉林省不同时期的代表性品种,为吉林省粮食生产做出了巨大贡献。但近十年来,吉林省玉米市场逐渐受到来自国外公司品种先玉335的冲击[1-2],对吉林省乃至我国的玉米产业带来巨大挑战和深刻影响,我国的玉米新品种培育陷入了种质遗传基础薄弱的瓶颈。而以美国为代表的玉米育种发达国家,早已开展了对已推广玉米品种的回顾性研究,这可为进一步发掘新品种遗传潜力及提高产量能力提供参考和指导。因此,开展玉米品种的种质遗传基础研究对今后确定育种策略和路线具有重要意义。
在国外,对玉米商业化杂交种的遗传背景研究比较深入。Mikel[3-4]分析了2004-2008年商业杂交种的遗传背景,包括孟山都、杜邦先锋和先正达等种业公司的杂交种,对305个亲本自交系进行研究,分析了商业杂交种在现代商业育种中的贡献,以及母本群和父本群的遗传基础及变化趋势等。在国内,吴景锋[5]、曾三省[6]、王懿波等[7]基于系谱法对我国的玉米种质基础进行了研究;郭海鳌等[8]、焦仁海等[9-10]、王敏等[11]对吉林省不同时期主要玉米杂交种的遗传基础进行了研究,但缺乏吉单系列玉米品种的系统性研究,尤其对于2000年后玉米品种的遗传基础进行研究更具有现实意义。
分子标记技术的发展为玉米自交系的遗传关系研究提供了新的手段。国内外的研究均已证实,利用分子标记可有效地对玉米自交系进行遗传变异分析及类群划分[12-13],尤其是SSR标记因具有共显性、高度重复性、多态性好、稳定可靠以及经济方便等优点更适合用来进行分析[12-21]。但传统的SSR标记技术用PAGE胶分离银染检测耗时、耗力、非自动化,在大规模、多批次的数据收集和分析时不适用,不能满足现代规模化分子育种的要求。荧光标记毛细管电泳检测技术因具有高效、自动化的优点,实现了SSR标记与高效、自动化技术的结合[22],并已经应用于研究中[23-25]。
本研究基于SSR荧光标记检测技术,对2000-2009年审定的吉单系列玉米品种的亲本自交系进行基因型分析,剖析该阶段种质的遗传基础,可为今后玉米自交系的改良与利用及育种技术路线的确立提供理论依据。
1 材料与方法
1.1供试材料
选择2000-2009年育成的吉单系列玉米品种的亲本自交系共59份,另外以代表我国玉米核心种质的6个骨干自交系黄早四(四平头群)、掖478(PA群)、B73(BSSS)、Mo17(Lancaster群)、齐319(PB群)和丹340(旅大红骨)为标准测验种,共计65份自交系(表1),均由吉林省农业科学院玉米研究所提供。

表 1 供试玉米自交系及来源Table 1 Tested maize inbred lines and their origins

表 1(续) Continued table 1

表 1(续) Continued table 1
1.2SSR引物
按照扩增条带清晰、多态性丰富、扩增带型稳定、在染色体上均匀分布的原则筛选49对SSR标记(表2),SSR标记的5′端分别用Hex、6-Fam、Ned 等进行荧光标记,供试标记由中美泰和生物技术(北京)有限公司合成。
1.3试验方法
1.3.1DNA的提取将供试玉米自交系种子种植于苗盘,待长至3~5 叶期时采集叶片,采用CTAB法提取并纯化DNA[26],经紫外分光光度计检测DNA 的品质和质量浓度,并将DNA 质量浓度稀释至10 ng/μL,备用。
1.3.2PCR扩增(1)PCR反应体系。采用10 μL 的扩增反应体系,其中含1×PCR Buffer(含2 mmol/L Mg2+)、25 μmol/L dNTP、0.4 UTaqDNA 聚合酶、2.4 mmol/L 正反向引物、25 ng DNA 模板。
(2)PCR 反应条件。DNA 预变性5 min;94 ℃变性45 s,60 ℃退火45 s,72 ℃ 1 min,35 个循环;72 ℃终延伸5 min,4 ℃保存。不同引物选择适宜的退火温度。
1.3.3扩增产物的变性和荧光检测向96 孔板中,分别加入1~2 μL 纯化的PCR 产物,9 μL 甲酰胺和0.12 μL内标,3 000 r/min 离心1 min。于PCR 仪上95 ℃变性5 min,立即置于冰上。在ABI3730XL DNA 分析仪上完成自动荧光检测。
1.4数据分析方法
1.4.1数据读取利用GeneScan 和Genotyper 软件进行数据收集与图像分析。
1.4.2遗传参数分析利用PowerMarker V3.25软件[27]对数据进行遗传参数分析,计算等位基因数(number of alleles)、基因多样性指数(gene diversity,D)和多态性信息量(PIC)。
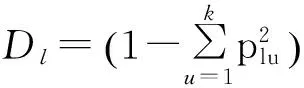
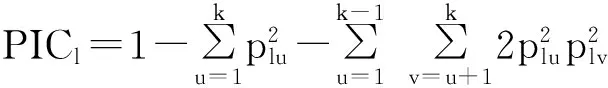
式中:plu为第l个位点第u个等位变异的频率,k为等位变异数,plv为第l个位点第v个基因型的频率,v为基因型。
1.4.3遗传距离聚类分析利用PowerMarker V3.25软件[27]计算Nei’s(1972年)遗传距离。
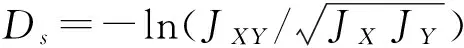

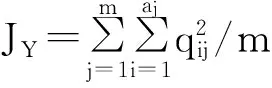
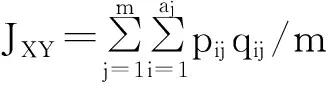
式中:pij、qij分别为两群体在第j位点第i个等位变异的频率,aj是在j位点的等位变异数,m是检测位点总数。
按UMGMA法进行聚类分析,用MEGA3.1[28]绘制种群间的聚类图。
1.4.4主成分分析基于Nei’s 遗传距离,利用NTSYS-pc2.11软件进行主成分分析,并绘制二维、三维空间聚类图。
2 结果与分析
2.165份玉米自交系的SSR标记
表2结果表明,49对SSR荧光标记共检测出340个等位基因变异,每个标记检测出3~12个等位基因,平均6.94个。phi96100的等位基因变异最丰富(12个),phi073、phi014标记的等位基因变异丰富度最低(3个)。每个标记的多态性信息量(PIC)在0.289~0.850,平均0.601,其中标记phi064的PIC最大(0.850),而umc1061的PIC最低(0.289)。基因多样性指数在0.335~0.865,平均0.644。表明所选的标记绝大多数都具有较好的多态性。

表 2 49个标记在65份玉米自交系之间扩增的遗传多样性统计结果Table 2 Summary of genetic diversity of 49 SSRs markers detected in 65 maize inbred lines

表 2(续) Continued table 2
2.265份玉米自交系的遗传距离和聚类分析
对49个SSR 标记的340个等位基因变异进行计算,65份玉米自交系的遗传距离在0.15~2.26,平均为1.05,72.6%集中于0.8~1.4(图1)。按照UMGMA 法对65份玉米自交系进行遗传距离聚类,依据聚类结果可分成6个类群和1个其他群(图2),结合各聚类群中是否含有不同种质类群的代表性自交系来确定类群的名称。类群1(Group 1,G1)为Reid群,包含PA和BSSS,主要有B73、掖478、铁7922、C8605、9046等24份自交系,占自交系总数的36.92%。类群2(Group 2,G2)为兰卡斯特群,主要有Mo17、W9706、吉1037、合344、四-144等14份自交系,占自交系总数的21.54%。类群3(Group 3,G3)为PB群,主要有齐319、599-20-1、673等8份自交系,占自交系总数的12.54%。类群4(Group 4,G4)为四平头群,主要有黄早四、吉853、四-287等6份自交系,占自交系总数的9.23%。类群5(Group 5,G5)为旅大红骨群,主要有丹340、A415、GY349等4份自交系,占自交系总数的6.15%。类群6(Group 6,G6)是来源于欧洲的Volga种质,从中选育出吉V022、吉V993等3份自交系,独立成群。此外,还有丹598、956-34、中106、综31、H10、西公等6份自交系不能归属到这6个类群中,这些自交系均具有混合、外来或综合种等复杂的遗传背景。
在这65份玉米自交系中,有50份自交系具有明确的系谱信息,将聚类结果与系谱关系进行对比,有46份自交系符合,1份自交系(J9206)不符,3份(B467、428和丹598)因含有地方种质或血缘复杂,不能从系谱关系上明确其具体归属。
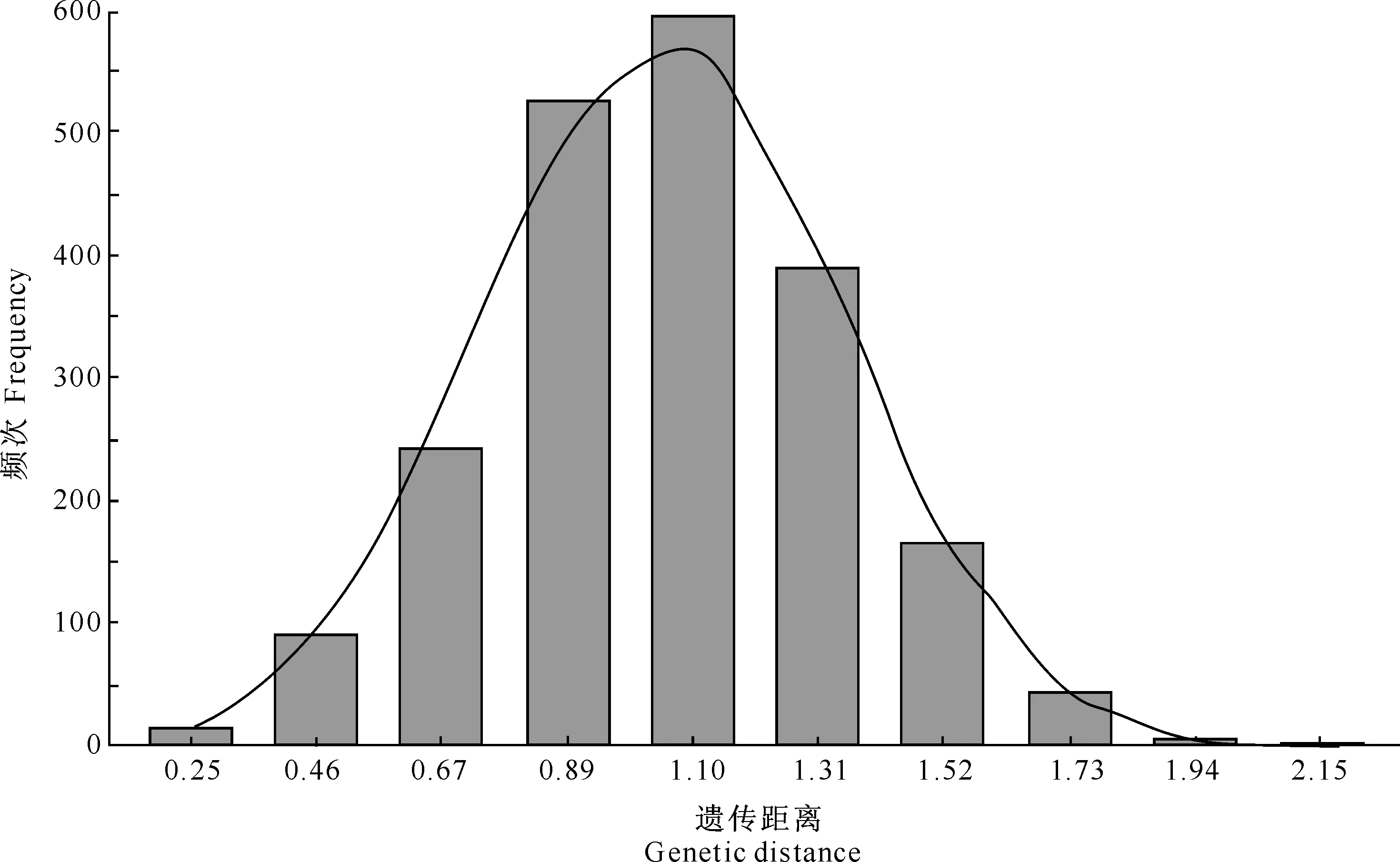
图 1 65份玉米自交系的Nei’s遗传距离的频次分布Fig.1 Distribution of pairwise Nei’s genetic distance calculated for 65 maize inbred lines genotyped with 49 SSR markers
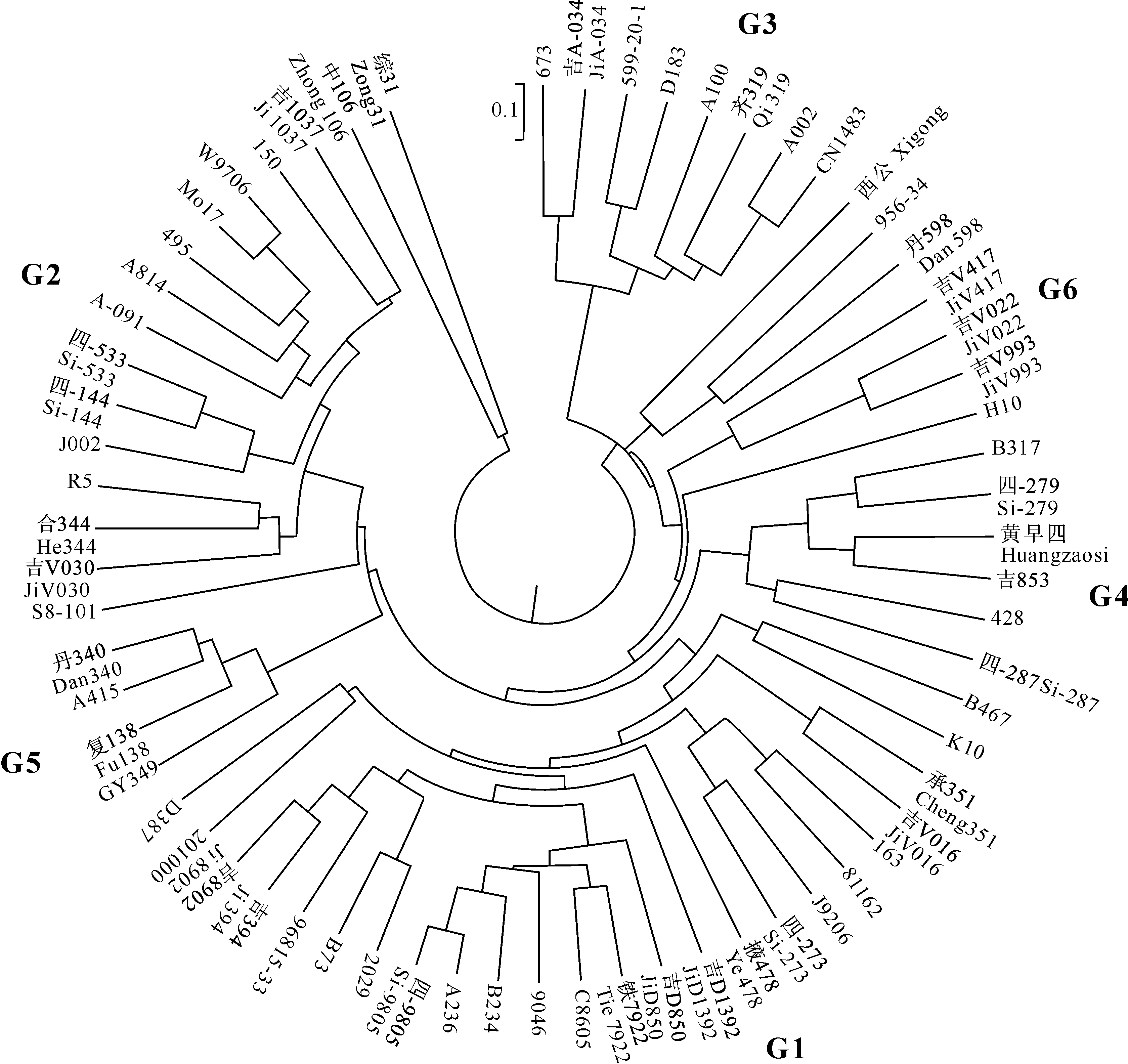
图 2供试玉米自交系的UPGMA 聚类树
Fig.2UPGMA tree for tested maize inbred lines
2.365份玉米自交系的主成分分析
基于Nei’s(1972)遗传距离进行主成分分析,前2个主成分可解释等位基因变异的42.03%,在由PC1(23.56%)和PC2(18.47%)做出的二维图(图3)中,根据各玉米自交系的集中程度,可清楚地鉴定出Reid群(G1)、兰卡斯特群(G2)、PB群(G3)、旅大红骨群(G5)这4个类群,而四平头群(G4)和Volga群(G6)集中度不够,不能明显鉴定,如四平头群自交系较为分散,黄早四与吉853等其他自交系具有较远距离。
利用三维图能更好地揭示65份玉米自交系类群的划分,前3个主成分可解释等位基因变异的58.38%,在由PC1(23.56%)、PC2(18.47%)和PC3(16.35%)做出的三维图(图4)中,可清楚地鉴定出Reid群(G1)、兰卡斯特群(G2)、PB群(G3)、四平头群(G4)、旅大红骨群(G5)和Volga群(G6)这6个类群。
2.4玉米育成品种的种质基础与杂种优势模式
对49份吉单系列玉米品种亲本自交系之间遗传距离的分析结果(表3)表明,亲本之间遗传距离在0.693~1.712,平均遗传距离为1.17,与65份自交系之间的遗传距离相比,高于其最小值,低于其最大值,平均值略高。这说明优良玉米品种的育成与其亲本间遗传距离只在一定范围内存在正相关。
根据本研究划分的类群,对这49份品种进行杂种优势的划分,结果见表3。由表3可以看出,49份吉单系列玉米品种中有31个品种的亲本含有Reid群(G1)种质,占63.27%;17个品种的亲本含有兰卡斯特(G2)种质,占34.69%;11个品种的亲本含有PB(G3)种质,占22.45%;16个品种的亲本含有四平头(G4)种质,占32.65%;4个品种的亲本含有旅大红骨(G5)种质,占8.16%;8个品种的亲本含有Volga(G6)种质,占16.33%。表明育成品种主要应用Reid群、兰卡斯特、四平头、PB和Volga这5类种质。

图 3 基于49个SSR标记的65份玉米自交系的二维PCA分析 1~65代表的玉米自交系同表1,图4同Fig.3 2D principal component analysis (PCA) of 65 maize inbred lines genotyped with 49 SSR markers 1-65 represent maize inbred line same as Table 1,the same for Fig.4

图 4 基于49个SSR标记的65份玉米自交系的三维PCA分析Fig.4 3D principal component analysis (PCA) of 65 maize inbred lines genotyped with 49 SSR markers
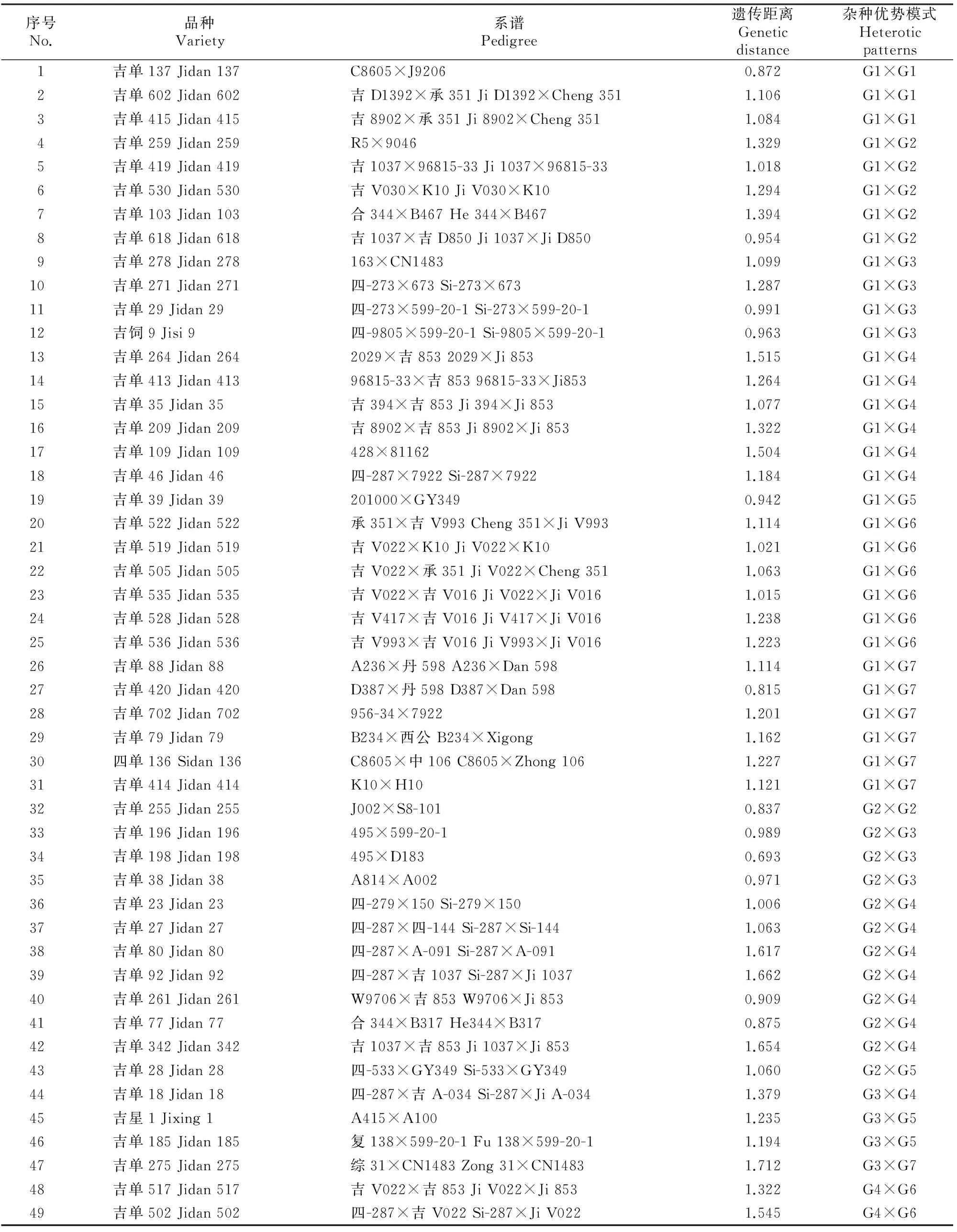
表 3 吉单系列玉米品种的亲本遗传距离和杂种优势模式Table 3 Genetic distances and heterotic patterns for parents of Jidan maize varieties
注:G1代表Reid群,G2代表兰卡斯特群, G3代表PB群,G4代表四平头群,G5代表旅大红骨群,G6代表Volga群,G7代表其他种质。
Note:G1 indicates Reid,G2 indicates Lancaster,G3 indicates PB,G4 indicates SPT,G5 indicates Lüda red cob,G6 indicates Volga,and G7 indicates others.
除个别品种的杂种优势模式相同外,应用的杂种优势模式共有13种(表3),其中Reid群与其他各群均构成杂种优势模式。根据育成品种的数量和在生产上的应用情况,主要应用的杂种优势模式有6种:(1)Reid群×四平头群:育成品种6个,代表品种有吉单209、吉单35、吉单264;(2)兰卡斯特群×四平头群:育成品种7个,代表品种有吉单27、吉单342、吉单261;(3)Reid群×Volga群:育成品种6个,代表品种有吉单519、吉单535、吉单522、吉单505;(4)兰卡斯特群×PB群:育成品种3个,代表品种有吉单198、吉单196;(5)Reid群×兰卡斯特群:育成品种5个,代表品种有吉单103、吉单259;(6)Reid群×PB群:育成品种4个,代表品种有吉单29、吉饲9。其中,以Reid群×四平头群、兰卡斯特群×四平头群和Reid群×Volga群这3种杂种模式占优势。
3 讨 论
3.1关于SSR荧光标记分析
供试自交系和标记的类型、数量对于揭示遗传变异具有重要作用。本研究利用毛细管电泳检测技术以49对SSR荧光引物对65份玉米自交系进行了分析,共检测出340个等位基因变异,每对引物检测出3~12个等位基因,平均6.94个,每个标记的多态性信息量(PIC)为0.289~0.850,平均为0.601。其中,每对引物平均检测等位基因6.94个,高于国内同类研究的3.88[14]和5.74[19],而在李新海等[14]和吴承来等[19]研究中所用的SSR标记分别为64个和112个,自交系分别为70个和97个,数量均比本研究多,这说明利用毛细管电泳技术的分辨率更高,能检测到更多的等位基因。前人也揭示了毛细管电泳荧光检测法因具有高通量、高效率、数据精确、检测系统灵敏等优点而优于传统的变性PAGE 银染检测法[22]。
分子标记数据也准确揭示和验证了自交系间的亲缘关系,特别是杂交种的二环选系与其亲本自交系的遗传关系,同时将系谱来源不明或血缘不清的自交系划分到了相应类群中。本研究中,在有具体系谱记载的50份玉米自交系中,92%的自交系划分结果与其记载的系谱一致;6%(B467、428和丹598)的自交系因含有地方种质或血缘复杂,从系谱记载上不能明确亲缘关系,而在本研究中得到了明确;仅有2%(J9206)与系谱记载不一致,系谱记载显示其来自444×丹黄02,而在本研究中划入Reid群,这还需要进一步分析和确认。对于来自不同类群的杂交种二环选系A814(419×4112)、四-533(8112×416)、GY349(5003×340)等自交系也明确了其所属类群。此外,也确认了96815-33、承351、四-144、R5、S8-101、CN1483、复138等外引系和杂交种选系的类群归属。
3.2欧洲Volga种质的地位和应用
扩大种质的遗传基础对于提高玉米育种水平具有重要意义。本研究对以吉V022、吉V993为代表的欧洲Volag种质进行聚类划分,首次表明其与我国的Reid群、兰卡斯特、四平头等主要类群存在距离,并独立成群。该类自交系是1992年以地理远缘的欧洲早熟、耐密、脱水快种质(Volga)为选育基础材料,同时注意克服欧洲材料不抗叶斑病、茎腐病等缺点,经多代自交选育而成的适于吉林省早熟生态条件的优良自交系,具有耐密、秆强、脱水快、配合力高等特点,拓宽了东北早熟春玉米区种质基础,成为东北早熟春玉米区骨干系,建立了Reid群×Volga和四平头群×Volga 2个杂种优势模式,育成吉单519、吉单535、吉单522、吉单505、吉单517等一系列玉米品种并进行了大面积推广应用,其中吉单519获得2011年吉林省科技进步一等奖,吉单535、吉单522、吉单505、吉单517分别获得2014年、2013年、2009年吉林省科技进步二等奖。
3.3吉单系列玉米品种的遗传基础
本研究用49对SSR荧光标记对59份吉单系列玉米品种亲本自交系进行分析,结果表明2000-2009年应用的玉米自交系可聚类分成Reid、兰卡斯特、PB、四平头、旅大红骨、Volga和其他等7个类群,涵盖了焦仁海等[10]分析的2000-2003年吉林省生产上主要应用的改良Reid、旅大红骨、塘四平头、Mo17亚群、P 群、综合种选系等类群,其中综合种选系属于本研究中的其他群,如综31等,而Volga类则未体现,这是因为Volga类群选育的具有影响力的品种如吉单519、吉单535都是在2005年、2006年审定,同时这类种质也是吉林省农业科学院专有种质,在吉林省其他育种单位未大面积推广应用。对于丹598类种质,本研究中不能将其聚类到其他类群中,而仅有956-34与其具有较近的遗传距离,这与其遗传基础较为复杂有关。陈刚等[29]研究表明,丹598具有8个自交系的遗传因子,其中OH43、丹340、丹黄11中长la、哈24、PEA、黄早四等各占9.375%,丹黄02占18.75%,丹黄18占25%。前人利用分子标记技术也表明丹598聚类结果不尽相同,可划分到旅大红骨、兰卡斯特、PB群、四平头等类群中[25,30-32]。这7个类群也涵盖了刘志斋等[25]对我国玉米自交系类群的划分(兰卡斯特、旅大红骨、塘四平头、瑞德与P 群)。Reid类群也被细分为BSSS 与PA[14,17],然而有研究证明这2个类群之间的遗传关系较近[13],所以本研究中将BSSS与PA合并为Reid群。
杂种优势群的鉴定与杂种优势模式原理对选育新型自交系或杂交组合具有重要指导意义[14]。本研究表明,2000-2009年吉单系列玉米品种主要应用Reid群、兰卡斯特、四平头、PB和Volga这5类种质,主要应用的杂种优势模式有Reid群×四平头群、兰卡斯特群×四平头群、Reid群×Volga群、兰卡斯特群×PB群、Reid群×兰卡斯特群和Reid群×PB群,尤其以Reid群×四平头群、兰卡斯特群×四平头群和Reid群×Volga群这3种杂种模式占优势。兰卡斯特群×四平头群是吉林省较有生命力的杂种优势模式,该模式自1984年就在吉林省生产上应用,这与东北地区易于高发玉米丝黑穗病有关,兰卡斯特类群种质对丝黑穗病具有较强的抗性[33]。其代表品种主要有吉单180、四单19、吉单27等,2002年选育的吉单27自2005年起连续11年成为农业部主导品种,2007年获得吉林省科技进步一等奖。Reid群×Volga群则是吉单系列品种的独特杂种优势模式,培育的吉单519、吉单535、吉单522、吉单505等在生产上得到了大面积推广应用。
3.4今后的育种策略
随着先玉335的大面积推广,吉林省玉米育种面临着前所未有的竞争压力,大量应用美国等外来玉米种质,放弃了国内种质的改良和利用,导致育出的修饰性、模仿性品种多,低水平重复的多,有突破性的原始创新品种少,遗传基础更加脆弱。本研究立足于2000-2009年吉单系列品种的亲本自交系,既是对“十五”、“十一五”期间吉林省农业科学院育种材料遗传基础的总结,也是今后育种的材料基础。Reid群、兰卡斯特、四平头、PB、Volga、旅大红骨等类群种质经过几十年的改良,融合了配合力高、抗病、适应性强等优良基因,如四平头群是我国特有种质,一般配合力较高,叶片窄短上冲,株型半紧凑,灌浆速度快,花粉量大,散粉集中,硬粒,结实性好,综合抗病性好。因此,以这些种质为基础,以本土化的杂种优势模式为核心,以今后我国玉米生产发展方向为目标,充分融合早熟、脱水快、耐密植、适应机械化等外来种质,从而实现种质改良和创新是今后的育种策略。
4 结 论
2000-2009年吉单系列玉米品种具有较丰富的遗传多样性。65份自交系可划分为Reid群、兰卡斯特、四平头、PB、Volga、旅大红骨和其他等7个类群,其中以Reid群、兰卡斯特、四平头、PB和Volga这5个类群为主。主要应用的杂种优势模式有Reid群×四平头群、兰卡斯特群×四平头群、Reid群×Volga群、兰卡斯特群×PB群、Reid群×兰卡斯特群和Reid群×PB群等6种,尤其以Reid群×四平头群、兰卡斯特群×四平头群和Reid群×Volga群这3种杂种模式占优势。在涵盖我国主要玉米类群的基础上,确定了以吉V022、吉V993为代表的欧洲Volag种质这一独特类群,与我国的Reid群、兰卡斯特、四平头等类群存在距离,建立了Reid群×Volga和四平头群×Volga 2个新的杂种优势模式。
[1]张亚辉,陈亚芹,王迎春,等.先玉335对吉林省玉米产业发展的机遇与挑战 [J].玉米科学,2014,22(2):66-69.
Zhang Y H,Chen Y Q,Wang Y C,et al.Impact of Xianyu 335 on corn industrial development in Jilin province [J].Journal of Maize Sciences,2014,22(2):66-69.
[2]吴晋源,侯有良,卢保红,等.先玉335应用对我国玉米产业技术的影响 [J].山西农业科学,2013,41(3):304-306.
Wu J Y,Hou Y L,Lu B H,et al.Effect of Xianyu 335 application on maize industrial technology system in China [J].Journal of Shanxi Agricultural Sciences,2013,41(3):304-306.
[3]Mikel M A.Availability and analysis of proprietary dent corn inbred lines with expired US plant variety protection [J].Crop Sci,2006,46:2555-2560.
[4]Mikel M A.Genetic composition of contemporary US commercial dent corn germplasm [J].Crop Sci,2011,51:592-599.
[5]吴景锋.我国主要玉米杂交种种质基础评述 [J].中国农业科学,1983,16(2):1-8.
Wu J F.A review on the germplasm bases of the main corn [J].Scientia Agricultura Sinica,1983,16(2):1-8.
[6]曾三省.中国玉米杂交种的种质基础 [J].中国农业科学,1990,23(4):1-9.
Zeng S S.The maize germplasm base of hybrids in China [J].Scientia Agricultura Sinica,1990,23(4):1-9.
[7]王懿波,王振华,陆利行,等.中国玉米种质基础、杂种优势群划分与杂优模式研究 [J].玉米科学,1998,6(1):9-13,28.
Wang Y B,Wang Z H,Lu L X,et al.Studies on maize germplasm base,division of heterosis groups and utilizing models of heterosis in China [J].Maize Science,1998,6(1):9-13,28.
[8]郭海鳌,王玉杰,盖儒学,等.吉林省玉米种质类群分析及其扩增与改良 [J].作物杂志,1998(增刊):55-59.
Guo H A,Wang Y J,Gai R X,et al.Analysis and improvement on maize germplasm base in Jilin province [J].Crops,1998(Sup):55-59.
[9]焦仁海,李凤任,孙发明,等.吉林省主要玉米杂交种系谱分析 [J].吉林农业科学,1999,24(1):32-35.
Jiao R H,Li F R,Sun F M,et al.Analysis of main maize varieties pedigree in Jilin province [J].Journal of Jilin Agricultural Sciences,1999,24(1):32-35.
[10]焦仁海,王绍萍,孙发明,等. 吉林省玉米种质基础的分析与归纳 [J].玉米科学,2006,14(1):21-25.
Jiao R H,Wang S P,Sun F M,et al.Analysis and induction on maize germplasm base in Jilin province [J].Journal of Maize Sciences,2006,14(1):21-25.
[11]王敏, 张洪伟,岳尧海,等. 近二十年吉林省玉米种质基础及杂优模式浅析 [J].吉林农业科学,2012,37(1):27-31.
Wang M,Zhang H W,Yue R H,et al.Analysis of germplasm basis and heterosis model of maize of Jilin Province in the past twenty years [J].Journal of Jilin Agricultural Sciences,2012,37(1):27-31.
[12]Smith J S C,Chin E C L,Shu H,et al.An evaluation of the utility of SSR loci as molecular markers in maize (ZeamaysL.):Comparisons with data from RFLPs and pedigree [J].Theor Appl Genet,1997,95:163-173.
[13]袁力行,傅骏骅,张世煌,等.利用RFLP 和SSR 标记划分玉米自交系杂种优势群的研究 [J].作物学报,2001,27(2): 149-156.
Yuan L X,Fu J H,Zhang S H,et al.Heterotic grouping of maize inbred lines using RFLP and SSR markers [J].Acta Agronomica Sinica,2001,27(2):149-156.
[14]李新海,袁力行,李晓辉,等.利用SSR标记划分70 份我国玉米自交系的杂种优势群 [J].中国农业科学,2003,36(6): 622-627.
Li X H,Yuan L X,Li X H,et al.Heterotic grouping of 70 maize inbred lines by SSR markers [J].Scientia Agricultura Sinica, 2003,36(6): 622-627.
[15]Smith J S C,Duvick D N,Smith O S,et al.Changes in pedigree backgrounds of pioneer brand maize hybrids widely grown from 1930 to 1999 [J].Crop Sci,2004,44:1935-1946.
[16]Nelson P T,Coles N D,Holland J B,et al.Molecular characterization of maize inbreds with expired U S plant variety protection [J].Crop Sci,2008,48:1673-1685.
[17]Xie C X,Warburton M,Li M S,et al.An analysis of population structure and linkage disequilibrium using multilocus data in 187 maize inbred lines [J].Mol Breed,2008,21:407-418.
[18]Lu Y,Yan J,Guimaraes C,et al.Molecular characterization of global maize breeding germplasm based on genome-wide single nucleotide polymorphisms [J].Theor Appl Genet,2009,120:93-115.
[19]吴承来,张倩倩,董炳雪,等.我国部分玉米自交系遗传关系和遗传结构解析 [J].作物学报,2010,36(11): 1820-1831.
Wu C L,Zhang Q Q,Dong B X,et al.Analysis of genetic structure and genetic relationships of partial maize inbred lines in China [J].Acta Agronomica Sinica,2010,36(11):1820-1831.
[20]Lu H,Bernardo R.Molecular marker diversity among current and historical maize inbreds [J].Theor Appl Genet,2001,103:613-617.
[21]Li Y,Du J,Wang T,et al.Genetic diversity and relationships among Chinese maize inbred lines revealed by SSR markers [J].Maydica,2002,47:93-101.
[22]易红梅,王凤格,赵久然,等.玉米品种SSR标记毛细管电泳荧光检测法与变cPAGE银染检测法的比较研究 [J].华北农学报,2006,21(5):64-67.
Yi H M,Wang F G,Zhao J R,et al.Comparison of two maize SSR detection methods:Capillary electrophoresis with fluorescence detection method and denaturing PAGE silver staining detection method [J].Acta Agriculturae Boreali-Sinica,2006,21(5):64-67.
[23]刘晓鑫,谢传晓,赵琦,等.基于SSR荧光标记技术的玉米群体混合样本基因频率分析方法 [J].中国农业科学,2008,41(12):3991-3998.
Liu X X,Xie C X,Zhao Q,et al.Establishment of fluorescent SSR technique on detecting allelic frequency in maize (ZeamaysL.) populations with bulk sampling strategy [J].Scientia Agricultura Sinica,2008,41(12):3991-3998.
[24]雍洪军,张世煌,张德贵,等.利用SSR荧光标记分析90个糯玉米地方品种的遗传多样性 [J].玉米科学,2009,17(1):6-12.
Yong H J,Zhang S H,Zhang D G,et al.Analysis of genetic diversity among 90 waxy corn landraces using fluorescent SSR markers [J].Journal of Maize Sciences,2009,17(1):6-12.
[25]刘志斋,吴迅,刘海利,等.基于40个核心SSR 标记揭示的820份中国玉米重要自交系的遗传多样性与群体结构 [J].中国农业科学,2012,45(11):2107-2138.
Liu Z Z,Wu X,Liu H L,et al.Genetic diversity and population structure of important Chinese maize inbred lines revealed by 40 core simple sequence repeats (SSRs) [J].Scientia Agricultura Sinica,2012,45(11):2107-2138.
[26]Saghai-Maroof M A,Soliman K M,Jorgenson R,et al.Ribosomal DNA spacer length polymorphisms in barley:Mendelian inheritance,chromosomal location and population dynamics [J].Proceedings of the National Academy of Science of the USA,1984,81:8014-8018.
[27]Liu K J,Muse S V.PowerMarker:an integrated analysis environment for genetic marker analysis [J].Bioinformatics,2005,21(9):2128-2129.
[28]Kumar S,Tamura K,Nei M.MEGA3:An integrated software for molecular evolutionary genetics analysis and sequence alignment [J].Brief Bioinform,2004,5:150-163.[29]陈刚,王孝杰,孙义,等.多抗、高配合力玉米自交系丹598的选育技术研究 [J].玉米科学,2003,11(4):34-38.
Chen G,Wang X J,Sun Y,et al.Breeding and application on the multiple resistances,high combining ability inbred line of maize Dan598 [J].Journal of Maize Sciences,2003,11(4):34-38.
[30]黎裕,王天宇.我国玉米育种种质基础与骨干亲本的形成 [J].玉米科学,2010,18(5):1-8.
Li Y,Wang T Y.Germplasm base of maize breeding in China and formation of foundation parents [J].Journal of Maize Sciences, 2010,18(5):1-8.
[31]肖木辑,李明顺,李新海,等.东北地区主要玉米自交系的SSR遗传多样性分析 [J].华北农学报,2006,21(增刊):23-27.
Xiao M J,Li M S,Li X H,et al.Genetic diversity of maize inbred lines revealed by SSR in northeast provinces [J].Acta Agriculturae Boreali-Sinica,2006,21(Sup):23-27.
[32]吴金凤,宋伟,王蕊,等.利用SNP标记对51 份玉米自交系进行类群划分 [J].玉米科学,2014,22(5):29-34.
Wu J F,Song W,Wang X,et al. Heterotic grouping of 51 maize inbred lines by SNP markers [J].Journal of Maize Sciences,2014,22(5):29-34.
[33]王振华,李新海,鄂文弟,等.玉米抗丝黑穗病种质鉴定及遗传研究 [J].东北农业大学学报,2004,35(3):261-267.
Wang Z H,Li X H,E W D,et al.Germplasm identification and genetics study of resistance to head smut in maize [J].Journal of Northeast Agricultural University,2004,35(3):261-267.
Genetic analysis of Jidan maize varieties using fluorescent SSR markers
LIU Wenguo1,2,ZHANG Zhijun2, ZHAO Wanqing2, YANG Weiguang1, LU Ming2
(1AgronomyCollege,JilinAgriculturalUniversity,Changchun,Jilin130118,China;2MaizeResearchInstitute,JilinAcademyofAgriculturalSciences/NationalEngineeringLaboratoryforMaize,Gongzhuling,Jilin136100,China)
【Objective】 Genetic relationship of Jidan maize inbred lines was analyzed using fluorescent molecular markers to provide basis for improvement and utilization of maize inbred lines in future.【Method】 In this study,49 fluorescent SSR markers were adopted in heterotic grouping of parent inbred lines from Jidan maize varieties between 2000 and 2009.According to Nei’s genetic distance,UPGMA and principal component analysis were conducted.【Result】 The 49 SSR markers detected 340 alleles among 65 tested inbred lines.The average number of alleles per SSR locus was 6.94 with a range from 3 to 12.The averaged polymorphism information content (PIC) and gene diversity were 0.601 and 0.644,respectively.The Nei’s genetic distance ranged from 0.15 to 2.26 with an average of 1.05.The 65 inbred lines were divided into 7 clusters:Reid,Lancaster,PB,Sipingtou (SPT),Lüda red cob (LRC),Volga,and other.The first 5 clusters were widely used in Jidan maize varieties.The main heterosis patterns included Reid×SPT,Lancaster×SPT,Reid×Volga,Lancaster×PB,Reid×Lancaster and Reid×PB.The heterosis patterns with large proportion were Reid×SPT,Lancaster×SPT and Reid×Volga.The Volag cluster was firstly identified and independent from Reid,Lancaster and SPT.A series of maize varieties were widely used by establishment of two new heterotic patterns (Reid×Volga and SPT×Volga). 【Conclusion】 Jidan maize varieties between 2000 and 2009 showed clear genetic diversity,including Volag,which is unique based on main maize groups in China.
Jidan series maize;SSR marker;genetic base
时间:2016-09-0709:02DOI:10.13207/j.cnki.jnwafu.2016.10.005
2015-04-15
国家科技技撑计划项目(2014BAD01B01);吉林省自然科学基金项目(20130101110JC);吉林省农业科技创新工程项目
刘文国(1971-),男,黑龙江延寿人,研究员,主要从事玉米育种研究。E-mail:liuwenguo168@163.com
杨伟光(1960-),男,吉林梨树人,教授,博士生导师,主要从事玉米遗传育种研究。E-mail:ywg789@126.com
S513.023
A
1671-9387(2016)10-0025-12
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160907.0902.010.html

