抗鸭坦布苏病毒NS5蛋白单克隆抗体的制备及鉴定
杨国平,刁有祥,赵丹丹,陈 浩,提金凤,张 璐,张 英,李川川
(山东农业大学 动物科技学院,山东 泰安 271017)
抗鸭坦布苏病毒NS5蛋白单克隆抗体的制备及鉴定
杨国平,刁有祥,赵丹丹,陈浩,提金凤,张璐,张英,李川川
(山东农业大学 动物科技学院,山东 泰安 271017)
【目的】 制备抗鸭坦布苏病毒(Duck Tembusu virus,DTMUV)NS5蛋白的单克隆抗体。【方法】 将实验室保存的PET28a-NS5载体转化入Rosetta(DE3)感受态细胞中进行诱导表达,利用纯化的鸭坦布苏病毒NS5蛋白作为抗原免疫BALB/c小鼠,应用淋巴瘤细胞杂交技术结合有限稀释法制备单抗,并对单抗的特异性、反应性及其抗原表位和亚类进行鉴定。【结果】 筛选获得2株稳定分泌针对DTMUV 的NS5蛋白单抗的杂交瘤细胞,分别命名为A4D1和B4B8。此2株杂交瘤细胞诱导BALB/c小鼠的抗体效价均可达到1∶64 000。间接ELISA、Western blot和间接免疫荧光(IFA)检测结果表明,所获细胞分泌的抗体能与DTMUV及纯化的NS5蛋白发生特异性反应。经鉴定2株单抗的亚类均为IgG1型,通过叠加ELISA方法,初步判定2株单抗识别不同的抗原表位。【结论】 成功获得了抗鸭坦布苏病毒NS5蛋白的单克隆抗体,为研究NS5蛋白的功能奠定了基础。
鸭坦布苏病毒;NS5蛋白;单克隆抗体
2010年春夏之交,在我国江浙和山东等地区的鸭群中爆发了一种以产蛋率大幅下降、生长发育迟缓、卵巢出血为主要特征的急性传染病,之后其迅速传播到福建、江西、安徽、河南和河北等地区,给养鸭业造成了严重的经济损失[1-4]。经病毒分离鉴定证明,该病是由黄病毒科、黄病毒属、恩塔亚病毒群的坦布苏病毒(Tembusu virus,TMUV)引起的[5-7]。坦布苏病毒对蛋鸭及肉鸭均有致病力,感染鸭中以麻鸭最易感,其次是樱桃谷种鸭,番鸭也可感染[8-9]。感染坦布苏病毒后,肉鸭主要表现为精神沉郁、体温升高、生长缓慢、瘫痪等,蛋鸭最明显的症状为产蛋量急剧下降甚至停止;剖检发现脾脏肿大明显,肝脏出血严重时伴有针尖状白色点状坏死[10],蛋鸭还见卵泡出血,严重时变性坏死。
鸭TMUV是一种不分节段的单股正链RNA病毒,其基因组长约10.5 kb,编码核衣壳蛋白(C)、外膜蛋白(PrM和M)和囊膜蛋白(E)等3个结构蛋白及NS1、NS2A、NS2B、NS3、NS4A、NS4B和NS5[11]等7个非结构蛋白。其中NS5蛋白是坦布苏病毒编码最大的蛋白质,是黄病毒依赖RNA的RNA聚合酶,具有甲基转移酶和RNA依赖的RNA聚合酶活性,对病毒基因组的复制起关键作用[12-13]。
单克隆抗体是由单一B细胞克隆产生的高度均一、仅针对某一特定抗原表位的抗体,具有高特异性、均一性等优点,是研究病毒蛋白抗原表位及结构功能的重要基础工具。因而制备病毒相关蛋白的单克隆抗体,有利于进一步研究病毒蛋白的组织结构和功能,为疾病预防提供实验基础。本研究对DTMUV NS5基因进行了原核表达,并以NS5蛋白为免疫抗原免疫BALB/c小鼠,应用淋巴细胞杂交技术,成功筛选获得了2株稳定分泌抗DTMUV-NS5的单克隆抗体(Monoclonal Antibodies,McAbs),为研究坦布苏病毒NS5蛋白结构功能提供了基础工具。
1 材料与方法
1.1材料
1.1.1病毒、细胞株、血清及载体鸭坦布苏病毒、H9N2亚型禽流感病毒(AIV)、新城疫病毒(NDV)、鸭瘟病毒(DPV)、呼肠孤病毒(RV)、小鼠骨髓瘤细胞株(SP2/0)、293T细胞、小鼠抗DTMUV阳性血清和阴性血清、大肠杆菌Rosetta(DE3)感受态细胞及表达坦布苏病毒NS5蛋白的原核表达载体PET28a-NS5,均由山东农业大学禽病学研究室保存。
1.1.2试验动物5~6周龄的雌性BALB/c小鼠及10周龄经产的雌性BALB/c小鼠,购自山东省新药评价中心。
1.1.3主要试剂BCA蛋白质定量试剂盒,购自北京康为世纪生物科技有限公司;蛋白预染Marker、异硫氰酸荧光素(FITC)标记的羊抗鼠IgG抗体和胎牛血清(FBS),购自北京全式金生物技术有限公司;弗氏完全佐剂、弗氏不完全佐剂、细胞融合剂PEG(50 g/L)、HAT、HT试剂、小鼠单克隆抗体亚类鉴定试剂盒,均购自Sigma公司;DMEM完全培养基,购自Gibcol公司;辣根过氧化物酶(HRP)标记的羊抗鼠IgG抗体,购自北京鼎国昌盛生物技术有限责任公司;PVDF膜,购自Bio-RAD公司;正辛酸,购自Aladdin公司;超敏性辣根过氧化物酶DAB显色试剂盒,购自上海生工生物工程股份有限公司;2×YT培养基自制保存。
1.2DTMUV NS5蛋白抗原的制备
将PET28a-NS5原核表达载体转化入大肠杆菌Rosetta(DE3)感受态细胞,经PCR和基因测序鉴定后于2×YT培养基中培养2~3 h,待菌液OD600达到0.4~0.6时,加入IPTG使其终浓度为1 mmol/L,于37 ℃诱导培养6 h,超声(超声3 s、间歇2 s,共循环200次)裂解菌体,对蛋白存在形式做SDS-PAGE鉴定后,确定目的蛋白为包涵体蛋白,并利用尿素梯度纯化法对产生的包涵体蛋白进行纯化,使用SDS-PAGE技术检测蛋白的表达情况。纯化后的蛋白利用BCA蛋白质定量试剂盒对产生的NS5蛋白进行定量。将定量后的DTMUV的NS5蛋白与弗氏完全佐剂按照1∶1的体积比乳化作为抗原备用。
1.3小鼠免疫及细胞融合
参照刘玉斌等[14]的方法,选择5~6周龄健康的雌性BALB/c小鼠5只,用制备的抗原采取背部皮下多点注射法对小鼠首次免疫,免疫剂量为100 μg/只;第2、3次免疫时,将抗原与弗氏不完全佐剂按1∶1等体积乳化后,采用腹腔注射法接种小鼠,免疫剂量与首免剂量相同,相邻2次免疫间隔时间为14 d。三免后采集小鼠血清,检测抗体效价。选择抗体效价达到1∶6 400以上且效价最高的小鼠进行加强免疫,免疫剂量为不加佐剂的DTMUV NS5蛋白 100 μg/只,免疫方式为腹腔注射。3 d后取其脾脏,分离脾细胞,采用常规的PEG融合法[15]将其与对数生长期的小鼠骨髓瘤细胞(SP2/0)进行细胞融合。利用HAT筛选培养基对融合细胞进行筛选培养。
1.4单抗筛选间接ELISA方法的建立
采用方阵滴定法确定单抗筛选间接ELISA方法的抗原最佳包被量和抗体最佳工作浓度。将纯化的DTMUV的NS5抗原按照400 ng/孔加入细胞培养板,横排对其进行2倍倍比稀释,直到NS5抗原量为12.5 ng/孔,鼠抗DTMUV的阳性血清和阴性血清分别按照1∶10的体积比加入细胞培养板;竖排分别进行10倍倍比稀释操作,直到稀释度达 1∶10 000,同时设立SP2/0细胞培养上清(防止试验过程中的假阳性,排除试验干扰)及空白对照孔(加生理盐水)。用空白对照孔试液调零,紫外分光光度计测定阳性血清和阴性血清孔的OD450,分别记作P和N。选择阳性血清OD450的值接近于1.0,P/N≥2.1孔中P/N最大的孔的抗原包被和抗体稀释度为最佳的抗原包被量及抗体最佳稀释浓度。
1.5融合细胞的亚克隆化
待融合细胞长满96孔培养板孔底部面积的 1/2~3/4时,采用上述建立的间接ELISA方法检测细胞液上清抗体效价,反复检测2次后,挑选稳定分泌抗体的细胞,采用有限稀释法进行细胞亚克隆筛选,用上述方法反复筛选2~3次,直至筛选的细胞上清均为阳性,即可得到纯化的单克隆抗体细胞。
1.6DTMUV NS5单抗腹水的制备及效价测定
参照文献[16],选择10周龄经产的雌性BALB/c小鼠6只,每只腹腔注射灭菌的液体石蜡0.5 mL,7 d后腹腔注射筛选的杂交瘤细胞5×105个/只,注射7~10 d后小鼠的腹部明显膨大,此时抽取腹水,12 000 r/min离心10 min,除去大分子杂质,收集离心后的上清,采用建立的间接ELISA方法检测抗体效价。利用正辛酸-饱和硫酸铵法对腹水进行纯化,采用SDS-PAGE检测纯化效果,对纯化腹水进行1∶500倍比稀释后,用建立的间接ELISA方法对其抗体效价进行测定。并利用紫外分光光度计检测蛋白在260和280 nm的吸光值A260和A280,按照蛋白质浓度=1.45×A280-0.74×A260计算抗体浓度。纯化后的腹水于-80 ℃保存备用。
1.7DTMUV NS5单抗特异性和反应性的鉴定
1.7.1特异性分别用H9N2亚型AIV、NDV、DPV、RV及DTMUV作为抗原包被酶标板,以杂交瘤细胞上清为一抗,HRP标记的羊抗鼠IgG抗体为二抗,用间接ELISA方法对单克隆抗体细胞上清进行检测。
1.7.2反应性采用Western blot法验证单抗对DTMUV的反应原性以及与体外大肠杆菌原核表达纯化的NS5蛋白的反应原性。将DTMUV病毒以及NS5蛋白进行SDS-PAGE电泳,设置电泳条件为:180 V,90 min。采用Bio-Rad半干法转膜,设置条件为:20 V,40 min。将膜置于50 g/L脱脂奶粉中4 ℃放置12 h。加入1∶500稀释的腹水作为一抗,37 ℃孵育1 h,并设置SP2/0细胞上清作为对照;而后加入1∶5 000稀释的HRP标记的羊抗鼠IgG抗体,37 ℃孵育1 h,用PBST清洗5次后,再用PBS清洗反应膜以除去Tween-20。用超敏性辣根过氧化物酶DAB显色试剂盒,37 ℃显色5 min后,室温晾干,观察结果。
1.8DTMUV NS5单抗的间接免疫荧光(IFA)鉴定
选择生长状态良好的293T细胞,将其接种到6孔细胞培养板上培养。待细胞长成单层且细胞面积为培养孔底部面积的3/4时,感染DTMUV,同时设立不感染DTMUV的293T细胞为空白对照。待其出现细胞病变后,用40 g/L的多聚甲醛进行固定,用PBST清洗5次,加入过度培养的杂交瘤细胞上清,37 ℃孵育1 h;PBST清洗5次,加入1∶2 000稀释的FITC标记的羊抗鼠IgG抗体,继续37 ℃孵育1 h;PBST清洗5次,室温晾干,置于荧光显微镜下观察。若出现绿色荧光则为阳性;反之为阴性。
1.9单抗抗原表位分析和亚类鉴定
采用叠加ELISA方法的OD450的值及公式AI=(2×A1+2/(A1+A2)-1) ×100%(A1、A2为相应单抗的OD450值),对单抗抗原表位进行初步分析,根据2株单抗两两配对,通过对单抗叠加OD450的计算,反映2株McAbs病毒抗原表位之间的关系。
单抗亚类采用Mouse Monoclonal Antibody Isotyping Reagents试剂盒鉴定,具体按照说明书要求进行操作。
2 结果与分析
2.1DTMUV NS5蛋白的表达与纯化
核酸检测结果显示,将PET28a-NS5转化入Rosetta(DE3)细胞中,表达出含有NS5蛋白的包涵体蛋白,利用尿素梯度纯化法对NS5蛋白进行纯化,SDS-PAGE分析结果(图1)显示,所获得的目的条带为50 ku,与预期结果一致。利用BCA蛋白质浓度定量试剂盒测得表达的NS5蛋白的质量浓度为5.23 mg/mL。
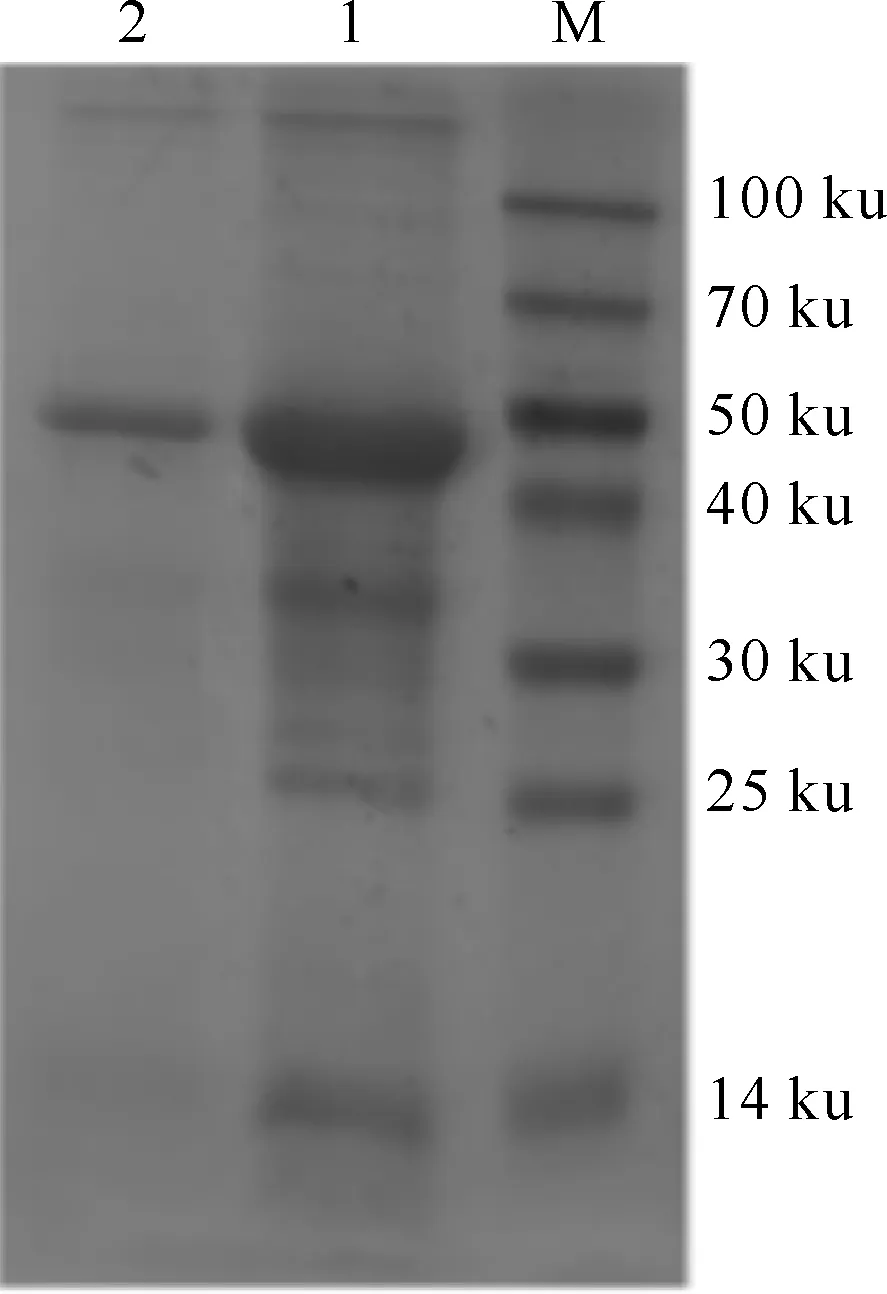
图 1 DTMUV NS5蛋白的SDS-PAGE分析M.蛋白质分子质量标准;1.初纯的包涵体;2.纯化的NS5蛋白Fig.1 SDS-PAGE analysis of purified NS5 protein of DTMUVM.Protein marker;1.Inclusion body protein;2.Purified NS5 protein
2.2DTMUV NS5筛选间接ELISA方法的建立
采用方阵滴定法确定筛选检测的间接ELISA方法中的NS5蛋白最佳包被量及阴阳性血清的抗体稀释度,计算的P/N值见表1。
根据P/N值≥2.1且最大、阳性血清OD450值为1.0左右的判定标准,由表1可知,抗原最佳包被量为100 ng/孔,血清最佳稀释倍数为1∶10。
2.3杂交瘤细胞的建立
应用淋巴细胞杂交瘤技术构建融合细胞,利用建立的间接ELISA方法对融合细胞进行筛选、扩大培养和亚克隆化。融合后5~7 d可见融合细胞呈集落式生长,细胞融合率达85%;间接ELISA筛选结果显示,细胞上清阳性率达到25%左右,对阳性细胞孔进行2~3次有限稀释法亚克隆,获得了2株稳定分泌抗DTMUV NS5蛋白的杂交瘤细胞,分别命名为A4D1和B4B8。
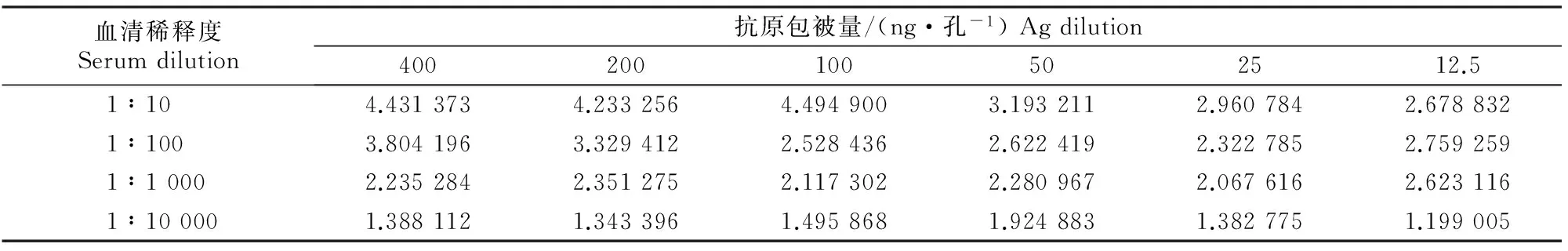
表 1 最佳抗原包被量及抗体稀释度的确定Table 1 Determination of the optimal concentration for coating antigen and the dilution of positive and negative control
注:表中数据为P/N值,其中P为阳性血清OD450值,N为阴性血清OD450值。
Note:The data in this table is P/N,P is positive serum of OD450,N is negative serum of OD450.
2.4杂交瘤细胞上清和腹水抗体效价的测定
由表2可知,2株单抗的细胞上清抗体效价可达到1∶100,腹水抗体效价可达到1∶64 000以上,说明抗体效价较高,纯化效果较好。
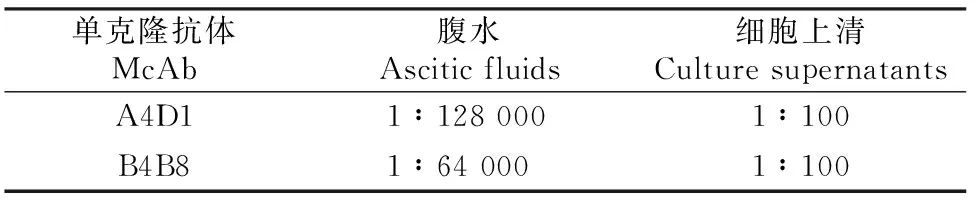
表 2 杂交瘤细胞上清和纯化腹水中抗 DTMUV NS5单抗的效价Table 2 Titers of culture supernatants and ascitic fluids of monoclonal antibodies against DTMUV NS5 by indirect ELISA
2.5DTMUV NS5单抗腹水的纯化
取纯化后的腹水进行SDS-PAGE,结果(图2)显示,纯化后的单抗纯度较高,重链、轻链明显。采用紫外分光光度法测得的2株单抗的蛋白含量分别为1.510和0.376 mg/mL。
2.6DTMUV NS5单抗的特异性鉴定
间接ELISA结果表明,A4D1和B4B8的单抗只与DTMUV反应,不与AIV、NDV、DPV、RV等发生反应。
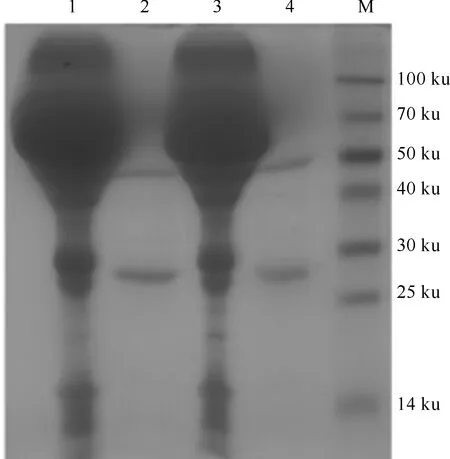
图 2 DTMUV NS5单抗的SDS-PAGE分析M.蛋白质分子质量标准;1.未纯化的B4B8单抗; 2.纯化的B4B8单抗;3.未纯化的A4D1单抗;4.纯化的A4D1单抗Fig.2 SDS-PAGE analysis of monoclonal antibodies against DTMUV NS5M.Protein marker;1.Unpurified B4B8 McAb;2.Purified B4B8 McAb;3.Unpurified A4D1 McAb;4.Purified A4D1 McAb
2.7DTMUV NS5单抗的反应性鉴定
Western blot鉴定结果(图3)显示,2株单抗均可以与纯化的DTMUV的NS5蛋白以及DTMUV在50 ku左右发生抗原抗体的特异性反应,而SP2/0细胞上清与两者均不反应,表明2株单抗均有良好的反应原性。
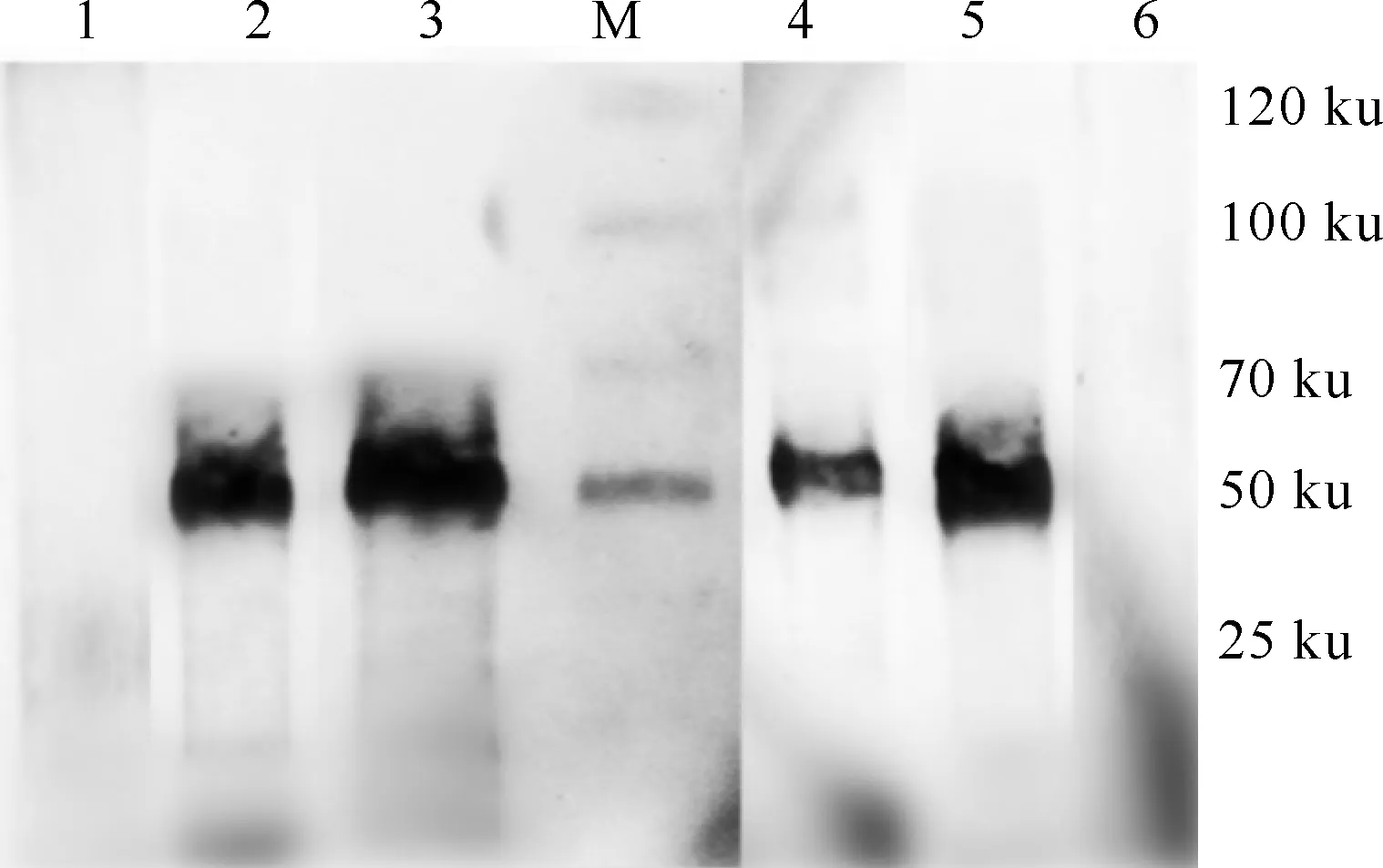
图 3 DTMUV NS5单抗的Western blot鉴定M.蛋白质分子质量标准;1,6.分别为SP2/0细胞上清与 NS5蛋白和DTMUV的反应结果;2,4.分别为单抗A4D1与 NS5蛋白和DTMUV的反应结果;3,5.分别为单抗 B4B8与NS5蛋白和DTMUV的反应结果Fig.3 Western blot identification of monoclonal antibodies against DTMUV NS5M.Protein marker;1 and 6.SP2/0 supernatants reacted with purified NS5 protein and DTMUV,respectively;2 and 4.A4D1 McAb reacted with purified NS5 protein and DTMUV,respectively; 3 and 5.B4B8 McAb reacted with purified NS5 protein and DTMUV,respectively
2.8DTMUV NS5单抗的IFA鉴定
图4结果显示,2株单抗均可显现特异性的绿色荧光,未感染的细胞未显现绿色荧光,表明这2株单抗均可以与DTMUV发生反应。
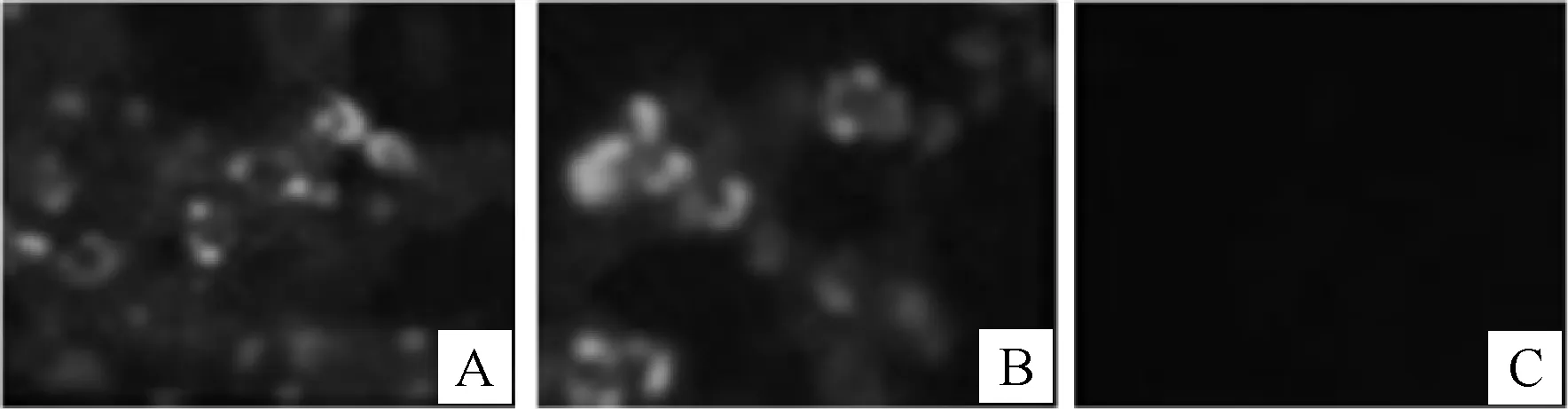
图 4 DTMUV NS5单抗与感染DTMUV的 293T细胞的IFA结果 A.A4D1;B.B4B8;C.阴性对照Fig.4 Indirect immunofluorescence assay of DTMUV in 293T cells with the two monoclonal antibodies against DTMUV NS5 A.A4D1 McAb;B.B4B8 McAb;C.Negative control
2.9单抗的亚类鉴定和抗原表位初步分析
叠加ELISA试验结果显示,A4D1和B4B8这2株单抗的叠加值AI=53%>10%,可初步判定2株单抗识别不同的抗原表位。
小鼠单克隆抗体亚类鉴定试剂盒检测结果显示,单抗A4D1和B4B8亚类重链均为IgG1型,轻链为κ链。
3 讨 论
NS5是坦布苏病毒依赖RNA的RNA聚合酶,具有RNA依赖的RNA聚合酶的活性,是坦布苏病毒属中较为保守的蛋白,在病毒复制过程中发挥着极其重要的作用。因此,研究NS5蛋白的结构和功能,对于坦布苏病毒感染的临床鉴别诊断和了解坦布苏病毒的致病机理具有重要意义。单克隆抗体以其特异性高、敏感性强而被广泛用于各类疾病病原的血清学检测和相关基础研究[17]。本研究应用纯化的坦布苏病毒的NS5蛋白作为免疫原,经过动物免疫、细胞融合和亚克隆,筛选出了2株能够稳定针对坦布苏病毒的NS5蛋白的单克隆抗体。该单抗的制备为进一步研究病毒的致病机理、蛋白功能以及抗原表位的鉴定奠定了相关的物质基础。
制备单克隆抗体时,在细胞融合之前,为了避免骨髓瘤细胞在后期HAT选择培养时出现突变返祖现象,在融合前10 d左右需用8-氮杂鸟嘌呤(8-AG)处理,以消除对氨基蝶呤不敏感的骨髓瘤细胞,利于融合。在单抗制备过程中,融合后第1次筛选阳性率较高,可能是细胞上清中某些物质的影响,因而会造成假阳性的结果,所以需要反复筛选2~3次,选择OD450值均较高且稳定的阳性值孔进行亚克隆。因融合细胞早期细胞数量较少,细胞极容易脱落死亡,筛选出的阳性值孔需扩大培养到24孔板培养,待细胞长到培养板孔底部面积的1/2~3/4时,再次进行检测,检测阳性值稳定的进行亚克隆,这样能增大亚克隆的成功率。得到了亚克隆后的杂交瘤细胞为了维持其抗体产生的稳定性,需要定期进行再克隆,以防止杂交瘤细胞突变或染色体丢失,以致丧失产生抗体的能力[18]。
[1]刁有祥.坦布苏病毒感染研究进展 [C]//中国畜牧兽医学会禽病学分会第十六次学术研讨会论文集.北京:中国畜牧兽医学会,2012.
Diao Y X.Advance in duck Tembusu virus research [C]//The conference proceedings for 16th poultry neurology of CAAV.Beijing:Chinese Association of Animal Science and Verterinary Medicine,2012.
[2]李玉峰,马秀丽,于可响,等.一种从鸭新分离的黄病毒研究初报 [J].畜牧兽医学报,2011,42(6):885-891.
Li Y F,Ma X L,Yu K X,et al.A brief report of Flavivirues newly isolated from duck [J].Acta Veterinaria et Zootechnica Sinica,2011,42(6):885-891.
[3]陈仕龙,陈少莺,王劭,等. 鸭黄病毒的分离鉴定 [J].动物医学进展,2012,33(3):123-125.
Chen S L,Chen S Y,Wang S,et al.Isolation and identification of a novel flavivirus strain from shelduck [J].Progress in Veterinary Medicine,2012,33(3):123-125.
[4]Yan P,Zhao Y,Zhang X,et al.An infectious disease of ducks caused by a newly emerged Tembusu virus strain in mainland China [J].Virology,2011,417(1):1-8.
[5]Su J,Li S,Hu X,et al.Duck egg-drop syndrome caused by BYD virus,a new Tembusu related Flavivirus [J].PLoS One,2011,6(3):e18106.
[6]滕巧泱,颜丕熙,张旭,等.一种新的黄病毒导致蛋鸭产蛋下降及死亡 [J].中国动物传染病学报,2010(6):1-4.
Teng Q Y,Yan P X,Zhang X,et al.A novel Flavivirus causing duck egg drops and death [J].Chinese Journal of Veterinary Parasitology,2010(6):1-4.
[7]赵圆圆,李传峰,朱良强,等.鸭产蛋下降-死亡综合征的临床诊断与病原的初步鉴定 [J].扬州大学学报(农业与生命科学版),2011,32(3):11-14.
Zhao Y Y,Li C F,Zhu L Q,et al.Clinical diagnosis and pathogenic identification of egg drop-death syndrome in duck [J].Journal of Yangzhou University (Agricultural and Life Science Edition),2011,32(3):11-14.
[8]万春和,黄瑜.坦布苏病毒致病特性及其流行病学 [J].动物医学进展,2011,32(12):116-118.
Wan C H,Huang Y.Pathogenicity and epidemiology of Tembusu virus [J].Progress in Veterinary Medicine,2011,32(12):116-118.
[9]刘友生,彭春香,黄瑜,等.2010-2011年中国部分地区禽坦布苏病毒感染调查及分子变异分析 [J].中国动物传染病学报,2012,20(1):47-53.
Liu Y S,Peng C X,Huang Y,et al.Detection and molecular analysis of avian Tembusu virus partial areas of China from 2010 to 2011 [J].Chinese Journal of Animal Infectious Diseases,2012,20(1):47-53.
[10]李玉峰.鸭黄病毒感染研究进展 [J].中国家禽,2011,33(17):30-31.
Li Y F.Advance in duck flavivirus research [J].China Poultry,2011,33(17):30-31.
[11]Tang Y,Diao Y,Gao X,et al.Analysis of the complete genome of Tembusu virus,a flavivirus isolated from ducks in China [J].Transbound Emerg Dis,2012,59(4):336.
[12]Bartholomeusz A,Tomlinson E,Wright P J,et al.Use of a flavivirus RNA-dependent RNA polymerase assay to investigate the antiviral activity of selected compounds [J].Antiviral Res,1994,24(4):341-350.
[13]Koonin E V.Computer-assisted identification of a putative me-thyl-transferase domain in NS5 protein of flaviviruses and lambda 2 protein of reovirus [J].J Gen Virol,1993,74(4):733-740.
[14]刘玉斌.动物免疫学实验技术 [M].长春:吉林科学技术出版社,1989:46-54.
Liu Y B.Animal immunology experiment technology [M].Changchun:Jilin Science and Technology Press,1989:46-54.
[15]曹雪涛.精编免疫学实验指南 [M].北京:科学出版社,2009:120-123.
Cao X T.Immunology experiment guide [M].Beijing:Science Press,2009:120-123.
[16]周宗安.单克隆抗体技术手册 [M].南京:南京大学出版社,1991.
Zhou Z A.Monoclonal antibody technology handbook [M].Nanjing:Nanjing University Press,1991.
[17]林源,柳金雄,陈普成,等.鸭坦布苏病毒E蛋白单克隆抗体的制备及鉴定 [J].畜牧与兽医,2013,45(10):6-9.
Lin Y,Liu J X,Chen P C,et al.Preparation and identification of monoclonal antibody to E protein of duck Tembusu virus [J].Animal Husbandry & Veterinary Medicine,2013,45(10):6-9.
[18]郑泓,韩双艳,林影,等.质粒DNA单次脾内注射制备单克隆抗体 [J].生物工程学报,2007,23(4):710-714.
Zheng H,Han S Y,Lin Y,et al.Preparation of monoclonal antibody based on single intrasplenic immunization of plasmid DNA [J].Chinese Journal of Biotechnology,2007,23(4):710-714.
Preparation and identification of monoclonal antibody against NS5 protein of duck Tembusu virus
YANG Guoping,DIAO Youxiang,ZHAO Dandan,CHEN Hao,TI Jinfeng,ZHANG Lu,ZHANG Ying,LI Chuanchuan
(CollegeofAnimalScienceandTechnology,ShandongAgricultureUniversity,Tai’an,Shandong271017,China)
【Objective】 This study prepared a monoclonal antibody (McAb) against NS5 protein of duck Tembusu virus (DTMUV).【Method】 PET28a-NS5 vector was transformed intoEscherichiacoliRosetta (DE3),and BALB/c mice were immunized by the purified protein NS5 of DTMUV.Then,the specificity,reactivity,epitope and subclasses were identified.【Result】 Two monoclonal antibodies A4D1 and B4B8 were obtained by lymphocyte hybridoma technique.The ascites antibody titers of A4D1 and B4B8 were both 1∶64 000.Indirect ELISA,Western blot and indirect immunofluorescence assay (IFA) showed that the two McAbs reacted specifically with DTMUV and purified NS5 protein.The subtypes of both McAbs were IgG1 and they can recognize different antigen epitopes based on superposition ELISA method.【Conclusion】 Monoclonal antibodies against DTMUV NS5 were successfully prepared,which provides basis for further study of DTMUV NS5 functions.
duck Tembusu virus;NS5 protein;monoclonal antibody
时间:2016-09-0709:02DOI:10.13207/j.cnki.jnwafu.2016.10.001
2015-03-11
国家自然科学基金项目(31272583);山东自然科学基金项目(ZR2012CM002);国家水禽产业技术体系项目(CARS-43-10)
杨国平(1989-),男,山东招远人,在读硕士,主要从事禽病学研究。E-mail:ygp89@126.com
刁有祥(1962-),男,山东胶州人,教授,博士,博士生导师,主要从事禽病学研究。E-mail:yxdiao@163.com
S852.65+7
A
1671-9387(2016)10-0001-06
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160907.0902.002.html

