不同转移潜能人肺癌细胞系中LASS2/TMSG-1的表达及其意义
徐海芹, 李时荣, 翁立新, 王静媛, 海 玲, 徐晓艳*
(1内蒙古医科大学基础医学院病理学教研室,呼和浩特 010059; 2内蒙古自治区人民医院血液科实验室; 3内蒙古医科大学附属医院病理科; *通讯作者,E-mail:xxy_patho@163.com)
不同转移潜能人肺癌细胞系中LASS2/TMSG-1的表达及其意义
徐海芹1,2, 李时荣3, 翁立新3, 王静媛3, 海玲3, 徐晓艳3*
(1内蒙古医科大学基础医学院病理学教研室,呼和浩特010059;2内蒙古自治区人民医院血液科实验室;3内蒙古医科大学附属医院病理科;*通讯作者,E-mail:xxy_patho@163.com)
目的探讨LASS2/TMSG-1在不同转移潜能人肺癌细胞系中的表达及其意义。方法培养95C细胞(人肺巨细胞癌低转移亚系)和95D细胞(人肺巨细胞癌高转移亚系)。采用 MTT 增殖实验、Transwell侵袭实验、划痕修复实验检测95C和95D细胞的增殖、侵袭及迁移能力;分别用RT-PCR和Western blot法检测两株细胞中LASS2/TMSG-1 mRNA和LASS2/TMSG-1、MMP-9、MMP-13蛋白的表达水平。结果MTT增殖实验显示,培养至第2-5天,95D细胞的增殖能力强于95C细胞(P<0.05);95D细胞的侵袭能力显著高于95C细胞(t=-20.62,P<0.05);划痕修复实验证实95D细胞的迁移能力强于95C细胞(t=23.56,P<0.05)。LASS2/TMSG-1的mRNA和蛋白在95C细胞中的表达明显高于95D细胞中的表达,差异具有显著性(P<0.01)。MMP-9及MMP-13蛋白在95C细胞中的表达明显高于在95D细胞中的表达(t=-7.009,-13.042;均P<0.01)。结论LASS2/TMSG-1的mRNA和蛋白在人肺癌低转移亚系95C中的表达显著高于在高转移亚系95D细胞中的表达。该基因可能参与抑制人肺癌细胞的增殖、侵袭及迁移过程,并且可能通过其下游基因MMP-9、MMP-13发挥重要的作用。
肺癌;LASS2/TMSG-1;逆转录-聚合酶链反应;蛋白质免疫印迹试验
肺癌为人类死亡的重要肿瘤之一,全球每年约1亿人死于肺癌[1]。目前研究表明,肺癌患者癌细胞的侵袭和转移是其恶性程度的主要标志,也是造成其生存率低、死亡率高的主要原因[2]。因此,探讨肺癌侵袭、转移机制,寻找与肺癌侵袭转移相关基因至关重要。
LASS2(homo sapiens longevity assurance homologue 2 of yeast LAG1)基因是上海市肿瘤研究所癌基因及相关基因国家重点实验室首次发现并报道的人类新基因[3],1999年首先将该基因在GenBank上登记(登记号为AF177335)。LASS2基因广泛存在于人多种组织中,基因定位在染色体lq21。同年,马春树等[4]发现肿瘤转移抑制相关基因TMSG-1(tumor metastasis suppressor gene-1),在GenBank中登记号为AF189062。通过生物信息学比较,发现LASS2的ORF(open reading frame)的5′端比TMSG-1的5′端要多450个核苷酸,且二者ORF中其余的核苷酸及对应编码的氨基酸序列一致[5],所以称为LASS2/TMSG-1。以往研究[6]表明LASS2/TMSG-1可以促进神经酰胺合成,并且与肿瘤转移有密切的关系,包括抑制肿瘤细胞生长,促进调亡,从而抑制肿瘤的侵袭和转移等。另外,其与质子泵V-ATPase相互作用,可调节细胞内外的H+含量,抑制基质金属蛋白酶的分泌和激活,从而抑制肿瘤的侵袭及转移[7]。前期研究已发现LASS2/TMSG-1能够抑制前列腺癌、肝细胞癌、膀胱癌以及乳腺癌等多种肿瘤细胞的侵袭及转移能力[8],从而被认为是一种候选的肿瘤转移抑制基因,但该基因与肺癌侵袭转移的关系研究较少。
因此,本研究通过检测不同侵袭、转移潜能人肺癌细胞中LASS2/TMSG-1 mRNA和蛋白的表达,进一步证实LASS2/TMSG-1是否参与抑制人肺癌细胞的生长、侵袭及迁移过程,为其与人肺癌侵袭、转移的关系及其相关性的研究奠定基础。
1 材料与方法
1.1主要试剂与仪器
胎牛血清和RPMI1640培养液购自美国Gibco公司;6孔细胞培养板和Transwell小室(内径6.5 mm,孔径8.0 μm)购自美国Corning公司;MatrigelTM购自美国BD公司;羊抗人多克隆抗体LASS2/TMSG-1购自北京博奥森生物技术有限公司;羊抗人单克隆抗体β-actin购自北京博奥森生物技术有限公司;兔抗人多克隆抗体MMP-9及兔抗人多克隆抗体MMP-13亦购自北京博奥森生物技术有限公司;Trizol购自美国invitrogen公司;RT试剂盒均购自法国Transgene基因有限公司。
1.2细胞系及细胞培养
人肺巨细胞癌低转移亚系95C细胞和高转移亚系95D细胞购于上海复祥生物科技有限公司,此两株细胞最早为北京301医院建株[9]。均用含10%(体积分数)小牛血清的RPMI1640培养液,于37 ℃、5%(体积分数)CO2孵育箱中培养。
1.3MTT细胞增殖能力
收集对数期生长细胞,1 ml 0.25%胰酶消化,1 ml完全培养基终止消化,1 000 r/min,离心5 min;弃上清,加1 ml培养基制成单细胞悬液;取10 μl台盼蓝及10 μl细胞悬液计数,后用培养基调整细胞浓度为1×103/100 μl;5个96孔板中每孔接种1×103个细胞,培养基补足100 μl,每个组均设6个平行复孔,过夜至细胞单层铺满孔底,接种当天记为0 d,温箱孵育,隔天换液;每天检测,连续监测5 d;测定前4 h,每孔加入20 μl MTT溶液,温箱孵育4 h;超净台弃每孔培养液,加入150 μl DMSO置摇床低速震荡10 min,使结晶充分溶解;30 min内在酶标仪中检测490 nm处各孔吸光值。该实验独立重复3次。两组细胞均设6个平行样本,取6个样本的平均值,以生长天数为横坐标,490 nm处吸光度为纵坐标,绘制95C和95D细胞的生长曲线。
1.4Transwell 体外侵袭实验
用50 mg/L Matrigel胶(1∶8稀释)包被Transwell小室的上室,37 ℃烘干30 min至胶凝固;细胞消化离心后用含10% FBS的培养基重悬细胞,调整细胞密度为1×105-10×105个,向Transwell上室每孔加入200 μl细胞,24孔板的下室加入500 μl 10% FBS的培养基;常规培养细胞12-24 h,依据镜下观察侵袭情况结束培养时间;侵袭结束后用0.1%结晶紫染色,PBS 清洗2次,每组设3个平行样本,每张膜由正中水平线及垂直线分为4个象限,选取象限及膜中心的5个高倍视野(×400)计数穿膜细胞数。该实验独立重复3次。
1.5划痕修复实验
用标记笔在6孔板背后每隔0.5-1 cm划线,每孔5条线;细胞制成单细胞悬液后接种到6孔板中,每孔约接种1×106个,接种后常规培养,掌握为过夜细胞能铺满孔底;第2天,用0.5-10 μl微量移液器垂直于孔底背后Marker做划痕,注意移液器要保持垂直;划痕后用 PBS清洗3次,加入无血清培养基常规培养;分别在划痕后0,6,12,24 h为细胞拍照,每组设3个平行样本,目测微尺测量划痕宽度并计算划痕修复率[划痕修复率=(0 h划痕宽度-各时点划痕宽度)/0 h划痕宽度×100%],每个样本观察两个视野(×400),取其平均值。该实验独立重复3次。划痕实验能够观察在一个细胞周期内,无血清培养基培养的细胞由细胞区迁移至无细胞区的能力。在我们的划痕实验中,95C、95D两组细胞均设3个平行样本,每个样本观察2个视野。
1.6Wesern blot方法检测LASS2/TMSG-1、MMP-9及MMP-13蛋白的表达水平
两种不同转移潜能人肺癌细胞的培养,细胞裂解提取总蛋白,然后SDS-PAGE电泳,转膜,蛋白免疫印迹反应,最后应用ChemiDox XRS图像分析系统观察并照相,蛋白表达量用灰度值OD来表示。
1.7RT-PCR检测LASS2/TMSG-1 mRNA的表达
GADPH及LASS2/TMSG-1的引物经Gene Bank检索,利用Primer5.0软件设计,由北京奥科生物公司合成,LASS2/TMSG-1引物序列为:上游,5′-TCCTGCCTT CTTTGGCTATTACTT-3′,位于基因的123-124碱基位;下游,5′-TGCGTTCAT CTTCTACCAGCTTTC-3′,位于基因的421-444碱基位,扩增片段长度约为134 bp。GADPH引物序列为:上游,5′-GAAGGTGAAGGTCGGAgTC-3′,位于基因的6-24碱基位;下游,5′-GAAGATGGTGATGGGATTTC-3′ ,位于基因的1935-1954碱基位,扩增片段长度约234 bp。95 ℃预变性3 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,30个循环;72 ℃延伸5 min。PCR产物于凝胶成像系统分析仪观察并照相。
1.8统计学分析

2 结果
2.195C和95D细胞LASS2/TMSG-1 mRNA表达的比较
95C细胞的LASS2/TMSG-1 mRNA表达水平明显强于95D细胞(0.83±2.91vs0.39±1.19,t=24.47,P<0.01,见图1)。

图1 95C和95D细胞中LASS2/TMSG-1及GADPH的mRNA表达Figure 1 The expression of LASS2/TMSG-1 and GADPH mRNA in 95C and 95D cells
2.2Western blot检测95C和95D细胞LASS2/TMSG-1蛋白的表达
Western blot结果显示95C细胞中LASS2/TMSG-1的蛋白表达量明显高于95D细胞(31.67±0.38vs19.13±0.22,t=48.89,P<0.01,见图2)。
2.3Western blot检测95C和95D细胞MMP-9及MMP-13蛋白的表达水平
95C细胞中MMP-9及MMP-13的蛋白表达量明显高于95D细胞(4.46±0.22vs1.77±0.63,t=-7.009,P<0.01;32.48±0.93vs15.97±1.99,t=-13.042,P<0.01,见图3)。

图2 95C与95D细胞中LASS2/TMSG-1的表达Figure 2 The expression of LASS2/TMSG-1 protein in 95C and 95D cells by Western blot
2.495C、95D两株细胞的增殖能力
MTT实验结果显示,第2-5天95C、95D细胞增殖能力差异均具有显著性(P<0.05,见表1、图4),95D细胞的增殖能力强于95C。

图3 95C与95D细胞中MMP-9及MMP-13的蛋白表达Figure 3 The expression of MMP-9 and MMP-13 protein in 95C and 95D cells
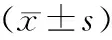
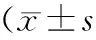
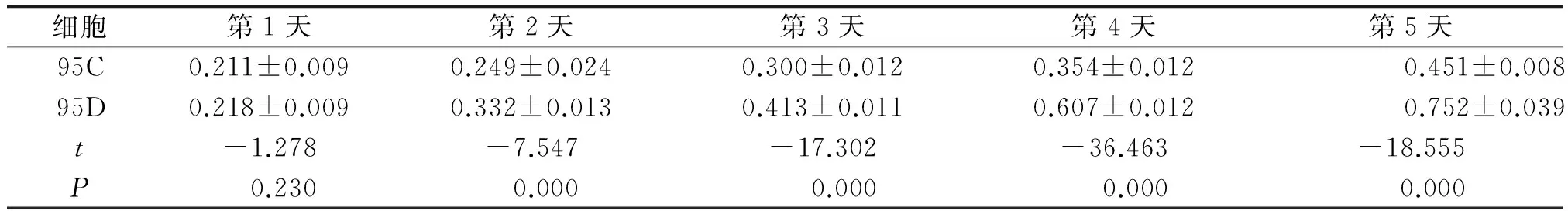
细胞第1天第2天第3天第4天第5天95C0.211±0.0090.249±0.0240.300±0.0120.354±0.0120.451±0.00895D0.218±0.0090.332±0.0130.413±0.0110.607±0.0120.752±0.039t-1.278-7.547-17.302-36.463-18.555P0.2300.0000.0000.0000.000

与95C细胞比较,*P<0.05图4 MTT法检测95C、95D细胞的增殖能力Figure 4 The proliferation ability of 95C and 95D cells by MTT
2.595C、95D两株细胞的侵袭能力
Transwell侵袭实验显示95C、95D细胞发生侵袭的细胞个数分别为9.07±0.96和82.53±3.43,差异具有统计学意义(t=-20.62,P=0.00,见图5),95D的侵袭能力高于95C。
2.695C、95D两株细胞的迁移能力
24 h后95C、95D两组细胞划痕修复率分别为55%±3%和92%±1%,差异具有统计学意义(t=23.56,P=0.00,见图6),95D细胞的迁移能力明显高于95C细胞。

图5 体外侵袭实验检测95C、95D细胞的体外侵袭能力Figure 5 The invasion ability of 95C and 95D cells in vitro by Transwell test

图6 95C与95D细胞24 h后体外迁移能力比较 (×400)Figure 6 The migration ability of 95C and 95D cells in vitro at 24 h (×400)
3 讨论
LASS2/TMSG-1作为参与抑制肿瘤侵袭、转移的分子,其主要功能可能与神经酰胺和质子泵V-ATPase有关。目前有研究[10]显示LASS2/TMSG-1主要是引起长链神经酰胺C22:0和C24:0-CoA特异性神经酰胺的合成,由此可以得出LASS2/TMSG-1基因能诱导神经酰胺的合成,使细胞内神经酰胺含量增加。神经酰胺是神经鞘脂的主要成员之一,是细胞信号传导途径中的第二信使,参与细胞的分化、增殖、衰老等过程,特别是在诱导细胞凋亡过程中起重要作用。Paschall等[11]研究发现,在肿瘤细胞中凋亡抑制蛋白(inhibitor of apoptosis proteins, IAP)可调节细胞凋亡阻力,而神经酰胺能诱导IAP蛋白的降解,使肿瘤细胞对凋亡诱导敏化,从而促进细胞凋亡。Rego等[12]研究表明神经酰胺生产醋酸导致细胞死亡,特别是通过Isc1p和Lag1p从头合成催化复杂的鞘脂类水解产生的醋酸引起细胞凋亡。也有人认为神经酰胺与细胞内吞、 Erk1/2依赖的信号传导通路、Cox的表达诱导,以及p53依赖的细胞凋亡有关[13]。 总之LASS2/TMSG-1可以调节体内神经酰胺的表达,从而通过神经酰胺的促凋亡作用抑制肿瘤生长。
也有研究者认为LASS2/TMSG-1可以通过直接绑定到V-ATPase的C亚基上与V-ATPase相互作用[14],而C亚基, 又称ATP6L,是V-ATPase质子泵的关键跨膜部分,可以逆浓度梯度将H+泵至细胞囊腔中或细胞外。已有研究[15]发现ATP6L在高转移的肿瘤中高表达,V-ATPase C亚基的高表达,会诱导Eiger/JNK依赖的细胞转型,促进正常组织细胞向早期癌组织的转变[16]。而用基因敲除或化学抑制剂,沉默ATP6L后,可以显著抑制肿瘤的生长、浸润及转移[17]。研究发现,LASS2/TMSG-1的过表达可通过与ATP6L结合,抑制V-ATPase活性来增加肝癌细胞的胞内H+,从而通过线粒体途径诱导细胞凋亡[18]。综上所述,LASS2/TMSG-1可以通过与V-ATPase的C亚基相互作用,从而抑制V-ATPase的活性,使得细胞内pH降低,而细胞外pH升高,导致肿瘤细胞凋亡增加,以及其浸润性和转移性降低。
陆应麟等[9]在20世纪80年代研究发现,来源于同一母细胞的人肺巨细胞癌95C、95D细胞具有不同的侵袭、转移潜能,且有较大差异。本研究通过MTT增殖实验、划痕实验和侵袭实验,证明了95C、95D这两种细胞的增殖能力、侵袭能力和迁移能力的显著差异,也进一步验证了95C细胞的低侵袭转移性能和95D细胞的高侵袭转移性能。本研究尝试用95C、95D细胞检测LASS2/TMSG-1 mRNA和蛋白的表达情况,在RT-PCR反应检测中发现95C细胞LASS2/TMSG-1的mRNA表达水平明显强于95D细胞,而95C细胞又为低侵袭、转移潜能细胞系,推测其低转移潜能可能受LASS2/TMSG-1影响;Western blot 检测显示95C中LASS2/TMSG-1的蛋白表达量明显高于95D细胞(P<0.05),结合两种细胞的增殖、侵袭及转移潜能确有较大差别,因此可推断LASS2/TMSG-1可能参与了抑制肺癌细胞的生长、侵袭及转移能力。
本实验检测了两种细胞系中MMP-9、MMP-13的表达情况,发现95C细胞中MMP-9、MMP-13的表达水平明显高于95D细胞。MMP-9是分子量为92 kD的明胶酶,能够降解Ⅳ型胶原(包括血管基底膜中的胶原),即ECM的主要蛋白结构。目前,许多研究都证明MMP-9是肿瘤预后的不良因素,Herszényi等[19]的免疫组化研究发现,MMP-9在Barrett食管中呈现高表达,这种改变可能是食管发生恶变的早期事件。在肺癌中,有研究发现MMP-9可能通过MEK/ERK通路调节其转录和表达,进而影响肺癌肿瘤细胞的侵袭能力,而MEK/ERK信号通路的激活是多种恶性肿瘤侵袭、转移的重要原因[20]。Yu等[21]发现,CYP ω-羟化酶可以通过PI3K/Akt信号通路来激活VEGF(vascular endothelial growth factor,血管内皮生长因子)和MMP-9,VEGF和MMP-9进而促进肿瘤周围和外周循环产生并募集血管内皮生长因子受体-1(vascular endothelial growth factor receptor-1,VEGFR-1)阳性造血干细胞和祖细胞,促进肿瘤新生血管的形成,为肿瘤组织提供营养。
MMP-13是胶原酶-3,最初在乳腺癌中被发现,其基因位于人类第11号染色体长臂上,MMP-13因其具有广谱降解作用而著名,能够降解ECM中的Ⅰ、Ⅱ、Ⅲ等多种胶原,其降解能力是同种类型胶原酶的40倍。Cowell等[22]发现,MMP-13一旦被激活,能够降解血管周围的胶原,激活ECM中的血管生长因子,帮助在已降解的胶原周围生成新的血管。目前发现,MMP-13在多种恶性肿瘤中有过表达,其处于MMPs家族瀑布效应的中心,除自身催化外,还通过调节其他MMPs家族成员,如通过促进活性MMP-9的产生,参与降解ECM。总之,MMP-13活性及表达水平的微调,均有可能对MMPs家族其他成员的活性和表达产生影响,进而影响降解ECM的过程,参与肿瘤的侵袭和转移。
因此,推测LASS2/TMSG-1基因可能通过与V-ATPase的C亚基相互作用, 从而抑制V-ATPase的活性, 使得细胞内外氢离子浓度发生改变,进而影响MMPs的表达和活性,从而参与抑制肿瘤的侵袭、迁移及生长。
综上所述,LASS2/TMSG-1在人肺癌低侵袭转移亚系的蛋白及mRNA表达均高于人肺癌高侵袭转移亚系,说明该基因可能与抑制人肺癌的增殖、侵袭、转移密切相关,并且其下游基因MMP-9、MMP-13可能发挥了重要的作用。
[1]González-Arriaga P,Pascual T,Garcí-Alvarez A,etal.Genetic polymorphisms in MMP 2,9 and 3 genes modify lung cancer risk and survival[J].BMC cancer,2012,12:121.
[2]张鹏,韩一平,黄玲,等.NapsinA和SP-A在原发性肺腺癌及肺转移癌的作用研究[J].临床肿瘤学杂志,2010,15(3):211-214.
[3]Pan H,Qin WX,Huo KK,etal.Cloning, mapping,and characterization of A human homologue of the yeast longevity assurance gene LAG1[J].Genomics,2001,77(1-2):58-64.
[4]马春树,刘宇欣,郑杰,等.应用mRNA差异显示技术克隆肿瘤转移相关基因TMSG-1[J].中国科学(C辑:生命科学),2002,45(5):553-560.
[5]裴斐,由江峰,宁均宇,等.人肿瘤转移抑制基因TMSG-1单克隆抗体的制备、鉴定及在肿瘤检测中的作用[J].中华病理学杂志,2005,34(1):15-21.
[6]Xu XY,Pei F,You JF.TMSG-1 and its roles in tumor biology[J].Chin J Cancer,2010,29(7):697-702.
[7]左华楚,李秀霞,李时荣,等.LASS2/TMSG-1基因沉默对人肺癌95C细胞侵袭迁移机制探讨[J].中华肿瘤防治杂志,2015,22(24):1865-1878.
[8]左华楚,李秀霞,徐晓艳.LASS2/TMSG-1基因与肿瘤转移关系的研究进展[J].临床与病理杂志,2014,34(3):280-285.
[9]陆应麟,黄靖香,李向红,等.人肺巨细胞癌PLA-801母系细胞系及其克隆化细胞株(A、B、C、D)裸鼠皮下种植后自发转移特性的研究[J].中华肿瘤杂志,1989,11(1):3-7.
[10]Mizutani Y,Kihara A,Igarashi Y.Mammalian Lass6 and its related family members regulate synthesis of specific ceramides[J].Biochem J,2005,390(Pt 1):263-271.
[11]Paschall AV,Zimmerman MA,Torres CM,etal.Ceramide targets xIAP and cIAP1 to sensitize metastatic colon and breast cancer cells to apoptosis induction to suppress tumor progression[J].BMC Cancer,2014,14:24.
[12]Rego A,Costa M,Chaves SR,etal.Modulation of mitochondrial outer membrane permeabilization and apoptosis by ceramide metabolism[J].PLoS One,2012,7(11):e48571.
[13]Lin HY,Delmas D,Vang O,etal.Mechanisms of ceramide-induced COX-2-dependent apoptosis in human ovarian cancer OVCAR-3 cells partially overlapped with resveratrol[J].J Cell Biochem,2013,114(8):1940-1954.
[14]Yu W,Wang L,Wang Y,etal.A novel tumor metastasis suppressor gene LASS2/TMSG1 interacts with vacuolar ATPase through its homeodomain[J].J Cell Biochem,2013,114(3):570-583.
[15]Xu J,Xie R,Liu X,etal.Expression and functional role of vacuolar H(+)-ATPase in human hepatocellular carcinoma[J].Carcinogenesis,2012,33(12):2432-2440.
[16]Petzoldt AG,Gleixner EM,Fumagalli A,etal.Elevated expression of the V-ATPase C subunit triggers JNK-dependent cell invasion and overgrowth in a Drosophila epithelium[J].Dis Model Mech,2013,6(3):689-700.
[17]Feng S,Zhu G,McConnell M,etal.Silencing of atp6v1c1 prevents breast cancer growth and bone metastasis[J].Int J Biol Sci,2013,9(8):853-862.
[18]唐宁,金洁,邓云,等.人源性长寿保障基因2通过与V-ATPase作用抑制肝癌细胞的生长[J].生理学报,2010,62(3):169-201.
[19]Herszényi L,Hritz I,Pregun I,etal.Alterations of glutathione S-transferase and matrix metalloproteinase-9 expressions are early events in the esophageal carcinogenesis[J].World J Gastroenterol,2007,13(5):676-682.
[20]Sebolt-Leopold JS,Herrera R.Targeting the mitogen-actived protein kinase cascade to treat cancer[J].Nat Rev Cancer,2004,4(12):937-947.
[21]Yu W,Chen L,Yang YQ,etal.Cytochrome P450ω-hydroxylase promotes angiogenesis and metastasis by upregulation of VEGF and MMP-9 in non-small cell lung cancer[J].Cancer Chemother Pharmacol,2011,68(3):619-629.
[22]Cowell S,Knauper V,Stewart ML,etal.Induction of matrix metalloproteinase activation cascades based on membrane-type 1 matrix metalloproteinase:associated activation of gelatinase a, gelatinase b and collagenase-3[J].Biochemistry,1998,331(Pt2):453-458.
Expression and significance of LASS2/TMSG-1 in human lung cancer cell lines with different metastatic potentiality
XU Haiqin1,2, LI Shirong3, WENG Lixin3, WENG Jingyuan3, HAI Ling3, XU Xiaoyan3*
(1DepartmentofPathology,InnerMongoliaMedicalUniversity,Hohhot010059,China;2DepartmentofHematologicalLaboratory,InnerMongoliaMedicalUniversityAffiliatedHospital;3DepartmentofPathology,InnerMongoliaMedicalUniversityAffiliatedHospital;*Correspondingauthor,E-mail:xxy_patho@163.com)
ObjectiveTo investigate the expression and significance of LASS2/TMSG-1 mRNA and protein expression in human lung cancer cell lines with different metastatic potentiality.MethodsThe proliferation, invasion and migration ability of cells were observed by MTT, Transwell assay and wound healing assay. The expression levels of LASS2/TMSG-1 mRNA in human lung cancer cell lines were detected by RT-PCR and the expression levels of LASS2/TMSG-1, MMP-9 and MMP-13 protein in human lung cancer cell lines were detected by Western blot.ResultsMTT proliferation test verified that the proliferation ability of 95D cells was stronger than that of 95C cells(P<0.05). Transwell invasion assay showed that the invasion ability of 95D cells was significantly higher than that of 95C cells(t=-20.62,P<0.05). Wound healing assay confirmed that the migration ability of 95D cells was higher than that of 95C cells(t=23.56,P<0.05). The expression levels of LASS2/TMSG-1 mRNA and protein in 95C cells were significantly higher than that of 95D cells(P<0.01). The expression of MMP-9 and MMP-13 protein in 95C cells were significantly higher than in 95D cells(t=-7.009,-13.042;P<0.01).ConclusionThe expression levels of LASS2/TMSG-1 mRNA and protein in lung cancer cell lines with low metastatic potentiality are significantly higher than that with high metastatic potentiality, which confirm that LASS2/TMSG-1 may be involved in inhibition of the proliferation, invasion and migration of human lung cancer cells by regulating the downstream gene, MMP-9 and MMP-13.
lung cancer;LASS2/TMSG-1;RT-PCR;Western blot
国家自然科学基金资助项目(81201854);内蒙古自然科学基金资助项目(2014MS0858)
徐海芹,女,1980-04生,本科,检验技师
2016-04-18
R734.2
A
1007-6611(2016)10-0884-06DOI:10.13753/j.issn.1007-6611.2016.10.002

